Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.43 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rcciquifa.v43n1.45465
http://dx.doi.org/10.15446/rcciquifa.v43n1.45465
Artículo de investigación tecnológica
Desarrollo y validación de un método analítico indicativo de estabilidad por HPLC para la cuantificación de Rosuvastatina Cálcica
Development and validation of a stability indicating analytical HPLC method for the quantification of Rosuvastatin Calcium
Abeimar Alvarez Bilbao1, Mary Trujillo González2.
1Laboratorios Procaps S.A.S., Barranquilla, Colombia. Correo electrónico: abalvarez@procaps.com.co.
2Grupo Aseguramiento de la Calidad, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, sede Bogotá, D. C., Colombia. Correo electrónico: mtrujillog@unal.edu.co.
Recibido para evaluación: Septiembre 22 de 2013
Aceptado para publicación: Mayo 15 de 2014
RESUMEN
En este trabajo, fue desarrollado y validado un método indicador de estabilidad por cromatografía líquida, para ser aplicado al estudio cinético de Rosuvastatina Cálcica en diferentes valores de pH y temperatura. Las condiciones cromatográficas seleccionadas fueron: columna C18, 50 x 4.6 mm y 3,5 µm de tamaño de partícula; fase móvil MeOH: Agua-0.1%TFA, temperatura de la columna de la columna 25 ° C, y velocidad de flujo 1 mL/min. El método validado presentó una adecuada repetibilidad y precisión intermedia y una recuperación superior al 98%. Por otra parte, el método fue lineal en el rango de 10 a 150 ppm. En condiciones ácidas, fueron identificados tres posibles productos de degradación como: Rosuvastatina Lactona, Rosuvastatina Anti-isómero y Rosuvastatina Lactona Anti-isómero y en condiciones de degradación con la luz se identificaron dos posibles productos mayoritarios. El método validado puede ser empleado en estudios de estabilidad y de degradación cinética del fármaco.
Palabras clave:Rosuvastatina cálcica, método indicativo de estabilidad, cinética de degradación, Energía de activación, validación de métodos
SUMMARY
In this work, a liquid chromatography stability-indicating method was development and validated to be applied at study the hydrolytic behavior of Rosuvastatin Calcium in different pH values and temperatures. The selected chromatographic conditions were a column C18 50 x 4.6 mm and 3.5 µm. The mobile phase was Methanol: Water-1%TFA; 25°C column temperature and flow rate 1 mL/min. The validation method exhibited an adequate repeatability and intermediate precision and a recovery higher than 98%. Furthermore, the method was lineal in range of 10 to 150 ppm. Under acidic conditions, three degradation products possible were identified as Rosuvastatin lactone, Rosuvastatin anti-isomer and Rosuvastatin lactone anti-isomer, with light were identified two major decomposition products. The validated method can be used in the stability studies and drug degradation kinetics.
Key words: Rosuvastatin Calcium, stability-indicating method, degradation kinetic, Activation energy, Validation of methods.
INTRODUCCIÓN
Uno de los últimos fármacos de la familia de las estatinas en salir al mercado fue la Rosuvastatina Cálcica (ROSUCa), cuyo uso fue aprobado por primera vez en Holanda en el año 2002 y a partir de esta fecha ha sido aprobada en otros 23 países [1]. La ROSUCa se obtiene por síntesis, mediante la saponificación de tert-butil-(3R-5S)-7-[4-(4-flurofenil)-6-isopropil-2-(N-metil-N-metano sulfonil aminopirimidina-5-yl)-3.5-dihidroxi 6 heptanoato [2].
La ROSUCa se comercializa en la forma de sal cálcica. La vía de administración es peroral, en forma de tabletas o cápsulas, ya que se absorbe a través de la mucosa gastrointestinal, sin verse interferida por los alimentos. Tras la administración de una dosis única alcanza la concentración plasmática máxima entre las tres y las cinco horas, obteniéndose una biodisponibilidad cercana al 20%. Se distribuye por todo el cuerpo ya que la unión a proteínas plasmáticas, principalmente a albúminas, es cercana al 88% y se metaboliza en el hígado, fundamentalmente por la vía de citocromo P450 [3, 4].
Estudios realizados sobre la estabilidad de la ROSUCa muestran que se degrada fácilmente en soluciones ácidas, en soluciones expuestas a luz directa y en condiciones de oxidación [5]. Algunos de los productos de degradación han sido identificados como Rosuvastatina Lactona metil éster, Rosuvastatina Lactona, Rosuvastatina metil éster y Rosuvastatina antiisómero [6].
Se han desarrollado varios métodos indicativos de estabilidad para la cuantificación de ROSUCa [5-8], sin embargo, en algunos ellos los tiempos de análisis son demasiados largos para una aplicación de rutina en el laboratorio, y en otros, donde los tiempos son adecuados, se emplean equipos UPLC lo cual constituye una limitante para los laboratorios que no poseen equipos con esta tecnología.
El objetivo de esta investigación fue desarrollar y validar un método practico para la cuantificación de ROSUCa por cromatografía líquida de alta eficiencia (CLAE, HPLC), tomando como referencia lo establecido en la guía ICH Q2(R) [9], que pueda ser empleado en estudios de la degradación cinética de la ROSUCa en función de la temperatura y el pH, o en estudios de estabilidad acelerada o natural de este fármaco.
Propiedades fisicoquímicas de la Rosuvastatina
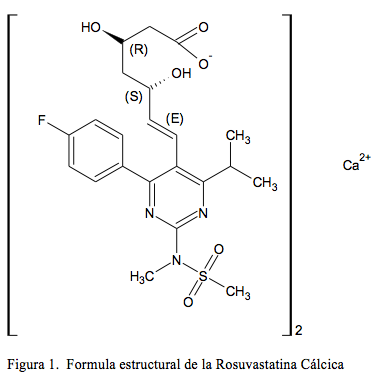
El nombre (IUPAC) sistemático de la ROSUCa es: Calcium (E, 3R, 5S)-7-[4-(4-(4-fluorophenyl)-2-(methyl-methylsulfonylamino)-6-propan-2-ylpyrimidin-5-yl)-3,5 dihydroxyhet-6-enoate, que corresponde a la formula condensada CaH54F2N6O12S2 cuya fórmula estructural se presenta en la Figura 1.
La ROSUCa es un polvo blanco a crema, ligeramente higroscópico. Es poco soluble en agua y en metanol y ligeramente soluble en etanol. La solubilidad en agua a una temperatura de 23°C es de 8 mg/mL [10]. La solubilidad de la ROSUCa fue determinada a pH de 1,2, 4,5 y 6,8, y se reportó que es ligeramente soluble en agua y a pH 6,8 y muy poco soluble a pH 1,2 y 4,5 [11]. Tiene un coeficiente de reparto octanol/agua de 0,13 a pH 7,2, un pKa de 4,5 a 25°C y un pH entre 7,5 y 8,3 en solución acuosa. La rotación óptica en una solución de metanol al 2,0% a 25°C está entre +5,5° y +7,5° [10].
METODOLOGIA
Equipos
Los análisis fueron realizados en un cromatografo líquido marca Merck Lachrom Elite con detector de arreglo de diodos (DAD), usando una Columna Waters Symmetry C18 de 50 x 4,6 mm, y un tamaño de partícula de 3,5µm. Para los análisis por espectrometría de masas se empleó un equipo Shimadzu LCMS-2010 EV, Modelo SCL-10AVP con un flujo de gas del Nebulizador de 1,5 L/min, temperatura del bloque de calentamiento 250 °C, Detector de Voltaje 1.50 Kvaltz, Qarray RFi Voltaje 150V, CDL Voltaje 200 V.
Reactivos
Estándar de Rosuvastatina Cálcica Working estándar , Estándar de Rosuvastatina Anti-isómero, Estándar de Rosuvastatina Lactona (Suministrados por MSN Lab); Metanol grado HPLC (MeOH), Acetonitrilo grado reactivo (ACN), ácido Clorhídrico, Hidróxido de sodio, Peróxido de Hidrógeno, Cloruro de sodio, Acetato de sodio, ácido Acético, Fosfato de Potasio (Merck Chemicals); Acido trifluoracético (TFA) (Sigma Aldrich), Viales ámbar para HPLC, Filtros jeringas tipo Nylon, material volumétrico clase A y B de volúmenes adecuados.
Estandarización del sistema cromatográfico
Existen diferentes métodos publicados que se pueden usar como indicativo de estabilidad de ROSUCa, sin embargo, ellos poseen ciertas desventajas pues solo identifican uno o dos productos de degradación [6, 8] y las corridas cromatográficas son extensas, requiriendo demasiada inversión en tiempo y en consumo de reactivos [7, 12]. De los métodos consultados se tomaron los aspectos más relevantes como fase móvil, flujo, longitud de onda, y se fueron adaptando con el fin de obtener el cumplimiento de los parámetros críticos como resolución, platos teóricos, factor de asimetría para cumplir con la idoneidad del sistema.
Estandarización del método de extracción
Para obtener una buena recuperación del fármaco se debe tener un conocimiento claro de sus propiedades fisicoquímicas como son: Solubilidad, pKa, coeficiente de reparto Octanol/agua, y pH, además, se debe escoger un solvente que no produzca interacción con el fármaco. Para la selección de la solución diluyente, se sometió la ROSUCa a degradación en medio ácido, y las soluciones degradadas se trataron con soluciones diluyentes (SD) Agua: ACN en proporción 1:1 y Agua: MeOH en proporción 1:1, respectivamente. Los resultados mostraron que con la solución diluyente que contiene metanol se forman más productos de degradación, posiblemente por la interacción entre el grupo OH de Metanol con el grupo ácido carboxílico de la ROSUCa para formar el éster correspondiente [12]. En este caso la mejor solución diluyente es donde se emplea un solvente aprótico como es el caso de ACN, para evitar la interacción que pueda tener el solvente con el grupo ácido carboxílico de la molécula de ROSUCa. Además esta solución diluyente mantiene la estabilidad de la muestra y el estándar, permitiendo una buena recuperación del fármaco [7].
Selectividad
La selectividad se evaluó respecto a la solución diluyente y frente a soluciones de diferentes pH como 1,2, 2,5, 3,5, 4,5, 6,8 y 8,0. Además, se realizó la degradación forzada del fármaco en condiciones ácidas, básicas, oxidativas (Peróxido de hidrógeno), en luz solar directa y bajo luz ultravioleta a 255 y 360 nm.
Linealidad
La linealidad fue evaluada según la guía ICH2QR [9], y se determinó al preparar soluciones de ROSUCa en solución diluyente con las siguientes concentraciones: 10, 20, 50, 80, 100, 120, 150 ppm.
Precisión
La repetibilidad se evaluó como lo recomienda la USP 36, sobre tres niveles de concentración y tres réplicas de cada nivel, en un rango de soluciones de 10 a 150 ppm. La precisión intermedia se evaluó para dos analistas en dos días diferentes a la concentración nominal de 100 ppm.
Exactitud
La evaluación de este parámetro se determinó mediante el porcentaje de recuperación para tres niveles de concentración: 10%, 100% y 150%, que cubre el rango de la linealidad. La exactitud se evaluó en los pH de 1,2, 4,5 y 8,0.
Límites de Cuantificación (LOQ) y detección (LOD)
Los valores de LOQ y LOD, se estimaron a partir del nivel inferior de la exactitud (10 ppm) a partir de las ecuaciones 1 y 2, donde Cstd es concentración del estándar y S/N es la relación señal/ruido.
RESULTADOS Y DISCUSION
Idoneidad del Sistema
Para verificar la idoneidad del sistema se preparó una solución de ROSUCa a una concentración de 0,2 mg/mL, que se sometió a hidrólisis ácida con el objetivo de generar el producto de degradación de Rosuvastatina Anti-isómero. La resolución entre ambos picos fue mayor a 2,0, el número de platos teóricos (N) fue mayor a 1500, el factor de cola fue menor de 2,0, y el coeficiente de correlación para la curva de calibración de estándar fue mayor a 0,99. Los valores obtenidos cumplen con los criterios establecidos en el capítulo 621 de la USP 36 [13].
Estandarización del Método Cromatográfico
Tomando como referencia la bibliografía consultada [6,8,11] y después de realizar diversas modificaciones a las condiciones cromatográficas, se seleccionaron las siguientes: columna C18 encapada, de 50 x 4,6 mm y 3,5 micrómetros de tamaño de partícula, el flujo de 1,0 mL/min, 30°C de temperatura, y 10 µL de volumen de inyección. La fase móvil fue MeOH: Agua- 0,1% TFA, (1:1). Se empleó un detector UV-DAD con una longitud de onda fija de 243 nm.
Estandarización en la preparación de estándar y muestras
Se transfirió aproximadamente 100 mg de ROSUCa, exactamente pesados, a una volumétrica de 100-mL ámbar, se adicionó 20 mL de ACN, se agitó manualmente hasta la disolución total y se llevó a volumen con SD. Se seleccionó la solución diluyente (SD) agua: ACN en la proporción 1:1, porque en esta solución la ROSUCa presenta una buena solubilidad y no presenta interferencia, además la estabilidad en esta solución a temperatura ambiente es de 36 horas [7]. De la solución inicial se tomaron diferentes alícuotas para preparar la curva de calibración a concentraciones de 10, 100 y 150 ppm, la solución muestra se preparó a una concentración de 100 ppm. La solución estándar y la muestra fueron pasadas por filtros jeringa de Nylon de 0,45 micrómetros, este filtro fue seleccionado porque se encontró que no produce retención del activo [7]. Para evitar que se produzca degradación del activo se protegieron de la luz directa el material de vidrio usado para almacenar las soluciones muestras y estándar.
Selectividad
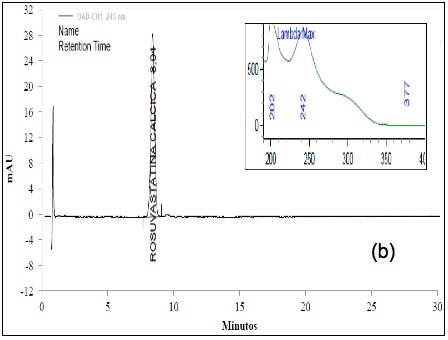
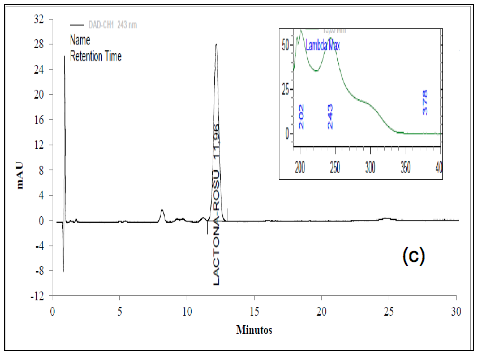
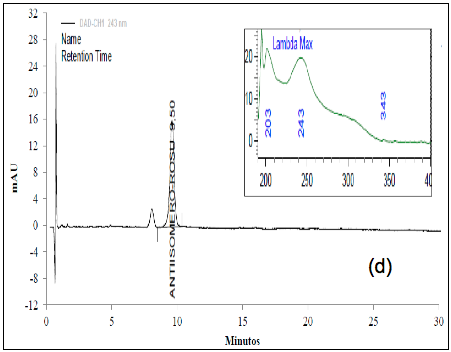
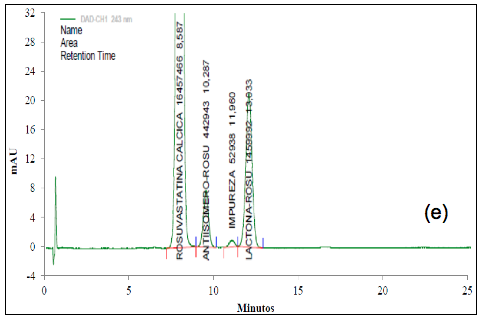
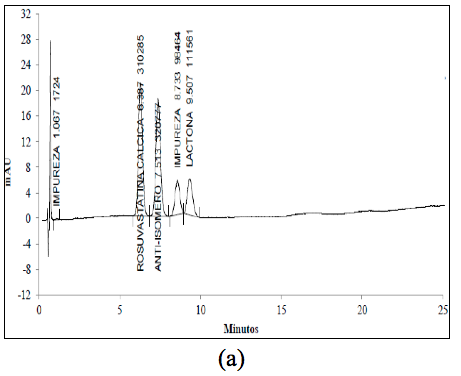
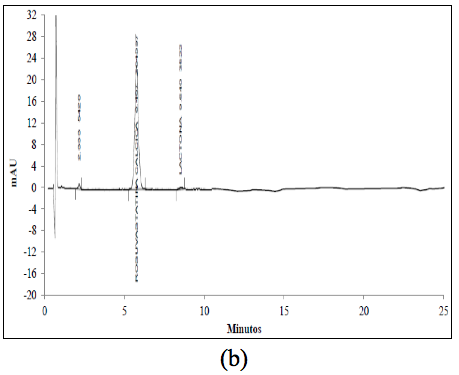
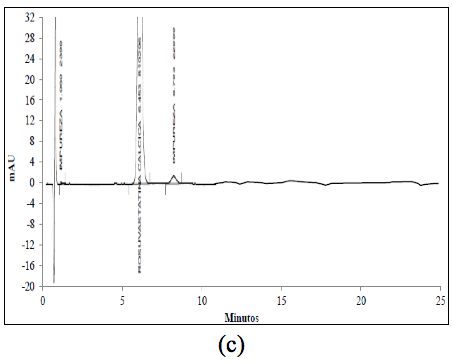
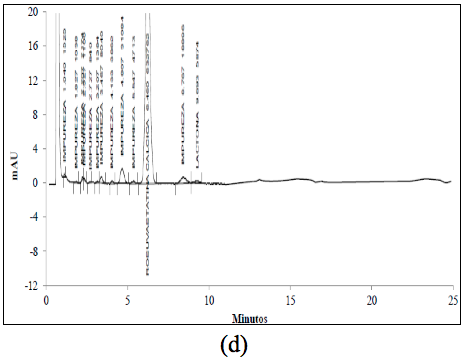
El análisis de los cromatogramas obtenidos para evaluar la selectividad frente a las soluciones buffer, frente a soluciones de estándar de impurezas como: Rosuvastatina anti-isómero y Rosuvastatina Lactona, y frente a soluciones de muestra en diferentes condiciones de degradación, como fueron condiciones ácidas, básicas, calor, oxidativas, y fotolíticas, permiten concluir que las soluciones y los productos de degradación generados bajo cada una de las condiciones no interfieren con la señal correspondiente al activo (Figura 2 y Figura 3).
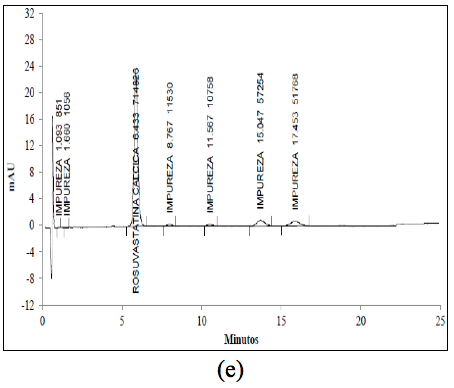
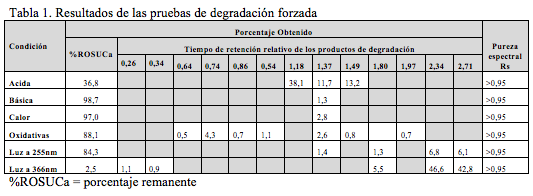
En la Tabla 1 se resumen los porcentajes de degradación obtenidos para cada señal y el porcentaje de degradación remanente para la ROSUCa, así como los TRR (Tiempos de retención relativo) para cada compuesto de degradación y la pureza espectral de pico de la ROSUca. La ROSUCa resultó ser estable en condiciones básicas y térmicas.
El cromatograma correspondiente a la hidrólisis ácida (Figura 3a) presenta cuatro señales: aproximadamente a los 6,4 min., aparece la señal correspondiente a la ROSUCa; y con TRR de 1,18, 1,37 y 1,49 min, aparecen los posibles compuestos de Rosuvastatina Anti-isómero, Rosuvastatina Anti-isomero Lactona y Rosuvastatina Lactona respectivamente. Estos compuestos coinciden con los reportados en la literatura bajo las condiciones descritas [14]. Esta solución fue evaluada por espectrometría de masas, en donde se encontró que la señal correspondiente a la ROSUCa presenta un pico base con m/z de 482, que coincide con el peso molecular de la ROSU, la señal correspondiente a la Rosuvastatina Anti-isómero produce un pico base con m/z 482 y la señal correspondiente a la Rosuvastatina Lactona produce un pico base con m/z 464, debida a la ciclación entre el grupo OH y el grupo carboxílico y la pérdida de una mol de agua para producir la lactona correspondiente. La señal presenta un pico base con m/z 464, posiblemente corresponde al compuesto Rosuvastatina Anti-isomero Lactona [15]. En los espectros ultravioleta para la ROSUCa y los productos de degradación mayoritarios bajo las condiciones ácidas, se observa un similar máximo absorción a los 243 nm (Figura 2b, c y d).
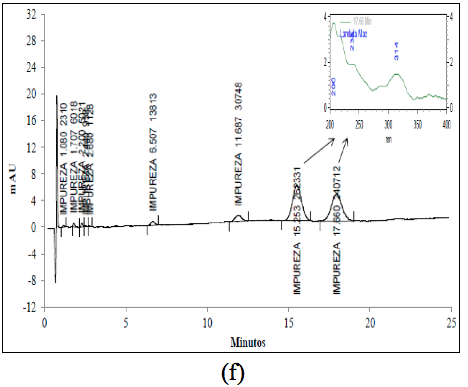
La ROSUCa en solución resultó ser muy inestable cuando se somete a una radiación de 255 nm, originando dos productos de degradación principales con un porcentaje de 6,8% y 6,1% y tiempos de retención relativos de 2,34 y 2,71, respectivamente. Los porcentajes de los productos de degradación cuando se somete la ROSUCa a una radiación de 366 nm son de 46,6% y 42,8% y los espectros obtenidos presentan un máximo de 314 nm (Figura 3f). Estos productos se pueden deber a la transformación fotoquímica de la ROSUCa en solución acuosa, proceso que ha sido estudiado y ha permitido la identificación de cuatro productos de degradación, dos de los cuales son mayoritarios y consisten en una mezcla diastomérica de dos especies, las cuales presentan una máxima absorbancia en el espectro UV a 314 nm [16]. Los dos diastero-isómeros formados presentan la misma masa molecular de la ROSUCa con un ión molecular con m/z 482 [14].
Linealidad
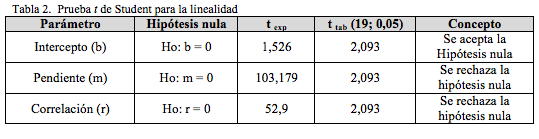
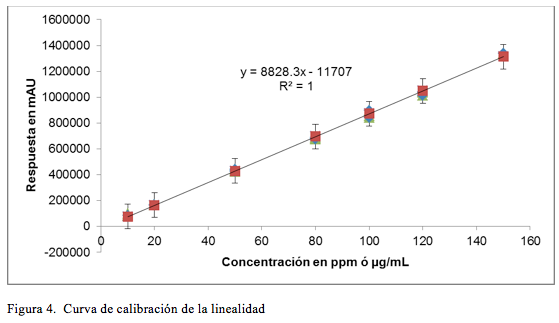
La Figura 4 muestra la curva de calibración para la linealidad, según las guías ICHQ2(R). Como se muestra en la Tabla 2, la prueba t para un nivel de confianza del 95% y n-2 grados de libertad indican que estadísticamente hay proporcionalidad entre la concentración y la respuesta analítica para el rango comprendido entre 10 y 150 ppm. También muestra que la pendiente es estadísticamente diferente a cero y el intercepto no es estadísticamente diferente de dicho valor. Todo lo anterior indica que para el modelo lineal propuesto, los errores sistemáticos no afectan la linealidad.
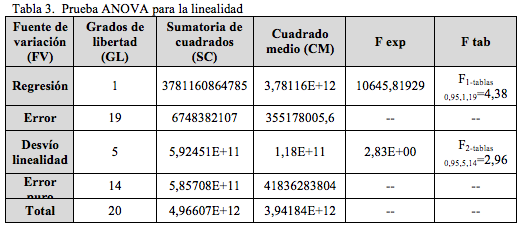
Los resultados de la prueba ANOVA (Tabla 3), indican que no hay dispersión estadísticamente significativa entre los resultados de las réplicas de las distintas concentraciones, corroborando el cumplimiento de la linealidad de la metodología.
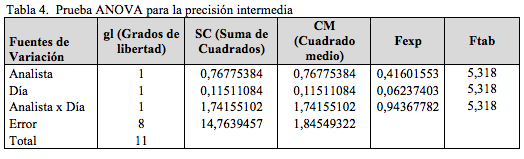
Precisión
Como se muestra en la Tabla 4, el análisis de varianza, mediante un test F para la precisión intermedia, indica que no se presentan diferencias estadísticamente significativas por realizar el análisis en días diferentes o con analistas diferentes [17].
Exactitud
Las soluciones a pH 1,2, 4,5 y 8,0, fueron preparadas adicionando 1 mL de cada solución buffer a la solución final de muestra y aforadas en solución diluyente, este procedimiento se realizó a temperatura entre 2 y 5°C. Las muestras fueron inyectadas en el menor tiempo posible para evitar la degradación. La Tabla 5 muestra que el porcentaje de recuperación en las soluciones fue superior al 98.0% e inferior al 102.0%. Para la prueba t de Student se puede apreciar que el valor calculado es menor que el tabulado, por lo tanto se acepta la hipótesis nula (Ho) y se afirma que no existe diferencia estadísticamente significativa entre los datos y el 100%. La prueba de Cochran muestra que existe homogeneidad entre las varianzas para los diferentes niveles de concentración a pH de 4,5 y 6,8, indicando que el nivel de concentración no influye en la variación de los resultados. A pH 1,2 se acepta la hipótesis alternativa Gexp 0,906 > Gtab 0,8709, significando que las varianzas para los tres niveles no son equivalentes.
Límites de Detección y Cuantificación
A partir del nivel inferior de la exactitud, que equivale a 0,01 mg/mL (10 ppm) se estimaron los límites de detección y cuantificación [18]. Los valores de LOD y LOQ para los diferentes pH se resumen en la tabla 6.
Estos valores sirven para comprobar que el equipo posee una sensibilidad tal que permite cuantificar el analito con el método empleado en soluciones de concentración de 5,99 ppm, y detectarlo en soluciones a una concentración de 1,80 ppm.
CONCLUSIONES
Se desarrolló y validó una metodología analítica indicativo de estabilidad por HPLC para la cuantificación de ROSUCa en diferentes soluciones buffer. Los resultados de la validación muestran que la metodología propuesta es selectiva, lineal, precisa y exacta; por tanto, es confiable para utilizarla en la cuantificación del activo ROSUCa en estudios de degradación, cinéticas en función del pH y la temperatura y en estudios de estabilidad del fármaco.
AGRADECIMIENTOS
Agradecemos a PROCAPS S.A.S. y al Laboratorio de HPLC/masas del Departamento de Química de la Universidad Nacional de Colombia.
REFERENCIAS
1. A. Troncoso-Mariño, C. Martín-Cantera, Novedades sobre estatinas: Rosuvastatina y Pivastatina, Butlletí d´Informació Terapèutica, 22, 45-50 (2011). [ Links ]
2. M. Watanabe, H. Koike, I. Teruyuki, T. Okada, S. Seo, K. Hirai, Synthesis and biological activity of methanesulfonamide pyrimidine-and N-methanesulfonyl pyrrole-substituted 3,5-dihydroxy-6-heptenoates, a novel series of HMG-CoA reductase inhibitors, Bioorganic & Medicinal Chemistry, 5(2), 437-444 (1997). [ Links ]
3. A. Wierzbickia, R. Postonb, A. Ferro, The lipid and non-lipid effects of statins, Pharmacology & Therapeutics, 99, 95-112 (2003). [ Links ]
4. G. Giunta, E. Guevara, L. Marziali, Rosuvastatin slows the progression of aortic stenosis caused by hypertension regardless of its lipid-lowering effects, Revista Argentina de Cardiología, 80(1), 14-20 (2012). [ Links ]
5. T. Mehta, A. Patel, G. Kulkarni, G. Suubbaiah, Determination of Rosuvastatin in the presence of its degradation products by a stability-indicating LC method, Journal of AOAC International, 88(4), 1142-1147 (2005). [ Links ]
6. G. Reddy, B. Reddy, S. Haque, H. Gautam, P. Kumar, A. Kumar, J. Park, Development and validation of a stability-indicating UPLC method for rosuvastatin and its related impurities in pharmaceutical dosage forms, Química Nova, 34, 250-255 (2011). [ Links ]
7. H. Kaila, M. Ambasana, R. Thakkar, H. Saravaia, A. Shah, A new improved RP-HPLC method for assay of rosuvastatin calcium in tablets, Indian Journal of Pharmaceutical Sciences, 72(5), 592-598 (2010). [ Links ]
8. H. Trivedi, M. Patel, Development and validation of a stability-indicating RP-UPLC method for determination of rosuvastatin and related substances in pharmaceutical dosage forms, Scientia Pharmaceutica, 80, 393-406 (2012). [ Links ]
9. ICH Harmonised Tripartite Guideline, ICHQ2(R), Validation of analytical procedures: text and methodolgy Q2(R1), International Conference on Harmonisation of Technical Requirements for registration pharmaceuticals for human use, 1994, pp. 1-12. [ Links ]
10. "The Merck Index", Merck & Co. Inc., New York, 2006. [ Links ]
11. J. Dwivedi, R. Dwivedi, M. Ashawat, I. Singhvi, A. Mehta, A. Chandwani, O. Mahatma, Solubility and dissolution rate determination of rosuvastatin calcium in different pH media using UV-visible spectrophotometer, Inventi Rapid: Pharmaceutical Technology, Inventi:ppt/359/11, 1-3 (2011). [ Links ]
12. D.-J. Yang, L.S. Hwang, Study on the conversion of three natural statins from lactone Study on the conversion of three natural statins from lactone Study on the conversion of three natural statins from lactone, Journal of Chromatography A, 1119, 277-284 (2006). [ Links ]
13. The United States Pharmacopeial Convention, US Pharmacopeia 36, Baltimore, 2012, pp. 4594-4596. [ Links ]
14. R. Shah, A. Sahu, S. Singh, LC-MS/TOF, LC-MSn, on-line H/D exchange and LC-NMR studies on rosuvastatin degradation and in silico determination of toxicity of its degradation products: a comprehensive approach during drug development, Analytical and Bioanalytical Chemistry, 405(10), 3215-3231 (2013). [ Links ]
15. S. Singh, T. Handa, M. Narayanam, A. Sahu, M. Junwal, R. Shah, A critical review on the use of modern sophisticated hyphenated tools in the characterization of impurities and degradation products, Journal of Pharmaceutical and Biomedical Analysis, 69, 148-173 (2012). [ Links ]
16. A. Astarita, M. DellaGreca, M.R. Iesce, S. Montanaro, L. Previtera, Polycyclic compounds by sunlight exposure of the drug rosuvastatin in water, Journal of Photochemistry and Photobiology A, 187, 263-268 (2007). [ Links ]
17. J.C. Miller, J.M. Miller, "Estadística para Química Analítica", Addison-Wesley Iberoamericana, Wilmington, 1993. [ Links ]
18. Y. Kazakevich, R. Lobrutto, "HPLC for Pharmaceutical Scientists", John Wiley & Sons, Inc., New Jersey, 2007. [ Links ]