Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.43 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rcciquifa.v43n1.45466
http://dx.doi.org/10.15446/rcciquifa.v43n1.45466
Artículo de investigación tecnológica
Determinación de clorhidrato de ranitidina por cromatografía líquida de alta resolución en una solución inyectable
Ranitidine hydrochloride assay by high resolution liquid chromatography in an injectable solution
Ernesto Benítez Hechavarría•, Maryori Núñez Cuadra, German Eduardo Colindres Galindo, Keiryn Merary Moncada Mendoza.
• Laboratorios Andifar, Col. Kennedy, Zona Industrial Jacaleapa, Carretera a UNITEC, Tegucigalpa, Honduras. Correo electrónico: 1 ebhrria@yahoo.com
Recibido para evaluación: Diciembre 23 de 2013
Aceptado para publicación: Mayo 22 de 2014
RESUMEN
En la Farmacopea de los Estados Unidos se orienta como valorar el clorhidrato de ranitidina en una solución inyectable pero cuando se intentó reproducir esta monografía, la ranitidina no se adsorbió a una columna similar a la recomendada. El objetivo del presente trabajo fue validar un método alternativo para la cuantificación de clorhidrato de ranitidina en una solución inyectable. El método alternativo empleado fue el descrito en la Farmacopea de los Estados Unidos para la cuantificación del clorhidrato de ranitidina (la sustancia activa), con modificaciones. La validación del método se realizó siguiendo las indicaciones de la Guía Q2(R1) de la Conferencia Internacional sobre la Armonización. Además se determinó la incertidumbre del método. Los coeficientes de variación obtenidos para la precisión intermedia fueron inferiores a 1,0 %; en la exactitud el recobrado fue de 100,30 % y en la linealidad se demostró la ausencia de curvatura en el intervalo 80 a 120 %. La incertidumbre expandida calculada fue inferior al 2 % de la concentración presente en las muestras. Todos los parámetros de validación evaluados se encontraron dentro los límites de aceptación establecidos por lo que se concluye que el método es adecuado para los fines propuestos.
Palabras claveClorhidrato de ranitidina, Cromatografía Líquida de Alta Resolución, CLAR, validación, incertidumbre.
SUMMARY
The United States Pharmacopeia instructs for the determination of ranitidine hydrochloride in an injectable solution but when we tried to reproduce this monograph, the ranitidine was not adsorbed in a similar column as the recommended. The aim of the present work was to validate an alternate method for the determination of ranitidine hydrochloride in an injectable solution. The alternate method was the one described in the United States Pharmacopeia for the determination of ranitidine hydrochloride (active pharmaceutical ingredient), with modifications. The method was validated as per Q2(R1) Guideline, of the International Conference on Harmonization. Method´s uncertainty was also determined. The coefficient of variation obtained for intermediate precision was less than 1.0 %; in the accuracy, the recovery was 100.30 % and the linearity showed absence of curvature in the range of 80 to 120 %. The expanded uncertainty calculated was less than 2 % of the amounts in the samples. All validation parameters evaluated were within acceptation limits established, therefore it is concluded that the method is suitable for the intended purposes.
Key words:Ranitidine hydrochloride, High Performance Liquid Chromatography, HPLC, validation, uncertainty.
INTRODUCCIÓN
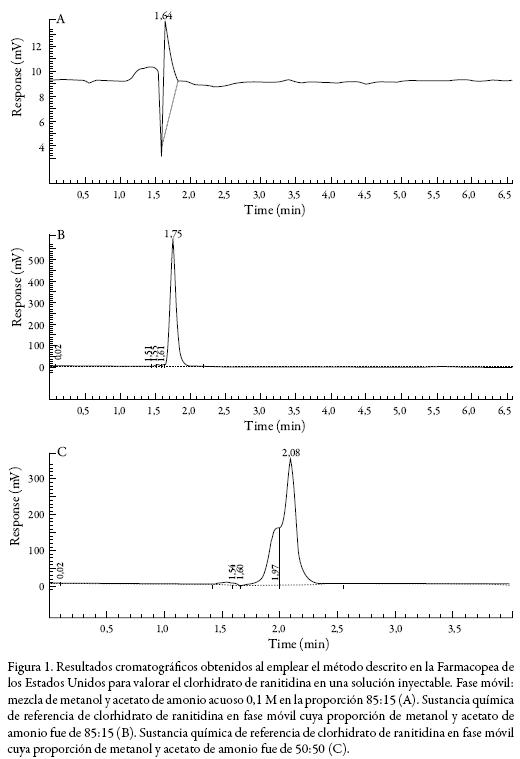
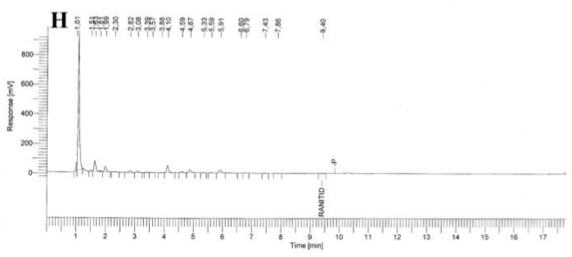
El clorhidrato de ranitidina es un antagonista de los receptores H2 de histamina por lo que es utilizado como inhibidor de la secreción gástrica así como para el tratamiento de las ulceraciones gástricas y duodenales [1]. En la Farmacopea de los Estados Unidos (USP, para sus siglas en inglés) existe una monografía que orienta la manera de valorar esta sustancia en una solución inyectable por Cromatografía Líquida de Alta Resolución (CLAR) y donde se indica el uso de una columna de 4,6 mm x 20 - 30 cm, rellena con material L1 (C18) [2]. Se intentó reproducir esta monografía utilizando una columna Agilent Eclipse Plus C18 (4,6 mm x 15 cm, 5 µm de tamaño de partícula) pero la ranitidina no se adsorbió a la columna y cuando se disminuyó la fuerza de la fase móvil, los picos obtenidos fueron anchos y con hombros (Figura 1).
El objetivo del presente trabajo fue validar un método alternativo para la cuantificación de clorhidrato de ranitidina en una solución inyectable, con el propósito de ser utilizado para el control de calidad de esta solución.
METODOLOGíA
Químicos y reactivos
Como sustancias químicas de referencia primaria y secundaria de clorhidrato de ranitidina se utilizaron: sustancia de referencia USP (lote H1G103) y sustancia de referencia de Laboratorio Andifar (lote A015), respectivamente. Las soluciones inyectables de clorhidrato de ranitidina y su placebo, fueron elaboradas en el Laboratorio Andifar. Los reactivos: ácido fosfórico, hidróxido de sodio y acetonitrilo (grado CLAR), fueron adquiridos de Merck (Honduras).
Instrumentación CLAR y condiciones
En el ensayo se empleó un sistema cromatográfico (Perkin Elmer, series 200) con detector UV-Visible ajustado a 230 nm y una columna Agilent Eclipse Plus C18 (4,6 x 150 mm, 5 µm de tamaño de partícula), la velocidad de flujo fue de 1,5 mL/min y la temperatura de 35° C.
Se preparó una solución amortiguadora de fosfato, pH 7,1 (en matraz volumétrico de 2,0 L se añadieron 1900 mL de agua, 6,8 mL de ácido fosfórico concentrado y 8,6 mL de hidróxido de sodio 50 % (m/V), se comprobó que el pH fuera 7,1 ± 0,1 y se llevó a marca de aforo con agua destilada). Se preparó la Solución A donde se mezcló la solución amortiguadora de fosfato y acetonitrilo en la proporción 98:2. Se preparó la Solución B donde se mezcló la solución amortiguadora de fosfato y acetonitrilo en la proporción 78:22. Como fase móvil se utilizaron mezclas variables de Solución A y Solución B, tal y como se indica en la tabla 1. Tanto la sustancia química de referencia como la muestra se prepararon a una concentración de 72 µg/mL de clorhidrato ranitidina, en Solución A.
Validación del método
La validación se realizó siguiendo las indicaciones de la Guía Q2(R1) de la Conferencia Internacional sobre la Armonización (ICH, para sus siglas en inglés) [3]. De acuerdo a esta guía, el método clasifica como ensayo cuantitativo de una sustancia activa en un producto terminado al cual se le deben evaluar los siguientes parámetros de validación: especificidad, precisión (repetibilidad y precisión intermedia), exactitud, linealidad y rango.
Preparación de las muestras. Se prepararon muestras adicionadas al 80 %, 90 %, 100 %, 110 % y 120 % de la cantidad declarada de clorhidrato de ranitidina en la solución inyectable: 30 mg/mL. Para evaluar los diferentes parámetros, a estas muestras se les realizaron diluciones hasta obtener la concentración del ensayo: 72 µg/mL.
Especificidad. Se analizó el placebo y el placebo sometido a condiciones de estrés: hidrólisis básica (NaOH 0,1 N), hidrólisis ácida (HCl 0,1 N) y oxidación (H2O2 3 %), la relación placebo y solución de estrés fue de (1:1), todas se sometieron a 100° C durante 15 minutos, con reflujo. También se analizó la sustancia química de referencia secundaria sometida a hidrólisis ácida, básica y oxidación (se disolvieron 144 mg de clorhidrato de ranitidina en 100 mL de HCl 0,1 N, NaOH 0,1 N, y H2O2 3 % respectivamente, estas soluciones se sometieron a 100° C durante 15 minutos, con reflujo y luego se les realizó una dilución de 1 mL en 20 mL con la solución A indicada en Instrumentación CLAR y condiciones). Criterio de aceptación (CA): la señal, en los cromatogramas del placebo y placebos sometidos a estrés, en la zona correspondiente al clorhidrato de ranitidina debió ser menor a 0,5 % de la señal de la sustancia química de referencia [3].
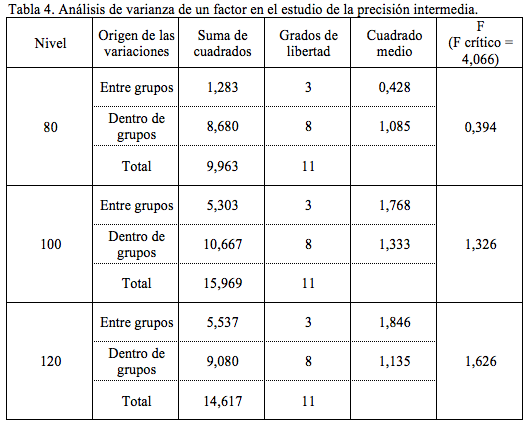
Precisión (Repetibilidad y Precisión Intermedia). Para la repetibilidad se realizó 6 veces el método completo a una misma muestra, preparada al 100 % de la cantidad declarada de clorhidrato de ranitidina [3]. Se determinó el intervalo de confianza (IC=Promedio ±t(n-1)*s/n½),donde (tn-1(p=0,05,n-1=5)=2,571) y el coeficiente de variación (CV) [3, 4]. Para la precisión intermedia se analizaron las muestras al 80 %, 100 % y 120 % de la cantidad declarada de clorhidrato de ranitidina: 30 mg/mL. Las muestras fueron analizadas por triplicado, por cuatro analistas, en dos sistemas cromatográficos diferentes y en cuatro días distintos [3]. Se realizó un análisis de varianza de un factor (factor día) para las tres concentraciones. Se calculó el coeficiente de variación esperado (CVesp) utilizando la ecuación de Horwitz [5]. Se determinaron los intervalos de confianza (IC) y los coeficientes de variación (CV) [3, 4]. El CA para la repetibilidad fue que el CV debió ser inferior a 2,74 % (intervalo de aceptación 95-105 % y dos réplicas) [6]. El CA para la precisión intermedia fue que el CV obtenido para cada una de las concentraciones debió encontrarse por debajo o en el intervalo de 0,2 a 1 veces el CVesp [7].
Exactitud. Para la exactitud se analizaron las muestras al 80 %, 100 % y 120 % de cantidad declarada de clorhidrato de ranitidina (tres réplicas por concentración, un día, un analista) [3]. Se determinó el recobrado y el intervalo de confianza del recobrado. Como CA se utilizó que la recuperación debió encontrarse entre 97 y 103 % [6].
Linealidad. Para la linealidad se analizaron cinco concentraciones (cada una por triplicado) obtenidas a partir de una solución madre de la sustancia química de referencia [3]. Las concentraciones inyectadas fueron: 80 %, 90 %, 100 %, 110 % y 120 %, donde el 100 % correspondió a 72 µg/mL de clorhidrato de ranitidina de la sustancia química de referencia. Se determinaron: la ecuación de la recta y el coeficiente de determinación [3]. Para comprobar la bondad de ajuste al modelo lineal se graficaron los residuales y además se comparó la varianza de la falta de ajuste contra la varianza del error experimental puro a través de un análisis de varianza, previamente se demostró homogeneidad de varianzas por Cochran (CA: los residuales debieron de encontrarse normalmente distribuidos, con ausencia de curvatura y de datos aberrantes; en el análisis de varianza el F calculado debió ser menor que el F tabulado, 3,71) [7]. La dispersión de los datos alrededor de la línea de regresión se determinó a través de desviación estándar relativa de la pendiente, Sbrel(%) (CA: el valor de Sbrel(%) debió ser menor que 5,0 %) [7]. Por último, para determinar si el intercepto era significativamente distinto de cero, se realizó la prueba t de student (criterio de aceptación: el t calculado debió ser menor que el tabulado, 3,18) [4, 7].
Rango. El rango se estableció desde un 80 % hasta un 120 % de la concentración del ensayo: 72 µg/mL que corresponde al intervalo de concentración en la muestra de (24-36) mg/mL [3].Todos los datos obtenidos fueron procesados por el programa Microsoft Excel del paquete de programas Office y por el programa SPSS 15.0 para Windows [8].
Determinación de la Incertidumbre del Método Se utilizaron los datos de la validación para el cálculo de la incertidumbre del método. Se combinó la incertidumbre asociada al recobrado (exactitud) y a la precisión intermedia [9-11]. Para obtener la incertidumbre asociada al recobrado se utilizaron los datos obtenidos con las muestras del estudio de la precisión intermedia, (se determinó el recobrado, la desviación estándar y la incertidumbre asociada a la preparación de estas muestras) [10, 11]. La incertidumbre asociada a la precisión intermedia fue la desviación estándar obtenida cuando se analizaron las muestras por los diferentes analistas y en los diferentes días [9, 10].
RESULTADOS Y DISCUSIÓN
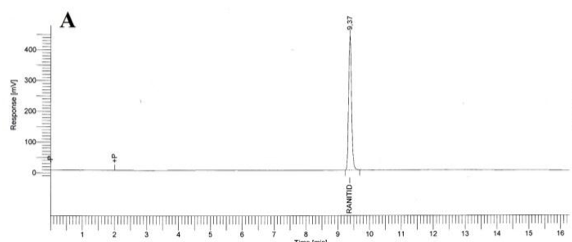
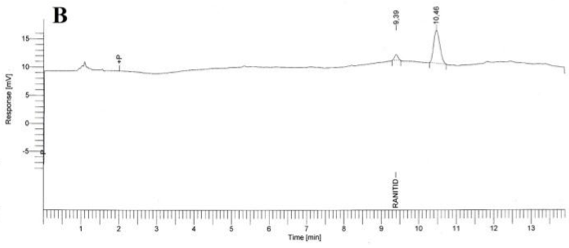
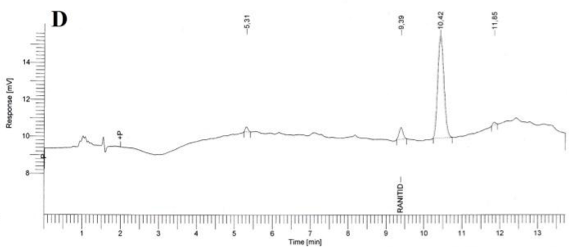
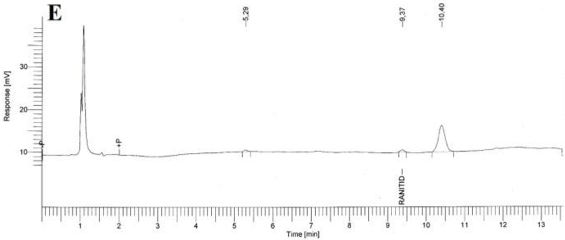
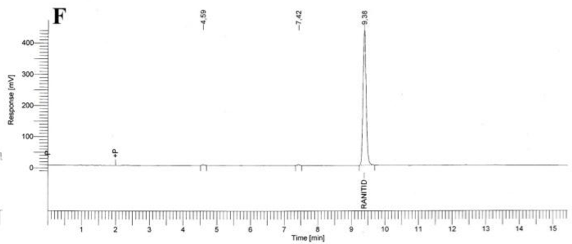
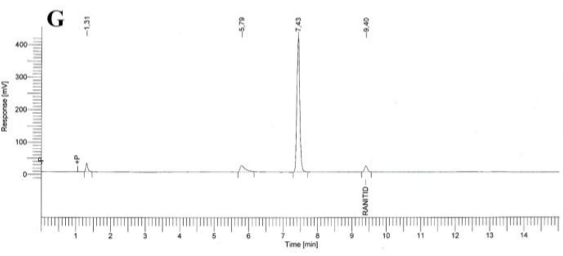
Especificidad. Los resultados del estudio de la especificidad se muestran en la Figura 2. Se observó una pequeña señal en la zona correspondiente al clorhidrato de ranitidina, tanto en el cromatograma del placebo (B), como en los cromatogramas del placebo sometido a estrés (C, D, E); sin embargo en todos los casos, esta señal fue inferior a 0,2 % de la señal de la sustancia química de referencia. Cuando se realizó la hidrólisis ácida de la sustancia química de referencia (F) no existió degradación; en cambio la hidrólisis básica de esta sustancia de referencia provocó la degradación casi total del clorhidrato de ranitidina con la aparición de un pico con tiempo de retención (TR) de 7,43 (G). La oxidación con peróxido de hidrógeno de la sustancia química de referencia también condujo a una degradación total del clorhidrato de ranitidina con la aparición de varios picos, de los cuales el mayoritario no fue retenido por la columna (H).
Como se evidencia en los resultados obtenidos, los componentes del placebo no interfieren en la determinación de clorhidrato de ranitidina. Respecto a la sustancia química de referencia, ella permanece estable a pH ácido pero muestra una degradación severa a pH alcalino. Del mismo modo, un medio oxidante también provoca una descomposición drástica del clorhidrato de ranitidina. El hecho de que no aparezcan picos, en la zona correspondiente al clorhidrato de ranitidina, en las degradaciones a pH alcalino y en medio oxidante; es un indicador que los productos de estas degradaciones no interfieren en su análisis.
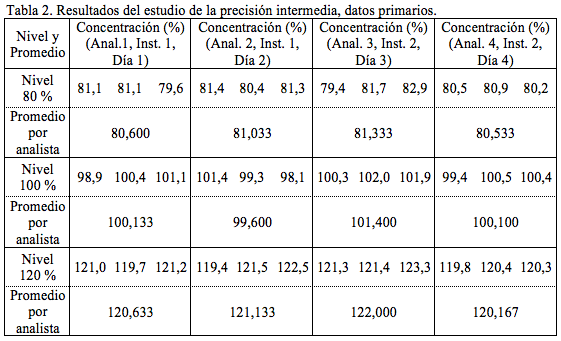
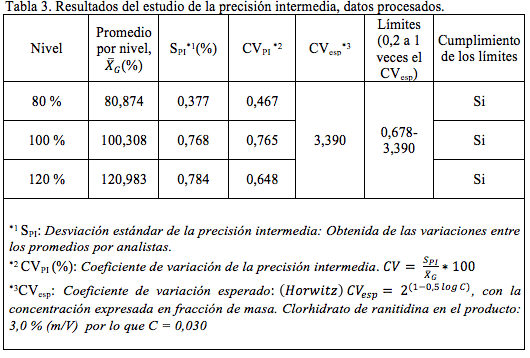
Precisión. En el estudio de la repetibilidad del método se obtuvo: desviación estándar = 0,58 %, CV = 0,59 % y un intervalo de confianza de ± 0,61 %. Los resultados obtenidos por cada analista, en el estudio de la precisión intermedia se muestran en la tabla 2 y 3 y los resultados del análisis de varianza se muestran en la tabla 4.
La repetibilidad del método cumple con el límite establecido, el CV fue inferior a 2,74, que es el límite cuando se realizan dos réplicas y el intervalo de aceptación es de 95 a 105 % de la cantidad declarada [6], este es el intervalo establecido por control de calidad para la liberación de los lotes. La Guía ICH Q2(R1) establece como debe ser evaluada la repetibilidad del método; sin embargo respecto a la precisión intermedia, no establece una pauta concreta. En el caso de la precisión intermedia muchos autores prefieren determinar el coeficiente de variación global, es decir, considerando cada resultado de manera independiente [12, 13]. Otros autores prefieren separar la contribución de uno o más factores a la varianza global de la precisión intermedia [14-16]. En la tabla 3 se observa que para las tres concentraciones se cumple con el límite establecido, es decir los CV de la precisión intermedia (0,5 %; 0,8 % y 0,6 %) se encontraron en o por debajo del intervalo de 0,7 % a 3,4 %. En el análisis de varianza (tabla 4), para las tres concentraciones el F calculado fue inferior al crítico, por lo que los promedios obtenidos en los diferentes días no difieren estadísticamente y la variabilidad total es explicada por la variabilidad dentro de los grupos, es decir por la variabilidad de la repetibilidad.
Exactitud. En cuanto a la exactitud, la guía de la ICH para la validación de métodos analíticos [3] especifica que esta debe reportarse como el porciento de recobrado (valor obtenido: 100.30 %) en conjunto con los intervalos de confianza (valores obtenidos: x± 0,37 %). La recuperación obtenida se encuentra dentro de los valores aceptables para los formulados farmacéuticos (97-103 %) [6].
Linealidad. Los resultados de la linealidad se muestran en la tabla 5, el gráfico de los residuales indica que los mismos se distribuyeron normalmente, sin datos aberrantes o tendencias hacia un mismo signo de los datos cercanos, también demuestra que la varianza es constante en todo el intervalo de X, lo cual fue confirmado con la prueba de Cochran. Al ser la varianza independiente de la concentración, no hubo necesidad de realizar una regresión ponderada. En el análisis de varianza, el valor de F calculado fue menor que el tabulado, esto indica que la varianza de falta de ajuste no es estadísticamente mayor que la del error puro; esto quiere decir que no existe un error debido a la falta de ajuste que no pueda ser atribuido al error propiamente aleatorio, por lo que el modelo lineal se ajusta a los datos experimentales. Una vez demostrada la ausencia de curvatura, se evalúa la dispersión de los datos alrededor de la curva de calibración a través de la Sbrel(%), la cual es inferior al límite recomendado de 5 % [7]. Finalmente se demuestra que el intercepto no fue distinto de cero utilizando la prueba t de student.
En la guía de la ICH [3] especifican que la linealidad puede ser demostrada directamente en la sustancia activa (por dilución de una solución madre) y/o en pesadas separadas de mezclas sintéticas de los componentes del producto. Como no se encontraron errores sistemáticos significativos en el estudio de la exactitud y como la señal del placebo fue muy baja en el estudio de la especificidad, entonces se infiere que la recta proveniente de la mezcla de los componentes del producto no difiere de la obtenida con la sustancia activa.
Determinación de la Incertidumbre del Método. Las incertidumbres expandidas calculadas a partir de los datos obtenidos en los ensayos de la precisión intermedia, para las muestras del 80 %, 100 % y 120 %, fueron: (24,3 ± 0,3), (30,1 ± 0,5) y (36,3 ± 0,5) mg/mL respectivamente; esta incertidumbre se calculó utilizando un factor de cobertura de 2, el cual ofrece un nivel de confianza del 95 %. La forma detallada de cómo se calculó esta incertidumbre para la muestra del 100 %, se presenta en la tabla 6.
La incertidumbre expandida, calculada para las tres concentraciones, es inferior al 2 % de las concentraciones de las muestras. Para el cálculo de la incertidumbre asociada al recobrado, algunos autores sugieren el análisis de un material de referencia certificado o una muestra adicionada, al menos 10 veces, utilizando las mismas condiciones y en un mismo día [10]. Otros autores sugieren que para calcular el recobrado, el análisis del material de referencia certificado o la muestra adicionada debe realizarse en series analíticas diferentes (días distintos) [9]. El recobrado que se obtiene para las tres muestras no es significativamente diferente de 1, aunque siempre existe una incertidumbre asociada al cálculo del mismo. Las muestras analizadas son soluciones, por lo que no es necesario considerar el factor que corrige las diferencias de recobrado de las muestras reales y las muestras adicionadas porque son de igual composición [10]. Respecto a la incertidumbre asociada a la precisión, es necesario continuar analizando las muestras adicionadas por un período más amplio, para así tener un mejor estimado de la variabilidad del método.
El propósito de este método es la cuantificación de clorhidrato de ranitidina en una solución inyectable, este producto terminado se libera en producción si cumple con una especificación para la potencia de 95 % a 105 % de la cantidad declarada (± 5 %).
CONCLUSIONES
Todos los parámetros de validación evaluados se encuentran dentro los límites de aceptación establecidos y la incertidumbre expandida calculada es menor al 2 % de las concentraciones de las muestras en todo el rango del método (80 % - 120 % de la cantidad declarada), por lo que el método es adecuado para los fines propuestos [10]. Los lotes de producción serán rechazados si el resultado obtenido más/menos la incertidumbre del método se encuentra fuera de la especificación para la potencia.
AGRADECIMIENTOS
Agradecemos al personal técnico del Laboratorio Andifar y en especial al doctor Jacobo Andonie Pinel por respaldar el desarrollo de este trabajo e incentivar el trabajo científico técnico de nuestra institución.
REFERENCIAS
1. M. Hohnjec, J. Kuftinec, M. Malnar, Ranitidine, en: "Analytical profiles of drug substances and excipients", editado por K. Florey, Academic Press, Inc, San Diego, 1986, vol.15, pp. 533-546. [ Links ]
2. United States Pharmacopoeial Convention, "Farmacopea de los Estados Unidos de América, USP 35", United Book Press, Rockville, 2012, pp. 5018-5023. [ Links ]
3. International Conference of Harmonisation (ICH) Q2(R1), Validation of Analytical Procedures: Text and Methodology. Step 4, November 2005. p. 1-13, URL: http://www.ich.org/products/guidelines/quality/article/quality-guidelines.html, consultado en julio de 2013. [ Links ]
4. J.C. Miller, J.N. Miller, "Estadística para Química Analítica", Addison-Wesley Iberoamericana, Wilmington, 1993, pp. 28-40. [ Links ]
5. W. Horwitz, Evaluation of analytical methods used for regulation of foods and drugs, Anal. Chem., 54, 67 (1982). [ Links ]
6. L. Aguirre, F.J. García, T. García, M. Illera, M. Juncadilla, M. Lizardo et al., Validación de métodos de análisis en materias primas y especialidades farmacéuticas, en: "Validación de Métodos Analíticos", editado por J.A. Pérez y M. Pujol, AEFI, Barcelona, 2001, pp. 45-133. [ Links ]
7. A.G. González, M.A. Herrador, A practical guide to analytical method validation, including measurement uncertainty and accuracy profiles, Trends in Analytical Chemistry, 26, 227 (2007). [ Links ]
8. SPSS 15.0 para Windows [programa de computadora]. Versión 15.0.1., New York, NY: SPSS Inc., 2006. [ Links ]
9. B. Magnusson, T. Näykki, H. Hovind, M. Krysell, Handbook for calculation of measurement uncertainty in environmental laboratories, Oslo, Noruega: Nordic Innovation Stensberggata 25 NO-0170; 2012. NT techn report 537, ed. 3.1. URL: http://nordtest.info/index.php/technical-reports/category/environment.html, consultado en julio de 2013. [ Links ]
10. V. Barwick, S. Ellison, Protocol for uncertainly evaluation from validation data, United Kingdom: National Measurement Systems Valid Analytical Measurement (VAM) Programme; 2000. VAM Project 3.2.1, version 5.1. URL: http://blpd.dss.go.th/knowledge_el/VAM_uncertainty-0452.pdf, consultado en julio de 2013. [ Links ]
11. S. Ellison, A. Williams, Quantifying Uncertainly in Analytical Measurement. Eurachem/CITAC guide; 2012. Tercera edición, ISBN 978-0-948926-30-3. URL: http://www.eurachem.org/index.php/publications/guides/quam, consultado en julio de 2013. [ Links ]
12. N. M. Jiménez, J.E. Calero, A.S. Padrón, J.C. Izquierdo, Método analítico por cromatografía de alta resolución para la determinación de carbamazepina en plasma humano, Revista Cubana de Farmacia, 41(1), Artículo 6 (2007). [ Links ]
13. C. M. García, D. Pereda, A. González, Y. Montes de Oca, Y. Cañizares, G.M. León, Determinación de diclofenaco de sodio por cromatografía líquida de alta resolución en un colirio al 0.1 %, Revista Cubana de Farmacia, 43(3), Artículo 5, 1-10 (2009). [ Links ]
14. R. Boqué, A. Maroto, J. Riu, F.X. Rius, Validation of analytical methods, Grasas y Aceites, 53, 128 (2002). [ Links ]
15. M. Thompson, S. Ellison, R. Wood, Harmonized guidelines for single-laboratory validation of methods of analysis (IUPAC technical report), Pure and Applied Chemistry, 74, 835 (2002). [ Links ]
16. N. Trejos, M.E. Tello, Validación de una metodología analítica por HPLC para la cuantificación de sulfadiazina de plata en crema, Revista Colombiana de Ciencias Químico Farmacéuticas, 37(2), 191-199 (2008). [ Links ]