Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.43 no.1 Bogotá Jan./June 2014
https://doi.org/10.15446/rcciquifa.v43n1.45469
http://dx.doi.org/10.15446/rcciquifa.v43n1.45469
Artículo de investigación clínica
Determinación cualitativa de algunos metabolitos de seis glucocorticoides en orina a través de cromatografía líquida de alta eficiencia acoplada a masas-masas.
Qualitative determination of metabolites in urine of six glucocorticoids by high performance liquid chromatography coupled to mass-sprectrometry
Ana María Morales Herrera1, Diana Carolina Puerto Avella2, Miguel Angel Torres Wilches3, Gloria Gallo Isaza 4, Lucrecia Rodríguez R.5, Marian Dalila Vallejo6
1,2,3Departamento de Farmacia, Facultad de ciencias, Universidad Nacional de Colombia, Sede Bogotá D.C., Colombia. Correos electrónicos:1 amoralesh@unal.edu.co, 2 dcpuertoa@unal.edu.co, 3 matorresw@unal.edu.co
4,5,6Laboratorio de Control al Dopaje, Coldeportes Colombia, Bogotá D.C., Colombia. Correos electrónicos:4 aggallo@coldeportes.gov.co, 5 lrodriguez@coldeportes.gov.co, 6 mariandalila206@hotmail.com
Recibido para evaluación: Marzo 16 de 2014
Aceptado para publicación: Mayo 24 de 2014
RESUMEN
El uso de glucocorticoides está prohibido en el campo deportivo durante las competencias si son administrados por vías sistémicas, para lo cual, WADA definió un nivel de reporte de 30ng/mL para los compuestos padre y sus metabolitos. En este trabajo ha sido desarrollada una metodología analítica para la determinación cualitativa de los principales metabolitos de algunos glucocorticoides sintéticos: Betametasona, Budesonida, Dexametasona, Metilprednisolona, Prednisolona, y Triamcinolona Acetónido, presentes en muestras de orina conservadas por el Laboratorio de Control al Dopaje de COLDEPORTES. La metodología incluyó una comparación entre la extracción de los analitos libres y conjugados con glucurónido (para determinar cuál de las dos fracciones era más útil en el análisis de estas sustancias), su separación por cromatografía liquida de alta eficiencia con ionización positiva y la detección por medio de trampa iónica (HPLC-MS-MS). Se seleccionaron los metabolitos mayoritarios a través de sus tiempos de retención, posteriormente se fragmentaron para obtener sus espectros y a través de la abundancia se determinó la cantidad presente en cada fracción (libre y conjugada). Se identificaron los seis glucocorticoides y un total de doce metabolitos, que permitirán hacer un rastreo más prolongado del consumo de las sustancias. Además se confirmó que las cantidades para la mayoría de los compuestos de interés, fueron más altas en la fracción libre de las muestras de orina, pero que no es posible eliminar el proceso de hidrolisis porque algunos metabolitos se excretan conjugados.
Palabras clave:Glucocorticoides, Cromatografía líquida de alta eficiencia, ESI Espectrometría de masas, Análisis de control al dopaje, Muestras de orina.
SUMMARY
Glucocorticoids use is prohibited on the sport during competitions when they are administered by systemic routes for which WADA defined a reporting level of 30ng/ml for parent compounds and their metabolites. In this paper has been developed an analytical methodology for the qualitative determination of the main metabolites of some synthetic glucocorticoids: Betamethasone, Budesonide, Dexamethasone, Methylprednisolone, Prednisolone and Triamcinolone Acetonide, present in urine samples preserved by the Laboratory of Doping Control of COLDEPORTES. The methodology included a comparison between the extraction of free and conjugated with glucuronide analytes (to determine which of the two fractions was more useful in the analysis of these substances), their separation by high performance liquid chromatography with positive ionization and detection using ion trap (HPLC -MS- MS). Major metabolites were selected by their retention times, later fragmented to obtain its spectra and through their abundance determine the amount present in each fraction (free and conjugated). There were identified the six glucocorticoids and twelve metabolites, that will allow to make a more extended screening of the consumption of these substances. Also it was confirmed that the amounts for most of the compounds of interest, were higher in the free fraction of the urine samples, but it is not possible to eliminate the hydrolysis process because some metabolites are excreted as conjugates.
Key words:Glucocorticoids, HPLC, ESI Mass spectrometry, Anti-doping analysis, Urine samples.
INTRODUCCIÓN
Los glucocorticoides constituyen un grupo de moléculas conocidas inicialmente por su actividad como reguladoras del metabolismo de carbohidratos y que más adelante evidenciaron propiedades sobre distintos sistemas tales como: cardiovascular e inmunitario, riñones, músculo estriado, endocrino y nervioso [1]. Dada su capacidad anti-inflamatoria y analgésica, su uso se extendió rápidamente dentro del deporte, sin embargo, otras de sus propiedades farmacológicas sugieren que en la práctica, podrían aumentar el rendimiento de los deportistas teniendo en cuenta que a nivel metabólico crean reservas de glucógeno en tejido muscular y aceleran los mecanismos de lipólisis y glucólisis, inducidos por catecolaminas y la hormona de crecimiento, lo que lleva a la utilización más eficiente de las fuentes de energía por los músculos durante la actividad física [2]. Adicionalmente su acción a nivel de los receptores cerebrales atenúa las impresiones centrales de la fatiga y gracias a los ya nombrados efectos anti-inflamatorios y analgésicos, inhiben las sensaciones de dolor muscular por el esfuerzo, así como también, elevan el umbral de fatiga. Otras fuentes indican que los glucocorticoides en el deporte también producirían euforia e incremento en la actividad motora [3].
El uso de glucocorticoides en la práctica deportiva está prohibida por la AMA Agencia Mundial Anti-Dopaje o WADA (World Anti-Doping Agency) por sus siglas en inglés, durante el periodo de competencia si son administrados por vía oral, intravenosa, intramuscular o rectal [4], mientras que la inhalada y tópica están permitidas. Por la dificultad para establecer la vía de ingreso al organismo, WADA estableció un MRPL (Minimun Required Performance Levels) de 30 ng/mL para reportar un hallazgo analítico adverso [5], tanto para los compuestos padre (PC: Parent Compound), como para sus metabolitos. Por debajo de este valor no se debe reportar. Matabosch y col. afirman que esta concentración permite descartar la administración tópica múltiple de metil-prednisolona, pero no la oral, cuando se usan dosis bajas de la misma [6], comportamiento que podría extenderse a otros corticoides.
Los laboratorios de control al dopaje cuentan con metodologías analíticas validadas para la detección de los PC de glucocorticoides, sin embargo se ha evidenciado que estos tienen una alta tasa de biotransformación, razón por la cual es necesario determinar la presencia no solo de los PC sino también de sus metabolitos para ampliar la ventana de detección y obtener resultados más acertados y confiables. Como regla general los corticoides se excretan en forma libre, cuando se metabolizan lo hacen mediante adiciones secuenciales de átomos de oxígeno o hidrógeno, seguidas por conjugación para formar derivados hidrosolubles (compuestos conjugados), principalmente a nivel hepático, los cuales se eliminan en la orina; ni la excreción biliar ni la fecal poseen importancia cuantitativa [1]. En estudios de excreción de dichas sustancias se han detectado en forma libre en orina los compuestos padre entre 10 y 36 horas después de su administración, dependiendo de la técnica de análisis y de la molécula [3], pero no es del todo claro si los metabolitos se excretan de la misma forma, pues se podría suponer que por su alta biotransformación e hidroxilación se excreten conjugados con glucurónido.
Comúnmente, el análisis de estas sustancias y sus metabolitos se lleva a cabo mediante cromatografía de gases acoplada a espectrometría de masas, técnica catalogada como de mayor especificidad y sensibilidad frente al inmunoensayo y a la cromatografía líquida utilizando detectores UV o de arreglo de diodos [7], aunque en la literatura se describen ampliamente las técnicas analíticas [8, 9] no se encuentran reportados la totalidad de los metabolitos en los que se transforman.
El objetivo de este trabajo fue llevar a cabo la determinación cualitativa tanto de los compuestos padre como de sus metabolitos reportados en la literatura, por medio de LC-MS/MS a través de los tiempos de retención y los iones característicos de las moléculas y establecer en cuál de las fracciones (libre o conjugada) son más abundantes.
METODOLOGÍA
Elección de glucocorticoides objeto de estudio y metabolitos a identificar Los glucocorticoides fueron seleccionados por la disponibilidad de muestras de orina conservadas en el laboratorio en las que se encontró la presencia de los PC en el periodo de tiempo para el cual aún su uso no era prohibido durante competencia (se analizaron 6 muestras de orina, una para cada una de las sustancias junto con un blanco de reactivos y un control negativo de orina): Betametasona, Budesonida, Dexametasona, Metilprednisolona, Prednisolona, y Triamcinolona Acetónido. Mediante revisión bibliográfica se identificaron los metabolitos a buscar en dichas muestras, los cuales se describen a continuación:
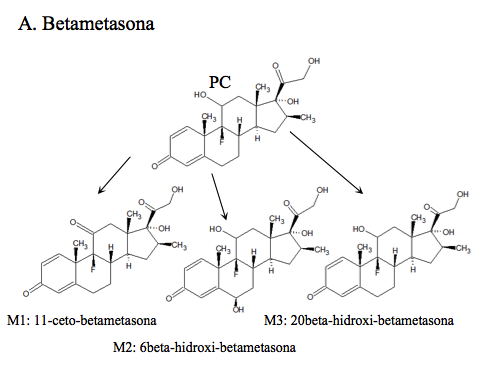
Betametasona: (9α-fluoro-11β,17α,21-trihidroxi-16β-metilpregna-1,4-dien-3,20-diona), se excreta principalmente como 6β-hidroxi-betametasona, mientras que el PC y otro de sus metabolitos, el 20-hidroxi-betametasona están presentes en cantidades menores en la orina [10]. La ruta metabólica ya ha sido estudiada previamente [10, 11] y se ilustra en A de la Figura 1a.
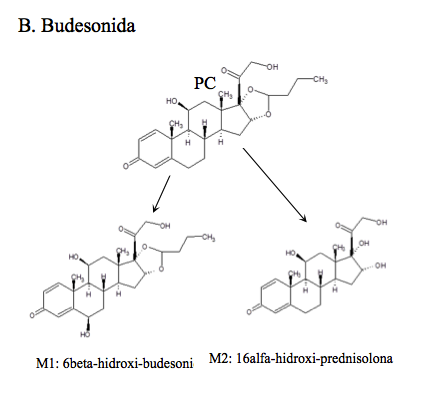
Budesonida: (22(R,S)-16α,17α-butilidenedioxi-11β,21-dihidroxipregna-1,4-dien-3,20-diona), más de 16 metabolitos fueron identificados después de la administración oral en un estudio realizado por Matabosch y col.(2013, 2012) siendo los mayoritarios los excretados en la fracción libre de la orina: 16α-hidroxi-prednisolona formado por la pérdida del grupo acetal y, 6β-hidroxi-budesonida formado por hidroxilación [6, 12], e ilustrados en B de la Figura 1b. Se ha reportado que después de la administración de budesonida vía inhalada, los niveles de dicho metabolito superan los 30 ng/mL, por lo cual cabe la posibilidad de reportarlo como hallazgo analítico adverso a pesar de haber ingresado al organismo por una vía de administración permitida [13].
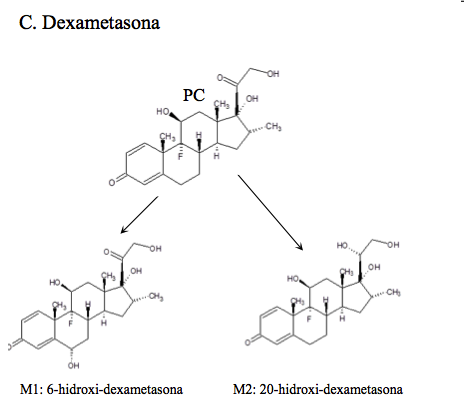
Dexametasona: (9α-fluoro-11β,17α,21-trihidroxi-16α-metilpregna-1,4-dien-3,20-diona), los mayores productos de excreción son los metabolitos isoméricos 6-hidroxi, y en una menor proporción, el PC y su metabolito 20-hidroxi [14]. Los principales productos del metabolismo de dexametasona se ilustran en C de la Figura 1c.
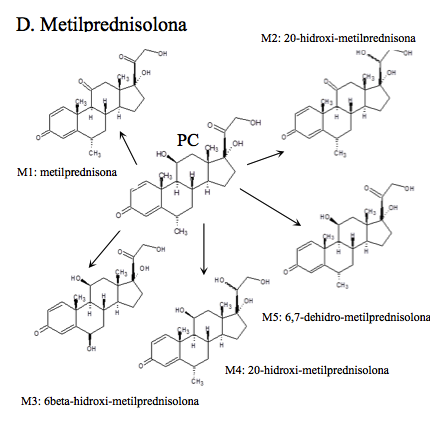
Metilprednisolona: (11β,17α,21-trihidroxi-6α-metilpregna-1,4-dien-3,20-diona), se han reportado 15 metabolitos, siendo los mayoritarios la 11-ceto-metil-prednisolona (metilprednisona) debido a la oxidación del grupo hidroxilo en C11 y, 20-hidroxi-metil-prednisolona por la reducción en C20, además de la 6,7-dehidro-metil-prednisolona [15], como se ilustra en D de la Figura 1d. Después de la administración oral han detectado, metilprednisolona y todos sus metabolitos en orina hasta 36 horas después, mientras que luego del uso tópico, solo se han detectado cinco. Los metabolitos 16β,17α,21-trihidroxi-6α-metilpregna-1,4dien-3,11,20-triona y 17α,20α,21-trihidroxi-6α-metilpregna-1,4-dien-3,11-diona son los mejores marcadores para diferenciar entre las administraciones tópica y oral, puesto que ambos se detectan en orina pero en concentraciones bien diferenciadas: las señales después de la administración tópica son más bajas que aquellas después de 48 horas de la administración oral [6]. Luego de una administración intra-articular e intramuscular fueron identificados 13 metabolitos [16].
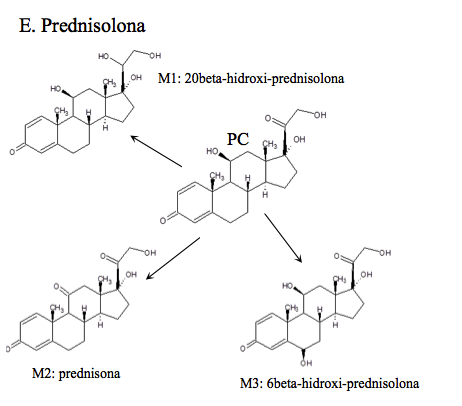
Prednisolona: (pregna-1,4-dieno-11-β, 17-α, 21-triol-3,20-diol), Shobha y col. identificaron un extenso metabolismo de este fármaco [17], los principales se ilustran en E de la Figura 1e. Se pensó que era posible que la Prednisolona se produjera de manera endógena a partir de la cortisona, pues en 33 voluntarios sanos que no la consumían, encontraron concentraciones promedio de 460-500 pg/mL, sin distinción de género [18, 19]. Sin embargo cuando se administra el fármaco las concentraciones son muy superiores a las endógenas.
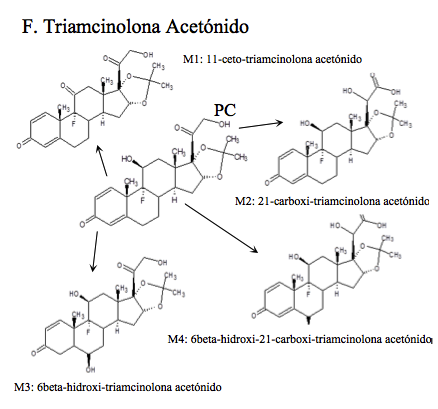
Triamcinolona Acetónido:
(9α-fluoro-l1β,16α,17α,21-tetrahidroxi-pregna-1,4-dien-1,3-diona-16,17-acetal cíclico), se biotransforma como se muestra en F de la Figura 1f [20].Reactivos y estándares
Las muestras de orina utilizadas pertenecían al Laboratorio de Control al Dopaje de COLDEPORTES, de cada una se tenía conocimiento de la presencia de los PC de interés y de su estabilidad para llevar a cabo los análisis. La Metiltestosterona, utilizada como estándar interno fue obtenida de Cerilliant (Texas, USA), la enzima β-glucuronidasa, de Laboratorios Roche (Basilea, Suiza), el Acetonitrilo grado HPLC marca Merck (Darmstadt, Alemania), el Metanol, Metilterbutil éter y ácido Acético, grado HPLC, marca J.T. Baker (USA), Acetato de Etilo de Honey Well (Morristown, NJ, USA )y el Agua ultra purificada (de resistividad 18.2M.cm) fue obtenida mediante un Sistema de purificación Milli-Q.
Tratamiento de las muestras
Las muestras se sometieron a un proceso de alistamiento con el fin de determinar su pH y densidad. Posteriormente se realizó una hidrolisis enzimática, con β-glucuronidasa para romper la unión de las sustancias en estudio del ácido glucurónico. Posteriormente se realizaron extracciones líquido-líquido en medio básico y en medio ácido respectivamente, para aislar los metabolitos de interés, siguiendo la metodología validada por el Laboratorio de Control al Dopaje de COLDEPORTES.
Los extractos obtenidos de la fracción conjunta (sustancias libres y conjugadas) se inyectaron en el equipo HPLC-MSMS, por el método SCAN Positivo el cual permitió detectar los pesos moleculares [M+H+] e identificar los tiempos de retención (tanto de metabolitos como de compuestos padre) para luego con esta información crear el método de MS/MS denominado METCORTICOIDES. Se analizaron igualmente orinas negativas certificadas y un blanco. Se creó una librería de espectros de referencia, de gran utilidad para los análisis rutinarios.
Extracción de la fracción libre
A 5 mL de orina se adicionaron 50 µL de estándar interno (Metiltestosterona 10 µg/mL). Se ajustó a pH básico con 200 µL de Buffer Carbonatos (pH 10). Se realizó una extracción líquido-líquido con 5 mL de Metilterbutil éter. Después de centrifugar, se separaron las fases por congelación de la acuosa y posterior decantación. La fase orgánica se evaporó hasta sequedad a 20 mBar y 35 °C. Se descongeló la fase acuosa y se ajustó a pH ácido con 700 µL de AcOH 10%, para realizar una segunda extracción con 5 mL de Acetato de Etilo. Nuevamente, después de centrifugar, se separaron las fases por congelación y la fase orgánica resultante se transfirió al tubo seco de la primera transferencia y se evaporó a sequedad. El residuo se reconstituyó en 50 µL de solución AcOH 0,1% : ACN (60:40) y se inyectaron 15 µL en el equipo HPLC -MS/MS.
Fracción Conjugada
La fase acuosa remanente de la extracción de la fracción libre, se ajustó a pH 7. Se adicionaron 50 µL de estándar interno (Metiltestosterona 10 µg/mL) y 1,0 mL de Buffer Fosfatos (pH 7). La hidrólisis enzimática se llevó a cabo a 60 °C durante 1 hora, empleando 40 µL de Glucuronidasa de E. Coli. Después de dejar enfriar los tubos, se continuó con las extracciones básica y ácida descritas anteriormente. Para la reconstitución de utilizaron 50 µL de una solución de ACN-AcOH 0.1% (60:40) y se inyectaron 15 µL en el equipo HPLC-MS/MS.
Condiciones Instrumentales
La determinación cualitativa de los analitos se llevó a cabo en un Cromatógrafo Líquido Agilent 1100 LC equipado con una fuente de ionización por electrospray (ESI) y acoplado a un Detector selectivo de masas tipo Trampa Iónica, MSD Trap SL. Se usó una Columna Cromatográfica Zorbax SB C8 (150mm x 2,1mm x 3,5µm), a una temperatura de 35°C. La fase móvil estuvo compuesta por ACN- AcOH 1% a un flujo de 0,35 mL/min, cuyo gradiente inició en 15% de ACN por 1.0 minuto, aumentó a 40% en los siguientes 7 minutos y permaneció constante durante 4 minutos, luego incrementó a 90% en tres minutos, posteriormente a 100% en 2,5. El método utilizado para la fragmentación de las moléculas fue METCORTICOIDES consistente en: Polaridad iónica positiva, Temperatura de secado 325°C, presión en nebulizador 35 psi, flujo del gas de secado 10 L/min, trap Drive 47.2, Skim1 15.0 Volt, Skim2 -3,1 Volt, Amplitud del Octopolo RF 150 Vpp, capilary exit 82,8 Volt. La adquisición y procesamiento de los datos se realizó utilizando el software Data Analysis Instrument 1.
RESULTADOS Y DISCUSIÓN
Con la inyección de la fracción conjunta mediante el Modo SCAN Positivo, se identificaron los PC y sus metabolitos, por medio de su peso molecular, su estructura y su tiempo de retención, así:
Los resultados preliminares arrojaron una idea de los metabolitos mayoritarios gracias a las abundancias de los picos cromatógraficos y los tiempos de retención permitiendo seleccionar los que se incluirían en el método MS/MS y que posteriormente se incorporarían en los métodos de rutina del laboratorio.
A partir de allí, se creó el método METCORTICOIDES, con el cual se ajustaron las condiciones del analizador de manera que solo se seleccionara el ion de interés, que para nuestro caso fue el M+1, el cual sufriría una fragmentación obteniendo iones característicos con las mismas abundancias relativas. Con base en estos resultados, se hizo seguimiento a los iones en varios ensayos, confirmando que se reprodujo para todos los compuestos el ion más abundante.
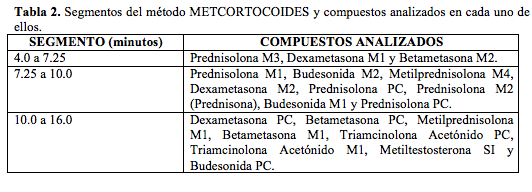
El método tenía cuatro segmentos, uno inicial que va a desechos y otros tres establecidos por tiempo de retención, así:
Se analizaron igualmente orinas negativas certificadas y un blanco con el fin de comprobar que ni la matriz de orina ni los reactivos, generaran picos que pudiesen interferir con los compuestos de interés y arrojar falsos positivos.
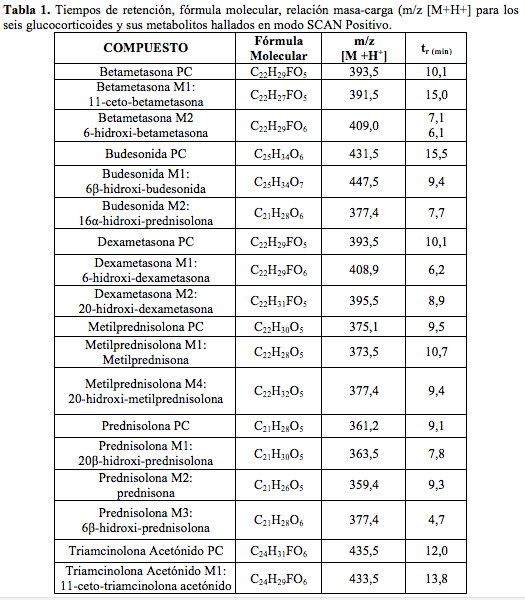
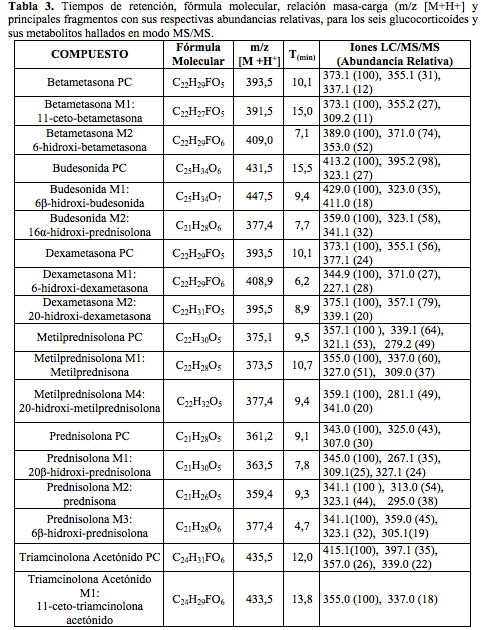
En la Tabla 3 se describen los resultados de la utilización del método METCORTOCOIDES, el cual permitió establecer los iones más abundantes a los que se fragmentan las moléculas iniciales, los cuales a su vez servirán como iones diagnóstico para la identificación de los compuestos padre y sus metabolitos en las muestras de orina.
Todos los compuestos padre se encontraron en los tiempos de retención establecidos en la validación del método realizada anteriormente por el laboratorio. Adicionalmente se identificaron: dos metabolitos de alta intensidad de Betametasona, que por su peso molecular e iones diagnósticos permitieron establecer que son la 11-ceto-betametasona (M1) y 6-hidroxi-betametasona (M2); dos metabolitos de Budesonida, la 6β-hidroxi-budesonida (M1) y la 16β-hidroxi-prednisolona (M2), cuyas intensidades también fueron altas; con respecto a la Dexametasona, se hallaron los metabolitos 6-hidroxi-dexametasona (M1) y la 20-hidroxi-dexametasona (M2); la Metilprednisolona mostró que se transformó en varios metabolitos pero solo se identificaron por fines prácticos, la Metilprednisona, metabolito (M1) y la 20-hidroxi-metilprednisolona (M4), que según la literatura son los mayoritarios (14). Los picos para los metabolitos de Prednisolona, 20β-hidroxi-prednisolona (M1), prednisona (M2) y 6β-hidroxi-prednisolona (M3), presentaron altas abundancias también. Para el caso de Triamcinolona Acetónido, se identificó el metabolito 11-ceto.
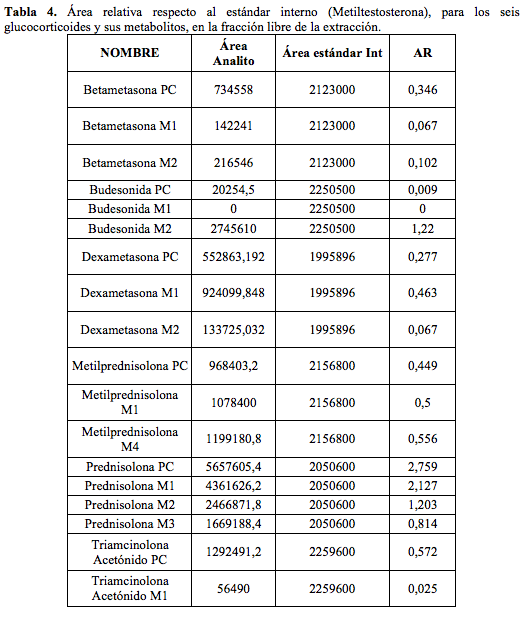
Con el fin de comparar las cantidades aproximadas excretadas de cada compuesto de forma libre y forma conjugada con glucurónido, se utilizaron las áreas de los picos de interés, para lo cual las muestras extraídas para ambas fracciones se sometieron al método METCORTICOIDES. Una vez obtenidos los cromatogramas con ayuda del software Data Analysis, se integraron las áreas de los picos del estándar interno (Metiltestosterona) de cada muestra, y las de los compuestos padre y sus metabolitos (Ver Tabla 4).
Se definió un área relativa AR, con la relación del área del compuesto AC respecto al área del estándar interno ASI y así se obtuvieron los datos que se muestran en la Tabla 4.
Posteriormente se analizaron las áreas relativas (AR) de los corticoides y sus metabolitos en la fracción conjugada que no fueron representativos por su baja concentración confirmando lo establecido en la literatura. Es acertado afirmar que la abundancia relativa de los iones correspondientes a los compuestos excretados en su forma libre mostrados en la Tabla 4, es lo suficientemente alta para hacer el seguimiento de los compuestos estudiados únicamente en esta fracción. Sin embargo, como algunos metabolitos se conjugan con glururónido y por tanto se detectan en la fracción conjugada, como en el caso de la metilprednisolona [16], esto no permitiría eliminar la etapa de hidrólisis en el tratamiento de la muestra como se esperaba.
REFERENCIAS
1. A. Goodman-Gilman, J.G. Hardman, L.E. Limbird, "Las Bases Farmacológicas de la Terapéutica" 10 ed., McGraw-Hill, México, 2001, vol. I, pp. 1667-1696. [ Links ]
2. M. Duclos, Evidence on ergogenic action of glucocorticoids as a doping agent risk, The Physician and Sports Medicine, 38(3), 121-127 (2010). [ Links ]
3. F. Bévalot, Y. Gaillard, M.A. Lhermitte, G. Pépin, Analysis of corticosteroids in hair by liquid chromatography-electrospray ionization mass spectrometry, Journal of Chromatography B, 740, 227-236 (2000). [ Links ]
4. World Anti-Doping Agency (WADA). (n.d.). The 2014 Prohibited List. [ Links ]
5. World Anti-Doping Agency (WADA). (n.d.). Technical Document TD2013MRPL. [ Links ]
6. X. Matabosch, O.J. Pozo, N. Monfort, C. Pérez-Mañá, M. Farré, J. Marcos et al., Urinary profile of methylprednisolone and its metabolites after oral and topical administrations, Journal of Steroid Biochesmistry and Molecular Biology, 138, 214-221 (2013). [ Links ]
7. E. Pujos, M.M. Flament-Waton, O. Paisse, M.F. Grenier-Loustalot, Comparison of the analysis of corticosteroids using different techniques, Analytical and Bioanalytical Chemistry, 381, 244-254 (2005). [ Links ]
8. M. Mazzarino, S. Turi, F. Botré, A screening method for the detection of synthetic glucocorticosteroids in human urine by liquid chromatography-mass spectrometry based on class-characteristic fragmentation pathways, Analytical and Bioanalytical Chemistry, 390, 1389-1402 (2008). [ Links ]
9. I.I. Salem, M. Alkhatib, N. Najib, LC-MS/MS determination of betamethasone and its phosphate and acetate esters in human plasma after sample stabilization, Journal of Pharmaceutical and Biomedical Analysis, 56, 983-991 (2011). [ Links ]
10. G. Rodchenkov, V. Uralets, V. Semenov, Gas chromatographic and mass spectral study of betamethasone synthetic corticosteroid metabolism, Journal of Chromatography, 432, 283-289 (1988). [ Links ]
11. D. Skrabalak, K. Cuddy, J. Henion, Quantitative determination of betamethasone and its major metabolite in equine urine by micro-liquid chromatography-mass spectrometry, Journal of Chromatography, 341, 261-269 (1985). [ Links ]
12. X. Matabosch, O.J. Pozo, C. Pérez-Mañá, M. Farré, J. Marcos, J. Segura et al., Identification of budesonide metabolites in human urine after oral administration, Analytical Bioanalytical Chemistry, 404, 325-340 (2012). [ Links ]
13. X. Matabosch, O.J. Pozo, C. Pérez-Mañá, M. Farré, J. Marcos, J. Segura et al., Discrimination of prohibited oral used from authorized inhaled treatment of budesonide in sport, Therapeutical Drug Monitoring, 35(1), 118-128 (2013). [ Links ]
14. G. Rodchenkov, V. Uralets, V. Semenov, P. Leclercq, Analysis of Dexamethasone, Triamcinolone, and their Metabolites in Human Urine by Microcolumn Liquid and Capillary Gas Chromatography Mass Spectrometry, Journal of High Resolution Chromatography, 11(3), 283-288 (1988). [ Links ]
15. O. Pozo, J. Marcos, X. Matabosch, R. Ventura, J. Segura, Using complementary mass spectrometric approaches for the determination of methylprednisolone metabolites in human urine, Rapid Communications in Mass Spectrometry, 26, 541-553 (2012). [ Links ]
16. A. Panusa, L. Regazzoni, G. Aldini, M. Orioli, A. Giombini, P. Minghetti et al., Urinary profile of methylprednisolone acetate metabolites in patients following intra-articular and intramuscular administration, Analytical and Bioanalytical Chemistry, 400, 255-267 (2011). [ Links ]
17. A. Shobha, D. Sachin, U. Awanish, Y. Rakesh, P. Rahul, B. Alka, Identification of prednisolone, methylprednisolone and their metabolites in human urine using HPLC (+) ESI-MS/MS and detection of possible adulteration in Indian herbal drug preparations. Ibnosina, Journal of Medicine BS, 4(2), 44-52 (2012). [ Links ]
18. M. Fidani, M.C. Gamberini, G. Pompa, F. Mungiguerra, A. Casati, F. Arioli, Presence of endogeneous prednisolone in human orine, Steroiods, 78, 121-126 (2013). [ Links ]
19. R. DiFrancesco, V. Frerichs, J. Donnelly, C. Hagler, J. Hochreiter, K.M. Tornatore, Simultaneous determination of cortisol, dexamethasone, methylprednisolone, prednisone, prednisolone, mycophenolic acid and mycophenolic acid glucuronide in human plasma utilizing liquid chromatography-tandem mass spectrometry, Journal of Chromatography B, 859, 42-51 (2007). [ Links ]
20. D. Kupfer, R. Partridge, 6-Beta-hydroxylation of triamcinolone acetonide by a hepatic enzyme system. The effect of phenobarbital and 1-benzyl-2-thio-5,6-dihydrouracil, Archives of Biochemistry and Biophysics, 140, 23-28 (1970). [ Links ]