Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.1 Bogotá Jan./April 2015
https://doi.org/10.15446/rcciquifa.v44n1.54236
Doi: http://dx.doi.org/10.15446/rcciquifa.v44n1.54236
Estabilidad del aceite de hígado de tiburón microencapsulado vs. pool de aceite
Stability of microencapsulated shark liver oil vs pool oil
Caridad García a
Mirna Fernández b
Mirta Castiñeira c
Claudia Buendía d
Brian Martínez e
Orestes López f
Antonio Nogueira g
a Centro de Investigación y Desarrollo de Medicamentos (CIDEM), La Habana, Cuba. Correo electrónico: caridadgp@infomed.sld.cu.
b Instituto de Farmacia y Alimentos (IFAL), calle 23 No. 21425 e/ 214 y 222 y Departamento de Tecnología y Control de los Medicamentos (TCM), Universidad de La Habana, Cuba. Correo electrónico: mirnafc@ifal.uh.cu.
c Instituto de Farmacia y Alimentos (IFAL), calle 23 No. 21425 e/ 214 y 222 y Departamento de Tecnología y Control de los Medicamentos (TCM), Universidad de La Habana, Cuba. Correo electrónico: mirta.castineira@infomed.sld.cu.
d Instituto de Farmacia y Alimentos (IFAL), calle 23 No. 21425 e/ 214 y 222, La Habana, Cuba. Correo electrónico: claudiabuendiac@gmail.com.
e Laboratorios MEDSOL, La Habana, Cuba. Correo electrónico: brian@ms.medsol.cu.
f Universidad Técnica de Ambato, Ecuador. Correo electrónico: orestes.lopez@dlipsa.com.
g Centro de Investigación y Desarrollo de Medicamentos (CIDEM), La Habana, Cuba. Correo electrónico: antonio.nogueira@cidem.sld.cu.
Recibido para evaluación: 28 de agosto de 2013.
Aceptado para publicación: 13 de noviembre de 2014.
Resumen
El estudio de estabilidad del aceite microencapsulado y sin microencapsular se realizó por el método de vida de estante a las temperaturas de 2-8 °C, y temperatura ambiente, respectivamente, durante doce meses. Los parámetros analizados al pool de aceite fueron: características organolépticas, índice de acidez, peróxido, saponificación, contenido de vitamina A y conteo microbiológico. Mientras que al aceite microencapsulado se le evaluaron las características organolépticas, la eficiencia de encapsulación, contenido de humedad, aceite superficial, contenido de vitamina A y conteo microbiológico. Los resultados evidenciaron una disminución superior al 5% en el contenido de vitamina A en el aceite sin microencapsular, a diferencia del aceite microencapsulado. Se logró el enmascaramiento del olor intenso a pescado, y los restantes parámetros evaluados se encontraron dentro de los límites establecidos.
El aceite de hígado de tiburón microencapsulado resultó estable física, química y microbiológicamente por doce meses, mientras que el aceite sin microencapsular solo seis meses. El proceso de microencapsulación no solo mejoró sus características organolépticas, sino también favoreció su estabilidad lográndose un mayor período de vida útil.
Palabras clave: pool de aceite de hígado de tiburón, aceite microencapsulado, vitamina A, estabilidad.
Summary
A stability study was carried out for microencapsulated and non-microencapsulated oil by applying the shelf-life method at temperature ranges of 2 to 8 °C, and ambient temperature, respectively, for a period of 12 months. The analyzed parameters in the case of pool oil were: organoleptic characteristics, acidity index, peroxide, saponification, vitamin-A content and microbiological count. For microencapsulated oil, the following parameters were evaluated: organoleptic characteristics, capsulation efficiency, humidity content, superficial oil, vitamin-A content and microbiological count. The stability study for non-microencapsulated oil proved that there was a decrease of over 5% in vitamin-A content, when compared to microencapsulated oil. The intense fish smell was properly masked and the remaining evaluated parameters were within established limits. Microencapsulated shark liver oil turned out to be physically, chemically and microbiologically stable for a period of 12 months, while non-microencapsulated oil remained stable for only 6 months. The microencapsulation process not only improved the oil´s organoleptic characteristics, but it also made it more stable, allowing for a longer shelf life.
Key words: shark liver oil pool, microencapsulated oil, vitamin-A, stability.
Introducción
El secado por aspersión es un proceso muy útil para la encapsulación de fragancias, aceites y saborizantes. El principio del secado por aspersión es la producción de un polvo seco por medio de la atomización de una emulsión en una corriente de aire caliente en una cámara de secado. El agua se evapora instantáneamente, permitiendo que el material activo presente en la emulsión, quede atrapado dentro de una película de material encapsulante [1, 2]. Para la obtención de microcápsulas, a través de este método, pueden ser empleados líquidos o sólidos como fase interna [3]; ingredientes farmacéuticos activos (IFA) solubles o insolubles en agua, sensibles o resistentes al calor, así como polímeros hidrofílicos o hidrofóbicos [4, 5]. Entre sus aplicaciones farmacéuticas pudiera mencionarse la obtención de ingredientes activos, que pudieran constituir por sí mismos una forma farmacéutica o bien ser utilizados en la elaboración de formas farmacéuticas secundarias, así como excipientes [1, 2].
Los polímeros solubles en agua como la goma arábiga y maltodextrina, derivados del almidón y gelatina hidrolizada son empleados como material de cubierta [6-8]. Los almidones modificados y la goma arábiga no forman soluciones de alta viscosidad, por lo que son fácilmente atomizables. El agua es el disolvente más favorable en los procesos de secado por aspersión debido a que los solventes orgánicos son tóxicos y originan problemas medioambientales [9].
La combinación de polímeros maltodextrina y goma arábiga ha sido utilizada como encapsulante de sustancias de naturaleza lipídica como aceites fijos, aceites volátiles y vitaminas, resultando adecuada por su garantía en la protección de los mismos [1, 10, 11].
El hígado del tiburón se utiliza para la obtención de aceite el cual es rico en vitamina A, obteniéndose esta naturalmente. Este aceite constituye una importante fuente natural de otras vitaminas liposolubles como la D y E, y ácidos grasos saturados e insaturados, en comparación con otros aceites de origen marino.
Estudios previos han demostrado la presencia de las vitaminas A, D y E en el pool de aceite de tiburones costeros de Cuba, resultando la vitamina A su componente mayoritario, así como diferentes ácidos grasos [12-15].
Las vitaminas son sustancias muy sensibles a factores como la luz, la temperatura, la presencia de oligoelementos y bisulfitos, o el tipo de material del envase utilizado [16-18].
Para lograr una mayor estabilidad de las vitaminas presentes en el pool de aceite de hígado de tiburón, se realizó la microencapsulación del aceite, empleando goma arábiga y maltodextrina como agentes encapsulantes, a través del método de secado por atomización.
La estabilidad de los productos farmacéuticos representa un importante eslabón en el desarrollo y formulación de toda forma terminada. De esta manera se pueden definir las condiciones de almacenamiento en el envase propuesto y establecer la vida útil del producto farmacéutico. Los estudios de estabilidad contemplan la conservación de la potencia, pureza, características organolépticas y su efectividad [19, 20].
El presente trabajo tiene como objetivo realizar el estudio de estabilidad, durante doce meses, del pool de aceite de hígado de tiburón y del aceite microencapsulado obtenido mediante el método de secado por atomización.
Metodología
Productos químicos y reactivos
La sustancia de referencia química de vitamina A acetato fue suministrada por el Grupo de Sustancias de Referencias del CIDEM (Centro de Investigación y Desarrollo de Medicamentos) (Cuba). El resto de los reactivos y soluciones fueron de calidad analítica (Merck, Alemania). El pool de aceite de hígado de tiburón fue suministrado por el Centro de Investigaciones Pesqueras (CIP) (Cuba). La microencapsulación del pool de aceite de hígado de tiburón fue desarrollada por medio de un proceso de secado por aspersión en el Grupo de Materias Primas del CIDEM (Cuba).
El pool de aceite de hígado de tiburón fue envasado en frascos de vidrio ámbar de 250 mL de calidad hidrolítica II, con tapas de polipropileno de 28 mm; mientras que el aceite microencapsulado en bolsas dobles de polietileno de baja densidad selladas y protegidas de la luz.
Estudio de estabilidad del pool de aceite de hígado de tiburón
Los tres lotes seleccionados se almacenaron a temperatura de 2-8 °C; valorándose al inicio, 3, 6, 9 y 12 meses. La determinación de los parámetros fisicoquímicos se realizó según lo descrito en la farmacopea de los Estados Unidos USP 35 [20], métodos generales para grasas y aceites fijos, y las especificaciones de calidad establecidas para el pool de aceite [15]. En todos los casos, las determinaciones se realizaron por triplicado. Los parámetros considerados fueron características organolépticas, índices de acidez, saponificación y peróxido.
La cuantificación de la vitamina A se realizó por un método de cromatografía líquida de alta resolución previamente validado [13, 15]. Las condiciones cromatográficas fueron las siguientes: columna Lichrosorb RP-18 (5 µm) 250 - 4 mm (Merck, Alemania), fase móvil de metanol - agua (90:10) v\v, velocidad de flujo de 1,0 mL/min y longitud de onda de 325 nm. El procedimiento se realizó en un cromatógrafo líquido de alta resolución (Merck); integrador Shimadzu modelo CRD 8AV; detector UV (longitud de onda variable) Knauer; bomba Knauer K-1001; Interface Box Knauer.
La preparación de la sustancia de referencia se realizó pesando con exactitud 15,1 mg de patrón de vitamina A acetato, disolviéndolo en 10 mL de solución de hidróxido de potasio metanólico (KOH met) 0,5 N en un frasco volumétrico de 25 mL. La disolución resultante se enrasó con solución de KOH met.
Se pesó un 1 g del pool de aceite de hígado de tiburón, se le adicionaron 35 mL de etanol absoluto, 10 mL de KOH al 50% y 25 mg de hidroquinona, los que se calentaron a reflujo 30 minutos. Posteriormente se adicionaron 40 mL de agua destilada y 50 mL de una mezcla de éter dietílico/n-hexano (1:1). A la fase acuosa se le realizaron cinco extracciones, tomándose únicamente la fase orgánica, lavando cuatro veces con 50 mL de agua acidulada. Se adicionaron 2 g de Na2SO4 anhidro, concentrando a sequedad en un rotoevaporador Buchi 461 RE 101 (Suiza). Se redisolvió en 25 mL de solución de KOH Met 0,5 N, inyectándose 20 µL.
Estudio de estabilidad del pool de aceite de hígado de tiburón microencapsulado
Tres lotes del pool de aceite de hígado de tiburón microencapsulado se almacenaron a temperatura ambiente (30 +/- 2 o C; 70 +/- 5% de humedad relativa); valorándose al inicio, 3, 6, 9 y 12 meses. La evaluación del aceite microencapsulado incluyó los siguientes parámetros fisicoquímicos:
Características organolépticas: a partir de la inspección visual de las muestras se evaluó la forma y apariencia de las microcápsulas [11, 21].
Pérdida por desecación: se pesó la muestra en un pesafiltro de 15 mL en una balanza analítica Sartorius R 200 D (Alemania), y se secó en un horno Heraeus UT 6060 (China) a 105 °C hasta peso constante. El procedimiento se realizó hasta que la diferencia de peso entre las dos últimas pesadas tuviera la exactitud requerida (< 0,0002 g), indicando peso constante [11, 20, 21].
Contenido de aceite libre o superficial: se realizó por el método de Soxhlet, empleando éter de petróleo de calidad para análisis (p.a) (Merck, Alemania) con un intervalo de ebullición de 60 a 80 °C. Se pesó la cápsula de extracción vacía y el dedal de celulosa con la muestra en balanza analítica. El proceso de extracción se realizó a una temperatura de 100 °C, pasando por las etapas de preextracción en disolvente caliente, enjuague y recuperación del disolvente. Posteriormente se secó a 96 °C durante 30 min en el horno. Se enfrió hasta temperatura ambiente en una desecadora con sílica gel e indicador de humedad, y se pesó en balanza analítica [11, 21]. El procedimiento se realizó por triplicado. Para el cálculo se empleó la expresión siguiente:
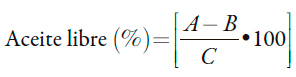
Donde:
A: masa de la cápsula con el aceite superficial después del proceso de extracción (g); B: masa de la cápsula vacía (g); C: masa de la muestra pesada en el dedal antes del proceso de extracción (g).
Eficiencia de encapsulación: se calculó a partir del contenido de aceite total teórico y los datos de la determinación del aceite superficial, según la expresión siguiente [11, 21]:
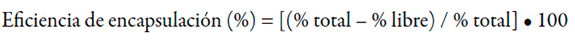
Contenido de la vitamina A: se determinó a través de un método de cromatografía líquida de alta resolución previamente validado [22], considerando la carga de lípidos en el aceite microencapsulado y la cantidad de aceite microencapsulado, equivalente a 1 g de aceite de hígado de tiburón.
La preparación de la sustancia de referencia se realizó de forma similar a lo descrito para el pool de aceite. En el caso de la muestra, se pesó una cantidad de aceite microencapsulado equivalente a 1 g de aceite de hígado de tiburón, y se realizó el resto del procedimiento igual a lo descrito para el pool de aceite.
Los resultados del contenido de vitamina A del aceite microencapsulado y sin microencapsular, a tiempo inicial y final (doce meses), se analizaron estadísticamente (software Statgraphics Plus versión 5.1 -1994-2001- y Statgraphics Centurion XV versión 15.2.05 StatPoint, Inc.) mediante el análisis de varianza y de un Anova doble.
La estabilidad microbiológica del pool de aceite de hígado de tiburón y el aceite microencapsulado se determinó a través del conteo diferencial de bacterias (CB) y hongos (CH) al inicio y a los doce meses, empleando el método general de conteo microbiano para productos no estériles [20].
Resultados y discusión
Los resultados del estudio de estabilidad del pool de aceite de hígado de tiburón por vida de estante, con evaluaciones periódicas durante doce meses, se resumen en la tabla 1.
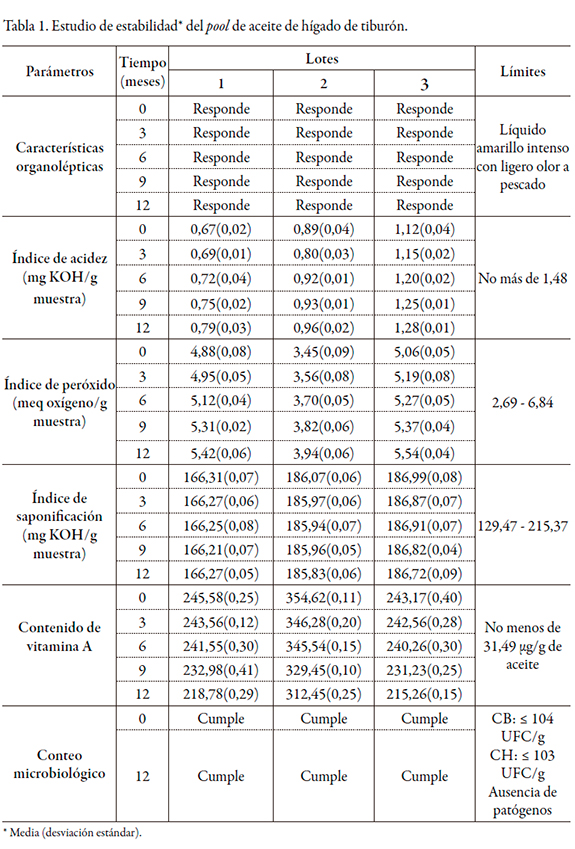
Las características organolépticas, índices de acidez, peróxido y saponificación del pool de aceite se encuentran dentro de los límites establecidos; similar comportamiento se observó con el conteo microbiológico [15]. Sin embargo, el contenido de vitamina en los tres lotes disminuyó en más de un 5%, respecto al valor inicial, por lo que se consideró un cambio significativo derivado de las condiciones de almacenamiento estudiadas [19]. Los índices de acidez y peróxido aumentaron ligeramente, en el rango de especificación establecido para cada caso. En general, los parámetros restantes, aunque mostraron ligeras variaciones, se mantuvieron dentro de los límites de especificación para cada caso.
En la ejecución de los estudios de estabilidad de productos farmacéuticos se considera un cambio significativo una disminución del contenido mayor al 5% [19], por lo que la vitamina A presente en el pool de aceite, bajo las condiciones de estudio ensayadas, se degradó. Estos resultados se deben a que al aumentar el índice de acidez y peróxido existe un mayor contenido de ácidos libres presentes en el aceite, lo que trae consigo una disminución del pH en el aceite. Como la vitamina A es inestable a pH ácidos provoca la disminución de su contenido [16-18].
A través del procesamiento estadístico realizado para los contenidos de vitamina A obtenidos a tiempo inicial y a los doce meses, se demostró que existía homogeneidad entre las varianzas para los tres lotes de pool de aceite, con valores de p > 0,05 (lote 1 p = 0,4686, lote 2 p = 0,3012 y lote 3 p = 0,1685). El análisis de la influencia del tiempo (inicial y doce meses) y de los lotes sobre la valoración de la vitamina A, demostró que la disminución del contenido de vitamina, como resultado del almacenamiento del pool de aceite a temperatura ambiente, fue estadísticamente significativa con valores de p < 0,05 (influencia del lote p = 0,0000, influencia del tiempo p = 0,0000), para un 95% de confianza. Estos resultados se consideran lógicos teniendo en cuenta la inestabilidad de las vitaminas y la disminución de su contenido como consecuencia del estudio de estabilidad.
Por tanto, se establecieron seis meses como período de validez del pool de aceite de hígado de tiburón, en el cual se mantuvieron sus propiedades físicas, químicas y microbiológicas en el envase y condiciones de almacenamiento evaluadas.
A partir de estos resultados y con el objetivo de aumentar la estabilidad del pool de aceite, se realizó su microencapsulación a través del método de secado por aspersión, empleando como agentes encapsulantes la goma arábiga y la maltodextrina [10, 11, 21].
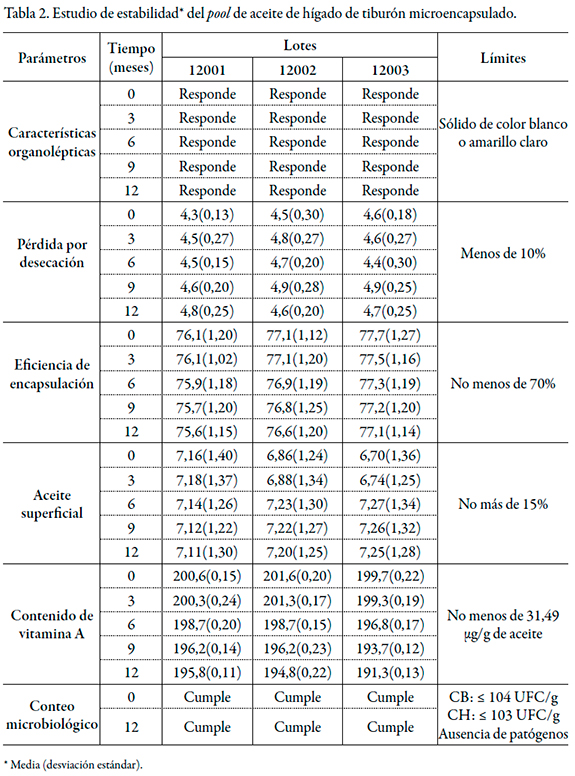
En la tabla 2 aparecen los resultados del estudio de estabilidad realizado al aceite microencapsulado, envasado en bolsas dobles de polietileno de baja densidad selladas, protegidas de la luz y almacenadas a temperatura ambiente (30 +/- 2 °C) y 70 +/- 5% de humedad relativa.
La microencapsulación es una técnica que se ha aplicado para preservar o proteger numerosos ingredientes. Puede considerarse una forma especial de empacar materiales sólidos, líquidos y gaseosos en miniatura. El material, en particular, puede ser cubierto de manera individual para protegerlo del ambiente, de la reacción con otros compuestos o para impedir que sufra reacciones de oxidación debido a la luz o al oxígeno. Protege del ambiente a sustancias sólidas o líquidas, divididas en pequeñas partículas o gotas, recubriéndolas con una película de carbohidrato u otro material polimérico (pared) [1, 2]. Una de las grandes ventajas de este proceso, en comparación con otros métodos de microencapsulación, además de su simplicidad, es que es apropiado para materiales muy volátiles y sensibles al calor, ya que el tiempo de exposición a temperaturas elevadas es muy corto [10].
Se observa que los resultados obtenidos se encuentran dentro de los límites establecidos y la disminución del contenido de vitamina A en el tiempo fue inferior al 5% [19], demostrándose la mayor estabilidad del aceite microencapsulado en comparación con aquel sin microencapsular. Además, se mejoraron sus características organolépticas en cuanto al olor intenso a pescado.
Las pérdidas por desecación estuvieron por debajo del 10% considerándose satisfactorios los resultados [20], sin manifestaciones de deterioro en el tiempo estudiado, lo que es de gran importancia para una materia prima natural para uso farmacéutico.
Los valores de eficiencia de encapsulación se mantuvieron por encima del 70%, denotando un comportamiento estable en el período evaluado, lo cual es una medida de la integridad de la estructura de las microcápsulas. Igualmente, los valores de aceite superficial demuestran que la envoltura lograda por la combinación de los polímeros utilizados impide la exudación del aceite hacia el exterior, denotando la integridad de la estructura de las microcápsulas.
A través del procesamiento estadístico realizado para los contenidos de vitamina A, en el tiempo se demostró que existía homogeneidad entre las varianzas para los tres lotes de pool de aceite microencapsulado, con valores de p > 0,05 (lote 1 p = 0,640, lote 2 p = 0,2748 y lote 3 p = 0,7630). Los valores de p < 0,05 (p = 0,0000 para la influencia del lote y p = 0,0000 para la influencia del tiempo) demostraron que ambos factores tienen influencia significativa sobre el contenido de vitamina A, como resultado del almacenamiento del pool de aceite microencapsulado a temperatura ambiente, para un 95% de confianza. No obstante a ello, desde el punto de vista de la calidad química, como la disminución del contenido de vitamina A en el tiempo fue inferior al 5% [19], y se encuentra en el límite establecido, se considera que el aceite microencapsulado es estable en las condiciones de envase y almacenamiento estudiadas. Por tanto, se evidenció la utilidad del procedimiento de microencapsulación por spray drying como alternativa tecnológica para aumentar la estabilidad de la vitamina A presente en el pool de aceite de hígado de tiburón.
Conclusiones
El pool de aceite de hígado de tiburón microencapsulado, a través de un proceso de secado por asperión, resultó estable física, química y microbiológicamente durante doce meses; mientras que el aceite sin microencapsular solo fue estable por seis meses. El proceso de microencapsulación no solo mejoró sus características organolépticas, sino que también favoreció la estabilidad de la vitamina A contenida en el aceite.
Referencias
1. B. Nogueiro, F. Rocha, L. Santos, A. Alves, Microencapsulation with chitosan by spray drying for industry applications: A review, Trends in Food Science & Technology, 31, 138 (2013). [ Links ]
2. J. Pu, J.D. Bankston, S. Sathivel, Developing microencapsulated flaxseed oil containing shrimp (Litopenaeus setiferus) astaxanthin using a pilot scale spray dryer, Biosystems Engineering, 108(2), 121 (2011). [ Links ]
3. J.A. Bakan, Microencapsulation. En: "The theory and practice of industrial pharmacy", Ed. por L. Lachman, H.A. Lieberman, J.L. Kanig, Lea and Febiger, Philadelphia, 1986, pp. 412-429. [ Links ]
4. Y.J. Fu, F.L. Mi, T.B. Wong, S.S. Shyu, Characteristic and controlled release of anticancer drug loaded poly (D,L-lactide) microparticles by spray drying technique, J. Microencapsulation, 18, 733 (2001). [ Links ]
5. K.G.H. Desai, H.J. Park, Encapsulation of vitamin C in tripolyphosphate crosslinked chitosan microspheres by spray drying, J. Microencapsulation, 22, 179 (2005). [ Links ]
6. M.I. Teixeira, L.R. Andrade, M. Farina, M.H.M. Rocha-Leão, Characterization of short chain fatty acid microcapsules produced by spray drying, Mater. Sci. Eng., 24, 653 (2004). [ Links ]
7. S. Krishnan, A.C. Kshirsagar, R.S. Singhal, The use of gum arabic and modified starch in the microencapsulation of a food flavoring agent, Carbohydr. Polym., 62, 309 (2005). [ Links ]
8. S. Adachi, H. Imaoka, H. Ashida, H. Maeda, R. Matsuno, Preparation of microcpasules of w/o/w emulsions containing a polysaccharide in the outer aqueous phase by spray-drying, Eur. J. Lipid Sci. Technol., 106, 225 (2004). [ Links ]
9. S.K. Das, S.R. Nakka, R. Rajabalaya, H.K. Mukhopadhyay, T. Halder, M. Palanisamy, J. Khanam, A. Nanda, Microencapsulation techniques and its practice, Int. J. Pharm. Sci. Tech., 6(2), 1 (2011). [ Links ]
10. A. Gharsallaoui, Roudaut, O. Chambin, A. Voilley, R. Saurel, Applications of spray-drying in microencapsulation of food ingredients: an overview, Food Research International, 40(9), 1107 (2007). [ Links ]
11. O.D. López, T. Márquez, O. Mayo, C. Toledo, E. Pérez, Características del aceite de semillas de Cucurbita pepo L. microencapsulado mediante secado por aspersión con maltodextrina y goma arábiga, Lat. Am. J. Pharm., 28(4), 628 (2009). [ Links ]
12. C. Bécquer, M. Castiñeira, D. Santa Ana, M. Sánchez, Validación de un método cromatográfico (CLAR) para la determinación de vitamina A en aceite de hígado de tiburón, Rev. CENIC. Ciencias Químicas, 30(3), 164 (1999). [ Links ]
13. C.M. García, M. Castiñeira, M. Fernández, J.A. Romero, S. Collazo, B. Mancebo, L. Torres, Determinación por CLAR de las vitaminas A y D en aceite de hígado de tiburón, Lat. Am. J. Pharm., 27(3), 419 (2008). [ Links ]
14. C.M. García, M. Castiñeira, M. Fernández, J.A. Romero, S. Collazo, A. Arcia, Determinación por CLAR de la vitamina E en el pool de aceite de hígado de tiburón, Lat. Am. J. Pharm., 27(5), 771 (2008). [ Links ]
15. C.M. García, M. Fernández, M. Castiñeira, J. Rodríguez, J. Romero, T. Márquez, Evaluación y establecimiento de las especificaciones de calidad del pool de aceite de hígado de tiburón, Ars Pharm., 55(1), 23 (2014). [ Links ]
16. M. Catiñeira, A. Cairó, I. Perdomo, U. Perdomo, Preformulación de vitamina A en tabletas, Rev. Cub. Farm., 30(1), (1996). Disponible en: http://scielo.sld.cu/scielo.php. [ Links ]
17. R. Pérez, Estudio de validación de la metodología para la determinación de vitamina A en alimentos infantiles instantáneos por cromatografía líquida de alto rendimiento (HPLC), Rev. Med. Exp., 17, 1 (2000). [ Links ]
18. A. Such, C. Sánchez, P. Gomis, A. Herreros, Estabilidad de vitaminas en nutrición parenteral, Nutrición Hospitalaria, 24(1), 1 (2009). [ Links ]
19. Regulación No. 23-2000, Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos, Centro Estatal para el Control de Medicamentos (Cecmed), Cuba, 2000. [ Links ]
20. United States Pharmacopeia (USP 35), The United States Pharmacopeia Convention (USP 35/2012 NF 30), Inc. Washington DC, 2012, pp. 176, 253. [ Links ]
21. M. Bringas, I. Expósito, O.D. López, J. Pino, Influence of spray-dryer air temperatures on encapsulated mandarin oil, Drying Technology, 29, 520 (2011). [ Links ]
22. C.M. García, M. Fernández, M. Castiñeira, V. Martínez, O. López, A. Nogueira, Validación de un método cromatográfico aplicable al control de calidad y estudio de estabilidad del pool de aceite de hígado de tiburón microencapsulado, Ars Pharm., 55(2), 18 (2014). [ Links ]













