Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Químico - Farmacéuticas
versão impressa ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.2 Bogotá maio/ago. 2015
https://doi.org/10.15446/rcciquifa.v44n2.56290
O comportamento de paracetamol durante a sua oxidação eletrocatalítica sobre poli(azul da anilina) e a sua descrição matemática
Paracetamol behavior during the electrocatalytic oxidation of poly (aniline blue) and its mathematical description
Bahadurghatta Kumara Swamy b
Reza Ojani c
Olena Aksimentyeva d
Jorge Zerbino e
Petró Yagodynets' a
Ronald Mascarenhas f
a Universidade Nacional de Chernivtsi, Ucrânia * E-mail: nightwatcher2401@gmail.com
b Universidade de Kuwempu, Índia
c Universidade de Mazandarã, República Islâmica do Irã
d Universidade Nacional de L' viv, Ucrânia
e Instituto de Investigações Fisico-Químicas Teóricas e Aplicadas (INIFTA), Universidade Nacional de La Plata, República Argentina
f Instituto Indiano de Tecnologia, Bombaim, Índia
Recibido para evaluación: 29 de noviembre de 2014
Aceptado para publicación: 25 de abril de 2015
Resumo
A oxidação eletrocatalítica de paracetamol, acompanhada ou não pela eletropolimerização do próprio, sobre poli(azul da anilina) foi descrita matematicamente (usando a teoria de estabilidade linear e análise de bifurcações). Para o comportamento do composto foi sugerido o mecanismo que concorda com os dados experimentais e com os cálculos teóricos. Foi investigada também a dependência do desempenho do polímero e do comportamento do composto do pH.
Palavras-chave: paracetamol, poli(anilina azul), eletropolimerização, oscilações, estado estacionário estável.
Summary
The electrocatalytic paracetamol oxidation over poly(aniline blue), accompanied or not by its electropolymerization, has been described mathematically (using the linear stability theory and bifurcation analysis). For the compound' s behavior a mechanism, according with the experimental data and theoretical calculations, has been suggested. Also the pH-dependence of the work of the polymer and the compound' s behavior has been investigated.
Keywords: paracetamol, polu(aniline blue), electropolymerization, oscillations, stable steady-state
Introdução
Paracetamol (acetaminofeno ou N-acetil-p-aminofenol) é uma fenolamida acilada, introduzida por primeira vez por Von Mering em 1893, como um fármaco analgético efetivo para adultos e crianças. [1-2]. A sua ação no organismo consiste na inibição da síntese de prostaglandina no sistema nervoso central, o que tranquiliza o centro de calor e febre. No entanto, tem vários efeitos colaterais e o seu excesso no organismo pode causar a intoxicação do fígado e até a morte [3]. Por isso, o desenvolvimento de um método exato, preciso e sensível da análise das suas concentrações permanece sendo uma tarefa atual [4-7].
Além disso, tendo na sua composição uma hidroxila fenólica e um grupo imina (embora acilada), é um composto eletroquimicamente ativo [8-11], o que levou ao desenvolvimento dos procedimentos eletroanalíticos da sua detecção, Vale a pena mencionar também que paracetamol é um composto polimerizável [12-13], o que torna o seu comportamento eletroquímico ainda mais interessante do ponto de vista da obtenção de polímeros condutores (PC) com atividade biológica.
Por outro lado, azul da anilina (também chamada de azul da China e azul solúvel) é um corante aniônico, baseado em trifenilmetano, capaz da transferência intermolecular de carga [14]. Ele também pode ser indicador do pH.
O que dificulta a tarefa é o problema da detecção de um mecanismo mais provável da eletrooxidação de paracetamol (acompanhada ou não pela eletropolimerização), sobre poli(azul da anilina) ou outro polímero condutor. No trabalho [15] o comportamento eletroquímico de paracetamol sobre poli (azul da anilina) foi descrito experimentalmente por meio dos métodos diferentes. Neste trabalho, continua-se a investigação da eletrooxidação do fármaco, sugerindo-se o mecanismo e acrescentando-se os cálculos teóricos, baseados no desenvolvimento e análise de um modelo matemático, capaz de descrever adequadamente os processos neste sistema. Esta modelagem, além de fornecer um mecanismo mais provável, não baseado apenas em deduções fenomenológicas, também dá a possibilidade de comparar o comportamento deste sistema com o dos semelhantes e, segundo o terceiro teorema de semelhança, descreve não só um sistema concreto, mas também os semelhantes.
Antes, foram feitas várias tentativas de descrever matematicamente os sistemas do desempenho de sensores e biossensores, baseados em polímeros condutores [17-27], ferroceno [28, 29], dióxido de titânio e nanopartículas do óxido de cobre (II) [30], bem como a eletrossíntese de polímeros condutores em condições diversas [31-41]. Este estudo, continuando a pesquisa, descrita nos trabalhos [15-42], aborda (na seção II), pela primeira vez, um sistema do comportamento eletroquímico de um sensor de um analito eletropolimerizável, o que é muito importante não só no contexto eletroanalítico de polímeros condutores, mas também no contexto da sua eletrossíntese. N seção (I) será descrita a aplicação para o caso particular do sistema Paracetamol - Poli(azul da anilina) o modelo geral, descrito nos trabalhos [31-41].
Seção I. O desempenho eletroanalítico da poli(azul da anilina) na eletrooxidação de paracetamol, não acompanhada pela eletropolimerização
O comportamento químico e eletroquímico de paracetamol neste sistema depende do pH, haja vista a sensibilidade de ambos os compostos (paracetamol e polímero) contra os ataques protônicos e pode ser descrito mais ou menos de seguinte forma:
A oxidação que leva à aparição do polímero tem um mecanismo diferente eserá descrita na seção (II).
Este mecanismo é um dos exemplos particulares do mecanismo geral que matematicamente já é descrito nos trabalhos [16-30]. Nesta seção, explicar-se-á o funcionamento dos modelos mencionados para este caso particular.
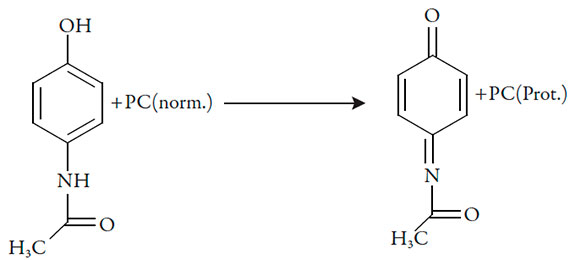 | [1] |
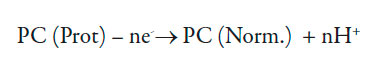 | [2] |
Como o desempenho eletroanalítico do PC, bem como o comportamento de paracetamol, depende do pH, introduzir-se-ão, nesta seção, as três variáveis:
- c - a concentração de paracetamol na camada pré-superficial;
- θ - o grau de recobrimento da superfície pela forma protonada do PC;
- h - a concentração dos prótons na camada pré-superficial.
Como nos artigos anteriores, a fim de simplificar a modelagem, supõe-se que o reator esteja agitando-se intensamente (para menosprezar o fluxo de convecção), que o eletrólito de suporte esteja em excesso (para menosprezar o fluxo de migração) e que o perfil concentracional na camada pré-superficial seja linear, sendo a espessura da camada constante e igual a δ.
O paracetamol entra na camada pré-superficial por meio da sua difusão, é oxidado pelo polímero condutor e reage com os prótons. Posto assim, a sua equação de balanço descrever-se-á como:
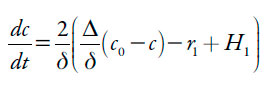 | [3] |
Sendo Δ o seu coeficiente de difusão, c0 a concentração de paracetamol no interior da solução, r1 a velocidade da reação (1).
O polímero condutor é protonado na reação (1) e a forma protonada é oxidada na reação (2), voltando o polímero para a forma inicial e liberando os prótons. Ele também pode ser protonado pelos prótons, presentes na solução. Destarte, a sua equação de balanço será descrita como:
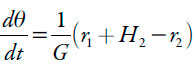 | [4] |
Sendo G a concentração máxima do polímero da azul da China na superfície, r2, a velocidade da reação (2) e H2 a velocidade da reação da protonação direta da poli(azul da anilina).
Os prótons entram na camada pré-superficial por meio da sua difusão, e a sua concentração também aumenta durante a reação (2). A concentração dos prótons se diminui durante a protonação do analito e do polímero condutor. Assim sendo, a sua equação de balanço, neste sistema será descrita como:
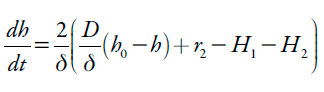 | [5] |
Sendo D o coeficiente de difusão dos prótons, h0 a concentração dos prótons no interior da solução.
As velocidades das reações podem ser descritas como:
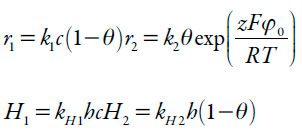 | [6-9] |
Sendo os parâmetros k as velocidades-padrão das respectivas reações, z o número de elétrons transferidos, F=NA*e - o número de Faraday, φ0 o salto do potencial na dupla camada elétrica (DCE), relativo ao da carga zero, R a constante universal de gases e T a temperatura absoluta.
Resultados e discussão (seção I)
A fim de investigar matematicamente o comportamento eletroquímico e eletroanalítico do sistema paracetamol - poli(azul da anilina), analisamos o conjunto das equações diferenciais (3-5) por meio da teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são calculados para o estado estacionário, pode ser descrita como:
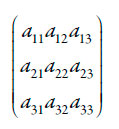 | [10] |
Sendo
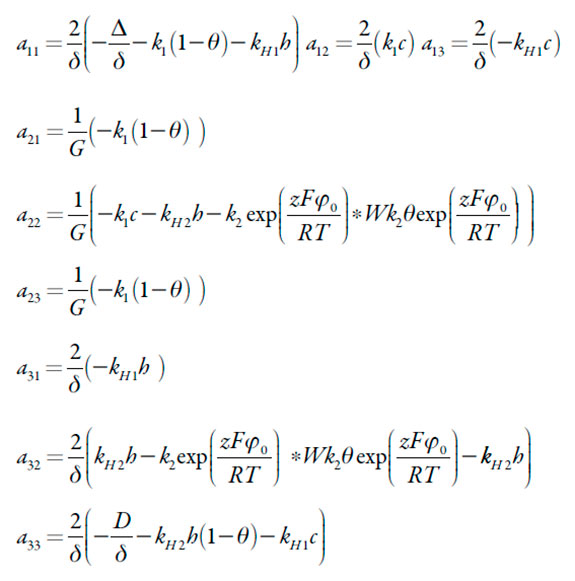 | [11-19] |
A instabilidade oscilatória pode ser realizada, neste sistema, nas condições da bifurcação de Hopf, para cuja satisfação é preciso (não sendo bastante) que na diagonal principal da matriz haja elementos positivos. O único elemento dela, capaz de sê-lo, é a22, no caso da negatividade do parâmetro W, que descreve as influências fortes da reação eletroquímica na DCE. Esta causa do comportamento oscilatório é geral para todos os sistemas análogos [16-30].
A estabilidade de estado estacionário. Para simplificar a análise de Jacobiano, vamos introduzir as novas variáveis de modo que o seu determinante se reescreva como:
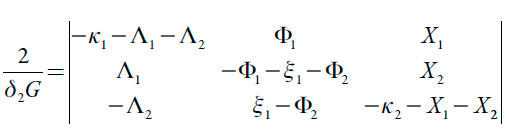 | [20] |
Abrindo os parênteses, ver-se-á que a estabilidade do estado estacionário nesta reação é regida pela difusão do analito e dos prótons (altos valores dos parâmetros k, bem como pela saída mais rápida dos prótons da camada pré-superficial que a do monômero (∧2 > ∧1 ou ),
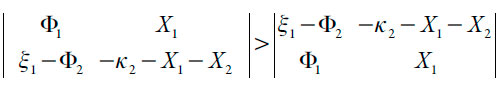
o que também está ligado à pior sensibilidade do sensor no meio fortemente ácido (junto com a difusão mais rápida dos prótons que do analito). Neste caso, a região de estabilidade de estado estacionário (e da sensitividade do sensor e da manutenção da reação) é mais vasta que no caso do trabalho [42].
A condição de estabilidade do estado estacionário obter-se-á, resolvendo-se a inequação, saliente do critério de Routh e Hurwitz (Det J<0), relativamente, por exemplo, ao parâmetro da difusão do analito κ1. Sob a forma de:
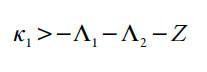 | [21] |
em que
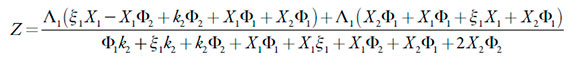
Esta condição não se satisfaz no caso da negatividade de §1, o que descreve as influências do processo eletroquímico na DCE, e no caso do valor negativo do coeficiente, adjacente ao parâmetro ∧1, o que descreve o fator da influência do possível excesso dos prótons. Neste valor marginal, correspondente ao limite de estabilidade de estado estacionário, acontece a bifurcação estática (ou bifurcação de sela e nó), co rrespondente à instabilidade monotônica, cuja condição, para este sistema é:
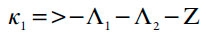 | [22] |
Meio básico. Como observamos anteriormente, o meio ácido faz o sensor menos sensível, haja vista a atividade dos prótons, pior impacto à estabilidade de estado estacionário e a difusão mais rápida. Formar-se-ia, assim, a conclusão de que o pH alto favoreceria o desempenho eletroanalítico e eletrocatalítico do polímero condutor. No entanto, nos baixos valores do pOH as bases também são ativas (participando da dopagem do polímero condutor pela hidroxila, que altera a sua condutividade, reação com a hidroxila fenólica do analito, etc).
Sem embargo, como a base participa de menor número de reações com os componentes deste sistema, a curva "pico do parâmetro eletroquímico - pH" deve ter seu máximo no pH=pOH=7, ou seja, no meio neutro.
Autocatálise. Se, em vez de paracetamol, no sistema houver outro analito, cuja oxidação é autocatalítica, far-se-ão as observações, descritas em [16-30], sendo a autocatálise mais uma causa do comportamento oscilatório.
A presença das substâncias interferentes. O fator da presença das substâncias interferentes ao processo foi abordado no trabalho [17] e as suas observações continuarão vigentes para este caso.
Conclusões (seção I)
1) O mecanismo do desempenho da poli (azul da anilina) inclui a formação da forma quinônica, aliás, quinonimínica do analito e de fato a transferência dos prótons da molécula do paracetamol para o polímero condutor com a sua seguinte oxidação.
2) No meio fortemente ácido a protonação do polímero também pode ser realizada pelos prótons da solução.
3) A estabilidade do estado estacionário estável (e, em consequência, a reação) é controlada pela difusão do analito, e, no meio fortemente ácido, dos prótons. No meio fortemente ácido a velocidade sumária das reações dos prótons na camada pré-superficial deve ser menor que a do analito.
4) A instabilidade oscilatória para este sistema pode ocorrer, sendo causada pelas influências do processo eletroquímico na DCE.
5) A instabilidade monotônica tem a mesma causa, mas ocorre no ponto marginal do estado estacionário.
Seção II. Oxidação normal, acompanhada pela eletropolimerização
Sendo substituída por um grupo ativador (-OH) e outro apassivador (-NHCOCH3), a molécula do paracetamol é polimerizável, sendo que o seu potencial de polimerização deve ser semelhante ao do benzeno.
A eletropolimerização se realiza conforme o mecanismo, análogo ao de Díaz[43-49], sendo que as unidades monoméricas se ligarão nas posições 2 e 6 (haja vista a orientação "concordante" da substituição eletrofílica), ou através do átomo de oxigênio fenólico. A eletropolimerização, neste caso, é precedida pela adsorção do monômero.
No caso da eletrooxidação de paracetamol sobre poli (azul da anilina), acompanhada pela sua eletropolimerização em meio neutro, introduzem-se as seguintes variáveis:
- c - a concentração de paracetamol na camada pré-superficial;
- θ* - o grau de recobrimento do paracetamol na superfície do polímero condutor;
- θ - o grau do recobrimento da forma protonada da poli(azul da anilina),
supondo o suposto na seção I. Também supomos que a oxidação (1) do paracetamol acontece de forma mais efetiva na superfície que na solução.
O paracetamol entra na camada pré-superficial por meio da sua difusão, bem como por meio da dessorção. Sai da camada por meio da sua adsorção. Assim sendo, a sua equação de balanço será descrita como:
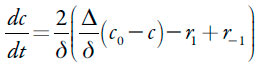 | [23] |
Sendo r1 e r-1 as velocidades de adsorção e dessorção do analito-monômero.
O analito (e monômero ao mesmo tempo) entra na superfície polimérica por meio da adsorção, saindo dela por meio da dessorção. Ele é oxidado formando composto quinônico (1) e polimerizado. Posto assim, a sua equação de balanço descrever-se-á como:
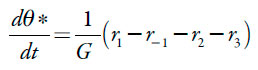 | [24] |
Sendo r3 a velocidade da eletropolimerização.
A forma protonada da poli(azul da China) aparece na superfície no processo da oxidação de paracetamol, bem como na sua polimerização (pois os prótons, subprodutos da eletropolimerização, entram na matriz do polímero do corante). Oxidando-se o polímero volta ao estado inicial. Destarte, a sua equação de balanço será
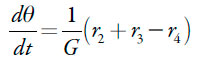 | [25] |
sendo r4 a velocidade da eletrooxidação da forma protonada do polímero.
As velocidades dos respectivos processos podem ser descritas como:
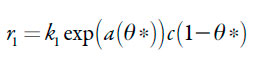 | [26] |
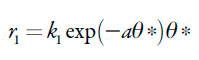 | [27] |
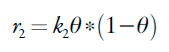 | [28] |
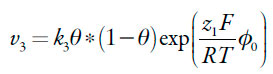 | [29] |
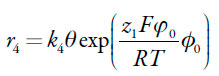 | [30] |
Resultados e discussão (seção II)
Usando, para o sistema de equações (23-25) o procedimento, anteriormente descrito e introduzindo as novas variáveis, para simplificar a análise de Jacobiano, obtê-lo-emos sob a forma de:
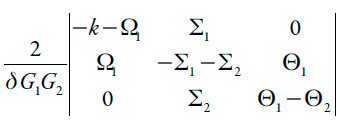 | [31] |
O comportamento oscilatório para este sistema, bem como para todos os sistemas com a eletropolimerização e com o desempenho eletroanalítico de polímeros condutores é possível (experimentalmente foi observado em [46-49], sendo causado pela interação atrativa entre partículas adsorvidas de paracetamol (positividade do elemento - ∑1, através da positividade do parâmetro da interação a1) e pelas influências dos processos eletroquímicos (eletropolimerização e eletrooxidação) na DCE (positividade de - ∑2 e de Θ2).
A estabilidade do estado estacionário: Introduzindo, segundo o critério de Routh e Hurwitz, a inequação Det J < 0 e abrindo os colchetes, vê-se que, no caso da interação repelente entre as partículas adsorvidas e ausência das influências das reações eletroquímicas na DCE (positividade de ∑1, ∑2 e Θ2), introduz-se o estado estacionário estável, regulado, neste caso, pela difusão do paracetamol. A condição de estabilidade do estado estacionário (sendo a inequação resolvida relativamente ao parâmetro de difusão κ), descrever-se-á como:
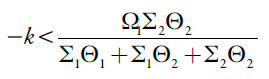 | [32] |
Satisfazendo-se os requisitos mencionados, a condição (32) se satisfaz sempre, o que define a instalação rápida e duradoura do estado estacionário estável. Na margem de estabilidade, como no caso anterior, realiza-se a instabilidade monotônica.
A eletropolimerização não é favorável para fins eletroanalíticos. Sem embargo, as condições da sua realização com impacto grande, são para mais além do potencial de trabalho e(ou) dos valores concentracionais do sensor.
Conclusões (seção II)
1) O comportamento do sistema com a eletrooxidação catalítica do paracetamol, acompanhado pela sua eletropolimerização, tende à formação do estado estacionário estável, controlado pela difusão e garantido pela interação repelente das partículas adsorvidas e pela ausência das influências na dupla camada elétrica.
2) As estruturas dissipativas temporais para este sistema, bem como para os semelhantes, existem, sendo mantidas pela difusão do monômero e formação do polímero. As causas do comportamento oscilatório são análogas às doutros casos da eletropolimerização e desempenho eletroanalítico de polímeros condutores.
Referências
1. S. Mehretie, S. Admassie, M. Tessema, T. Solomon, Anal. Bioanal. Electrochem., 3, 38 (2011). [ Links ]
2. N.R. Goyal, V.K. Gupta, M. Oyama, N. Bachheti, Electrochem. Comm., 7, 803 (2005). [ Links ]
3. M.J. Hodjmann, A.R. Garrard, Crit. Care Clin., 28, 499 (2012). [ Links ]
4. A.R. Solangi, S.Q. Memon, A. Mallah et al., Pak. J. Pharm. Sci., 24, 539 (2011). [ Links ]
5. S. Zhao, W. Bai, H. Yuan, D. Xiao, Anal. Chem. Acta, 559, 195 (2006). [ Links ]
6. O. Calinescu, I. Badea, L. Vladescu et al., J. Chromat. Sci., 50, 335 (2012). [ Links ]
7. A. Pyka, M. Budzisz, M. Dolowy, BioMed Res. J., N. 545703 (2013). [ Links ]
8. L. Ozcan, Y. Sahin, Sens. Act. B. Chem., 2, 362 (2007). [ Links ]
9. S. Shahrorkhian, R. Saberi, Int. J. Electrochem., N.764294 (2011). [ Links ]
10. F. Yang, J. Liu, H. Ting, Q. Zhang, Coll. Surf. B., 85, 289 (2011) [ Links ]
11. Y. Peng, Z. Wu, L. Zhigang, Anal. Met., 6, 5673 (2014). [ Links ]
12. J. Van Steveninck, J.F. Koster, T. Dubbelman, Biochem. J., 259, 633 (1989). [ Links ]
13. Y. Li, Sh. M. Chen, Int. J. Electrochem., 7, 2175 (2012). [ Links ]
14. C.Y. Ying, Y. Liu, D. Zheng et al., J. Photochem. Photobiol., 188, 51 (2007). [ Links ]
15. C.C. Vishwanath, B. Kumara Swamy, Anal. Bioanal. Electrochem., 6, 573 (2014). [ Links ]
16. V. Tkach, V. Nechyporuk, P. Yagodynets' , Anal. Bioanal. Electrochem., 6, 273 (2014). [ Links ]
17. V. Tkach, V. Nechyporuk, P. Yagodynets' , Rev. Colomb. Cienc. Quím. Farm.,42, 215 (2013). [ Links ]
18. V. Tkach, V. Nechyporuk, P. Yagodynets' , I. Rusnak, Orbital Elec. J. Chem.,4, 136 (2012). [ Links ]
19. V. Tkach, V. Nechyporuk, P. Yagodynets, Rev. Colomb. Cienc. Quím. Farm., 42, 30 (2013). [ Links ]
20. V. Tkach, V. Nechyporuk, P. Yagodynets' , Rev. Colomb. Cienc. Quím. Farm., 41, 203 (2012). [ Links ]
21. V. Tkach, V. Nechyporuk, P. Yagodynets' , Yu. Meslyuk, Rev. Soc. Quím. Perú, 77, 259 (2011). [ Links ]
22. V. Tkach, G. Maia, S.C. de Oliveira, R. Ansari, R. Ojani, P. Yagodynets' , Anais do 7° Encontro Nacional de Tecnologia Química, Vitória, ES, Brasil, 17 a 19 de Setembro de 2014. [ Links ]
23. V. Tkach, V. Nechyporuk, P. Yagodynets' , III Encontro em Técnicas de Caracterização em Análise Química, 6 de junho de 2014, Braga, Portugal, p. 73. [ Links ]
24. V. Tkach, B. Kumara Swamy, R. Ojani, M. Blanes, P. Yagodynets' , Orbital Elec. J. Chem., 7, 1 (2015). [ Links ]
25. V. Tkach, V. Nechyporuk, P. Yagodynets' , Proceedings of the 1st CQM Annual Meeting and the 9th Materials' Group Meeting of the University of Madeira, 31st of January - 1st of February 2014, Funchal, Região Autónoma da Madeira, Portugal, p. 37. [ Links ]
26. V. Tkach, V. Nechyporuk, R. Ojani, P. Yagodynets' , M. Tazyrov, Anales del XXX Congreso Argentino de Química, 22 al 24 de Octubre de 2014, Buenos Aires, URL: http://aqa.org.ar/pdf101/cd/Qca.Analitica/1-001.pdf, acessado aos 17 de novembro de 2014. [ Links ]
27. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets' , M. Tazyrov, Libro del XXVII Congreso Nacional de Química Analítica, 25 al 27 de junio de 2014, Puebla, México, p. 56. [ Links ]
28. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets, Rev. Colomb. Cienc. Quím. Farm., 43, 35(2014). [ Links ]
29. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets' , III Encontro em Técnicas de Caracterização em Análise Química, 6 de junho de 2014, Braga, Portugal, p. 72. [ Links ]
30. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets' , Orbital. Elec. J. Chem., 6, 142 (2014). [ Links ]
31. V. Tkach, V. Nechyporuk, P. Yagodynets' , Cienc. Tecn. Mat., 24, 54 (2012). [ Links ]
32. V. Tkach, V. Nechyporuk, P. Yagodynets' , Proc. Quím., 8, 49 (2014). [ Links ]
33. V. Tkach, V. Nechyporuk, P. Yagodynets' , M. Hryhoryak, Cienc. Tecn. Mat., 24, 50 (2012). [ Links ]
34. V. Tkach, V. Nechyporuk, P. Yagodynets' , Tecn. Met. Mat. Min., 10, 249 (2013). [ Links ]
35. V. Tkach, V. Nechyporuk, P. Yagodynets' , Avan. Quím., 8, 9 (2013). [ Links ]
36. V. Tkach, V. Nechyporuk, P. Yagodynets' , Avan. Quím., 8, 97 (2013). [ Links ]
37. V. Tkach, V. Nechyporuk, P. Yagodynets' , Afinidad, 70, 73 (2013). [ Links ]
38. V. Tkach, V. Nechiporuk, P. Yagodinets, S.C. de Oliveira, A. M. da Rocha, J. Sib. Fed. Univ. Chem., 7, 403(2014). [ Links ]
39. V. Tkach, V. Nechyporuk, P. Yagodynets' , Anais do 10o Encontro Brasileiro sobre Adsorção, Guarujá, SP, 27-30 de abril de 2014, N. 122-1 [ Links ]
40. V. Tkach, V. Nechyporuk, P. Yagodynets' , Med. J. Chem., 3, 1122 (2015). [ Links ]
41. V. Tkach, V. Nechyporuk, P. Yagodynets' , 3rd Portuguese Young Chemists' Meeting, Porto, 9-11 of May, 2012, p. 176. [ Links ]
42. S.E. Baghbamidi, H. Beitollahi, S. Tajik, Anal. Bioanal. Electrochem., 6, 634 (2014). [ Links ]
43. S. Sadki, Ph. Scottland, N. Brodie, G. Saboraud, Chem. Soc. Rev., 29, 283 (2000). [ Links ]
44. O.I. Aksimentyeva, "Physico-chemical regulaments of obtaining and properties of conducting polymers in thin films" (in Ukranian), Sc. D. Thesis in Physical Chemistry, National University of Chernivtsi, 2000. [ Links ]
45. J. Roncali, Chem. Rev., 92, 711 (1992). [ Links ]
46. I. Das, N. R. Agrawal, S. A. Ansari, S. K. Gupta, Ind. J. Chem., 47A, 1798 (2008). [ Links ]
47. M.S. Ba-Shammakh, "Electropolymerization of pyrrole on mild steel for corrosion protection", Ph. D. Thesis, King Fahd University of Petroleum and Minerals, Dharan, Saudi Arabia, 2003. [ Links ]
48. D. Sazou, Synth. Met., 130, 45 (2002). [ Links ]
49. K.R. Lemos-Castagno, "Eletropolimerização de pirrol sobre liga de alumínio 1100", Tés. D. Sc., Universidade Federal do Rio Grande do Sul, Porto Alegre, 2007. [ Links ]













