Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/rcciquifa.v44n2.56294
Mecanismo de desempenho eletroanalítico da 2,7-bis(ferrocenil-etinil)-fluoreno-9-ona para eletrodetecção da hidrazina e sua descrição matemática
Mechanism of the electroanalytical performance of 2,7-bis (ferrocenyl-ethinyl) fluorene-9-one to electro-detection of hydrazine and its mathematical description
Somayeh Tajik b
Reza Ojani c
Michel O. G. Espínola d
Montserrat Blanes d
Petró I. Yagodynets' a
Márcia H. de Rizzo da Matta e
a Universidade Nacional de Chernivtsi, Ucrânia * E-mail: nightwatcher2401@gmail.com
b Universidade de KermanShahidBahonar, República Islâmica do Irã
c Universidade de Mazandarã, República Islâmica do Irã
d Universidade Nacional de Assunção, República do Paraguai
e Universidade Federal de Mato Grosso do Sul, Brasil
Recibido para evaluación: 19 de noviembre de 2014
Aceptado para publicación: 2 de julio de 2015
Resumo
Para o processo da eletrooxidação da hidrazina sobre a camada do composto carbonílico derivado de ferroceno, foi sugerido o mecanismo do desempenhoeletroanalítico. Para ele, também foi desenvolvido e analisado (por meio da teoria de estabilidade lineal e análise de bifurcações) o modelo matemático, capaz de descrever os processos no sistema. Os resultados da modelagem foram comparados com os experimentais, bem como com os teóricos, observados para sistemas análogos.
Palavras-chave: hidrazina, 2,7-bis(ferrocenil-etinil)-fluoreno-9-ona, sensores eletroquímicos, oscilações eletroquímicas, teoria de estabilidade linear
Summary
For the process of hydrazine electrooxidation over the layer of ferrocene-carbonylic derivative, the electroanalytic functionmechanism has been suggested. Also there has been developed and analyzed (by means of linear stability theory and bifurcation analysis) the mathematical model, capable to describe the processes in the system. The results of the modeling have been compared with experimental and theoretical for analogous systems.
Keywords: hydrazine, 2,7-bis-(ferrocenil-ethynyl)-fluoren-9-one, electrochemical sensors, electrochemical oscillations, linear stability theory.
Introdução
A hidrazina é uma substância nociva para a saúde [1-5], que atua como cancerígena, hepatotóxica, mutagênica e criadora de anomalias de sangue. Além disso, a hidrazina é reconhecida um composto nocivo para o ambiente, sendo a sua concentração máxima permitida em esgotos de 1,0 ppm [5]. Por outro lado, a hidrazina é uma substância amplamente usada como matéria-prima em Síntese Orgânica, na obtenção de fertilizantes, explosivos e como combustível em células a combustível [6]. Assim, haja vista a sua importância, o desenvolvimento de um método claro, exato, sensível e preciso para a sua detecção permanece atual [7-8].
Já foram sugeridos vários métodos da detecção de hidrazina [9-10]. O mecanismo da sua eletrooxidação foi investigado em diferentes elétrodos metálicos [11-15] e foi observado que os sobrepotenciais deeletrooxidação da hidrazina sobre os metais nobres são inferiores aos da eletrooxidação sobre os outros metais. Outrossim, o comportamento oscilatório em potencial foi observado no processo da eletrooxidação da hidrazina sobre platina [11], o que também põe em questão o porquê e a probabilidade da aparição de instabilidades eletroquímicas. Sem embargo, os metais nobres são muito caros e os eletrodos de grafite não são usados neste processo por causa de altos sobrepotenciais. Destarte, a modificação de elétrodos com vários materiais mediadores [16-26] realiza-se a fim de diminuir o sobrepotencial. Destaca-se o uso de nanopartículas[9, 16-18], dióxido de titânio [19], polímeros condutores [20-23] e do óxido de grafeno [24-26]. No entanto, o desconhecimento do mecanismo mais provável da oxidação da hidrazina sobre certos materiais faz mais difícil a procura de um material compatível e o desenvolvimento de um modelo matemático, capaz de descrever adequadamente o comportamento do sistema, fornecer conclusões, válidas não só para o sistema concreto, mas também para semelhantes (segundo o terceiro teorema de semelhança), é um passo muito importante nesta procura.
No trabalho [27] foi construído um sensor de hidrazina, baseado no elétrodo de óxido de grafeno e pasta de carbono, modificado pelo derivado ferrocênico de natureza carbonílica. O composto atuou na eletrocatálise da eletrooxidação da hidrazina, especialmente em meio neutro, em que as influências da basicidade e alcalinidade no desempenho eletroanalítico do composto ferrocênicocarbonílico não são muito fortes. Neste trabalho será dada a continuação de estudo [27], e nele será sugerido o mecanismo ao desempenho do composto, confirmado pelos cálculos matemáticos, o que dará a possibilidade de comparar o mecanismo com os dos sistemas análogos.
Foram feitas várias tentativas de descrever matematicamente o desempenho eletroanalítico dos polímeros condutores e compósitos [28-38], ferroceno [39-40], dióxido de titânio [35] e nanopartículas do óxido de cobre (II) [41] na eletrodetecção de vários analitos, inclusive hidrazina. Agora, segue a continuação desta pesquisa importante para a compreensão do mecanismo do desempenho eletroanalítico e eletrocatalítico dos novos materiais.
O mecanismo e a sua descrição matemática
O desempenho dos elétrodos,baseados emferroceno,não depende do pH e é apresentado como:
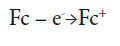 | [1] |
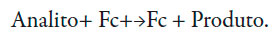 | [2] |
No entanto, observandoalguns detalhes, dá para notar que do pH só não depende a reação (1) e a semirreação, oposta a (1), que faz parte da reação (2). A outra semirreação, em geral, dependendo pH.Ademais, quando o ferroceno é derivado (e na molécula modificadora tem um grupo carbonila, bem como duas ligações triplas) a primeira semirreação também vai depender do pH e, na hora da oxidação da hidrazina,o processo em meio neutro pode ser descrito como:
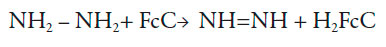 | [3] |
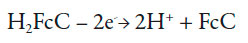 | [4] |
Neste caso, se o pH é baixo, pode acontecer a reação, oposta a (4), o que piora o desempenho eletroanalítico do composto (além do ataque protônico à hidrazina). No caso do pH alto, acontece o ataque nucleofílico do grupo carbonila, ou dos grupos adjacentes.
Por outro lado, as ligações triplas, existentes na molécula, podem reagir com as substâncias, presentes na solução. Das reações laterais também é preciso mencionar o possível ataque do grupo carbonila e das ligações triplas pela hidrazina.
Haja vista o anteriormente dito, para descrever o desempenho deste sensor, introduzimos as três variáveis:
- c - a concentração da hidrazina na camada pré-superficial;
- θ -o grau de recobrimento da forma modificada do composto quinônico;
- h - a concentração dos prótons na camada pré-superficial.
Para simplificar a modelagem, supomos que a solução dentro do reator esteja agitandose intensamente, e assim é possível menosprezar o fluxo de convecção, que o eletrólito de suporte se esteja em excesso (podendo-se, destarte, menosprezar o fluxo de migração e as despesas do dopante). Também supomos que o perfil concentracional na camada pré-superficial seja linear e a espessura da camada, constante, igual a δ.
A hidrazina entra na camada pré-superficial por meio da sua difusão, reage lá com os prótons e é oxidada pelo composto ferrocênico, cujas ligações triplas também é capaz de atacar. Destarte, a sua equação de balanço será descrita como:
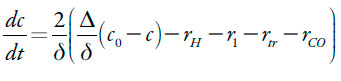 | [5] |
Sendo Δ o seu coeficiente de difusão, c0 a concentração da hidrazina no interior da solução, rH a velocidade da protonização da hidrazina, r1 a reação da oxidação dela, rtr a reação do ataque nucleofílicoda ligação tripla pela hidrazina (que e, porém, mais rápido nas condições do pH alto), rCO a velocidade do ataque nucleofílico do grupo carbonila pela hidrazina.
O composto ferrocênico pode ser modificado pela hidrazina e pelos prótons, sendo depois oxidado e, também, atacado pelos prótons. Posto assim, a sua equação de balanço vai ser descrita como:
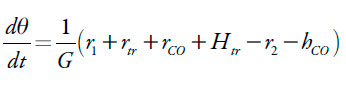 | [6] |
Sendo que r2 a reação da oxidação, G a concentração máxima superficial do composto ferrocênico e Htr ataque protônico da ligação tripla, hCO a velocidade do ataque protônico.
Os prótons entram na camada pré-superficial por meio da sua difusão, bem como pela oxidação do composto quinônico modificado. Assim sendo, a equação de balanço dos prótons será descrita como:
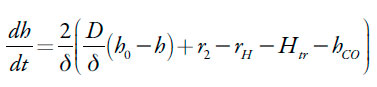 | [7] |
Sendo D o coeficiente de difusão, h0 a concentração dos prótons no interior da solução.
As velocidades das respectivas reações podem ser calculadas como:
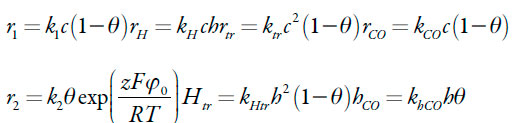 | [8-14] |
Geralmente o sistema de equações é muito semelhante aos descritos anteriormente, o que não contraria o terceiro teorema de semelhança. No entanto, haja vista a derivação do composto que agora tem grupos, cujo comportamento depende do pH, e ligações triplas, o sistema sofre mudanças que dão impacto ao comportamento do estado estacionário.
Resultados e discussão
A fim de investigar o comportamento eletroanalítico do composto quinônico do ferroceno, analisamos o sistema de equações diferenciais linearizados por meio da teoria de estabilidade linear. A matriz funcional de Jacobi, cujos elementos são apresentados abaixo:
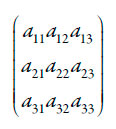 | [15] |
Sendo:
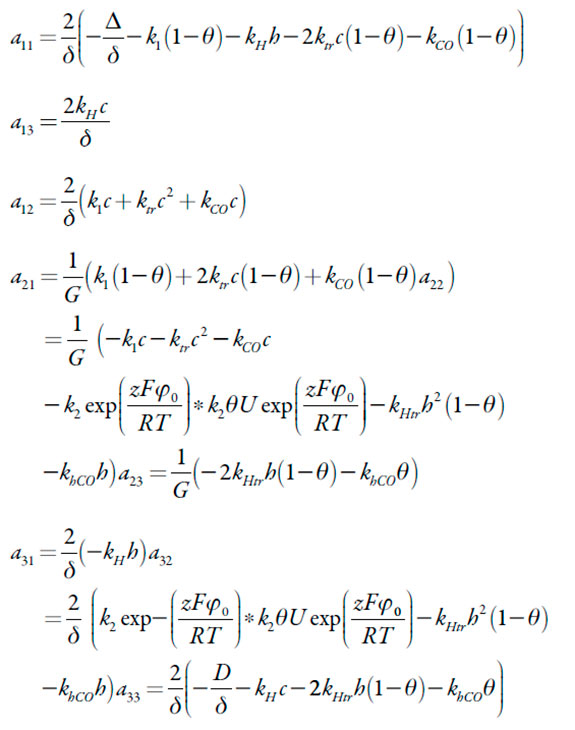 | [16-24] |
A fim de simplificar a análise do jacobiano, introduzimos as novas variáveis, de modo que ele se reescreva como:
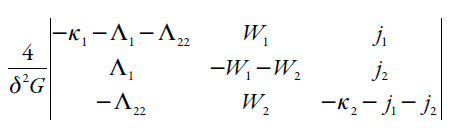 | [25] |
A instabilidade oscilatória acontece nas condições da bifurcação de Hopf, para cuja satisfação, é preciso haver (não sendo bastante) elementos positivos na diagonal principal da matriz. Como neste sistema não tem etapas autocatalíticas, o único elemento da diagonal, capaz de ser positivo é W2, o que acontece, como nos sistemas descritos em [28-42], por causa das influências da oxidação eletroquímica na dupla camada elétrica (DCE), que provocam alteração periódica nas suas cargas e capacitâncias. Esta causa coincide com uma das causas do comportamento oscilatório em [11].
Usando o critério de Routh-Hurwitz de estabilidade de estado estacionário, resolvemos a inequação Det J<0. A sua resolução dá a possibilidade de inferir a condição de estabilidade do estado estacionário sob a forma de:
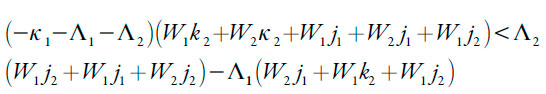 | [26] |
Segundo a inequação (26), a estabilidade do estado estacionário (e, consequentemente, a manutenção da reação por si só) é controlada pela difusão (valores altos de κ1 e κ2) e, no caso do meio ácido, pela saída mais rápida dos prótons que do analito (neste caso, hidrazina) da camada pré-superficial (∧2 > ∧1), o que, diga-se a verdade, é muito semelhante às observações já feitas acerca dos polímeros condutores [28-30]. Resolvendo a inequação (26) relativamente ao parâmetro da difusão do analito, que é ï«1 (e trocando os signos, a fim da melhor compreensão), obter-se-á o valor crítico dele, correspondente à margem de estabilidade do estado estacionário.
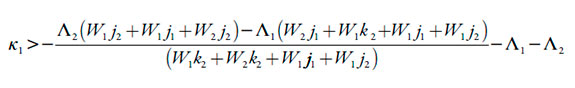 | [27] |
A condição, expressa em (27) só não é satisfeita no caso das altas influências do processo eletroquímico sobre a DEL (ou seja, no caso do alto valor negativo do parâmetro W2).Esta condição vai ao encontro do descrito no artigo [27]. Neste mesmo valor crítico realiza-se a instabilidade monotônica (sendo a condição dela Det J=0).
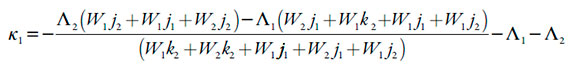 | [28] |
Neste ponto, coexistem vários estados estacionários, todos instáveis, sendo que o sistema existe só em um. Este se destrói, após a mudança das condições do sistema.
Meio alcalino. No meio alcalino, troca-se a terceira variável (introduz-se a concentração da hidroxila), bem como a sua descrição. A hidroxila alcalina pouco afeta a molécula da hidrazina, no entanto catalisa o ataque da ligação tripla, bem como da carbonila. Assim sendo, no trecho, correspondente ao meio alcalino,a curva pH - pico do parâmetro eletroquímico não deve ser igual ao correspondente ao meio ácido, ou seja, a curva, possuindo o máximo no valor neutro do pH, não deve apresentar simetria.
Meio básico orgânico. No meio fortemente básico de aminas primárias e secundárias (cíclicas, ou não), o comportamento é diferente do observado no caso das bases inorgânicas que contêm hidroxila, porque algumas aminas tendem a juntar-se à ligação tripla. A equação de balanço da amina deverá ser diferente da equação de balanço da hidroxila alcalina.
No entanto, na ausência da hidroxila, o ataque nucleofílico da hidrazina corre mais devagar, o que "distribui" a atividade da base mais ou menos dentro da atividade do álcali no caso anterior. Portanto a curva pH - pico do parâmetro eletroquímico não deve ser muito diferente do caso do meio básico alcalino.
Autocatálise. No caso dos analitos, cuja oxidação é autocatalítica, tomam-se em conta as observações, mencionadas em [28-40]. A autocatálise então se torna mais uma causa para o comportamento oscilatório.
Conclusões
1. O desempenho do derivado carbonílico de ferroceno na eletrodetecção da hidrazina é diferente do funcionamento do próprio ferroceno, haja vista a presença do grupo carbonílico e ligações triplas, cujo comportamento depende do pH.
2. No meio ácido a atividade do composto é diferente que no meio básico (sendo também levemente diferente nos meios básicos alcalino e amínico).
3. A estabilidade de estado estacionário é controlada pela difusão e pela superioridade da velocidade da saída dos prótons da camada pré-superficial, comparada à da saída do analito.
4. A instabilidade oscilatória para este processo é possível, sendo causada pelas influências do processo da eletro-oxidação na DCE, suas cargas e capacitâncias.
5. A instabilidade monotônica é possível no caso das influências fortes da eletrooxidação na DCE no valor marginal crítico do parâmetro da difusão do analito (neste caso, hidrazina) κ1, correspondente à multiplicidade de estados estacionários, dos quais o sistema escolhe apenas um e ele se destrói após a alteração das condições físico-químicas.
Referências
1. S. Garrod, M.E. Bollard, A.W. Nicholls et al., Integrated metabonomic analysis of the multiorgan effects of hydrazine toxicity in rat, Chem. Res. Toxicol., 18, 115 (2005). [ Links ]
2. E. H. Vernot, J.D. McEwen, R.H. Bruner et al., Long-term inhalation toxicity of hydrazine, Fund. Appl. Toxicol., 5, 1050(1985). [ Links ]
3. J. A. Munhoz, "Apostila de riscos de toxicidade e de explosividade, Para uso em treinamento de membros da segurança do trabalho", URL: http://www.saudeetrabalho.com.br/download/riscos-explosividade.pdf, acessado aos 17 de novembro de 2014. [ Links ]
4. J. W. Mo, B. Ogorevc, X. Zhang, B. Pihlar, Cobalt and copper hexacyanoferrate modified carbon fiber microelectrode as an All-solid potentiometric microsensor for hydrazine, Electroanal., 12, 48 (2000). [ Links ]
5. S. Amlathe, V.K. Gupta, Spectrophotometric determination of trace amounts of hydrazine in polluted water, Analyst, 113, 1481 (1988). [ Links ]
6. All About Hydrazine, The Artemis Project, Private enterprise on the moon, URL: http://www.asi.org/adb/04/03/09/hydrazine-info.html, acessado aos 17 de novembro de 2014. [ Links ]
7. R. Ojani, S. Safshekan, J. Raoof, Photoelectrochemical oxidation of hydrazine on TiO2-modified titanium electrode: its application for detection of hydrazine, J. Solid State Electrochem.,196, 610 (2014). [ Links ]
8. S. Babanova, U. Martínez, K. Artyushkova et al., Hydrazine sensor for quantitative determination of high hydrazine concentrations for direct hydrazine fuel cell vehicle applications, J. Electrochem. Soc., 161, 79 (2014). [ Links ]
9. R. Ahmad, N. Tripathy, D.U. Jung, Y.B. Hahn, Highly sensitive hydrazine chemical sensor based on ZnO nanorods field-effect transistor, Chem. Commun., 50, 1890 (2014). [ Links ]
10. R. Devasenatripathy, V. Mani, S.M. Chen, Highly selective amperometric sensor for the trace level detection of hydrazine at bismuth nanoparticles decorated graphene nanosheets modified electrode, Talanta, 124, 43 (2014). [ Links ]
11. G. Horanyi, G. Inzelt, E. Izetey, Open circuit potential oscillations of platinum electrodes immersed in solutions of organic fuels and redox systems. Imitation of galvanostatic potentialoscillations observed in the course of electrooxidation of organic fuels, J. Electroanal. Chem., 81, 395 (1977). [ Links ]
12. K. Korinek, J. Korita, M. Nusiloua, Electro-oxidation of hydrazine on mercury, silver and gold electrodes in alkaline solutions, J. Electroanal. Chem., 21, 319 (1969). [ Links ]
13. M. Fleischmann, K. Korinek, D. Piewner, Electro-oxidation of hydrazine on mercury, silver and gold electrodes in alkaline solutions, J. Electroanal. Chem., 34, 499 (1972). [ Links ]
14. S. Karr, L. Meites, The voltammetric characteristics and mechanism of electrooxidation of hydrazine, J. Am. Chem. Soc., 84, 906 (1962). [ Links ]
15. J.A. Harrison, Z.A. Khan, The oxidation of hydrazine in alkaline solution at platinum and mercury, J. Electroanal. Chem., 26, 1 (1970). [ Links ]
16. S.K. Mehta, K. Singh, A. Umar et al., Ultra-high sensitive hydrazine chemical sensor based on low-temperature grown ZnO nanoparticles, Electrochem. Acta, 69, 128 (2012). [ Links ]
17. J. Liu, Y. Li, J. Jiang, X. Huang, C@ZnO nanorod array-based hydrazine electrochemical sensor with improved sensitivity and stability, Dalton Trans., 37, 8693 (2010). [ Links ]
18. J.B. Raoof, R. Ojani, F. Jamali, S.R. Hosseini, Electrochemical detection of hydrazine using a copper oxide nanoparticle modified glassy carbon electrode, Casp. J. Chem., 1, 73 (2012). [ Links ]
19. R. Ojani, E. Zarei, A new and simple electrochemically assisted photocatalysis sensor of hydrazine using a Ti/TiO2 electrode, J. Braz. Chem. Soc., 24, 657 (2013). [ Links ]
20. H. Shu, "Applications of poly(3-hexylthiophene) thin film as a hydrazine-sensitive chemoresistor", M. Sc. Thesis, Alburn, Alabama, 2006. [ Links ]
21. S. Ameen, M. Shaheer Akhtar, H.S. Shin, Hydrazine chemical sensing by modified electrode based on in situ electrochemically synthesized polyaniline/graphene composite thin film, Sens. Act. B., 173, 177 (2012). [ Links ]
22. D. Oukil, L. Benhaddad, L. Makhloufi et al., Gold nanoparticles modified polypyrrole/iron electrode used as sensor for hydrazine detection, Sens. Lett., 11, 295 (2013). [ Links ]
23. S. Virji, R.B. Kaner, B.H. Weiller, Hydrazine detection by polyaniline using fluorinated alcohol additives, Chem. Mater., 17, 1256-1260 (2005). [ Links ]
24. M.A. Gross, M. J. A. Sales, M.A.G. Soler et al., Reduced graphene oxide multilayers for gas and liquid phases chemical sensing, RSC Adv., 34, 17917 (2014). [ Links ]
25. S. Takahashi, N. Abiko, J. Anzai, Redox response of reduced graphene oxidemodified glassy carbon electrodes to hydrogen peroxide and hydrazine, Materials, 6, 1840 (2013). [ Links ]
26. Z. Bo, X. Shuai, S. Mao et al., Green preparation of reduced graphene oxide for sensing and energy storage applications, Sci. Rep., N. 4684 (2014). [ Links ]
27. S.E. Baghbamidi, H. Beitollahi, S. Tajik, Graphene oxide nano-sheets/ferrocene derivative modified carbon paste electrode as an electrochemical sensor for determination of hydrazine, Anal. Bioanal. Electrochem., 6, 634 (2014). [ Links ]
28. V. Tkach, V. Nechyporuk, P. Yagodynets' , I. Rusnak, Los biosensores, basados en los polímeros conductores, y la descripción matemática de su desempeño, Orbital Elec. J. Chem., 4, 136 (2012). [ Links ]
29. V. Tkach, V. Nechyporuk, P. Yagodynets' ,The mathematical stability study of the work of isomerization sensors, based on conduction polymers, Anal. Bioanal. Electrochem., 6, 273 (2014). [ Links ]
30. V. Tkach, V. Nechyporuk, P. Yagodynets, El estudio de estabilidad en el proceso del desempeño de los sensores y biosensores, basados en los polímeros conductores en medio fuertemente ácido, Rev. Colomb. Cienc. Quím. Farm., 42, 30 (2013). [ Links ]
31. V. Tkach, V. Nechyporuk, P. Yagodynets' , A descrição matemática do processo da detecção de duas substâncias com um grupo funcional comum pelos sensores e biossensores eletroquímicos, baseados em polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 42, 215 (2013). [ Links ]
32. V. Tkach, V. Nechyporuk, P. Yagodynets' , A investigação matemática do desempenho de biossensores eletroquímicos enzimáticos, baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 41, 203 (2012). [ Links ]
33. Tkach, V. Nechyporuk, P. Yagodynets' , Yu. Meslyuk, Mathematical model of the work of the mediated conducting polymer sensors with the use of the polymers of heterocyclic compounds, Rev. Soc. Quím. Perú., 77, 259 (2011). [ Links ]
34. V. Tkach, G. Maia, S.C. de Oliveira, R. Ansari, R. Ojani, P. Yagodynets' , Anais do 7° Encontro Nacional de Tecnologia Química, Vitória, ES, Brasil, 17 a 19 de Setembro de 2014. [ Links ]
35. V. Tkach, V. Nechyporuk, P. Yagodynets' , III Encontro em Técnicas de Caracterização em Análise Química, 6 de junho de 2014, Braga, Portugal, p. 73. [ Links ]
36. V. Tkach, B. Kumara Swamy, R. Ojani, M. Blanes, P. Yagodynets' , El mecanismo de la oxidación de omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y su descripción matemática, Orbital. Elec. J. Chem., 7, 1 (2015). [ Links ]
37. V. Tkach, V. Nechyporuk, P. Yagodynets' , Proceedings of the 1st CQM Annual Meeting and the 9th Materials' Group Meeting of the University of Madeira, 31st of January - 1st of February 2014, Funchal, RegiãoAutónoma da Madeira, Portugal, 2014, p. 37. [ Links ]
38. V. Tkach, V. Nechyporuk, R. Ojani, P. Yagodynets' , M. Tazyrov. Anales del XXX CongresoArgentino de Química, 22 al 24 de Octubre de 2014, Buenos Aires, URL: http://aqa.org.ar/pdf101/cd/Qca.Analitica/1-001.pdf, acessado a os 17 de novembro de 2014. [ Links ]
39. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets' , M. Tazyrov, Libro del XXVII Congreso Nacional de Química Analítica, 25 al 27 de junio de 2014, Puebla, México, p. 56. [ Links ]
40. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets, Modelagem matemática do desempenho de elétrodos, modificados por camada de ferroceno nos processos da eletrooxidação de compostos orgânicos em meios neutro e ácido, Rev. Colomb. Cienc. Quím. Farm., 43, 35 (2014). [ Links ]
41. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets' , A descrição matemática do desempenho eletroanalítico de nanopartículas de óxido de cobre (II) na eletrodetecção de hidrazina, Orbital. Elec. J. Chem., 6, 142 (2014). [ Links ]













