Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Ciencias Químico - Farmacéuticas
versão impressa ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.2 Bogotá maio/ago. 2015
https://doi.org/10.15446/rcciquifa.v44n2.56295
Solvatación preferencial de la naringina en mezclas cosolventes etanol + agua mediante el método de las integrales inversas de Kirkwood-Buff
Preferential solvation of naringin in ethanol + water cosolvent mixtures according with the inverse Kirkwood-Buff integrals
Diego Iván Caviedes Rubio a
Reinaldo Gabriel Sotomayor Pino b
a Grupo de Investigación en Administración de Operaciones y Producción, Programa de Ingeniería Industrial, Facultad de Ingeniería, Universidad Cooperativa de Colombia, calle 11 No. 1G-31B, Neiva, Huila, Colombia. * Correo electrónico: danielr.delgado@campusucc.edu.co.
b Grupo de Investigación en Control y Tecnología Farmacéutica (Gitecfar), Programa de Farmacia, Facultad de Química y Farmacia, Universidad del Atlántico, Km 7 Antigua Vía Puerto Colombia, Barranquilla, Atlántico, Colombia.
Recibido para evaluación: 19 de febrero de 2015.
Aceptado para publicación: 25 de julio de 2015.
Resumen
Los parámetros de solvatación preferencial, es decir, las diferencias entre la fracción molar local y de la solución de los solventes en solución de naringina se derivan de su solubilidad en mezclas cosolventes mediante el método de las integrales inversas de Kirkwood-Buff. Según el método IKBI, la naringina es sensible a los efectos específicos de solvatación según la composición cosolvente, por lo que el parámetro de solvatación preferencial por δx1,3, es negativo en mezclas ricas en agua y en mezclas ricas en etanol, pero positivo en composiciones entre 0,24 y 0,40 en fracción molar de etanol. Esto podría demostrar el papel relevante de hidratación hidrofóbica alrededor de los grupos no polares en la solvatación de fármacos en mezclas ricas en agua. Por otro lado, en mezclas de composiciones cosolventes intermedias, el fármaco es solvatado principalmente por etanol, posiblemente debido al comportamiento básico de la mezcla cosolvente; mientras que en mezclas ricas en etanol, la solvatación preferencial por el agua podría deberse al carácter ácido del agua.
Palabras clave: naringina, solubilidad, integrales inversas de Kirkwood-Buff, IKBI, solvatación preferencial.
Summary
The preferential solvation parameters, i.e., the differences between the local and bulk mole fractions of the solvents in solutions of naringin is derived from their solubility in binary solvent mixtures by means of the inverse Kirkwood-Buff integral (IKBI) method. According to IKBI method it is found that naringin is sensitive to solvation effects, so the preferential solvation parameter by ethanol δx1,3, is negative in waterrich and ethanol-rich mixtures but positive in compositions from 0.24 to 0.40 in mole fraction of ethanol. This could demonstrate the relevant role of hydrophobic hydration around the non-polar groups in the drug solvation in water-rich mixtures. Otherwise, in mixtures of intermediate co-solvent compositions, the drug is mainly solvated by ethanol, probably due to the basic behavior of the co-solvents; whereas, in ethanol-rich mixtures, the preferential solvation by water could be due to the acidic behavior of water.
Key words: Naringin, solubility, inverse Kirkwood-Buff integrals, IKBI, preferential solvation.
Introducción
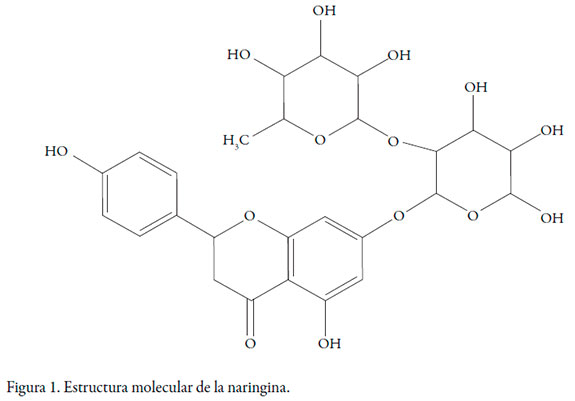
La naringina (véase figura 1) (4'-5-7'-trihidroxiflavanona-7-ramnoglucósido, C27H32O14, CAS 10236-47-2) es una flavanona predominante en frutos cítricos y es la principal responsable de su sabor amargo [1, 2]. Al administrarse por vía oral la naringina, es hidrolizada a naringenina, que es el principal metabolito que se absorbe [3]. La naringina y naringenina son posibles inhibidores de las enzimas CYP [4]; además, se han reportado varios efectos terapéuticos como antioxidante, antimicrobiana, hipolipemiante, antiinflamatorio, anticancerígeno [5] y posee propiedades hipocolesterolémicas, debido a que reduce el nivel del colesterol de baja densidad en el plasma [6].
En cuanto a la solubilidad de fármacos en mezclas cosolventes, esta ha sido ampliamente estudiada, en donde la mayoría de los estudios describen el comportamiento de las isotermas de solubilidad en función de la composición cosolvente; otro número importante de investigaciones dirige sus esfuerzos hacia el desarrollo de modelos matemáticos a partir de datos experimentales, con el ánimo de desarrollar modelos semiempíricos que permitan calcular la solubilidad de un fármaco con un margen de error bajo.
En este contexto, Acree y Rytting desarrollan el modelo denominado "solvente binario casi ideal, NIBS", el cual ha tenido éxito en la modelización de la solubilidad de algunos fármacos [7]; mientras que en otros casos, en donde los rangos de la polaridad de las mezclas cosolventes es mayor, el modelo de Jouyban, Khoubnasabiafari y Acree [8] ha sido más apropiado. Otros modelos, como los basados en áreas de superficie [9], la contribución de grupos UNIFAC [10], los parámetros de solubilidad de Hildebrand [11], las integrales Kirkwood-Buff [12], etc., también han sido empleados. Es innegable la gran importancia de estos estudios para la industria farmacéutica o alimentaria, permitiendo optimizar procesos de investigación y desarrollo, ofreciendo herramientas que permiten reducir el número de ensayos experimentales y exponiendo una alternativa viable para el aprovechamiento eficiente de algunos residuos agroindustriales, mediante la extracción, cristalización y purificación de sustancias de interés comercial presentes en estos materiales generalmente desechados. Sin embargo, tales investigaciones no describen el entorno próximo de la molécula de soluto en la solución, lo que permitiría racionalizar los eventos moleculares en procesos de importancia industrial como los mencionados anteriormente, salvo en algunos intentos como los realizados por Acree [13], quien empleó el método integrales inversas de Kirkwood-Buff (IKBI) propuestas por el profesor Ben-Naim [14]. Sin embargo, no hay información sobre la composición del disolvente en el entorno inmediato de las moléculas de soluto y las interacciones que conducen a estas preferencias. Otro caso en el que se empleó un enfoque bastante similar fue el estudio de Shulgin y Ruckenstein [15], quienes utilizaron las integrales de Kirkwood-Buff para estimar el exceso de hidratación de solutos gaseosos en soluciones acuosas diluidas de cloruro de sodio, donde la sal se trata como un codisolvente.
El propósito de este trabajo es aplicar el enfoque del modelo IKBI [14] a la solvatación preferencial de la naringina en mezclas cosolventes etanol + agua. Los resultados se expresan en términos del parámetro de solvatación preferencial δx1,3 para el soluto 3 por los solventes de la mezcla 1 y 2:
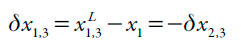 | [1] |
Dondex1 es la fracción molar del solvente 1 (solvente orgánico) en la mezcla cosolvente y x L 1,3 es la fracción molar local de 1 en la vecindad de la molécula del soluto 3. Si δx1,3 > 0, entonces 3 se solvata preferentemente por 1. Cuando |δx1,3| ≤ 0,01, los valores probablemente se encuentran dentro del error de la determinación, lo que significa que la solvatación preferencial es insignificante; de lo contrario, el grado de solvatación preferente se determina por la magnitud de δx1,3. De hecho, los valores δx1,3 ≈ x2 significan δx1,3 ≈ 1 o solvatación selectiva completa de 3 por 1; por tanto, δx1,3 no puede ser mayor que x2 [16].
La solvatación preferencial del soluto 3 en la mezcla cosolvente 1 + 2, no solo depende de las interacciones de 3 con 1 y con 2, sino también de las interacciones mutuas de los dos solventes, como se describe por la energía Gibbs de exceso G E 1+2, de la mezcla cosolvente libre se soluto. La competencia de interacciones de los tres componentes, se lleva a cabo en la solución.
A partir de los datos de solubilidad de 3 en los solventes puros y en las diferentes mezclas cosolventes, se calcula la energía Gibbs estándar de transferencia de 3 de 1 a 1 + 2.
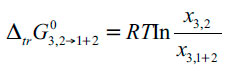 | [2] |
La ecuación (2) debe ser utilizada siempre que el soluto 3 sea escasamente soluble en todas las composiciones cosolventes, de tal forma que las interacciones soluto-soluto puedan ser descartadas asumiendo entonces que las moléculas de soluto están rodeadas únicamente por moléculas de solvente. De lo contrario, se deben tener en cuenta los coeficientes de actividad de 3 en cada composición cosolvente. Otra disposición para la aplicación de la ecuación (2), es que la identidad del sólido que está en equilibrio con las soluciones saturadas es independiente de la composición del disolvente; es decir, el soluto no forma solvatos o hidratos con los solventes puros alterando la composición cosolvente.
La aplicación del método IKBI está, por tanto, limitada a sistemas en los que la información de la energía Gibbs de exceso de las mezclas cosolventes entre disponible y las solubilidades sean lo suficientemente bajas.
En este contexto, las expresiones matemáticas para la aplicación del enfoque IKBI dada por Ben-Naim [14] han sido manipuladas algebraicamente, conduciendo a las siguientes expresiones [17, 18]:
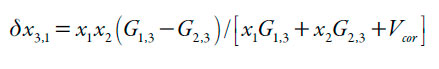 | [3] |
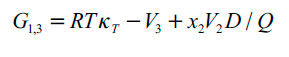 | [4] |
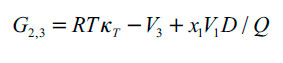 | [5] |
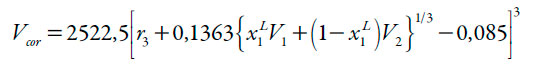 | [6] |
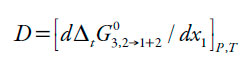 | [7] |
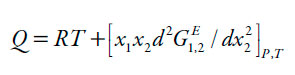 | [8] |
En donde G1,3 y G1,3 son las integrales Kirkwood-Buff (en cm3 mol-1), las cuales de calculan a partir de las ecuaciones (4) y (5) y Vcor es el volumen de correlación alrededor de 3 en el que la solvatación preferencial tiene lugar. En las ecuaciones (4) y (5), κT es la compresibilidad isotérmica de las mezclas (en GPa-1), V3 es el volumen molar parcial del soluto y V1 y V2 son los de los disolventes (en cm3 mol-1), mientras que D y Q (en kJ mol-1, al igual que RT) se calculan a partir de las ecuaciones (7) y (8).
Como κT depende de la composición cosolvente, puede ser calculada asumiendo comportamiento aditivo, donde la compresibilidad isotérmica de la mezcla cosolvente es calculada a partir de la compresibilidad isotérmica de los componentes puros, multiplicada por sus respectivas fracciones molares en la mezcla cosolvente:
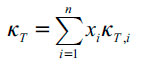 | [9] |
Los volúmenes molares parciales se calcularon por medio de las ecuaciones (10) y (11) [19], a partir de los valores de densidad de las mezclas de etanol + agua reportados por Jiménez, Manrique y Martínez [20], a todas las temperaturas de estudio, V es el volumen molar de las mezclas y se calcula como V = (x1M1 + x2M2)/ρ. Donde M1 y M2 son 46,06 y 18,02 g mol-1, respectivamente.
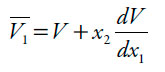 | [10] |
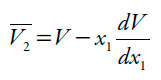 | [11] |
La ecuación (3) para el volumen de correlación requiere iteración porque depende de las fracciones molares locales dadas por las ecuaciones (1) y (3). Finalmente, el radio molecular de 3 se calculó a partir del volumen molecular, el cual, a su vez, se calculó a partir del volumen molar calculado mediante el método de contribución de grupos de Fedors [21] (véase tabla 1).
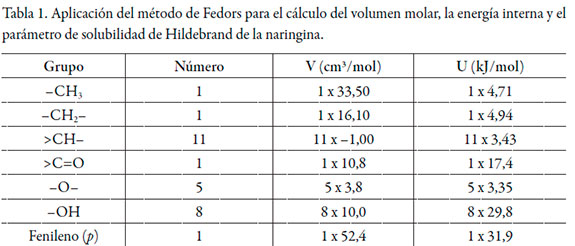
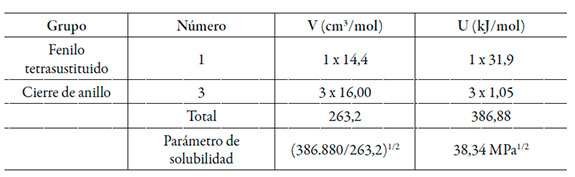
Resultados y discusión
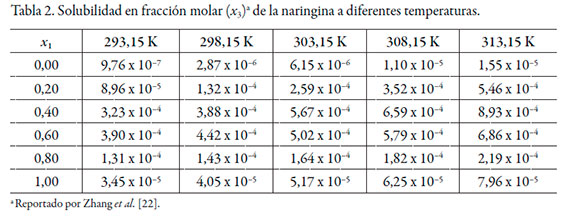
Los datos de solubilidad de la naringina se tomaron de Zhang et al. [22] (véase tabla 2), las energías Gibbs estándar de transferencia de la naringina desde el agua pura hasta las mezclas cosolventes etanol + agua se calcularon mediante la ecuación (2) y se correlacionaron mediante un polinomio regular de cuarto orden de acuerdo con la ecuación (12) (véase tabla 3).
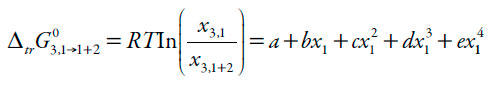 | [12] |
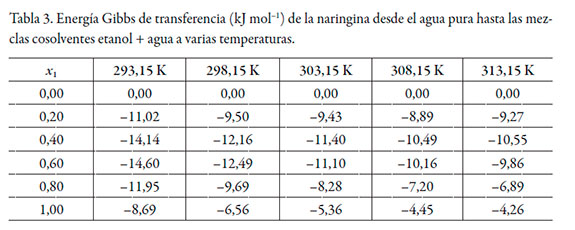
La figura 2 muestra la energía Gibbs de transferencia a diferentes temperaturas y los coeficientes de los polinomios se reportan en la tabla 4.
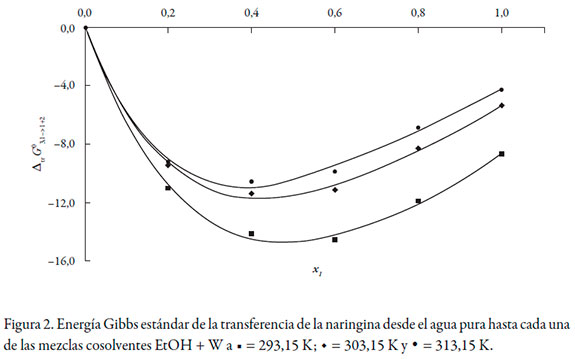
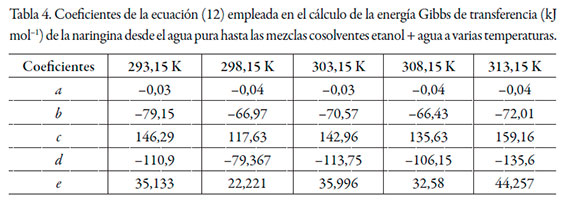
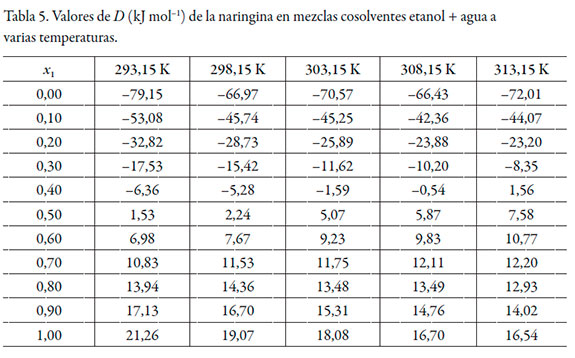
Los valores de D se calcularon a partir de la primera derivada de los modelos polinomiales (ecuación 13) en función de la fracción molar de cosolvente (véase tabla 5).
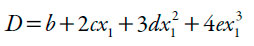 | [13] |
Para calcular los valores de Q, son necesarios los valores de las energías Gibbs molar de exceso G E 1,2 de las mezclas cosolventes etanol + agua a las diferentes temperaturas de estudio calculadas mediante la ecuación (14) propuesta por Marcus [18] para 298,15 K y la ecuación (15) para las otras temperaturas de estudio, en donde H E 1,2 es la entalpía molar de exceso de la mezcla cosolvente, T1 es 298,15 K y T2 es la temperatura diferente de 298,15 K a la que se desea calcular G E 1,2. Las entalpías molares de exceso se calculan a partir de la ecuación (16) también propuesta por Marcus [18].
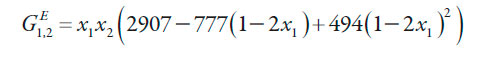 | [14] |
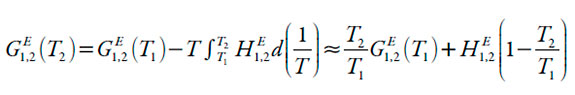 | [15] |
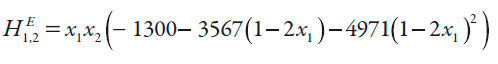 | [16] |
Sin embargo, los valores de Q, RTKT y el volumen molar parcial del etanol y el agua en cada mezcla cosolvente y de los solventes puros se tomaron de Delgado, Vargas y Martínez [23], y de Delgado, Peña y Martínez [24]. El radio molecular de la naringina calculado a partir del volumen molar usando la ecuación (17) es de 0,471 nm.
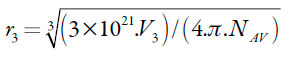 | [17] |
En donde NAv es el número de Avogadro [25].
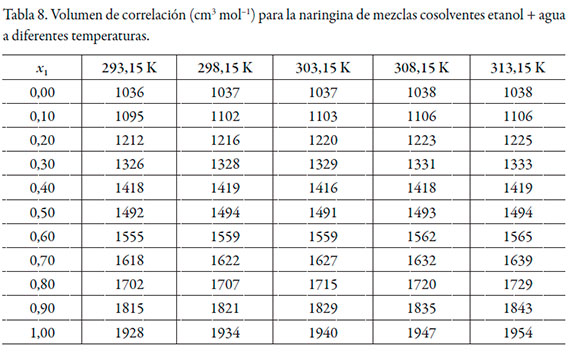
En las tablas 6 y 7 se muestran los valores de G 1,3 y G 2,3 y en la tabla 8 los valores del volumen de correlación de la naringina a diferentes temperaturas.
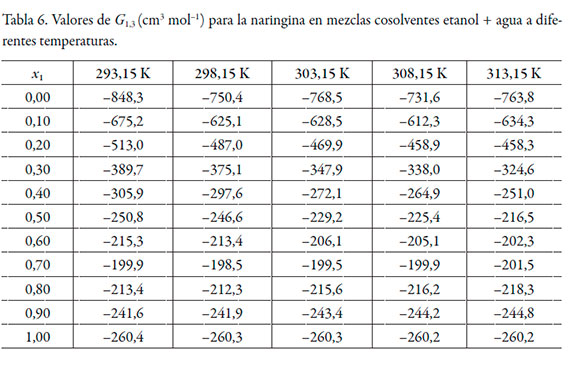
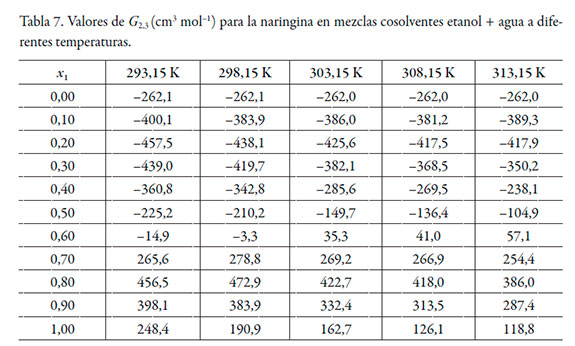
De acuerdo con los valores de G 1,3 y G 2,3, la naringina se hidrata preferentemente en mezclas ricas en agua (0,00 ≤ x1 ≤ 0,20) a todas las temperaturas de estudio, puesto que G 1,3 < G 2,3. Sin embargo, entre x1 = 0,20 y 0,40, G 1,3 > G 2,3, lo que indica que la naringina se solvata preferentemente por el etanol en este rango de composición. En mezclas intermedias y ricas en etanol (0,50 ≤ x1 ≤ 1,00), nuevamente se hidrata. Este análisis es corroborado por los datos de δx1,3 (véase tabla 9), que varían de manera no lineal en función de la composición cosolvente (véase figura 3). Al adicionar etanol δx1,3 adquiere valores negativos, indicando que la molécula de naringina tiende a hidratarse preferentemente en mezclas ricas en agua de manera similar a otras moléculas en este sistema cosolvente [26, 27]. Usualmente, en la mayoría de los fármacos esta hidratación es consecuencia de la hidratación hidrofóbica; sin embargo, aunque la naringina presenta algunos grupos poco polares, el gran número de grupos -OH produciría una mayor interacción con agua actuando como un ácido de Lewis, estableciendo puentes de hidrógeno con los grupos funcionales de los solventes (-OH). Además, este flavonoide podría actuar como una base de Lewis debido a los pares de electrones libres en los átomos de oxígeno de los grupos hidróxido, éter y oxo para interactuar con los hidrógenos de ambos disolventes.
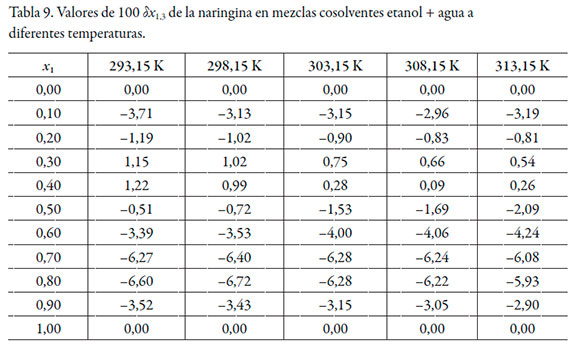
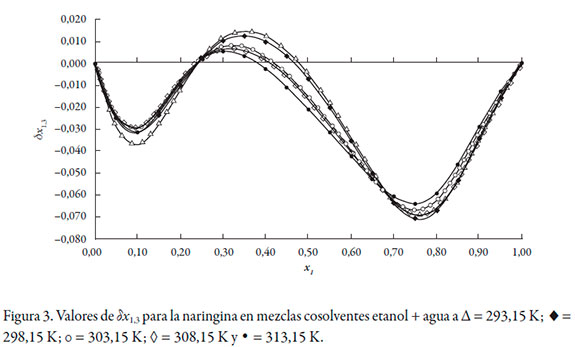
En las mezclas con composición 0,20 ≤ x1 ≤ 0,40, δx1,3 toma valores positivos indicando que la naringina se solvata preferentemente por el etanol; esta solvatación por parte del etanol contribuye al aumento de la solubilidad de la naringina por al menos tres mecanismos: 1) promueve la desestructuración del agua alrededor de los grupos no polares aumentando el agua libre y, por ende, las interacciones agua-naringina, 2) el aumento en la concentración de etanol en la mezcla cosolvente favorecería las interacciones no polares entre el etanol y el flavonoide y 3) al aumentar la concentración de etanol, la polaridad de la mezcla disminuye hasta igualar la de la naringina (38,34 MPa1/2).
En mezclas intermedias y ricas en etanol, 0,50 ≤ x1 ≤ 1,00, δx1,3 vuelve a tener valores negativos indicando una hidratación preferencial. Delgado y Martínez [28] proponen que esta hidratación de las moléculas en mezclas ricas en cosolvente, se debe a que la fracción molar local de cosolvente en la esfera de solvatación depende de la polaridad del soluto, el cual promueve un entorno con una polaridad similar, razón por la cual la molécula de naringina tendería a hidratarse para aumentar la polaridad de la esfera de solvatación en mezclas cuya polaridad es menor de 38,34 MPa1/2. Sin embargo, siendo más rigurosos en el análisis de los resultados de δx1,3, es importante resaltar que en mezclas 0,20 ≤ x1 ≤ 0,40 a todas las temperaturas y 0,20 ≤ x1 ≤ 0,50 a 293,15 K y 298,15 K los valores de δx1,3 son muy próximos a 0,01 o menores a este valor, por lo que no es posible definir si la naringina se solvata o no por el etanol.
En las mezclas con composición 0,20 ≤ x1 ≤ 0,40, δx1,3 toma valores positivos indicando que la naringina se solvata preferentemente por el etanol; esta solvatación por parte del etanol contribuye al aumento de la solubilidad de la naringina por al menos tres mecanismos: 1) promueve la desestructuración del agua alrededor de los grupos no polares aumentando el agua libre y, por ende, las interacciones agua-naringina, 2) el aumento en la concentración de etanol en la mezcla cosolvente favorecería las interacciones no polares entre el etanol y el flavonoide y 3) al aumentar la concentración de etanol, la polaridad de la mezcla disminuye hasta igualar la de la naringina (38,34 MPa1/2).
En mezclas intermedias y ricas en etanol, 0,50 ≤ x1 ≤ 1,00, δx1,3 vuelve a tener valores negativos indicando una hidratación preferencial. Delgado y Martínez [28] proponen que esta hidratación de las moléculas en mezclas ricas en cosolvente, se debe a que la fracción molar local de cosolvente en la esfera de solvatación depende de la polaridad del soluto, el cual promueve un entorno con una polaridad similar, razón por la cual la molécula de naringina tendería a hidratarse para aumentar la polaridad de la esfera de solvatación en mezclas cuya polaridad es menor de 38,34 MPa1/2. Sin embargo, siendo más rigurosos en el análisis de los resultados de δx1,3, es importante resaltar que en mezclas 0,20 ≤ x1 ≤ 0,40 a todas las temperaturas y 0,20 ≤ x1 ≤ 0,50 a 293,15 K y 298,15 K los valores de δx1,3 son muy próximos a 0,01 o menores a este valor, por lo que no es posible definir si la naringina se solvata o no por el etanol.
Finalmente, de acuerdo con los resultados de solvatación preferencial, es razonable suponer, que en mezclas de composición intermedia, la naringina actúa como ácido de Lewis con las moléculas de etanol, ya que este solvente es más básico que el agua, puesto que los parámetros de aceptor de enlace de hidrógeno de Kamlet-Taft son β = 0,75 para el etanol y 0,47 para el agua [29]. Por otro lado, en mezclas ricas en agua y etanol, en donde la naringina se hidrata preferentemente, está actuando principalmente como una base de Lewis frente al agua debido a que los parámetros de donantes de enlaces de hidrógeno de Kamlet-Taft son α = 1,17 para el agua y 0,86 para el etanol, respectivamente [30]. Así, el agua es más ácida que el etanol.
Conclusiones
De acuerdo con los valores del parámetro de solvatación preferencial, la naringina se hidrata preferentemente en mezclas ricas en agua y en mezclas ricas en etanol. Debido a que en las mezclas en donde δx1,3 es positivo, los valores del parámetro de solvatación preferencial son muy próximos a 0,01 o menores a este valor, no es posible definir si la naringina es solvatada o no por el etanol en estas mezclas cosolventes.
Referencias
1. M. Cavia-Saiz, M.D. Busto, M.C. Pilar-Izquierdo, N. Ortega, M. Pérez-Mateos, P. Muniz, Antioxidant properties, radical scavenging activity and biomolecule protection capacity of flavonoid naringenin and its glycoside naringin: A comparative study, J. Sci. Food Agric., 90, 1238-1244 (2010). [ Links ]
2. G.C. Jagetia, T.K. Reddy, The grapefruit flavanone naringin protects against the radiation-induced genomic instability in the mice bone marrow: A micronucleus study, Mutat. Res., 519, 37-48 (2002). [ Links ]
3. D.H. Kim, E.A. Jung, I.S. Sohng, J.A. Han, T.H. Kim, M.J. Han, Intestinal bacterial metabolism of flavonoids and its relation to some biological activities, Arch. Pharm. Res., 21, 17-23 (1998). [ Links ]
4. P.C. Ho, D.J. Saville, P.F. Coville, S. Wanwimolruk, Content of CYP3A4 inhibitors, naringin, naringenin and bergapten in grapefruit and grapefruit juice products, Pharm. Acta Helv., 74, 379-385 (2000). [ Links ]
5. S.M. Jeon, Y.B. Park, M.S. Choi, Antihypercholesterolaemic property of naringin alters plasma and tissue lipids, cholesterol-regulating enzymes, fecal sterol and tissue morphology in rabbits, Clin. Nutr., 23, 1025-1034 (2004). [ Links ]
6. I. Erlund, Review of the flavonoids quercetin, hesperetin, and naringenin. Dietary sources, bioactivities, bioavailability, and epidemiology, Nutr. Res., 24, 851- 874 (2004). [ Links ]
7. W.E. Acree Jr., J.H. Rytting, Solubility in binary solvent systems I: Specific versus nonspecific interactions, J. Pharm Sci., 71, 201-205 (1982). [ Links ]
8. A. Jouyban, M. Khoubnasabiafari, W.E. Acree Jr., Predicting solubility of anthracene in non-aqueous solvent mixtures using a combination of Jouyban-Acree and Abraham models, Chem. Pharm. Bull., 54, 1124-1130 (2006). [ Links ]
9. W.E. Acree Jr., J.H. Rytting, Solubility in binary solvent systems. III: Predictive expressions based on molecular surface áreas, J. Pharm. Sci., 72, 292-296 (1983). [ Links ]
10. W.E. Acree Jr., J.H. Rytting, Solubility in binary solvent systems. IV: Prediction of naphthalene solubilities using the UNIFAC group contribution model, Int. J. Pharm., 13, 197-204 (1983). [ Links ]
11. A. Martin, J. Newburger, A. Adjei, Extended Hildebrand solubility approach: Solubility of theophylline in polar binary solvents, J. Pharm. Sci., 69, 487-491 (1980). [ Links ]
12. E. Ruckenstein, I.L. Shulgin, Solubility of drugs in aqueous solutions: Part 1. Ideal mixed solvent approximation, Int. J. Pharm., 260, 193-201 (2003). [ Links ]
13. W.E. Acree Jr., Thermochemical investigations of preferential solvation in nonelectrolyte solutions. Estimation of preferential solvation from measured solute solubilities in binary solvent mixtures, Phys. Chem. Liq., 22, 107-119 (1990). [ Links ]
14. A. Ben-Naim, Preferential solvation in two- and in three-component systems, Cell Biophys., 12, 255-269 (1988). [ Links ]
15. I.L. Shulgin, E. Ruckenstein, Solubility and local structure around a dilute solute molecule in an aqueous solvent: From gases to biomolecules, Fluid Phase Equilib., 260, 126-134 (2007). [ Links ]
16. Y. Marcus, On the preferential solvation of drugs and PAHs in binary solvent mixtures, J. Mol. Liq., 140, 61-67 (2008). [ Links ]
17. K.E. Newman, Kirkwood-Buff solution theory: Derivation and applications, Chem. Soc. Rev., 23, 31-40 (1994). [ Links ]
18. Y. Marcus, "Solvent mixtures: Properties and selective solvation", Marcel Dekker, Inc., New York, 2002. [ Links ]
19. D.R. Delgado, F. Martínez, M.A.A. Fakhree, A. Jouyban, Volumetric properties of the glycerol formal + water cosolvent system and correlation with the Jouyban- Acree model, Phys. Chem. Liq., 50, 284-301 (2012). [ Links ]
20. J. Jiménez, J. Manrique, F. Martínez, Effect of temperature on some volumetric properties for ethanol + water mixtures, Rev. Colomb. Cienc. Quím. Farm., 33, 145-155 (2004). [ Links ]
21. R.F. Fedors, A method for estimating both the solubility parameters and molar volumes of liquids, Polym. Eng. Sci., 14, 147-154 (1974). [ Links ]
22. J. Zhang, P. Zhang, T. Liu, L. Zhou, L. Zhang, R. Lin, G. Yang, W. Wang, Y. Li, Solubility of naringin in ethanol and water mixtures from 283.15 to 318.15 K, J. Mol. Liq., 203, 98-103 (2015). [ Links ]
23. D.R. Delgado, E.F. Vargas, F. Martínez, Preferential solvation of xylitol in ethanol + water solvent mixtures according to the IKBI and QLQC methods, Rev. Colomb. Quím., 42, 59-66 (2013). [ Links ]
24. D.R. Delgado, M.A. Peña, F. Martínez, Preferential solvation of acetaminophen in ethanol + water solvent mixtures according to the inverse Kirkwood-Buff integrals method, Rev. Colomb. Cienc. Quím. Farm., 42, 298-314 (2013). [ Links ]
25. Z.J. Cárdenas, D.M. Jiménez, F. Martínez, Preferential solvation of ketoprofen in some co-solvent binary mixtures, J. Solution Chem., 43, 1904-1915 (2014). [ Links ]
26. D.M. Jiménez, Z.J. Cárdenas, D.R. Delgado, M.Á. Peña, F. Martínez, Preferential solvation of the antioxidant agent daidzein in some aqueous co-solvent mixtures according to IKBI and QLQC methods, J. Appl. Sol. Chem. Mod., 4, 110-118 (2015). [ Links ]
27. R.G. Sotomayor, D.R. Delgado, F. Martínez, Preferential solvation of naproxen and piroxicam in ethanol + water mixtures, Bulg. Chem. Commun. 47, 571-577 (2015). [ Links ]
28. D.R. Delgado, F. Martínez. Preferential solvation of sulfadiazine, sulfamerazine and sulfamethazine in ethanol + water solvent mixtures according to the IKBI method, J. Mol. Liq., 193, 152-159 (2014). [ Links ]
29. M.J. Kamlet, R.W. Taft, The solvatochromic comparison method. I. The beta. scale of solvent hydrogen-bond acceptor (HBA) basicities, J. Am. Chem. Soc., 98, 377-383 (1976). [ Links ]
30. R.W. Taft, M.J. Kamlet, The solvatochromic comparison method. 2. The .alpha.- scale of solvent hydrogen-bond donor (HBD) acidities. J. Am. Chem. Soc., 98, 2886-2894 (1976). [ Links ]













