Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.2 Bogotá May/Aug. 2015
https://doi.org/10.15446/rcciquifa.v44n2.56296
Estabilidad de gotas nasales de efedrina
Stability of ephedrine nasal drops
Niurka Benítez a
Juan Manuel Cordoví b
Reynerio Zamora c
Pavel Cabrera d
Nilia de la Paz e
a - d Laboratorio Farmacéutico Líquidos Orales Bayamo (Medilip), Cuba. Correos electrónicos: niurka@medilip.biocubafarma.cu, jm_analist@medilip.biocubafarma.cu, rey@medilip.biocubafarma.cu, pavel@medilip.biocubafarma.cu.
e Centro de Investigación y Desarrollo de Medicamentos (Cidem). Correo electrónico: nilia.delapaz@cidem.sld.cu.
f Departamento de Tecnología y Control de los Medicamentos, Instituto de Farmacia y Alimentos (IFAL), Universidad de La Habana, calle 23 No. 21425 e/ 214 y 222, La Habana, Cuba. Teléfonos: 271-4075, 271-9534. * Autor correspondiente, correo electrónico: mirnafc@ifal.uh.cu.
Recibido para evaluación: 2 de febrero de 2015.
Aceptado para publicación: 31 de julio de 2015.
Resumen
En el presente trabajo se realizó el estudio de estabilidad de las gotas nasales de efedrina. Primero se evaluó la influencia de los agentes preservantes demostrándose la incompatibilidad del clorhidrato de efedrina y el clorobutanol, por lo que fue seleccionada la combinación de cloruro de benzalconio y edetato disódico con excelentes resultados en la efectividad de preservos. Se elaboraron tres lotes pilotos de la formulación y se les realizó los estudios de estabilidad por el método acelerado y de vida de estante, respectivamente. Durante los seis meses (estabilidad acelerada) y hasta los 24 meses (vida útil) las características organolépticas cumplieron con las especificaciones establecidas. El pH del medio se comportó de manera estable cumpliendo con los límites establecidos. El principio activo no alcanzó una degradación mayor al 5%, mostrando buena estabilidad. La concentración de los preservos cumplió con los parámetros, así como el conteo microbiano del producto terminado. La formulación envasada en frascos de vidrio ámbar de calidad hidrolítica III, de capacidad nominal 15 mL con tapa de polipropileno de 18 mm y gotero interior de polietileno de alta densidad, mostró adecuada estabilidad física, química y microbiológica durante 24 meses.
Palabras clave: clorhidrato de efedrina, gotas nasales, estabilidad, preservos antimicrobianos.
Summary
The subject of this paper is a stability study of ephedrine nasal drops. We started by assessing the influence of preservative agents in the stability of the formulation. Ephedrine hydrochloride was proven to be incompatible with chlorobutanol. This led the researchers to choose a combination of benzalkonium chloride and edetate disodium, which yielded excellent results in terms of effectiveness. Three pilot batches of the formulation were prepared, and stability studies were carried out under the accelerated and shelf-life methods. For the six-month period of the accelerated stability study and the 24-month period of the shelf-life study, organoleptic characteristics were within established acceptable limits. The pH of the medium also remained stable, within acceptable limits. The degradation of the active ingredient was not greater than 5%, which indicates good stability. The concentration of preservative agents and microbial count in the finished product were also within established parameters. The formulation was packaged in amber glass bottles of hydrolytic quality III and 15 mL nominal capacity, with an 18 mm polypropylene cap and an HDPE internal dropper, and it showed adequate physical, chemical and microbiological stability during the 24 months of the shelf life stability study.
Key words: Ephedrine hydrochloride, nasal drops, stability, preservative agents
Introducción
Es responsabilidad del fabricante, como parte del desarrollo de un producto farmacéutico, diseñar y realizar estudios de estabilidad adecuados, que permitan obtener una información segura y que demuestren cómo varía su calidad con una formulación y un envase determinado, durante el tiempo y bajo la influencia de las condiciones de almacenamiento a que es sometido, y como resultado del cual se apruebe un período de validez en el que pueda emplearse con absoluta seguridad.
La estabilidad se define como el período de tiempo durante el cual es posible mantener las propiedades físico-químicas, microbiológicas, terapéuticas y toxicológicas de un producto farmacéutico, cumpliendo con las especificaciones presentadas en la monografía con respecto a identidad, pureza, calidad y potencia [1, 2].
El estudio de estabilidad tiene como objetivo determinar en qué lapso y bajo qué condiciones el producto es satisfactorio, así como predecir la estabilidad a largo plazo con el fin, esencialmente, de fijar una fecha de caducidad. Las condiciones del estudio y su duración deben ser suficientes para cubrir el almacenamiento, distribución y uso del fármaco [2-4]. Estos estudios contemplarán todos los índices susceptibles de cambiar durante el almacenamiento y que influyan sobre la calidad, seguridad o eficacia del medicamento, ya sea mediante ensayos organolépticos, físicos, químicos o microbiológicos. Los métodos de ensayo deben estar totalmente validados [5], y se incluirá información referente al contenido o efectividad de los preservos durante el período de validez [2-4].
El clorhidrato de efedrina, cuyo nombre químico es hidrocloruro de (1R, 2S)-1-fenil-2- metilaminopropan-1-ol, es un broncodilatador adrenérgico, vasopresor, estimulante de los receptores beta-2 adrenérgicos en los pulmones para relajar el músculo liso bronquial, que alivia el broncoespasmo, aumenta la capacidad respiratoria, disminuye el volumen residual y reduce la resistencia de las vías aéreas [6]. Es empleado en la preparación de jarabes para el tratamiento del asma y resfriados por sus propiedades broncodilatadoras. También se incluye en gotas nasales o sprays descongestivos, ya que induce vasoconstricción sobre la mucosa nasal y disminuye la producción de moco. En su forma parenteral está indicado para contrarrestar los efectos hipotensores de la anestesia raquídea o de otros tipos de anestesia por conducción no tópica y la hipotensión aguda [6, 7].
En estudios previos se desarrollaron y validaron métodos analíticos para el análisis de las gotas nasales de efedrina. Los resultados de la validación mostraron que el método cromatográfico en fase reversa con detección UV-visible, para la determinación del clorhidrato de efedrina, así como los métodos volumétricos de valoración complejométrica, para la cuantificación del cloruro de benzalconio y edetato disódico, preservos antimicrobianos, fueron específicos, lineales, precisos y exactos; resultando confiables para su empleo en el control de calidad y estudio de estabilidad del producto terminado [8].
El presente estudio tiene como objetivo evaluar la estabilidad de una formulación de gotas nasales de efedrina, a través de los estudios de estabilidad acelerada y de vida de estante.
Metodología
Productos químicos y reactivos
Clorhidrato de efedrina (Embio Limited, India), clorobutanol (Panreac, España), cloruro de benzalconio (Kirsch Ph, España) y edetato disódico 2 H2O (Panreac, España). El patrón de clorhidrato de efedrina lo suministró la Farmacopea Europea. El resto de los reactivos y soluciones fueron de calidad analítica (Merck, Alemania).
Formulación de gotas nasales de clorhidrato de efedrina
Las gotas nasales estaban compuestas por clorhidrato de efedrina 10 mg/mL, tampón fosfato para regular el pH del medicamento y agua purificada como vehículo. Se evaluaron como preservos el clorobutanol y el cloruro de benzalconio combinado con edetato disódico. Las concentraciones empleadas para cada uno de los excipientes se encontraban en los rangos usuales para esta forma farmacéutica [9].
Una vez seleccionado el preservo adecuado, se elaboraron tres lotes pilotos de la formulación, de 20 L cada uno, identificados como 2002, 2003 y 2004, los que fueron envasados en frascos de vidrio ámbar de 15 mL con tapas de polipropileno de diámetro 18 mm y gotero interior de polietileno de alta densidad.
Evaluación de la formulación
Características organolépticas: se transfirieron 25 mL de la muestra a un vaso para precipitados de 50 mL y se evaluaron el aspecto, el color y el olor. Se aceptaron líquidos transparentes, incoloros o ligeramente amarillos con ligero olor a cloruro de benzalconio.
pH: se transfirieron 30 mL de la muestra a un vaso de precipitado de 50 mL. Para la medición se utilizó un pH - metro Basic 20+ (Crison, España). La determinación se realizó por triplicado aceptando valores entre 4,0 y 7,0 [10].
Con el propósito de evaluar la influencia del agente preservante en la formulación, se realizó un estudio comparativo entre la preservada con clorobutanol y la que tenía la combinación de cloruro de benzalconio y edetato disódico. Para ello, ambas formulaciones se sometieron a incrementos de temperatura de 5 ° desde 35 ° a 90 °, durante 1 h. Los valores de pH de las soluciones fueron determinados y se analizaron estadísticamente utilizando el programa profesional Statgraphics Plus 5.1 (Statistical Graphics Corp., EUA).
Efectividad antimicrobiana
El estudio de efectividad antimicrobiana se realizó con la formulación seleccionada. El método aplicado fue el descrito en la USP 30 [11] donde las gotas nasales de clorhidrato de efedrina están clasificadas en la categoría 2, en función de la ruta de administración. Para el ensayo se emplearon las cepas de C. Albicans (ATCC 10231), P. aeruginosa (ATCC 27853), S. aereus (ATCC 65387) y Escherichia coli (ATCC 25922).
Las concentraciones finales de los inóculos se ajustaron con solución salina hasta 107 UFC/mL. Las suspensiones se cultivaron en Agar Triptona Soya por plaqueo directo, 24 h previas al ensayo verificando la viabilidad de los inóculos. Igual método se aplicó para determinar la carga microbiana al inicio, 14 y 28 días después de inoculados los productos. Las formulaciones se inocularon con un volumen que garantizó una concentración entre 105 y 106 UFC/mL de cada uno de los microorganismos.
Conteo microbiano diferencial
El conteo de hongos se realizó por el método de placa vertida y el conteo de bacterias se hizo por el método de tubos múltiples [11].
Métodos de análisis empleados
La concentración del ingrediente farmacéutico activo (IFA) se determinó mediante un método cromatográfico en fase reversa con detección UV-visible, previamente validado [8], cuyas condiciones fueron: columna Nucleosil RP-18 100 Å (5 µm) 150 mm - 4,6 mm (Teknokroma, España), volúmenes de 5/95 de acetronilo y solución de ácido fosfórico al 2% como fase móvil, y velocidad de flujo de 1,0 mL/min. La longitud de onda empleada fue de 257 nm inyectándose 20 µL. El procedimiento se realizó en un cromatógrafo líquido de alta resolución (Konik-Tech, España). El contenido del clorhidrato de efedrina debe encontrarse entre 9 y 11 mg/mL (90,0% - 110,0%) [10].
En el método volumétrico para la cuantificación del cloruro de benzalconio se usó el tetrafenilborato de sodio como valorante y el azul de bromofenol como indicador. En el método para el edetato disódico se empleó el sulfato de cinc como valorante y la ditizona como indicador. Ambos métodos se validaron previamente [8]. Se consideró adecuada la formulación si el contenido del cloruro de benzalconio se encontraba entre 0,09 y 0,11 mg/mL y entre 0,9 y 1,1 mg/mL de edetato disódico, de acuerdo con los criterios establecidos por el fabricante.
Estudio de estabilidad
El estudio acelerado se realizó durante seis meses, con la evaluación de las muestras a tiempo inicial, 1, 3 y 6 meses. Los lotes se almacenaron a una temperatura de 40 +/- 2 °C y humedad relativa de 75 +/* 5%, según lo establecido por la Regulación 23 del Cecmed [2].
El estudio de estabilidad en vida de estante se realizó durante 24 meses, evaluando las muestras a los 6, 12, 18 y 24 meses. Los lotes se almacenaron a una temperatura de 30 +/- 2 °C y humedad relativa de 70 +/- 5% [2].
Durante el período del estudio se evaluaron las características organolépticas, pH, cuantificación del principio activo y los preservos, efectividad de preservos y el conteo microbiano diferencial. Para realizar el estudio, de acuerdo con la frecuencia de análisis establecida, se emplearon seis frascos por cada lote.
Resultados y discusión
Como se conoce, uno de los aspectos a considerar en el diseño de las gotas nasales es el pH. Estas deben ser formuladas de manera que su instilación no lesione la integridad del epitelio nasal, y permitan que las funciones secretora y ciliar se realicen con normalidad. Lograr el mantenimiento del pH de la formulación implica el uso de los agentes reguladores de pH, y de los agentes preservantes para protegerlas del crecimiento de microorganismos al ser formas de dosificación no estériles.
La efedrina difiere de la mayor parte de los alcaloides por su solubilidad en agua, produciendo una solución que tiene fuerte reacción alcalina. Debido a esta alcalinidad, es incompatible con el clorobutanol y causa su descomposición con liberación de ácido clorhídrico [12]. El clorobutanol tiene actividad bacteriostática, la cual es reducida considerablemente a valores de pH mayores de 5,5. Su mayor estabilidad se logra a pH = 3; sin embargo, esta se ve afectada con el incremento del pH [9].
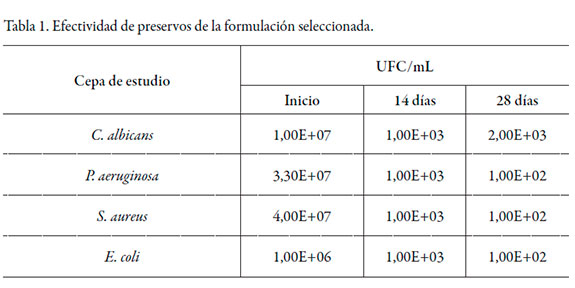
La figura 1 muestra los resultados obtenidos en el estudio comparativo pH vs. temperatura, según el agente preservante empleado en la formulación, mientras que en la tabla 1 aparecen los resultados del conteo de microorganismos como parte del estudio de efectividad de preservos de la formulación seleccionada.
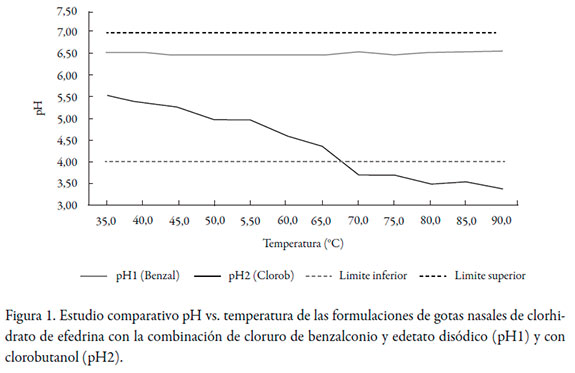
Bajo la influencia del incremento de la temperatura se demostró, en un corto período de tiempo, que efectivamente, como resultado de la incompatibilidad entre la efedrina y el clorobutanol, se produjo la disminución del pH y, por ende, la inefectividad del preservante. En contraste, con la combinación de cloruro de benzalconio y edetato disódico, se observó que el pH se mantuvo en el rango establecido para la formulación, acorde con el pH fisiológico de la mucosa nasal, demostrándose la efectividad del tampón empleado.
Por tanto, se corroboró la influencia del clorobutanol en la inestabilidad del pH de la formulación, a diferencia del comportamiento observado para la formulación preservada con cloruro de benzalconio y edetato disódico, favoreciendo la estabilidad del pH. De manera que la disminución del pH de las gotas nasales se produjo debido a la incompatibilidad ocurrida entre la efedrina y el clorobutanol.
Para analizar la normalidad de los datos de pH para ambas formulaciones, se aplicó el test de Shapiro-Wilks, cuyos valores de probabilidades resultaron mayores que 0,05, por lo que los datos cumplieron con una distribución normal para un intervalo de confianza del 95%. En el caso de la formulación con clorobutanol el p-valor fue de 0,12 y para la formulación con la combinación de preservos fue de 0,75. Al confirmar que los datos cumplían con una distribución normal, se realizó la prueba de homocedasticidad u homogeneidad de varianzas mediante el test de Fisher, teniendo como resultado que F = 2036,32 y p-valor = 0,00. Teniendo en cuenta que el p-valor fue menor que 0,05, hubo diferencias significativas entre las varianzas de ambas muestras para un nivel de confianza del 95%; por tanto, se demostró que no hay homogeneidad de varianzas. Estos resultados confirmaron que los valores de pH obtenidos cuando se empleó el clorobutanol como preservo fueron estadísticamente diferentes a los estimados al usar la combinación del cloruro de benzalconio y edetato disódico, con los cuales el pH del medicamento estuvo en el rango establecido (4,0 - 7,0) y acorde con el pH fisiológico de la mucosa nasal (6,4 - 6,8). Por tanto, se demostró que el uso del clorobutanol no brinda una adecuada conservación del producto, siendo la combinación del cloruro de benzalconio y el edetato disódico la más adecuada. Se seleccionó la formulación con estos agentes preservantes para los estudios de efectividad de preservos y escalada con vistas a realizar los estudios de estabilidad.
Los productos pertenecientes a la categoría 2 [11], deben mostrar una reducción de la carga microbiana inicial no menor de dos ciclos logarítmicos, a los 14 días de inoculado. Además, se espera que no ocurra un incremento en el conteo de viables desde los 14 días hasta el día 28, después de la inoculación del producto. Para el caso de los hongos y levaduras, se espera que no ocurra un incremento en el conteo de viables desde el inicio, ni a los 14 ni a los 28 días a partir de la inoculación del producto.
La formulación seleccionada mostró una reducción de la carga microbiana mayor que la esperada a los 14 días de ensayo y ningún incremento a los 28 días, excepto para la C. albicans. No obstante, se observa que este no es significativo, considerando la reducción alcanzada respecto a la carga inicial inoculada, así como para el resto de las especies ensayadas, por lo que se cumplió la prueba de efectividad de preservos.
El edetato disódico actúa sobre la pared celular provocando la remoción de iones Mg++ y la liberación de polisacáridos. La pared celular de la E. coli (bacteria Gram negativa) presenta una capa de lipopolisacáridos por encima de la capa del peptidoglicano, que protege a la bacteria de la acción del preservativo antimicrobiano. El edetato disódico actúa sobre la pared celular abriendo una brecha que favorece la entrada del cloruro de benzalconio para que este actúe sobre la membrana celular provocando la muerte del microorganismo [13, 14]. La concentración del edetato disódico empleada permitió que ocurriera el fenómeno descrito favoreciendo la destrucción de la pared celular de la E. coli. y la C. albicans, por lo que el cloruro de benzalconio actuó sinérgicamente en su sitio de acción para provocar la destrucción de los microorganismos.
Los excelentes resultados obtenidos en el escalado piloto de la formulación seleccionada, recién elaborada, demostraron la consistencia del proceso tecnológico desarrollado.
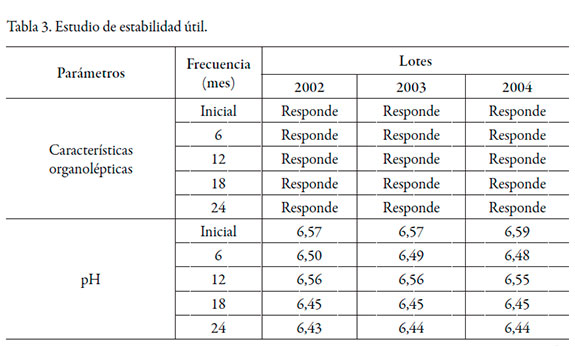
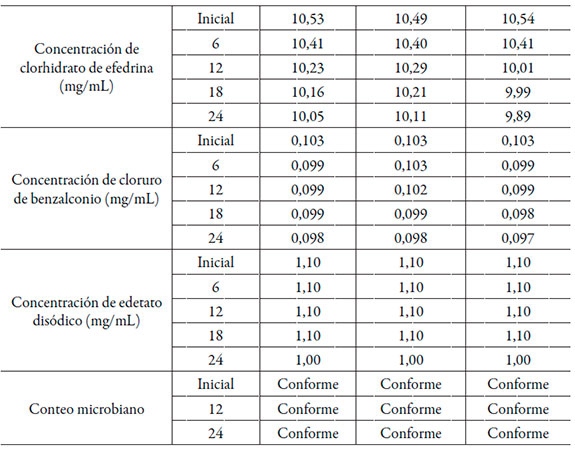
Los resultados del estudio de estabilidad acelerada correspondientes a los lotes pilotos se resumen en la tabla 2, mientras que los de vida útil en la tabla 3.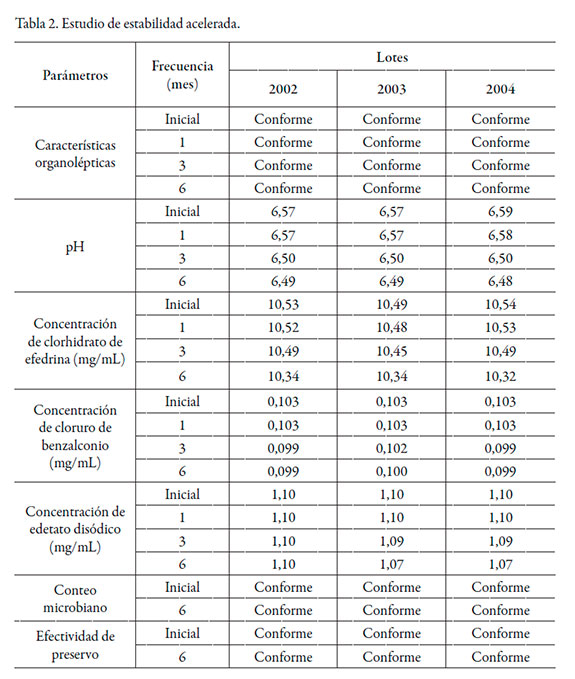
Durante los seis meses de estudio acelerado, los tres lotes se mantuvieron como líquidos transparentes, incoloros o ligeramente amarillos, con ligero olor a cloruro de benzalconio. El pH del medio se comportó de manera estable y el principio activo no marcó una degradación mayor al 5%, con valores de 1,9%, 1,5% y 2,2%, respectivamente, por lo se consideró un cambio no significativo derivado de las condiciones de almacenamiento estudiadas [2]. De forma similar se comportó la concentración de los preservativos antimicrobianos. El conteo microbiano y la efectividad de preservos demostraron la efectividad de los mismos en la protección antimicrobiana de la formulación.
En 24 meses de estudio, las características organolépticas se mantuvieron dentro de los límites de aceptación establecidos. El pH del medio se comportó de manera estable cumpliendo con los límites establecidos. El principio activo no alcanzó una degradación mayor al 5% en ninguno de los tres casos, mostrando buena estabilidad [2].
La concentración de los preservos se mantuvo en los límites establecidos. Los análisis correspondientes al conteo microbiano ofrecieron resultados acordes con lo requerido para su aceptación, así como su cuantificación. Al mismo tiempo, se demostró la utilidad del sistema envase-cierre seleccionado para las gotas nasales. Desde el punto de vista de la calidad química, como la disminución del contenido del ingrediente farmacéutico activo y los agentes preservantes en el tiempo fue inferior al 5% [2], y se encuentran en el límite establecido, se considera que la formulación de gotas nasales de efedrina es estable en las condiciones de envase y almacenamiento estudiadas.
Conclusiones
A partir de los resultados obtenidos en el estudio de estabilidad, se concluyó que la formulación de gotas nasales de efedrina, empleando la combinación de cloruro de benzalconio y edetato disódico como preservantes microbianos, mantuvo estables sus características físicas, químicas y microbiológicas durante los 24 meses en el material de envase propuesto: frascos de vidrio ámbar de 15 mL con tapa de polipropileno y gotero interior de polietileno de alta densidad.
Referencias
1. T. S. Lin, Ch.W. Chen, Overview of stability study design, Journal of Biopharmaceutical Statistics, 13(3), 337 (2003). [ Links ]
2. Regulación No. 23-2000, "Requerimientos de los estudios de estabilidad para el registro de productos farmacéuticos nuevos y conocidos", Centro Estatal para el Control de Medicamentos (Cecmed), Cuba, 2000. [ Links ]
3. World Health Organization, "Guidelines for stability testing of pharmaceutical products containing well establish drug substance in conventional dosage forms", Expert Committee on Specifications for Pharmaceutical Preparations, Thirty first Report, WHO Technical Report, Geneva, 1996. [ Links ]
4. USP35-NF30, United States Pharmacopeia (USP 35), The United States Pharmacopeial Convention, Inc., Washington, D. C., 2012, pp. 176, 253. [ Links ]
5. Regulación No. 41, "Validación de métodos analíticos", Centro Estatal para el Control de Medicamentos (Cecmed), Cuba, 2007. [ Links ]
6. British National Formulary (47 Ed.), Joint Formulary Committee, British Medical Association and Royal Pharmaceutical Society of Great Britain, London, 2004. [ Links ]
7. Formulario Nacional de Medicamentos 2011. Departamento de Farmacoepidemiología. Minsap. La Habana, Cuba. URL: http://bvscuba.sld.cu/librosde-autores-cubanos/listado-de-titulos-en-orden-alfabetico/. Consultado en diciembre de 2014. [ Links ]
8. N. Benítez, J.M. Cordoví, M. Fernández, R. Zamora, N. de la Paz, P. Cabrera, Validación de métodos analíticos aplicables al control de calidad y estudio de estabilidad de las gotas nasales de efedrina, Ars Pharmaceutica, 55(3), 11 (2014). [ Links ]
9. R.C. Rowe, P.J. Sheskey, M.E. Quinn, "Handbook of pharmaceutical excipients", 6th edition, Pharmaceutical Press and American Pharmacists Association, London, 2009. [ Links ]
10. British Pharmacopeia 2010. Versión 13.0. Data© Crown Copyright 2010. Londres, 2010 (versión electrónica). [ Links ]
11. USP30-NF25, United States Pharmacopeia (USP 30), The United States Pharmacopeial Convention, Inc., Rockville, Md., 2007 (versión electrónica). [ Links ]
12. R. Ugarte, J.L. Bello, "Texto para la formación del técnico en farmacia dispensarial. Farmacotecnia", Editorial Pueblo y Educación, La Habana, 1990. [ Links ]
13. C.E. Cabrera, F. Gómez, A. Zúñiga. La resistencia de las bacterias a antibióticos, antisépticos y desinfectantes, una manifestación de supervivencia y adaptación, Colombia Médica, 38(2), 49 (2007). [ Links ]
14. J. Y. Leveau, M. Bouix, "Manual técnico de higiene, limpieza y desinfección", Mundi Prensa, Madrid, 2002, p. 623. [ Links ]













