Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.3 Bogotá Sept./Dec. 2015
https://doi.org/10.15446/rcciquifa.v44n3.56282
DOI: http://dx.doi.org/10.15446/rcciquifa.v44n3.56282
Análisis comparativo de la cinética de liberación de diclofenaco sódico a partir de matrices hidrofílicas en medios de disolución convencionales y biorrelevantes
A comparative analysis of the release kinetics of sodium diclofenac from hydrophilic matrices in conventional dissolution media and biorelevant media is carried out
Plinio A. Sandoval a
Ali Rajabi-Siahboomi b
Luisa Fernanda Ponce D'León c
a Colorcon Colombia, Cr. 129 No. 22B-57, interior 13, Bogotá, Colombia. Correo electrónico: psandoval@colorcon.com.
b Colorcon Inc., Global Headquarters, 275 Ruth Road, Harleysville, PA 19438, USA. Correo electrónico: asiahboomi@colorcon.com.
c Universidad Nacional de Colombia, Departamento de Farmacia, Bogotá, Colombia. Correo electrónico: lfponced@unal.edu.co.
Recibido para evaluación: 5 de noviembre de 2014.
Aceptado para publicación: 22 de septiembre de 2015.
Resumen
Se utilizaron dos polímeros hidrofílicos comúnmente empleados en la formulación de matrices de liberación extendida, hidroxipropil-metil-celulosa (HPMC, hipromelosa) y óxido de polietileno (PEO), junto con celulosa microcristalina y lactosa, con el objetivo de estudiar la cinética de liberación del diclofenaco sódico en los aparatos II y III de la USP, en un medio de disolución compendial y en medios biorrelevantes. La cinética de liberación predominante en el aparato II fue uno y en el aparato III, cero. El valor de las constantes n y k aplicando la ley del exponente, indicaron tanto para el aparato II como para el III, que no se presenta el efecto "burst" y que el mecanismo predominante en la liberación del fármaco, es la relajación y la erosión del polímero. Los resultados sugieren que la metodología de disolución en un medio biorrelevante es apropiada para discriminar entre formulaciones y para predecir el desempeño in vivo de tabletas de liberación extendida de diclofenaco sódico.
Palabras clave: diclofenaco, Methocel, Polyox, cinética, medios biorrelevantes.
Summary
Two hydrophilic polymers commonly employed on the development of extended release products, hydroxypropyl-methyl-cellulose (HPMC, hypromellose) and polyethylene oxide (PEO) were formulated with microcrystalline cellulose or lactose in order to investigate the release kinetics of sodium diclofenac on USP apparatus II and III using a compendial or biorelevant media, respectively. The dominant release kinetic on apparatus II was first order and zero on apparatus III. The values of the kinetic constant (k) and the release exponent (n) from the Power Law Model indicated that there was no burst effect in none of the studied formulations, relaxation and polymer erosion was the dominant mechanism of drug release in both methods. The results suggest that biorelevant dissolution methodology is appropriate for the discrimination of formulations and prediction of in vivo performance of MR diclofenac sodium matrices.
Key words: Diclofenac, Methocel, Polyox, kinetics, biorelevant media.
Introducción
El diclofenaco sódico es un antiinflamatorio no esteroideo, que posee efecto antiinflamatorio y analgésico. Este fármaco de clase II del sistema de clasificación biofarmacéutico, presenta un valor de pKa de 4,2 y un coeficiente de reparto log P (n-octanol/agua) de 13,4, lo que indica que es afín por las membranas lipídicas [1]. La vida media biológica es de 1 a 2 horas, lo que indica que por sí solo este fármaco no tiene un efecto de acción sostenida. Esto justifica el desarrollo de una tableta de liberación extendida de este fármaco, en donde se reduce la dosificación de dos o tres tomas diarias a una sola, así como la incidencia y la gravedad de los efectos secundarios y adversos.
El producto de referencia del mercado es el Voltaren-XR®, comercializado por Novartis. La composición cualitativa del producto señala que corresponde a una matriz lipídica, no hinchable ni erosionable, en la cual, el agente formador de matriz es el alcohol cetílico [2, 3]. Las matrices lipídicas son elaboradas mediante el método de fusión adicionando el fármaco y otros diluentes solubles o insolubles sobre ceras o grasas fundidas, donde se mezclan en constante agitación. Posteriormente, toman lugar procesos de enfriamiento y granulación en el caso de la elaboración de pellets o compresión en el caso de compactos [4]. El método de fusión no es muy común en la industria farmacéutica, lo cual puede representar un obstáculo para la selección de las matrices lipídicas como un sistema de entrega de liberación prolongada. Por el contrario, los métodos tradicionales para la obtención de comprimidos como la compresión directa o la granulación (húmeda o seca), han demostrado ser adecuados para la manufactura de matrices hidrofílicas. Los fenómenos que gobiernan la liberación del fármaco a partir de matrices lipídicas corresponden a i) difusión del fármaco a lo largo de poros llenos de medio de disolución y ii) erosión interna o superficial, mediante el proceso de digestión [5, 6].
Las matrices hidrofílicas, en particular las conformadas con hipromelosa u óxido de polietileno, son las formas farmacéuticas de liberación prolongada más empleadas cuando se busca alcanzar un perfil de liberación extendido [7]. En la literatura se reportan ampliamente los métodos para el estudio de la liberación y el tipo de cinética a partir de dichas matrices, empleando los aparatos I o II de la United States Pharmacopeia (USP), y estos son rutinariamente empleados en las actividades de desarrollo de productos [8, 9]. En la mayoría de los casos, los medios de disolución empleados corresponden a soluciones buffer, en donde se ajusta la fuerza iónica y el tipo de especies en solución. Sin embargo, los estudios señalan que para los fármacos de clase II (Sistema de Clasificación Biofarmacéutico, BSC, por sus siglas en inglés), los medios de disolución compendiales (USP) no ofrecen un grado de predicción confiable de la disolución in vivo, al ser comparados con medios que simulan la realidad biológica, o también conocidos como medios de disolución biorrelevantes [10]. La composición de cada medio de disolución biorrelevante en términos de su fuerza iónica, pH, concentración de sales biliares y lecitina, es tal que provee propiedades fisicoquímicas similares a las del contenido de los fluidos fisiológicos en cada punto del tracto gastrointestinal. El proceso de reabsorción de las sales biliares que se realiza en el íleon, se considera a partir del medio de disolución que representa el íleon superior; de esta forma, la concentración de sales biliares se ajusta a la mitad en este medio y luego se reduce a cero en los medios de disolución posteriores [11]. La ventaja de los medios de disolución biorrelevantes es que permiten predecir el desempeño in vivo de la liberación del IFA (ingrediente farmacéutico activo) a partir de la forma farmacéutica, debido a que el factor limitante para la absorción de los IFA de clase II del BSC, el cual es la disolución, puede ser modelado in vitro [12]. De esta forma, los medios de disolución biorrelevantes pueden ser aplicados para predecir diferencias en biodisponibilidad entre formulaciones, en la fase de desarrollo [12, 13].
El aparato III de la Farmacopea de Estados Unidos (USP, por sus siglas en inglés) (cilindro reciprocante) acoplado a los medios de disolución biorrelevantes, ofrece un método de disolución diseñado desde un punto de vista fisiológico. Su aplicación permite establecer la liberación del fármaco, sometiendo la forma farmacéutica a una serie de medios de disolución que representan fluidos biológicos. El tiempo de exposición del producto a cada medio, se puede ajustar a tiempos que representan el tránsito en el tracto gastrointestinal. Además, el diseño del equipo permite cambiar el tipo de malla superior e inferior y la velocidad de inmersión del cilindro que contiene la forma farmacéutica, modificando así la hidrodinamia a la que se somete el producto; lo que finalmente conduce a la posibilidad de establecer un pronóstico in vitro del posible efecto del peristaltismo in vivo [11, 14, 15]. Varias publicaciones demuestran cómo el empleo de los medios de disolución biorrelevantes, permite predecir el efecto de la presencia de alimentos en la biodisponibilidad; de esta manera, su utilización en conjunto con el aparato III, permite optimizar y acelerar el proceso de preformulación y formulación de un sistema de liberación extendida [16-18].
El tracto gastrointestinal en el estado de ayuno, se caracteriza por tener un pH bajo en el estómago (~ 1,8) y un valor de pH mayor en el duodeno (~6) y en el yeyuno (~6,5 - 6,8). Los tiempos de tránsito en el estado de ayuno en voluntarios sanos, dependen del complejo motor migratorio intestinal [11, 16].
Por el contrario, en el estado alimentado, los tiempos de residencia en el estómago son más prolongados, y los valores de pH se modifican, siendo más elevado en el estómago (~4) y más bajos en el duodeno (~5) y en el yeyuno (~5,5 a 6,5). El vaciado gástrico y los tiempos de residencia en el estado alimentado, también son afectados por el tipo de alimentos presentes (contenido graso y de carbohidratos), la presión osmótica y el pH [11, 16, 18].
En el presente estudio, se planteó como objetivo principal: i) identificar los fenómenos involucrados en la liberación del IFA (difusión o erosión) y ii) comparar cuantitativamente la cinética de liberación del diclofenaco sódico (DS) a partir de matrices hidrofílicas de Methocel™ y Polyox™ (hidroxipropil-metil-celulosa y óxido de polietileno, respectivamente) en los diferentes medios seleccionados. Para ello se emplearon el aparato II y un medio de disolución compendial junto con un método de disolución diseñado fisiológicamente (aparato III acoplado a los medios de disolución biorrelevantes). La hipótesis planteada es que la cesión del activo permite establecer una cinética de primer orden para el proceso de liodisposición, en las matrices elaboradas con HPMC (hidroxipropil-metil-celulosa o hipromelosa) y de orden cero para las estructuradas con óxido de polietileno (PEO, por sus siglas en inglés), debido a la marcada diferencia entre las velocidades de hidratación de los dos polímeros.
Metodología
Materias primas: hidroxipropil-metil-celulosa, HPMC (Methocel K4M Premium CR, Colorcon), óxido de polietileno (PEO) (Polyox WSR 303), lactosa monohidrato (DMV Fonterra Excipients), lactosa Spray-Dried (NF Lactose-316 FastFlo, Sheffield Pharmaingredients), celulosa microcristalina de 50 µm y 90 µm (Microcel 101 y Microcel 102, Blanver), hidroxipropil-metil-celulosa (Methocel E5LV Premium, Colorcon), dióxido de silicio coloidal (Cab-O-Sil, CabotGmbH), talco (USP) y estearato de magnesio (USP), sistema de recubrimiento entérico (Acryl-EZE®, Colorcon). Methocel™ y Polyox™ son marcas registradas de "The Dow Chemical Company".
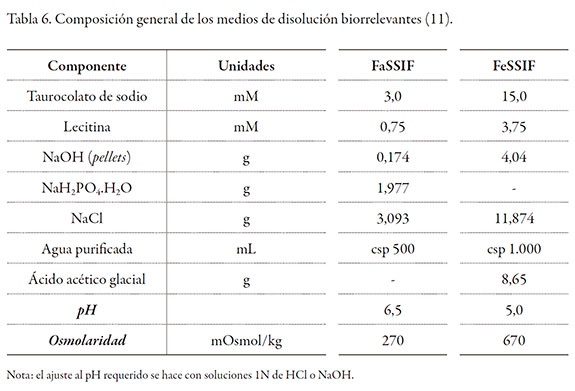
Reactivos analíticos: para los ensayos de disolución en el aparato II se emplearon 900 mL de buffer de fosfatos USP 0,05 M, pH 7,5 y en el aparato III se emplearon: taurocolato sódico, lecitina, NaOH en pellets, NaH2PO4.H2O, NaCl, ácido acético glacial y agua destilada.
Equipos: tableteadora tipo rotativa, marca Talleres Sánchez, granulador de lecho fluidizado NR Industries FBS-1, spectrophotometer Hewlett Packard 8452 con arreglo de diodos, equipo de disolución Hanson SR-8-PLUS-8S-P (aparato II), aparato de cilindros reciprocantes (aparato III, USP), automuestreador acoplado al aparato III (Logan Instruments Disso III) y equipo para cromatografía líquida de alta eficacia (HPLC, por sus siglas en inglés) (Alliance 2695, Waters Corp., Milford, MA).
Elaboración de las tabletas con recubrimiento entérico: el diclofenaco sódico y alguno de los dos diluentes seleccionados (lactosa o celulosa microcristalina) se mezclaron en una proporción 100:45 en un mezclador Hobart por 5 minutos. Posteriormente, esta mezcla se granuló mediante la técnica de granulación húmeda por lecho fluido, con una solución al 6% (p/p) de HPMC de bajo peso molecular (Methocel E5LV Premium).
La tabla 1 muestra los parámetros estandarizados empleados en la granulación.
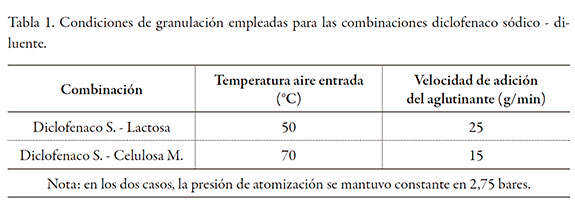
El granulado resultante, una vez estandarizado, se mezcló por 10 minutos con el polímero formador de matriz seleccionado (Methocel K4M Premium CR o Polyox WSR 303) y con el aerosil en un mezclador Hobart por 10 minutos. El talco y el estearato de magnesio se pasaron por una malla 60, se adicionaron a la mezcla anterior y se mezclaron por 3 minutos más. La mezcla final se comprimió en una tableteadora rotativa (Talleres Sánchez), empleando un diámetro de punzón de 9 mm. Las tablas 2 y 3 muestran la composición de las matrices evaluadas.
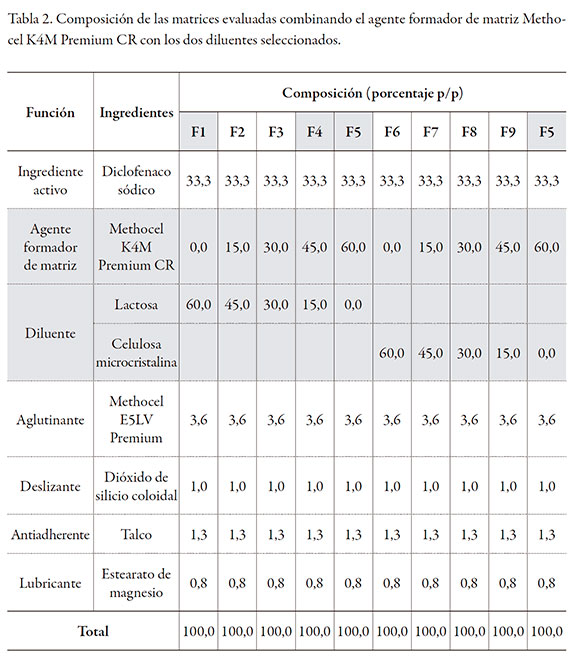
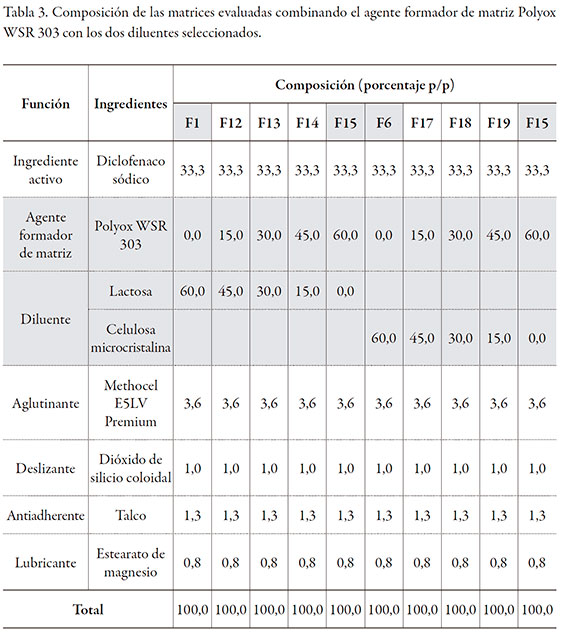
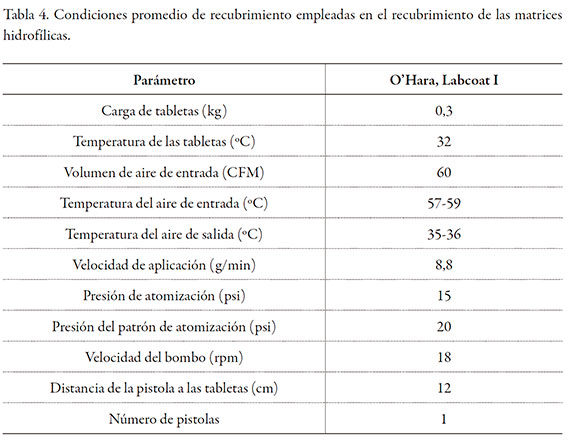
En todos los casos, el peso teórico de la tableta fue de 300 mg y el contenido de diclofenaco sódico de 100 mg. Las cinco formulaciones evaluadas corresponden a variaciones de la proporción: diluente-polímero formador de matriz, donde en todos los casos la suma total es 60% de la composición. Las matrices hidrofílicas se sometieron a un proceso de recubrimiento con película, en un equipo de recubrimiento marca O'Hara Labcoat con un producto comercial (Acryl-EZE, Colorcon), el que incluye en su composición al copolímero del ácido metacrílico tipo C, USP 34-NF 29. Las condiciones de recubrimiento empleadas se presentan en la tabla 4. La cantidad de recubrimiento entérico con el que se recubrieron las tabletas correspondió a un incremento en peso del 10% de su peso inicial, logrando un peso final teórico medio de 330 mg.
Evaluación del proceso de disposición del diclofenaco sódico empleando el aparato II
Para realizar la determinación del proceso de liodisposición del diclofenaco sódico, se empleó el aparato II a 100 rpm con "sinkers", en un medio de disolución de buffer de fosfatos 0,05 M ajustado a un pH de 7,5. La evolución de la cantidad disuelta en función del tiempo, se siguió por espectrofotometría a una longitud de onda de 276 nm mediante la aplicación de una metodología analítica validada.
Evaluación del proceso de disposición del diclofenaco sódico empleando el aparato III y medios de disolución biorrelevantes
La evaluación de la liberación del diclofenaco sódico en el aparato III, empleó un equipo marca Logan Instruments Disso III con cilindros reciprocantes. La velocidad de inmersión para todas las pruebas fue de 5 inmersiones por minuto y la longitud de desplazamiento del cilindro fue de 10 cm. Los tiempos de residencia in vitro en cada medio, representan los tiempos de tránsito gastrointestinal caracterizados y reportados en la literatura. La composición de cada medio en términos de su fuerza iónica, pH, concentración de sales biliares y lecitina, se ajustaron de tal forma, que proveen propiedades fisicoquímicas similares a las del contenido de los fluidos fisiológicos en cada punto del tracto gastrointestinal. El proceso de reabsorción de las sales biliares que se realiza en el íleon, se consideró a partir del medio de disolución que representa el íleon superior; de esta forma, la concentración de sales biliares se ajustó a la mitad y luego se eliminaron las sales biliares en los dos medios de disolución posteriores (BlankFaSSIF y BlankFeSSIF) [11]. La suspensión de nutrientes Ensure Plus® se empleó directamente sin ajustes de pH, con el fin de evitar la coagulación de los componentes. Las muestras de Ensure Plus® se sometieron a dilución, se centrifugaron y filtraron previo a la cuantificación del activo. Los muestreos se tomaron en tiempos preestablecidos, reportados en la tabla 5 y la cuantificación se realizó siguiendo la metodología de cromatografía líquida de alta eficiencia descrita en la monografía de tabletas de liberación extendida de diclofenaco sódico de la USP 32 [19].
La tabla 5 muestra los pH de los diferentes medios empleados y los tiempos de residencia para las pruebas de disolución.
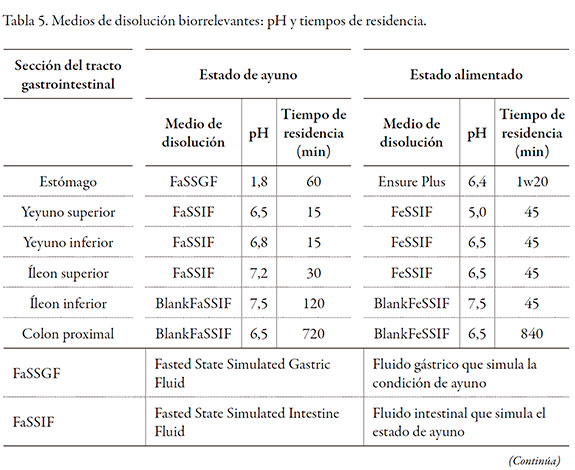
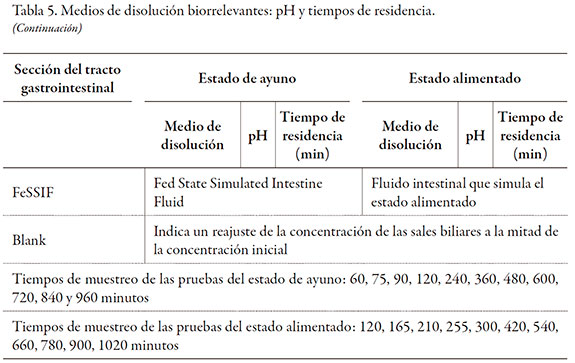
La preparación de los medios de disolución siguió las recomendaciones encontradas en la literatura y adoptadas por la USP (11, 14). La tabla 6 muestra la composición general de los medios de disolución biorrelevantes.
Los muestreos se tomaron en tiempos preestablecidos y la cuantificación se realizó por un método HPLC estandarizado (Alliance 2695, Waters Corporation, Milford, MA).
Evaluación de la cinética de liberación
A partir de los datos de la concentración de diclofenaco sódico disuelto en cada intervalo de muestreo, se calculó el porcentaje disuelto acumulado en función del tiempo. Mediante el análisis gráfico de los resultados, se calculó para cada réplica: el orden cinético más probable y el modelo matemático que describe el comportamiento del proceso, del que se obtiene la constante de velocidad específica de disposición. El análisis gráfico buscó, además, detectar y cuantificar posibles tiempos de latencia, alteraciones de la velocidad e incluso establecer probables cambios cinéticos ocurridos durante el proceso de disposición del diclofenaco sódico. También se emplearon los modelos de Korsmeyer-Peppas, ecuación (1) [20] para el análisis de los datos en el aparato II y el modelo modificado por Ford y cols., ecuación (2) [21] para los del aparato III, con objeto de identificar los fenómenos involucrados en el proceso de liberación y para comparar el desempeño de las diferentes formulaciones de matrices. El modelo modificado propuesto por Ford y cols., se aplicó con el fin de hacer el ajuste del tiempo, debido a la presencia del "lagtime" inicial. Las ecuaciones (1) y (2) se presentan a continuación:
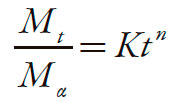 | [1] |
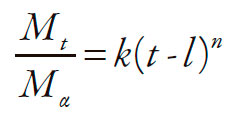 | [2] |
Donde: Mt / Mα es la fracción de fármaco liberado, k es la constante de difusión, n es el exponente asociado al mecanismo de liberación y t es el tiempo y l, en el caso de la ecuación (2), es el "lagtime".
Resultados y discusión
Evaluación de las formulaciones de las tabletas de diclofenaco sódico
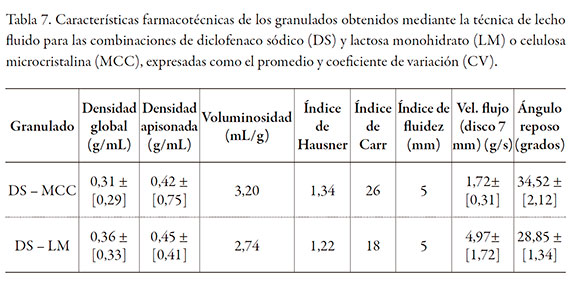
La granulación en húmedo del DS, permitió comunicarle características plásticas al granulado y evitar los inconvenientes encontrados cuando se intentó la compresión directa. La tabla 7 muestra las características farmacotécnicas de los granulados preparados; en los dos casos se obtuvieron granulados con una voluminosidad y densidad adecuadas [22].
Las tablas 8 y 9 muestran las características de las tabletas preparadas de acuerdo con la composición indicada en las tablas 2 y 3. Como se aprecia, las tabletas preparadas con materiales recomendados para compresión directa, presentaron un aspecto más uniforme, superficie lisa, con excelentes propiedades mecánicas y variación de peso baja.


Efecto de la composición de la matriz hidrofílica en la cinética de liodisposición del diclofenaco sódico empleando el aparato II
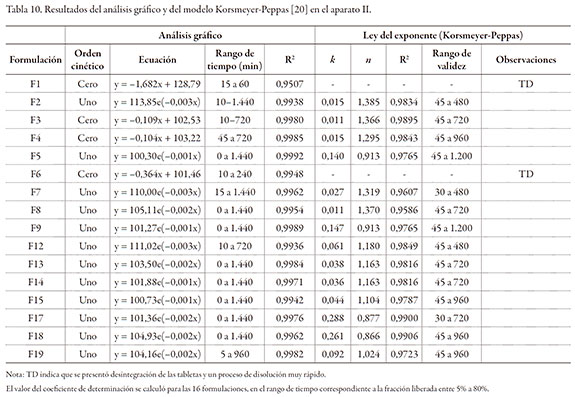
Las gráficas de la figura 1 muestran los perfiles de liberación para las 16 formulaciones de matrices, en el aparato II, n = 3 (100 rpm con "sinkers", buffer de fosfatos 0,05 M ajustado, pH de 7,5).
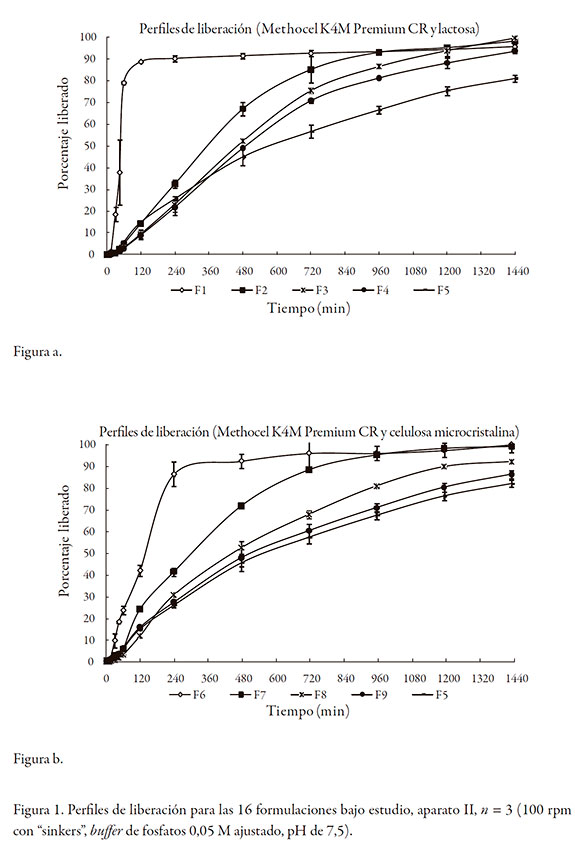
La tabla 10 resume el análisis de la cinética del proceso de liberación en el aparato II. Se observó desintegración de las tabletas, solo cuando el porcentaje presente del diluente fue del 100%, independiente del diluente (F1 y F6). Predominantemente, la cinética de liberación fue de primer orden. En todos los casos, la liberación del fármaco fue más lenta al incrementarse la proporción del polímero formador de matriz. La magnitud del valor de la constante k, para el caso del método de Korsmeyer-Peppas, indicó en términos generales, que no se presentó en ningún caso un efecto "burst" marcado, considerando que los valores de la constante k, son inferiores a 0,3 en todos los casos y que diversas publicaciones sugieren que estos valores son bajos [23, 24]. Para el total de las formulaciones evaluadas, el valor de la constante n estuvo en alrededor de 1,0, confirmando que los fenómenos que controlan la liberación son la relajación del polímero y la erosión (o disolución) del polímero [21, 25].
Efecto de la composición de la matriz hidrofílica en la cinética de liodisposición del diclofenaco sódico, empleando el aparato III acoplado a medios biorrelevantes
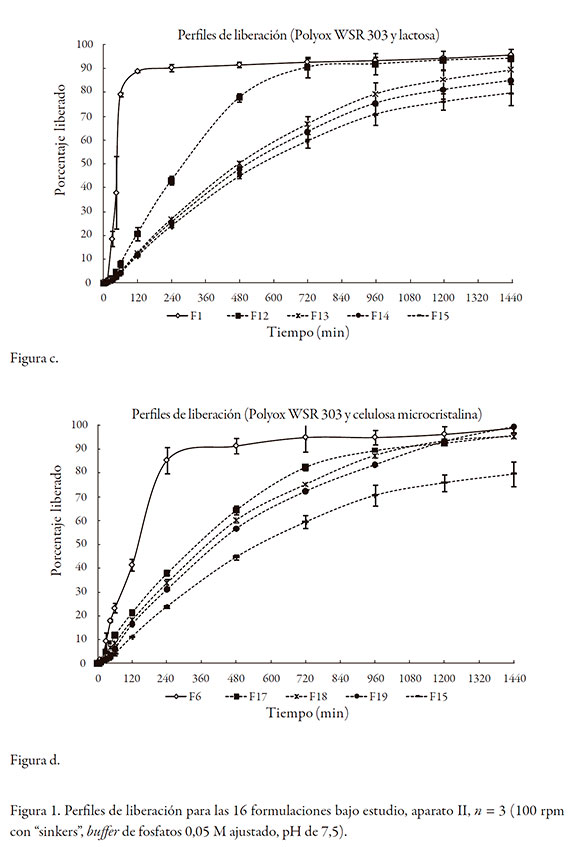
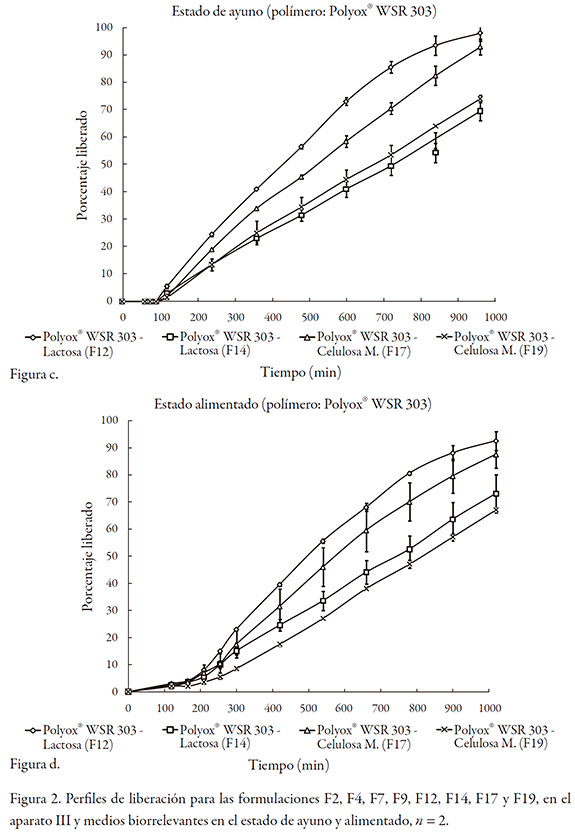
Las gráficas de la figura 2, muestran los perfiles de liberación logrados en las ocho formulaciones estudiadas. Se seleccionaron las formulaciones en las que el contenido de polímero formador de matriz fuera del 15% o del 45% con el objetivo de estudiar los fenómenos que controlaban la liberación en los extremos de contenido bajo y alto del polímero, en presencia del diluente.
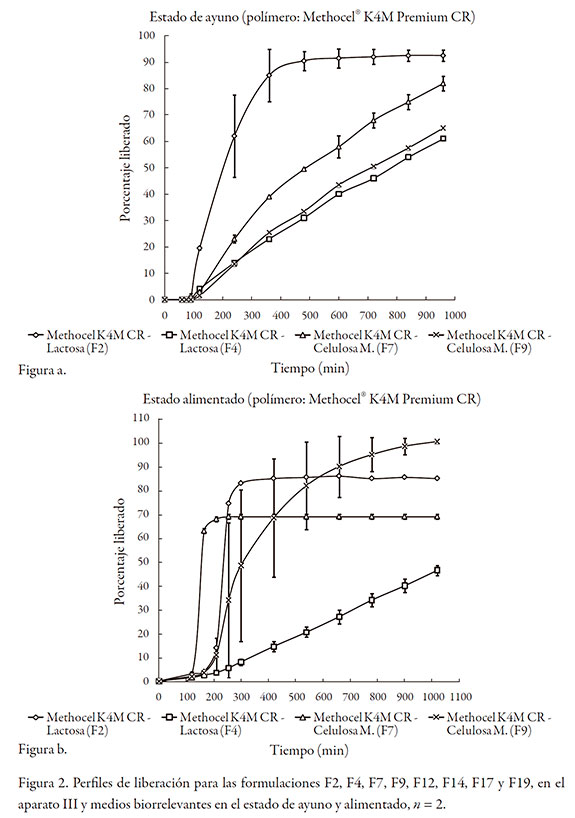
Para el caso de las formulaciones F2 y F4 donde el diluente es la lactosa, se observó la desintegración de las tabletas en el caso de la formulación F2, presumiblemente debido a la baja proporción de Methocel (15%), independiente del diluente, y de las condiciones del medio (estado de ayuno o alimentado). La formulación F4 no se desintegró en ninguno de los medios de disolución gracias a un mayor contenido de polímero formador de matriz Methocel (45%).
Para las formulaciones F7 y F9 donde el diluente es la celulosa microcristalina, la formulación F7 (Methocel al 15%) se erosionó de manera pronunciada en el medio que simula el estado de ayuno, sin presentar desintegración; sin embargo, hubo desintegración en el medio que simula el estado alimentado. La formulación F9 (Methocel al 45%) no presentó erosión superficial en el medio que simula el estado de ayuno; no obstante, se desintegró completamente en el medio que simula el estado alimentado.
En el caso de la formulación F9, a pesar de tener el contenido más alto de Methocel, se observa que la presencia de la celulosa (excipiente, prácticamente insoluble, pero hidrofílico) interfiere con la formación del gel. Aunque la celulosa facilita la entrada del agua por capilaridad, al no disolverse en ella la deja libre, y, a su vez, al rodear como una especie de malla a las partículas del Methocel en proceso de hidratación, interfiere en la coalescencia de las mismas, paso fundamental para estructurar el gel. Lo anteriormente descrito, explica esencialmente la desintegración de la tableta. Cabe resaltar que las tabletas de la formulación F4 (Methocel al 45% y lactosa al 15%) no se desintegraron en el medio que simula el medio alimentado, por lo que presumiblemente la lactosa no interfiere con la formación de la capa gel.
Aunque la evaluación de la cesión del diclofenaco sódico en el aparato II no pudo detectar la desintegración en las formulaciones anteriores, el método de disolución fisiológicamente diseñado (aparato III acoplado a los medios biorrelevantes) sugiere que para las tabletas de liberación prolongada con los IFA como el diclofenaco sódico, preferiblemente se debe evitar en la formulación de matrices hidrofílicas, porcentajes de Methocel bajos, y en combinación con celulosa microcristalina.
El análisis gráfico señaló que el orden cinético predominante fue cero en todas las formulaciones, excepto en la F7. Los resultados de la ley del exponente en el aparato III, confirman que en ningún caso hay un efecto "burst" significativo (k ≤ 0,3) y que en todos los eventos, los fenómenos que controlan la liberación del diclofenaco sódico, fueron la relajación y la erosión del polímero (n~ 1,0). Estos valores de k y n indican que para las formulaciones que no se desintegraron, hay una velocidad de formación del gel lo suficientemente rápida, como para controlar el ingreso masivo de agua al interior de la tableta.
Para el caso del Polyox, ninguna de las formulaciones se desintegró, independiente del tipo de diluente utilizado o de la composición del medio (ayuno frente a alimentado). En todos los casos, el orden cinético obtenido por análisis gráfico fue cero, y para el análisis por medio de la ley del exponente, todos los valores de k fueron inferiores a 0,3 y los de n~ 1,0; ello indica que el Polyox actúa sobre la liberación por un proceso de relajación y erosión.
Por otra parte, se puede establecer una correlación entre las velocidades de hidratación de los polímeros (siendo considerablemente más rápida la de Polyox comparada con la de Methocel) [26] y las formulaciones en las que no se presentó desintegración de las tabletas. En todos los casos en los que está presente el Polyox, incluso a porcentajes bajos, ninguna formulación se desintegró; mientras que para el Methocel, las que contenían porcentajes bajos del polímero se desintegraron.
En términos generales, al incrementarse la proporción del polímero, la liberación del diclofenaco sódico se hace más lenta.
Las tablas 11 y 12 resumen los resultados del análisis gráfico de la cinética del proceso de liberación de las ocho formulaciones en el aparato III.
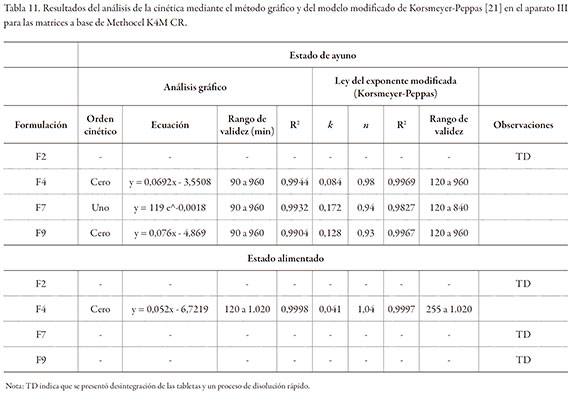
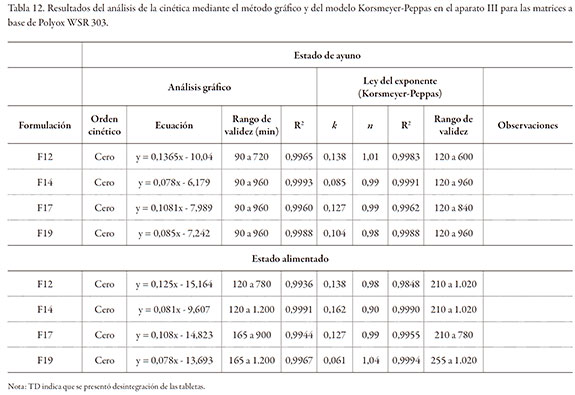
Las gráficas de la figura 3, muestran los perfiles de liberación en función de la composición del medio de disolución para las ocho formulaciones seleccionadas. Para las formulaciones donde no se presentó desintegración en alguno de los medios (F4, F12, F14, F17 y F19), se observa un retraso de la liberación del fármaco en los perfiles de liberación en el estado alimentado, ocasionado por las condiciones de la prueba durante la estadía de las matrices en las dos primeras celdas:
i) Celda 1: Ensure Plus® pH: 6,4 - tiempo de tránsito de 120 minutos, y
ii) Celda 2: FeSSIF pH: 5,0 - tiempo de tránsito de 45 minutos.
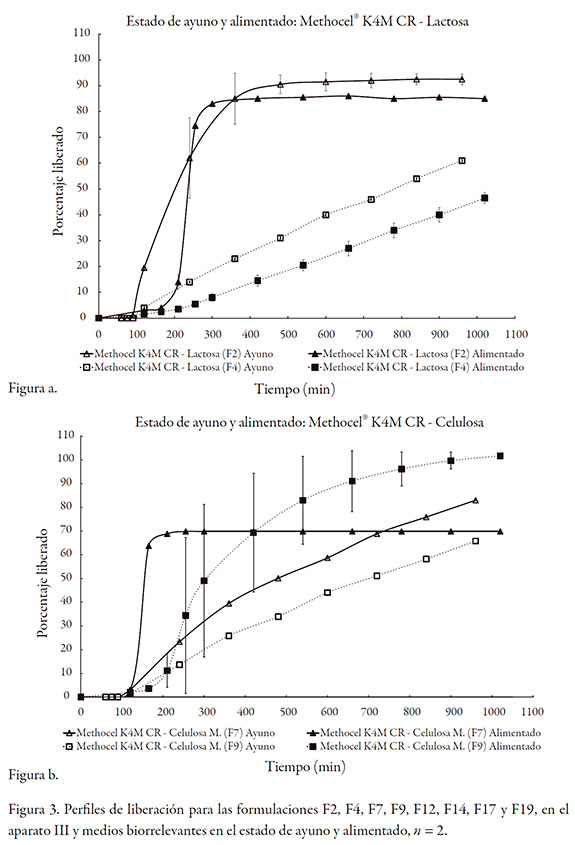
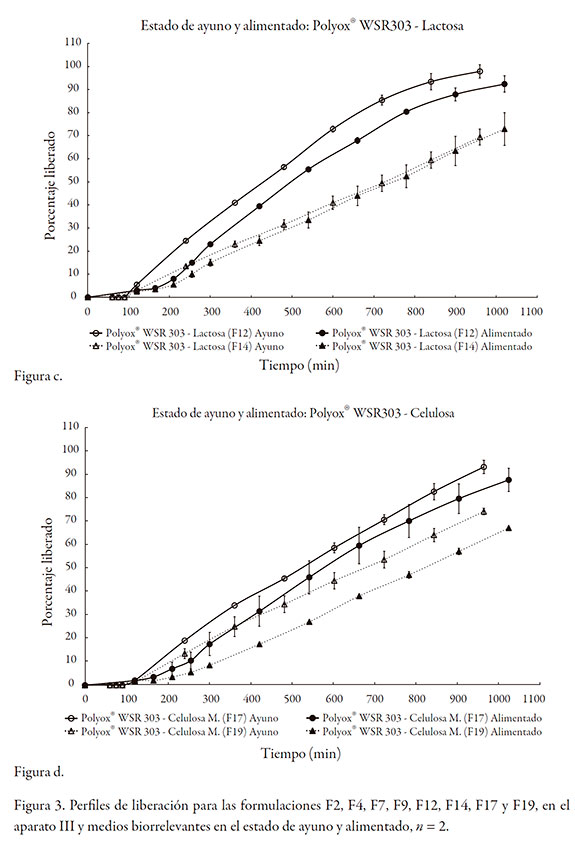
Sin embargo, no se observó un cambio significativo en el valor de los valores k (velocidad de erosión), para la mayoría de las formulaciones evaluadas, tanto en el medio que simula el estado de ayuno, como el alimentado. Esto sugiere que la velocidad de erosión es muy similar, en función de la hidrodinámica aplicada (cinco inmersiones por minuto), y que se vio afectada por la concentración del polímero.
El retraso observado en la liberación en el medio que simula el estado alimentado, se debió presumiblemente a:
- La exposición inicial de las matrices al Ensure Plus® durante 2 horas, en donde, debido a la mayor viscosidad de este medio de disolución, posiblemente se presentó una lenta hidratación y disolución de la película entérica o una velocidad de erosión considerablemente menor [11], y
- A que durante el lapso posterior de 45 minutos en el medio que simula el estado alimentado del yeyuno superior (celda 2), en el que las matrices se expusieron a un pH de 5,0, el fármaco estuvo expuesto a un pH donde se ve reducida su solubilidad. Sin embargo, una vez las matrices fueron transferidas a la celda 3, donde el pH es 6,5, se ve un incremento en la cantidad liberada.
Conclusiones
Se logró demostrar que la utilización de los medios de disolución biorrelevantes acoplados con el equipo III de la USP, constituyen una herramienta que permite discriminar entre formulaciones, con objeto de hacer un pronóstico del desempeño in vivo de productos de liberación extendida.
El método de disolución diseñado desde un punto de vista fisiológico, logró detectar la erosión pronunciada de las matrices de Methocel™, en las que el porcentaje del polímero fue del 15%, independiente del diluente lactosa / celulosa microcristalina.
Para la formulación F9, la que contenía Methocel™ en 45% en combinación con la celulosa microcristalina, se observó la desintegración completa de las matrices en el medio de disolución que simula el estado alimentado, por lo que se recomienda emplear como diluente la lactosa.
Para el caso de las formulaciones que contenían Polyox™, ninguna de las formulaciones se desintegró, independientemente del tipo de diluente utilizado o de la composición del medio (ayuno frente a alimentado), lo que posiblemente se atribuye a la mayor velocidad de hidratación de este polímero, en comparación con la del Methocel™.
Se encontró que el Polyox™ WSR 303, presentó un mayor grado de robustez frente a las diferentes condiciones evaluadas, presumiblemente gracias a su mayor velocidad de hidratación, exhibiendo cinéticas muy convenientes para este caso, de orden cero.
Agradecimientos
Por la colaboración prestada para el desarrollo de la tesis de Maestría de uno de los autores (P.A. Sandoval, Ref. [22]) manifestamos nuestros agradecimientos a las siguientes instituciones y estudiantes:
- A la Dirección de Investigación de la sede Bogotá, de la Universidad Nacional de Colombia, por el apoyo económico que hizo posible adelantar el presente estudio, y a los estudiantes del Programa de Farmacia de la misma universidad que participaron en las actividades investigativas de los estudios de granulación y disolución del presente estudio.
- A los departamentos analíticos y de desarrollo de nuevos productos de la casa matriz de Colorcon en los Estados Unidos, por el apoyo ofrecido al permitirnos realizar la determinación de los perfiles de disolución en el aparato III acoplado a los medios biorrelevantes (Colorcon Global Headquarters, Colorcon, Inc. 275 Ruth Road, Harleysville, PA 19438).
Referencias
1. M.E. Palomo, M.P. Ballesteros, P. Frutos, Analysis of diclofenac sodium and derivatives, J. Pharm. Biomed. Anal., 21(1), 83-94 (1999). [ Links ]
2. Novartis Pharmaceuticals Corporation (febrero 2011), Voltaren®-XR. Prescribing information. URL: http://www.pharma.us.novartis.com/product/pi/pdf/voltaren_xr.pdf, consultado el 18 de septiembre de 2015. [ Links ]
3. E. Mathiowitz (ed.), "Encyclopedia of Controlled Drug Delivery", New York: John Wiley & Sons, Inc., 1999, p. 729. [ Links ]
4. M. Ozyazici, E.H. Gökçe, G. Ertan, Release and diffusional modeling of metronidazole lipid matrices, Eur. J. Pharm. Biopharm., 63(3), 331-339 (2006). [ Links ]
5. X. Wen, A. Nokhodchi, A. Rajabi-Siahboomi, Oral extended release hydrophilic matrices: Formulation and design. In: "Oral controlled release formulation design and drug delivery: Theory to practice", H. Wen, K. Park (eds.), John Wiley & Sons, Inc., Hoboken, New Jersey, 2010, pp. 89-100. [ Links ]
6. D.L. Wise (ed.), "Handbook of pharmaceutical controlled release technology", CRC Press, London, 2000, pp. 193 y 443. [ Links ]
7. A. Rajabi-Siahboomi, M.P. Jordan, Slow release HPMC matrix systems, Eur. Pharm. Rev., 5, 21-23 (2000). [ Links ]
8. S. Tiwari, A. Rajabi-Siahboomi, "Drug delivery systems", Humana Press; 1 edition (March 7, 2008) Chapter 11. [ Links ]
9. S.B. Tiwari, A.R. Rajabi-Siahboomi, Extended-release oral drug delivery technologies: Monolithic matrix systems, Methods Mol. Biol., 437, 217-243 (2008). [ Links ]
10. H. Wei, R. Löbenberg, Biorelevant dissolution media as a predictive tool for glyburide a class II drug, Eur. J. Pharm. Sci., 29(1), 45-52 (2006). [ Links ]
11. J.J. Dressman, J. Kramer, "Pharmaceutical dissolution testing", CRC Press, Taylor & Francis Group LLC, Atlanta, 2005, pp. 195-224. [ Links ]
12. J. Dressman, C. Reppas, In vitro-in vivo correlations for lipophilic, poorly watersoluble drugs, Eur. J. Pharm. Sci., 11(Suppl 2), S73-S80 (2000). [ Links ]
13. S. Azarmi, W. Roa, R. Löbenberg, Current perspectives in dissolution testing of conventional and novel dosage forms, Int. J. Pharm., 328(1), 12-21 (2006). [ Links ]
14. M. Marques, Dissolution media simulating fasted and fed states (mayo 2004), Dissolution technologies, URL: http://www.dissolutiontech.com/DTresour/200405Articles/DT200405_A03.pdf, consultado el 18 de septiembre de 2015. [ Links ]
15. M.X. Guo, "Oral controlled release formulation design and drug delivery: Theory to practice", H. Wen, K. Park (eds.), Wiley, New York, 2010, p. 245. [ Links ]
16. S. Klein, Predicting food effects on drug release from extended-release oral dosage forms containing a narrow therapeutic index drug (agosto 2009), Dissolution technologies, pp. 28-40, URL: http://www.dissolutiontech.com/DTresour/200908Articles/DT200908_A04.pdf. [ Links ]
17. D. Ferrizzi, A. Rajabi-Siahboomi, Evaluation of verapamil hydrochloride (240 mg) extended release matrix formulations using USP apparatus 3 in biorelevant dissolution media, URL: http://abstracts.aapspharmaceutica.com/expoaaps06/cc/forms/attendee/index.aspx?content=sessionInfo&sessionId=2112. [ Links ]
18. E. Jantratid, V. de Maio, E. Ronda, V. Mattavelli, M. Vertzoni, J. Dressman, Application of biorelevant dissolution tests to the prediction of in vivo performance of diclofenac sodium from an oral modified-release pellet dosage form, Eur. J. Pharm. Sci. 37(3-4), 434-441 (2009). [ Links ]
19. United States Pharmacopeia and National Formulary (USP 32 - NF 27), Diclofenac sodium extended-release tablets. En: "The United States Pharmacopeia Convention". Rockville, Maryland, 2009. [ Links ]
20. R. Korsmeyer, R. Gurny, E. Doelker, P. Buri, N. Peppas, Mechanisms of potassium chloride release from compressed, hydrophilic, polymeric matrices: Effect of entrapped air, J. Pharm. Sci., 72, 1189-1191 (1983). [ Links ]
21. J. Ford, K. Mitchell, P. Rowe, D. Armstrong, P. Elliott, C. Rostron, J. Hogan, Mathematical modeling of drug release from hydroxypropylmethylcellulose matrices: Effect of temperature, Int. J. Pharm., 71, 95-104 (1991). [ Links ]
22. P. Sandoval, "Preformulación de tabletas de diclofenaco sódico de liberación extendida del tipo matriz hidrofílica y estudio de la cinética de liberación en medios de disolución biorrelevantes", Tesis de Magíster en Ciencias Farmacéuticas, Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Bogotá, 2013. [ Links ]
23. N.K. Ebube, A. Hikal, C.M. Wyandt, D.C. Beer, L.G. Miller, A.B. Jones, Sustained release of acetaminophen from heterogeneous matrix tablets: Influence of polymer ratio, polymer loading, and co-active on drug release, Pharm. Dev. Technol., 2, 161-170 (1997). [ Links ]
24. M. Levina, A. Rajabi-Siahboomi, The influence of excipients on drug release from hydroxypropyl methylcellulose matrices, J. Pharm. Sci., 93, 2746-2754 (2004). [ Links ]
25. R. Espinoza, E. Hong, L. Villafuerte, Influence of admixed citric acid on the release profile of pelanserin hydrochloride from HPMC matrix tablets, Int. J. Pharm., 201, 165-173 (2000). [ Links ]
26. P. Todd, J. L'Hote-Gaston, M. Sheick, Comparison of swelling, erosion, and gel strength of polyethylene oxide and hypromellose, URL: http://www.colorcon.com/literature/marketing/mr/Extended%20Release/Methocel/English/AAPS2008_L'Hote-Gaston_Technical_Paper_2008-11-13.pdf. [ Links ]














