Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.3 Bogotá Sept./Dec. 2015
https://doi.org/10.15446/rcciquifa.v44n3.56283
DOI: http://dx.doi.org/10.15446/rcciquifa.v44n3.56283
Determinación de hidroquinona usando un electrodo de carbono vítreo modificado con quitosano, nanotubos de carbono de pared múltiple y líquido iónico. Posible uso como sensor
Determination of hydroquinone using a glassy carbon electrode modified with chitosan, multi-wall carbon nano-tubes and ionic liquid. Possible use as sensor
Laura Scarpetta a
Adrián Mariño
Karen Bolaños
Yaritza Leiva
Paola Castiblanco
Édgar Nagles b
a Universidad de la Amazonia, Facultad de Ciencias Básicas, Programa de Química, Florencia, Colombia. Campus Porvenir. Calle 17, diagonal 17 con carrera 3F.
b Universidad de Ibagué, Facultad de Ciencias Naturales y Matemáticas, Ibagué, Colombia. Carrera 22, calle 67 B/Ambalá. Correo electrónico: edgar.nagles@unibague.edu.co.
Recibido para evaluación: 25 de abril de 2015.
Aceptado para publicación: 22 de septiembre de 2015.
Resumen
La propiedad electroactiva de hidroquinona (HQ) se estudió sobre un electrodo de carbono vítreo modificado con quitosano, nanotubos de carbono de pared múltiple (Ch-MWCNT-GCE). La HQ se depositó a un potencial controlado sobre la superficie del electrodo y la oxidación de la HQ se midió por voltametría de onda cuadrada (SWV, por sus siglas en inglés). Se observó una corriente de oxidación a 0,39 V y una corriente de reducción a 0,21 V con un ΔV de 0,18 V; ello indicó un proceso reversible. Un aumento en las corrientes de oxidación y de reducción de casi 50% se observó cuando el Ch-MWCNT-GCE se recubrió con líquido iónico (LI). El electrodo se caracterizó por voltamperometría cíclica (CV, por sus siglas en inglés) en presencia y sin la presencia de diferentes líquidos iónicos con distinto anión, siendo el más óptimo el líquido iónico (LI) 1-butil-3-metilimidazolio hexafluorofosfato (BMIMPF6). Se estudiaron las variables experimentales como pH, tiempo de adsorción (tads) y potencial de adsorción (Eads), así como también las potenciales interferencias. Bajo las óptimas condiciones (pH 3,0; tacc 60s; Eacc 0,10 V), el pico de la corriente es proporcional a la concentración de HQ entre 4,20 * 10-6 y 30,0 * 10-6 mol L-1, con un límite de detección de 2,45 * 10-7 mol L-1. La desviación estándar relativa para una solución que contiene 1,0 * 10-4 mol L-1 de HQ, fue de 1,5% para siete medidas iguales. El método se validó con una muestra de agua dopada con HQ.
Palabras clave: hidroquinona, voltamperometría de adsorción, electrodo modificado, líquido iónico.
Summary
Property of the electroactive hydroquinone (HQ) was studied on a glassy carbon electrode modified chitosan, multi wall carbon nanotubes (Ch-MWCNT-GCE). HQ is deposited at a controlled potential to the electrode surface and oxidation of HQ is measured by square wave voltammetry (SWV). An oxidation current to 0.39 V and a reduction current to 0.21 V with a 0.18 ΔV indicating a reversible process were observed. An increase in the flow of oxidation and reduction of almost 50% was observed when the Ch-MWCNT-GCE was coated with ionic liquid (LI). The electrode was characterized by cyclic voltammetry (CV) in the presence and without the presence of different ionic liquids with different anion being the most optimal ionic liquid (LI) 1-butyl-3-methyllimidazolio hexafluorophosphate (BMIMPF6). Experimental variables such as pH, adsorption time (TADs) and adsorption potential (Eads), as well as potential interference, were studied. Under optimal conditions (pH 3.0; tacc 60s; Eacc 0.10 V) the peak current is proportional to the concentration of HQ between 4.20 * 10-6 and 30.0 * 10-5 mol L-1 with a detection limit of 2.45 * 10-7 mol L-1. The relative standard deviation for a solution containing 1.0 * 10-4 mol L-1 HQ was 1.5% for seven equal measures. The method was validated with a water sample doped with HQ.
Key words: Hydroquinone, adsorption voltammetry, modified electrode, ionic liquid.
Introducción
La hidroquinona (HQ) (figura 1), cuya denominación de la Unión Internacional de Química Pura y Aplicada (IUPAC, por sus siglas en inglés) es benceno-1,4-diol, es un compuesto fenólico usado ampliamente como antioxidante, agente inhibidor, colorante, y en muchos más procesos industriales gracias a sus propiedades biológicas y químicas. Sin embargo, debido a la toxicidad que presenta en los seres humanos y la dificultad en su degradación, se convierte en un contaminante ambiental peligroso [1]. De ahí la necesidad del desarrollo de nuevas metodologías que permitan su determinación.
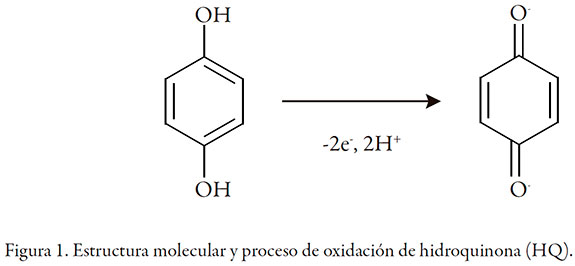
Algunas de las técnicas más usadas en la determinación de HQ son la cromatografía líquida de alto rendimiento (HPLC, por sus siglas en inglés) [2] y la espectrofotometría [3]. Por otro lado, las técnicas electroanalíticas han empezado a llamar la atención gracias a su bajo costo, fácil operación y gran sensibilidad. La innovación de esta técnica radica en la optimización del electrodo modificado, el cual incrementa la sensibilidad y la selectividad. Por esta técnica se ha cuantificado la HQ, usando una gran variedad de electrodos modificados. Algunos son: grafeno-quitosano [4], nanotubos de carbono [5, 6], poli(3,4-etilenedioxitiofeno) sobre electrodo de oro [7] y nanopartículas de oro [8]. Los cuales presentan límites de detección por debajo de 1,0 * 10
Parte experimental
Reactivos
El agua empleada para la preparación de disoluciones se obtuvo del sistema MiliQ. 18 MΩ cm. Las disoluciones de patrones con 2,0 * 10-3 y 2,0 * 10-5 mol L-1 de HQ se prepararon a partir del reactivo puro de Sigma-Aldrich. Las disoluciones de tampones de fosfato se prepararon a partir del ácido fosfórico y ajustando el pH requerido con disolución de NaOH 2,0 mol L-1 y diluyendo 10 veces con agua, LI: 1-etil-3-metilimidazolio trifluorometanosulfonato ([EMIM]F3MSO3), 1-butil-3-metilimidazolio tetrafluoroborato ([BMIM]BF4) y 1-butil-3-metilimidazolio hexafluorofosfato ([BMIM]PF6). Se obtuvieron de Merck: pureza del 99%, nanotubos de carbono de pared múltiple Ø 5-10 nm, altura 0,5-20 µm; pureza ≥ 95% y quitosano se adquirieron de Sigma-Aldrich.
Instrumentos y equipos
Para el desarrollo de las medidas voltamperométricas se utilizó un analizador voltamétrico VA Computrace (Metrohm). La celda consta de un sistema de tres electrodos: un electrodo de trabajo de carbono vítreo (GC, por sus siglas en inglés), un electrodo de referencia de Ag/AgCl/KCl 3 mol L-1, un alambre de platino como electrodo auxiliar y barra para agitación. En la preparación de los tampones se utilizó un pH-metro Orion 430 con electrodo de membrana de vidrio.
Procedimiento
En la celda electroquímica se agregó 9,0 mL de agua desionizada 18 MΩ cm y 1,0 mL de tampón; no es necesario desgasificar. Se trazó el blanco. Posteriormente, se agregó HQ entre 2,0 * 10
Preparación del electrodo de trabajo (Ch-MWCNT-LI-GCE)
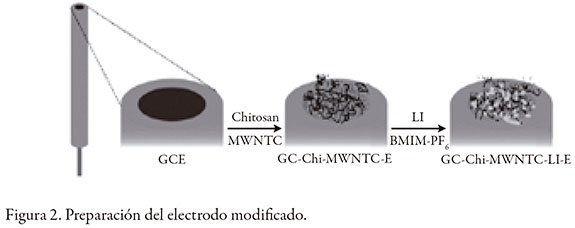
Antes de cada medición, el electrodo de carbono vítreo (GC) se pulió para limpiar completamente su superficie, utilizando sílice en suspensión (Al2O3) de 0,3 y 0,05 µm, se enjuagó con HNO3 0,3 mol L-1, agua y metanol durante cinco minutos en un baño ultrasónico, y se secó con N2. La preparación del electrodo modificado Ch-MWCNTIL fue desarrollado como reporta Nagles et al. [12]. El electrodo de carbono vítreo Ch-MWCNT-IL recién preparado se sometió a 10 ciclos de potencial entre 0,00 a 1,20 V (0,10 mV s-1) para obtener una superficie estable, reproducible y limpia. El mismo electrodo se usó en una serie de mediciones. La figura 2 muestra el proceso de modificación.
Resultados y discusión
Caracterización del electrodo de trabajo (Ch-MWCNT-LI-GCE) con HQ
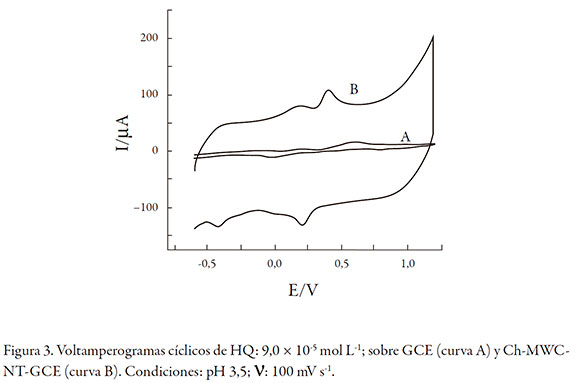
La respuesta de HQ sobre un electrodo de carbono vítreo modificado con Ch-MWCNT se muestra en la figura 3. Con 9,0 * 10-5 mol L-1 de HQ. En buffer acetato de pH 3,5 y velocidad de barrido (∨) de 100 mV s-1. Se observa claramente una señal de oxidación de HQ a 0,58 V y una señal de reducción a 0,02 V (curva A) con un ΔV de 0,56, indicando un proceso cuasi-reversible. Las señales de óxido-reducción de HQ 9,0 * 10-5 mol L-1 se incrementan más de 200% en la presencia del electrodo modificado con Ch-MWCNT (curva B). Por otro lado, la señal de oxidación cambia a 0,40 V y la de reducción a 0,23 V, con un ΔV de 0,17 V, indicando un proceso más reversible comparado con el electrodo sin modificar. Posiblemente, estos cambios de potencial a menos positivos y menos negativos pueden ser una evidencia de un proceso catalítico entre la HQ y la superficie del electrodo Ch-MWCNT-GCE.
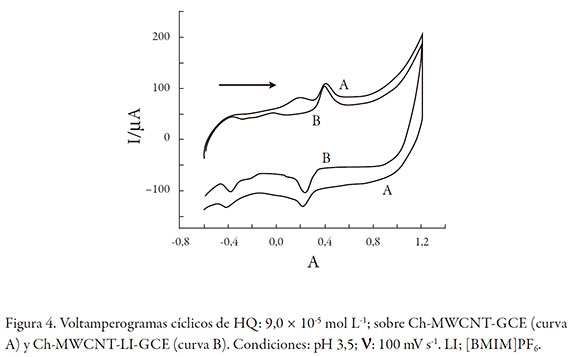
Cuando el Ch-MWCNT-GCE se modifica con LI ([BMIM]PF6), las señales presentan cambios en los potenciales y corrientes de óxido-reducción (figura 4). El ΔE cambia a 0,15 V, facilitando aún más el proceso de óxido-reducción de la hidroquinona. Por otro lado, los valores de corriente de oxidación y de reducción aumentaron casi 50% (figura 4, A y B), facilitando el depósito de hidroquinona sobre la superficie del electrodo o facilitando el transporte de carga. El electrodo de carbono vítreo modificado con Ch-MWCNT-LI se selecciona como el óptimo y se usó para todas las medidas. Estudios con otros líquidos iónicos con anión diferente como BF4 -, PF6 - y F3MSO3 -, en orden creciente de tamaño de anión respectivamente, mostraron que el PF6 - con tamaño mediano era el más favorable, ya que mejoraba la corriente y disminuía el ΔE. Se seleccionó como óptimo para todas las medidas.
Estudio en función del pH
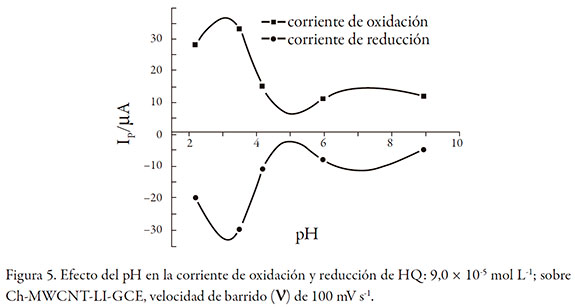
El pH es un parámetro importante que influye en la corriente y el potencial redox. La desprotonación de los dos grupos OH- de HQ produce la señal de oxidación y de reducción. A valores de pH mayores de 3,5 sucede la desprotonación química de dichos grupos disminuyendo la corriente. A valores de pH menores, la HQ está protonada y la corriente de oxidación se incrementa. Este estudio se realizó por (CV) con HQ: 9,0 * 10-5 mol L-1, y se varió el pH de la disolución entre 2,0 y 9,0 utilizando 1 mL de sistema tampón (H3PO4/H2PO4 -), (CH3COOH/CH3COO-) y (NH3/NH4 +) de concentración 0,1 mol L-1. Se aplicó una velocidad de barrido (∨) de 100 mV s-1. Los resultados se presentan en la figura 5. Como se muestra, la mayor corriente de pico se obtuvo a pH 3,2 y luego a pH mayores decrece rápidamente. Este valor de pH fue usado en los estudios posteriores.
Efecto de la velocidad de barrido (∨)
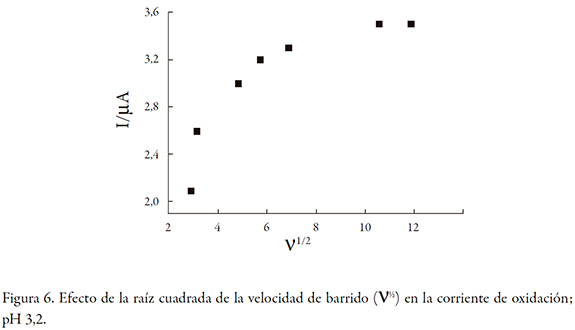
La figura 6 muestra el efecto de la raíz cuadrada de la velocidad de barrido (∨)½ sobre la corriente de pico de HQ: 9,0 * 10-5 mol L-1. Los resultados muestran un incremento proporcional de la corriente de pico entre 3,0 y 7,0 (∨)½. Esto indica que el proceso electroquímico es controlado por difusión. A valores mayores de (∨)½ la corriente de pico decrece, indicando que la transferencia de carga no es rápida. Resultados similar a los reportados por Liu et al. [9].
Estudio en función del potencial de adsorción (Eads)
Este estudio se realizó utilizando HQ: 9,0 * 10-5 mol L-1, y se varió el potencial de adsorción entre 0,0 y 0,9 V por voltamperometría de onda cuadrada (SWAdV), mientras las otras condiciones permanecieron constantes: pH 3,2; tads 60 s. La corriente de pico aumenta hasta un potencial de adsorción de 0,10 V para luego decrecer proporcionalmente. El valor de 0,10 V fue elegido para las posteriores mediciones.
Estudio en función del tiempo de acumulación (tads)
En este estudio se utilizó HQ: 1,65 * 10-6 mol L-1, y se varió el tiempo de adsorción entre 0,0 y 100 s por voltamperometría de onda cuadrada (SWAdV), mientras las otras condiciones permanecieron constantes: pH 3,2; Eads: 0,10 V. La corriente de pico aumenta con el tads hasta 60 s y luego decrece ligeramente, tal vez por la saturación de la superficie del electrodo. Se escogió el tads de 60 s.
Parámetros de la técnica en la etapa de barrido
La onda cuadrada se optimizó con una frecuencia de 15 Hz, un potencial del escalón de 4 mV y una amplitud del pulso de 40 mV. A otros valores diferentes se pierde la forma del pico de oxidación.
Construcción de curva de calibración
La figura 7 muestra los voltamperogramas de adsorción en función de la concentración de HQ sobre Ch-MWCNT-LI-GCE. Condiciones experimentales: pH 3,2 (100 µL de tampón fosfato 0,4 mol L-1); tads: 60 s y Eads: 0,10 V.
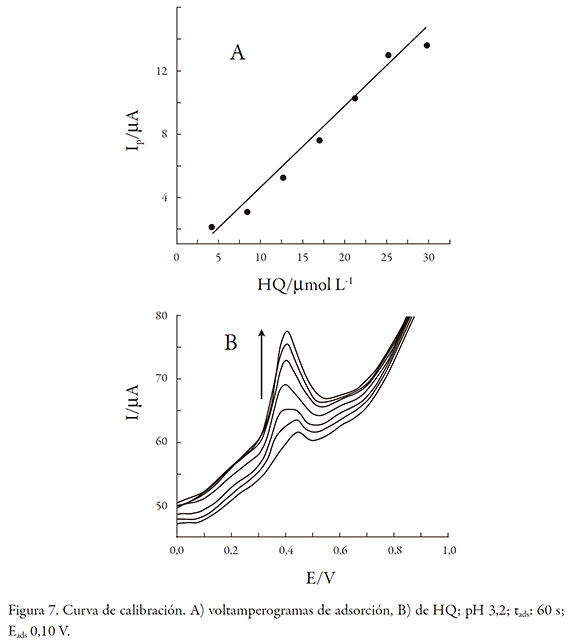
La curva de calibrado de HQ tiene un rango de concentración entre 4,20 * 10-6 y 30,0 * 10-5 mol L-1. La precisión expresada como la desviación estándar relativa (RSD, por sus siglas en inglés) fue de 1,5% para siete medidas consecutivas de la misma muestra, con un contenido de 1,0 * 10-4 mol L-1 de HQ. El límite de detección (LD), según el método de Miller y Miller [13], fue de 2,45 * 10
Validación y estudio de interferencias
Se validó la metodología usando muestras dopadas de agua MilliQ con 5,0 * 10-6 mol L-1 de HQ. Cuantificando por el método de adición de estándar se obtuvieron valores entre 4,2 y 3,7 * 10-6 mol L-1 con un error relativo de -13%. Colorantes como amaranto y tartracina no interfieren. Por otro lado, la presencia de catecol interfiere con el análisis de HQ por el método propuesto. La optimización del electrodo puede ser usada en otro tipo de matrices y su estudio quedaría abierto a futuras investigaciones.
Conclusiones
El electrodo modificado con Ch-MWCNT-LI-GCE es muy conveniente para la cuantificación de HQ. El método propuesto es sencillo, de bajo costo y es conveniente para determinar la HQ en matrices que contienen colorantes o en fármacos usados en dermatología.
Agradecimientos
Los autores agradecen a la Universidad de Ibagué, por su apoyo a la investigación con el proyecto 15-343-INT, y a la Universidad de la Amazonia, por el proyecto de semillero de electroquímica.
Referencias
1. H. Kunyun, W. Xingsheng, M. Xianghai, Z. Haitao, S. Shin-ichiro, Amperometric determination of hydroquinone and catechol on gold electrode modified by direct electrodeposition of poly(3,4-ethylenedioxythiophene), Sensors and Actuators B, 193, 212 (2014). [ Links ]
2. G. Marrubini, E. Calleri, T. Coccini, A. Castoldi, L. Manzo, Direct analysis of phenol, catechol and hydroquinone in human urine by coupled-column HPLC with fluorimetric detection, Chromatographia, 62, 25 (2005). [ Links ]
3. A. Afkhami, H. Khatami, Indirect kinetic-spectrophotometric determination ofresorcinol, catechol, and hydroquinone, J. Anal. Chem., 56, 429 (2001). [ Links ]
4. H. Yina, Q. Zhang, Y. Zhoud, Q. Ma, T. Liu, L. Zhu, S. Ai, Electrochemical behavior of catechol, resorcinol and hydroquinone at graphene-chitosan composite film modified glassy carbon electrode and their simultaneous determination in water samples, Electrochim. Acta, 56, 2748 (2011). [ Links ]
5. C. Bu, X. Liu, Y. Zhang, L. Li, X. Zhou, X. Lu, A sensor based on the carbon nanotubes-ionic liquid composite for simultaneous determination of hydroquinone and catechol, Colloids and Surfaces B: Biointerfaces, 88, 292 (2011). [ Links ]
6. X. Feng, W. Gao, S. Zhou, H. Shi, H. Huang, W. Song, Discrimination and simultaneous determination of hydroquinone and catechol by tunable polymerization of imidazolium-based ionic liquid on multi-walled carbon nanotube surfaces, Anal. Chim. Acta, 805, 36 (2013). [ Links ]
7. K. He, X. Wang, X. Meng, H. Zheng, S. Suye, Amperometric determination of hydroquinone and catechol on gold electrode modified by direct electrodeposition of poly(3,4-ethylenedioxythiophene), Sensors and Actuators B, 193, 212 (2014). [ Links ]
8. S. Hu, Y. Wang, X. Wang, L. Xu, J. Xiang, W. Sun, Electrochemical detection of hydroquinone with a gold nanoparticle and graphene modified carbon ionic liquid electrode, Sensors and Actuators B, 168, 27 (2012). [ Links ]
9. X. Liu, Z. Ding, Y. He, Z. Xue, X. Zhao, X. Lu, Electrochemical behavior of hydroquinone at multi-walled carbon nanotubes and ionic liquid composite film modified electrode, Colloids and Surfaces B: Biointerfaces, 79, 27 (2010). [ Links ]
10. W. Sun, Y. Wang, Y. Lu, A. Hu, F. Shi, Z. Sun, High sensitive simultaneously electrochemical detection of hydroquinone and catechol with a poly(crystal violet) functionalized graphene modified carbon ionic liquid electrode, Sensors and Actuators B, 188, 564 (2013). [ Links ]
11. N. Guzmán, J. Fernández, M. Parada, C. Orbegozo, M. Rodríguez, A. Padrón, Cation, anion and co-ion effect on the aggregation of ionic liquids in aqueous solution, Quim. Nova, 33, 1703 (2010). [ Links ]
12. É. Nagles, P. álvarez, V. Arancibia, M. Báez, V. Garretón, N. Ehrenfeld, Amperometric and voltammetric determination of oxytetracycline in trout salmonid muscle using multi-wall carbon nanotube, ionic liquid and gold nanoparticle film electrodes, Int. J. Electrochem. Sci., 7, 11745 (2012). [ Links ]
13. J.C. Miller, J.N. Miller, "Estadística y quimiometría para química analítica", 4a ed., Addison-Wesley, Madrid, 2002, pp. 124-125. [ Links ]














