Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.3 Bogotá Sept./Dec. 2015
https://doi.org/10.15446/rcciquifa.v44n3.56284
DOI: http://dx.doi.org/10.15446/rcciquifa.v44n3.56284
Usos terapeuticos potenciales de los antagonistas opioides: Fisiopatologia y evidencia preclinica
Potential therapeutic uses of opioid antagonists: Pathophysiology and preclinical evidence
Mauricio O. Nava-Mesa a
Daniel Rojas-Kozhakin a
Carlos A. Calderon-Ospina c
a Escuela de Medicina y Ciencias de la Salud. Unidad de Neurociencia, Grupo de Investigacion en Neurociencia (Neuros). Universidad del Rosario. Carrera 24 No 63C-69. Bogota, D. C., Colombia. Correos electronicos: mauricio.nava@urosario.edu.co y rojask.daniel@urosario.edu.co
b Toxicologa Clinica Universidad del Rosario. Residente de Farmacologia Clinica Universidad de La Sabana. Correo electrónico: tellez.angelica@urosario.edu.co
c Escuela de Medicina y Ciencias de la Salud. Unidad de Farmacologia, Universidad del Rosario. Carrera 24 No 63C-69. Bogota, D. C., Colombia. Correo electrónico: carlos.calderon@urosario.edu.co.
Recibido para evaluacion: 5 de noviembre de 2014.
Aceptado para publicacion: 11 de octubre de 2015.
Resumen
El sistema opioide, del cual forman parte los peptidos opioides endogenos y sus receptores (Miu, Kappa, delta y ORL), tiene un papel importante en la fisiologia de diferentes sistemas. Existe una creciente evidencia de su participacion en la fisiopatologia de multiples trastornos del sistema nervioso central, endocrino e inmunologico. La modulacion del sistema opioide mediante el uso de antagonistas especificos o inespecificos de sus receptores puede tener un papel terapeutico en el manejo sintomatico de diferentes contextos, incluyendo la intoxicacion aguda por opiaceos, la dependencia a opioides, y la reduccion de reacciones adversas de agonistas opioides utilizados en el manejo del dolor cronico. El presente trabajo tiene como objetivo revisar la farmacologia de los antagonistas opioides especificos e inespecificos, y realizar una actualizacion de sus posibles nuevas indicaciones y usos terapeuticos.
Palabras clave: antagonistas opiaceos, sistema opioide, trastornos relacionados con el sistema opioide.
Summary
Opioid system, which involved endogenous opioid peptides and their receptors (Miu, Kappa, delta and ORL), has a main role in the physiology of several systems. At the same time, there is cumulating evidence in the role of the opioid system in the physiopathology of several disorders in the central nervous, endocrine and immunological system. The modulation of the opioid system using nonspecific antagonists may have a therapeutic role in the symptomatic management of several diseases, as well as, in the emergency management of opioid analgesic overdose, opioid dependence and to reduce the drug side effects of the opioid agonists used in chronic pain. This paper aims to review the pharmacology of specific and nonspecific opioid antagonists, and update on possible new indications and therapeutic uses of such antagonists.
Key words: Opiate antagonist, opioid system, opioid-related disorders.
Introduccion
La palabra opium proviene del griego opos que significa 'jugo', haciendo referencia al jugo derivado de la planta Papaver somniferum. A pesar de la gran controversia con el uso de los terminos, opiaceo hace referencia a los alcaloides derivados de la morfina y del opio, que pueden ser de origen natural o sintetico; mientras que los peptidos opioides endogenos son los ligandos naturales para los receptores opioides [1]. Se han identificado tres familias diferentes de opioides endogenos: endorfinas, encefalinas y dinorfinas, cada una derivada de polipeptidos diferentes. Las endorfinas derivadas de la prepropiomelanocortina, las encefalinas de la preproencefalina y la dinorfina de la preprodinorfina. En anos recientes se han descrito nuevos peptidos opioides (nociceptina/orfanina y endomorfina) con propiedades diferentes a los tres peptidos opioides ya descritos [2, 3]. Gran parte de los efectos fisiologicos de estos opioides endogenos involucra los sistemas de modulacion del dolor, de tal manera que los opiaceos han sido ampliamente utilizados como analgesicos. Uno de los primeros y mas utilizados de dichos analgesicos es la morfina, la cual fue aislada por Serturner en 1806 [4]. A pesar de sus efectos adversos y potencial adictivo, es uno de los analgesicos mas utilizados. Por otro lado, en 1942 Weijlard y Erikson desarrollaron la nalorfina, farmaco con capacidad de revertir la depresion respiratoria producida por la morfina y acelerar el sin drome de abstinencia, conservando un efecto analgesico menor; es el primer opioide con accion agonista-antagonista mixta [4]. Gran parte de los antagonistas opioides son utilizados en la practica clinica cotidiana, con el fin de revertir los efectos adversos generados por la intoxicacion por opiaceos; sin embargo, dada la distribucion del sistema opioide (opioides y sus receptores) en el sistema nervioso, asi como la diversidad de sus funciones fisiologicas y, finalmente, su papel en la fisiopatologia de multiples trastornos, hace que los antagonistas de los receptores opioides puedan tener muchas indicaciones en diferentes enfermedades y trastornos del sistema nervioso central y periferico. La presente revision tiene como objetivo actualizar la farmacologia basica de los antagonistas opioides, con enfasis en la identificacion de nuevos ÂgblancosÂh de accion farmacologicos en aquellas entidades clinicas, cuya fisiopatologia involucra el sistema opioide. Ademas, se discutiran posibles usos en dichas patologias y se senala el estatus de desarrollo clinico actual.
Efectos fisiologicos de los opioides
Los opioides actuan sobre los receptores µ (Miu), κ (Kappa), δ (delta) (OPRM, OPRK y OPRD) y ORL-1 (opioid receptor like-1). Estos receptores pertenecen a la familia de receptores acoplados a proteina Gi; de esta manera, inhiben la adenilciclasa y canales de calcio dependientes de voltaje y estimulan canales de potasio y la fosfodiesterasa C. Al disminuir el AMPc intracelular, los opioides modulan la liberacion de neurotransmisores como la sustancia P, GABA, dopamina, acetilcolina y norepinefrina y ejercen una variedad de efectos dependiendo del tipo de receptor estimulado [5].
La estimulacion de receptores δ ha sido asociada con efectos antinociceptivos y estimulantes del apetito. La de receptores µ con analgesia, euforia, depresion respiratoria, miosis, disminucion de la motilidad gastrointestinal, supresion de la tos, sedacion, somnolencia y dependencia fisica [6].
Los receptores κ, al igual que los receptores µ, inducen analgesia, miosis y depresion respiratoria, pero tambien se han asociado con disforia, efectos psicomimeticos y trastornos del animo (estres, depresion y ansiedad). Por ultimo, los receptores ORL-1 participan en una variedad de funciones biologicas a nivel cardiovascular, renal, gastrointestinal y en procesos como nocicepcion, memoria y ansiedad [6].
Cronicamente, la estimulacion de receptores desencadena tolerancia, hiperalgesia y dependencia. Estas condiciones se presentan por regulacion a la baja y desensibilizacion de los receptores, incremento del AMP ciclico intracelular [5, 7] y un efecto excitatorio por acople a la subunidad Gs del receptor opioide [8].
En la tabla 1 se enumeran algunos de los efectos de farmacos opioides con el mecanismo involucrado.

Antagonistas opioides
Una variedad de agentes se une competitivamente a uno o mas de los receptores opioides, despliegan poca o ninguna actividad intrinseca y antagonizan de manera robusta los efectos de los agonistas de receptores (figura 1).

En algunos casos se producen congeneres que son antagonistas competitivos en los receptores µ, pero tienen acciones agonistas en los κ. Nalorfina y levalorfan tienen tales propiedades. Otros congeneres, especialmente naloxona y naltrexona, parecen estar desprovistos de acciones agonistas e interactuan con todos los tipos de receptores opioides, aunque con afinidades diferentes. Por otro lado, nalmefeno es un antagonista µ relativamente puro que es mas potente que la naloxona.
Una variedad de antagonistas no peptidicos han sido desarrollados, que son relativamente selectivos por tipos individuales de receptores opioides. Estos incluyen ciprodima y β funaltrexamina, para µ; naltrindol para δ; y norbinaltorfimina para κ, aunque estos agentes no estan en uso clinico actualmente [17].
Quimica de los antagonistas opioides
Cambios en la estructura de un opioide pueden convertir un farmaco que es un agonista, en otro con acciones antagonistas en uno o mas tipos de receptores opioides. La mas comun de tales sustituciones es la de un grupo quimico grande (p. ej., un grupo alil o metilcicropropil) por el grupo N-metil que es tipico de los agonistas µ. Tales sustituciones transforman la morfina en nalorfina, levorfanol en levalorfan y la oximorfona en naloxona o naltrexona. La naloxona es un derivado N-alil de oximorfona y la naltrexona es derivada de la tebaina con una estructura muy similar a la oximorfona [17].
De la naltrexona se deriva un antagonista de receptores opioides perifericos llamado metilnaltrexona. Este farmaco posee un grupo metilo con un nitrogeno, caracteristica quimica que incrementa su polaridad, reduciendo el paso a traves de la barrera hematoencefalica. La metilnaltrexona an tagoniza el receptor µ periferico y tiene una menor afinidad por los receptores κ y δ [22]. El alvimopan es otro antagonista de receptores perifericos, con mayor selectividad sobre receptores µ que la metilnaltrexona. El alvimopan es un compuesto cuaternario, con una forma zwitterionica que le brinda alto peso molecular y mayor polaridad [22, 23].
El nalexol es un antagonista de receptores µ perifericos que se encuentra en fase III de desarrollo. Es un derivado pegilado de la naloxona y sustrato de la glicoproteina-P, lo que limita su paso a traves de la barrera hematoencefalica [21].
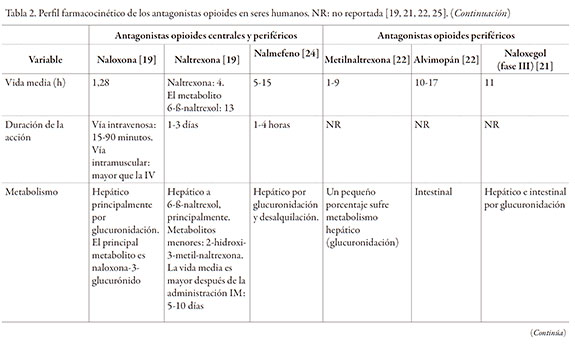
En la tabla 2 se resume el perfil farmacocinetico en humanos de diferentes antagonistas opioides. La farmacocinetica de antagonistas selectivos del receptor κ publicada, se ha determinado en modelos murinos.


Efectos farmacologicos de los antagonistas
La naloxona, el nalmefeno y la naltrexona son antagonistas opioides puros; sin embargo, existen algunas diferencias clinicas entre ellos. La naloxona y el nalmefeno revierten efectos clinicos y toxicos de los opioides; pero el antagonismo del nalmefeno a diferencia del ejercido por la naloxona, es al menos 5 a 10 veces mas prolongado. De esta manera, el nalmefeno revierte la depresion respiratoria, hipotension y sedacion, pero tambien la analgesia inducida por opioides. Por su parte, la naltrexona revierte efectos clinicos pero no toxicos. Esto es explicado porque la naltrexona desplaza a opioides endogenos y agonistas opiaceos a dosis terapeuticas; sin embargo, a dosis extremadamente altas, los opioides pueden desplazar a la naltrexona de los receptores [24].
Naloxona, naltrexona y nalmefeno pueden desencadenar sindrome de abstinencia en pacientes con dependencia a opioides, pero ninguno de estos medicamentos presenta fenomenos de tolerancia ni dependencia fisica o psicologica [24].
La administracion de antagonistas opioides reduce la prevalencia y gravedad de efectos indeseables de opioides como estrenimiento, ileo posoperatorio y vomito. El uso de naloxona para disminuir las reacciones adversas gastrointestinales se encuentra limitado, porque las dosis necesarias para revertir estos efectos son altas y disminuyen el efecto analgesico de los opioides, a diferencia de antagonistas como el alvimopan y metilnaltrexona, cuya actividad antagonista se encuentra restringida a receptores µ perifericos del tracto gastrointestinal, y de esta manera mejoran los sintomas gastrointestinales sin afectar la efectividad antinociceptiva de los opioides. Estos antagonistas perifericos tambien parecen disminuir la retencion urinaria y el prurito inducido por opioides, aunque esta es una reaccion adversa mediada por un efecto principalmente central [22].
La modulacion de otros efectos inducidos por opioides sobre la angiogenesis y alteraciones inmunologicas tambien ha sido materia de estudio en el uso de antagonistas opioides. Sobre la angiogenesis, los peptidos opioides presentan efectos estimulantes, incrementando la proliferacion, migracion y adhesion de celulas endoteliales. Esto es preocupante en pacientes con cancer que frecuentemente reciben opioides como terapia analgesica. La naloxona puede antagonizar estos efectos al coadministrarse con agonistas opioides, pero no ha mostrado efectos antiangiogenicos por si sola [26].
Respecto al sistema inmune, la morfina ha mostrado inducir inmunosupresion severa al intervenir en la inmunidad innata y adaptativa, contribuyendo a la insuficiente depuracion bacteriana y pobre curacion de heridas [27]. Por otra parte, opioides como la morfina y la metadona, parecen promover la inefectividad del tratamiento antirretroviral, por inhibicion de la secrecion de citoquinas que inhiben la expresion del virus de inmunodeficiencia humana y por estimulacion de la expresion de correceptores CCR5 y CCR3, importantes en el proceso de entrada del virus a los linfocitos T. La metilnaltrexona, naltrexona y s-funaltrexamina han demostrado antagonizar la replicacion de CCR5 por antagonismo sobre receptores [28].
A pesar de que a dosis altas, la naloxona disminuye el efecto analgesico, a dosis bajas, antagonistas opioides como naloxona y naltrexona potencian el efecto analgesico de un opioide coadministrado. El efecto de potenciacion analgesica es secundario a la inhibicion de la respuesta excitatoria inducida por la exposicion prolongada a opioides y que genera fenomenos como tolerancia, dependencia e hiperalgesia. El mecanismo por el que el antagonista opioide a dosis bajas produce mayor acople del receptor opioide por la proteina G inhibitoria (Gi) que por Gs, es su mayor afinidad por la filamina A que por el receptor opioide. La filamina A es una proteina que interfiere con el acople a Gs, generando una respuesta inhibitoria y mejorando la respuesta antinociceptiva del opioide coadministrado [19].
Otro mecanismo que podria explicar los efectos de potenciacion analgesica de la naloxona, es una accion antiinflamatoria en la glia de la medula espinal [29], a traves de la inhibicion del receptor toll-like 4 de celulas gliales que normalmente se encuentra asociado a transmision glutamatergica [19]. El incremento de glutamato, en casos de exposicion prolongada a morfina, se asocia a la activacion de celulas gliales, sobre expresion de glutamato, fenomenos de hiperalgesia, tolerancia, dependencia y depresion respiratoria inducidas por opioides [30, 31]. La coadministracion de dosis bajas de naloxona con morfina revierte la expresion de transportadores de glutamato, inhibe la expresion de receptores NMDA e inhibe la activacion glial, conservando los efectos antinociceptivos de la morfina [30].
Ademas, existe evidencia de que la naloxona a dosis bajas suprime la neuroinflamacion inducida por la administracion de opioides al incrementar la expresion de citoquinas antiinflamatorias como la IL-10 y mitigar la sobrerregulacion de citoquinas proinflamatorias como IL-1s, inhibir la activacion del NF-κβ y de canales de calcio tipo L activados en la respuesta inflamatoria [32, 33].
Bajo circunstancias ordinarias, los antagonistas opioides producen pocos efectos en ausencia de un agonista exogeno. En el sistema endocrino, la administracion de naloxona o maltrexona, por ejemplo, incrementa la secrecion de la hormona liberadora de gonadotrofinas y de corticotropinas, elevando las concentraciones de LH, FSH, ACTH y hormonas esteroideas. De esta manera, inducen la liberacion de prolactina en mujeres y la secrecion de cortisol y catecolaminas asociadas a situaciones como estres y ejercicio [17].
Cuando los sistemas opioides endogenos estan activados, la administracion de un antagonista opioide puede tener consecuencias visibles. El uso de naloxona en choque septico, por ejemplo, incrementa la presion arterial, preserva la perfusion tisular y alivia la hipoxia tisular [33]. Por otra parte, el uso de antagonistas del receptor . en trastornos adictivos y del animo en modelos animales, genera efectos ansioliticos y antidepresivos.
Actualmente se encuentra en etapa clinica fase I, el primer estudio sobre el uso de JDTic (antagonista del receptor .) en seres humanos. Este estudio pretende evaluar la seguridad, tolerabilidad y farmacocinetica de dosis orales unicas de JDTic para, posteriormente, poder evaluar su eficacia en pacientes con dependencia a la cocaina [34].
Efectos adversos
La naloxona puede inducir agitacion, alteraciones cardiovasculares (hipotension o hipertension, arritmias), disnea, edema pulmonar y sindrome de abstinencia a opioides en pacientes dependientes [35]. Con naltrexona se han descrito alteraciones neurologicas (cefalea, insomnio, confusion, alucinaciones), alteraciones gastrointestinales y anafilactoides. En dosis elevadas, la naloxona puede inducir toxicidad hepatica, reportandose casos de elevacion de transaminasas, hepatitis y lesion hepatocelular [35].
Las reacciones adversas presentadas con antagonistas opioides perifericos y con el naloxegol son gastrointestinales, principalmente (dolor abdominal, flatulencia, diarrea y nauseas). La metilnaltrexona se ha asociado a hipotension ortostatica, reaccion autolimitada y dosis dependiente, por lo que la dosis maxima sugerida es de 0,3 mg/kg [32]. Por otra parte, el alvimopan frente al placebo mostro un incremento en la incidencia de neoplasias e infarto agudo de miocardio en estudios clinicos a largo plazo [32].
Aplicaciones clinicas de los antagonistas opioides
La mala prescripcion, el abuso, asi como el creciente uso de los opiaceos en la practica clinica cotidiana, se relacionan con la sobredosis de los analgesicos opioides [36, 37]. De esta manera, una de las primeras indicaciones para el uso de los antagonistas opioides es, precisamente, el manejo de la intoxicacion con opiaceos, siendo la naloxona el farmaco de eleccion [38]. Asimismo, se ha reportado que el mismo farmaco puede ayudar a prevenir el deterioro memoristico en pacientes sometidos a terapia electroconvulsiva y en pacientes que toman opioides cronicamente [39, 40]. Por otro lado, junto con otros antagonistas (p. ej., buprenorfina y naltrexona), los antagonistas pueden ser utilizados como coadyuvantes en el manejo de la adiccion a los opioides, adiccion al alcohol e incluso, segun reportes aislados, en la dependencia a la ketamina [41-45]. Respecto a la naltrexona a bajas dosis, se han reportado beneficios sintomaticos en el caso de la enfermedad de Crohn, fibromialgia, esclerosis multiple y en otras enfermedades inflamatorias y autoinmunes. No hay evidencia significativa de que dicho tratamiento basado en antagonistas opioides pueda cambiar el curso natural de las patologias mencionadas anteriormente; sin embargo, puede ser una herramienta util para reducir el numero de agudizaciones y exacerbaciones. Finalmente, el uso combinado de los agonistas junto con los antagonistas de receptores opioides puede reducir los efectos adversos de dichos agonistas [46-54]. Al final de este capitulo, se discutira la evidencia clinica y el uso tradicional de los antagonistas opiaceos en indicaciones ya aprobadas.
Otras aplicaciones
A continuacion presentamos evidencia tanto clinica como experimental de otros posibles usos terapeuticos de los antagonistas opioides.
Amenorrea por ejercicio
Se sabe que el sistema opioide tiene un efecto regulador de la actividad del eje hipotalamo- hipofisis-adrenal. Gran parte de dicha regulacion depende del tipo de receptor activado. Por ejemplo, la administracion de morfina por via intracerebroventricular induce la activacion del eje, incrementando los niveles de hormonas tales como la corticosterona. Sin embargo, la endomorfina tipos 1 y 2 (EM-1 y EM-2) no genera dichos cambios, a pesar de ser un agonista de los receptores µ [55, 56]. Curiosamente, la administracion de antagonistas opiaceos inespecificos, genera activacion de dicho eje, con la consecuente liberacion de hormonas tanto hipotalamicas como hipofisarias [57, 58]. Por tanto, en terminos generales, se considera que el sistema opioide es un regulador negativo de la respuesta del eje, por ejemplo frente a condiciones estresantes [59]. El papel de los antagonistas opiaceos sobre la actividad de las hormonas sexuales se ha evaluado tanto en estudios clinicos como en modelos animales. La administracion aguda de naloxona incrementa los niveles de hormona luteinizante (LH, por sus siglas en ingles) y testosterona, plasmaticos de manera de dosis dependiente; mientras los niveles de hormona foliculo estimulante (FSH, por sus siglas en ingles) no son modificados en modelos animales [60]. Estudios clinicos confirman que efectivamente los niveles de LH son incrementados frente a la administracion aguda de naloxona en sujetos sanos [61]. Aparentemente, dichos efectos son independientes de la accion de la hormona liberadora de gonadotropina (GnRH, por sus siglas en ingles) sobre la adenohipofisis [62], lo cual indica una modulacion directa del sistema opioide sobre la liberacion de LH. La amenorrea, asi como la menarquia tardia que se presenta en atletas de alto rendimiento, pueden ser explicadas por varios factores, entre los que se encuentran los cambios nutricionales, factores psicologicos relacionados con el estres, disfuncion hipotalamica y, finalmente, un incremento en la actividad del sistema opioide [63, 64]; todos estos factores en conjunto afectan la liberacion de LH, asi como de estrogenos y de GnRH. Por lo cual, resulta logico pensar que el antagonismo del sistema opioide podria incrementar la liberacion de gonadotrofinas, y por tanto, tener un papel en el tratamiento de la amenorrea inducida por ejercicio. Sin embargo, estudios clinicos indican que el bloqueo de opioides por medio de naloxona no modifica los niveles de gonadotrofinas ni prolactina en este grupo de pacientes en comparacion con atletas eumenorreicos [65] ni tampoco al compararlo con controles [66]. Asi, el uso de antagonistas tales como naltrexona para el manejo de la amenorrea inducida por ejercicio o de otros disturbios ginecologicos, puede involucrar otros grupos de hormonas como la ACTH y cortisol [67], o involucrar mecanismos metabolicos [68] que restablecen el ciclo menstrual normal.
Disquinesia
Dado que el sistema opioide participa activamente en la regulacion del circuito dopaminergico mesolimbico de recompensa [69], y que la activacion de los receptores opioides (p. ej., µ y δ) incrementan los niveles de dopamina en el nucleo accumbens [70], no resulta improbable que el sistema opioide pueda ser un blanco terapeutico para pacientes con enfermedad de Parkinson. Estudios mediante imagenes funcionales en humanos [71], asi como en modelos animales [72], indican una desregulacion del sistema opioide en la enfermedad de Parkinson (EP), asi como mecanismos compensatorios generados por dicho sistema en los ganglios basales que pueden explicar parte de la fisiopatologia de la enfermedad [73]. No hay evidencia del uso de antagonistas opioides para el manejo de la EP; sin embargo, en el caso de la disquinesia inducida por levodopa [74], estudios en primates indican una mejoria clinica con el uso de antagonistas especificos para µ (cyprodime) y δ (naltrindole), sin afectar los efectos antiparkinsonianos de la misma levodopa [75], lo cual podria tener utilidad clinica para el manejo de las reacciones adversas de pacientes tratados con levodopa a largo plazo. Desafortunadamente, el uso de antagonistas inespecificos (naloxona y naltrexona) para el manejo de la disquinesia inducida por levodopa no ha presentado utilidad clinica en humanos [76]. Nuevamente, estudios en macacos indican que los antagonistas especificos para µ (ADL5510) son candidatos excelentes como antidisquineticos en pacientes con EP tratados cronicamente con levodopa [77]; sin embargo, hasta el momento no hay evidencia clinica que apoye su uso.
Epilepsia
Multiples estudios indican que el sistema opioide participa en la fisiopatologia de la epilepsia, y de ese mismo modo puede ser un blanco terapeutico susceptible de modulacion [78, 79]. Paradojicamente, la administracion de agonistas opioides (p. ej., morfina) ha mostrado efectos tanto proconvulsivantes como anticonvulsionantes dependiendo de la via de administracion [80] y del nivel de neurodesarrollo de los sujetos [81]. Dicho efecto es, en parte, explicado por sus efectos sobre los receptores µ y κ, y el sistema GABAergico. Estudios electrofisiologicos in vitro indican que la activacion de los receptores κ aumentan la excitabilidad de las celulas del giro dentado del hipocampo [82], y de hecho, se ha descrito un incremento de la inmunorreactividad de dinorfina en las recurrentes excitatorias del hipocampo en sujetos con epilepsia del lobulo temporal tras su estudio histopatologico [83]. De esta manera, la modulacion de dicho receptor puede ser blanco farmacologico frente a crisis epilepticas, cuyo foco se localiza en dicha estructura. Se ha descrito, igualmente, que los modelos animales de induccion de convulsiones mediante acido kainico, la modulacion ya sea del receptor κ [84] o del receptor ORL (nociceptina/orfanina) [85], puede tener repercusiones sobre la neurodegeneracion inducida por dichos modelos de epilepsia. Por lo anteriormente expresado, el antagonismo de dichos receptores puede tener efectos antiepilepticos. De hecho, se ha descrito que los antagonistas opiaceos inespecificos tienen efectos anticonvulsionantes en multiples modelos animales [86], aunque tambien pueden revertir los efectos anticonvulsionantes en otros modelos experimentales [87, 88]. Teniendo en cuenta el papel de los receptores opioides durante y despues de una crisis epileptica [89], otro de los posibles usos de los antagonistas opioides es, precisamente, el manejo del estado postictal [90]. Estudios experimentales resaltan el papel de los antagonistas especificos de los receptores µ (CTAP), asi como el uso de los antagonistas inespecificos para reducir el estado postictal [91, 92]. Por lo cual, los efectos tanto del sistema opioide como de sus antagonistas han mostrado resultados paradojicos en cuanto a su papel terapeutico en la epilepsia; por tanto, se considera que se deben realizar mas estudios sobre el papel del sistema opioide endogeno en la fisiopatologia de la epilepsia y de las crisis convulsivas en general.
Enfermedad de Alzheimer
El sistema opioide se encuentra expresado en estructuras que participan en el procesamiento cognitivo como el sistema limbico [93, 94]. Dentro de dicho sistema, el hipocampo es una estructura que es susceptible de lesion en enfermedades neurodegenerativas tan comunes como la enfermedad de Alzheimer (EA) [95] y explica gran parte de la sintomatologia de dichos pacientes. Diferentes estudios indican que el sistema opioide se encuentra alterado en algunas enfermedades neurodegenerativas como la EA [96, 97] y que, ademas, este sistema puede estar involucrado en la fisiopatologia de dicha demencia [98]. A pesar de la gran cantidad de evidencia experimental, no es claro si dichos cambios en el sistema opioide forman parte de la cascada que induce el deficit cognitivo o si es un mecanismo compensatorio frente a la neurodegeneracion. En este sentido, gran parte de la evidencia indica que la activacion del sistema opioide endogeno puede explicar parte del deficit cognitivo. Se ha reportado una sobreexpresion de los niveles de encefalina en el hipocampo de animales transgenicos que producen grandes cantidades de proteina humana PPA (proteina precursora del amiloide) [97, 99]. Por otro lado, en un interesante estudio de Meilandt et al. [100], se ha encontrado que dicha sobreexpresion de encefalina se presenta en tejido cerebral humano de pacientes con EA, y que la expresion de precursores opioides (preproencefalina), asi como de met-encefalina se relacionan con las alteraciones cognitivas y comportamentales en animales transgenicos como modelo de EA. Dicha afirmacion se basa en que el uso del antagonista para los receptores µ (β-funaltrexamine) puede revertir dichos efectos [100]. Asimismo, se ha planteado que los antagonistas . pueden prevenir la neurodegeneracion [101]; sin embargo, estudios clasicos con naltrexone en sujetos con alzheimer [102, 103] no han revelado una mejoria clinica significativa. Por ultimo, el antagonista altamente selectivo de receptores opioides tipo δ (naltridone), atenua el deficit cognitivo en modelos murinos de EA [104]. Evidencia reciente, indica que farmacos con actividad selectiva para diferentes tipos de neurotransmisores seran utilizados para atenuar el deficit cognitivo de los pacientes con alzheimer en fases tempranas [105, 106], asi como en deficit cognitivo leve, el cual se considera un estado previo al desarrollo de la enfermedad. Sin embargo, gran parte de dichos estudios son ensayos clinicos en fases preliminares y se requieren estudios con una poblacion mucho mayor.
Dolor
Dentro de los sistemas de modulacion del dolor, se han descrito diferentes estructuras del sistema nervioso central que participan activamente en dicho proceso: amigdala, corteza cingulada rostral anterior, sustancia gris periacueductal, locus ceruleus y medula rostral ventral, entre otros [107]. La mayoria de las neuronas que conforman dichas estructuras, son productoras de opioides endogenos e, igualmente, expresan receptores opioides [108, 109]. Una de las estructuras mas estudiadas en cuanto al procesamiento modulatorio descendente del dolor es la sustancia gris periacueductal; estudios clasicos indican que los efectos antinociceptivos de la estimulacion electrica de dicha region pueden ser revertidos por naloxona [110], lo cual indica que la activacion del sistema opioide endogeno es necesaria para la modulacion descendente del dolor, aunque no es el unico sistema de neurotransmision implicado. De esta manera, los agonistas opiaceos han sido utilizados ampliamente para el manejo de diferentes tipos de dolor [111, 112]; sin embargo, debido a los efectos adversos reportados con su uso cronico [113, 114], asi como los fenomenos de tolerancia [115, 116] y dependencia [117-119], revelan que su uso es limitado y, por tanto, tienen unas indicaciones terapeuticas especificas. Curiosamente, se ha reportado un fenomeno poco comprendido, denominado hiperalgesia inducida por opiaceos [117, 120, 121], donde paradojicamente la administracion de agonistas opioides puede incrementar la sensibilidad al dolor o reducir su umbral. Dicho fenomeno puede ser revertido mediante dosis ultrabajas de naloxona en modelos murinos [122]. Por otro lado, estudios clinicos indican que los antagonistas opiaceos en bajas dosis (p. ej., naltrexona) pueden aumentar la eficacia analgesica de algunos agonistas opiaceos como la oxicodona y la metadona, ademas de reducir la tolerancia y dependencia de estos analgesicos [123-125]. Dicha indicacion terapeutica es algo paradojica, asi como contraintuitiva; teniendo en cuenta que estos antagonistas pueden competir, asi como desplazar el efecto de los agonistas de receptores opiaceos. Los agonistas opiaceos tienen un efecto inicialmente inhibitorio; sin embargo, con su uso cronico los efectos sobre los receptores se vuelven excitatorios [126], posiblemente debido a una alteracion en el acople con las proteinas G y con la adenilatociclasa [124, 127]. De esta manera, el uso combinado de agonista/antagonista puede reducir dicha conversion y asi limitar los efectos adversos. Finalmente, hay evidencia tanto clinica como experimental de que los antagonistas opiaceos pueden ser utilizados en monoterapia para el tratamiento de diferentes tipos de dolor cronico [46, 128, 129], asi como en combinacion con metadona para el manejo del dolor neuropatico [123]. Estudios en modelos animales, indican que el uso de antagonistas opioides a bajas dosis genera una sobrerregulacion (up-regulation) de los receptores µ en regiones cerebrales que participan en el procesamiento del dolor [130, 131], y ademas incrementan la expresion de opioides endogenos tales como la beta-endorfina [46, 132]. Por lo cual, el uso de antagonistas opioides puede tener una utilidad terapeutica para reducir efectos adversos de los opiaceos (hiperalgesia inducida por opiaceos), potenciar los efectos analgesicos de los agonistas opiaceos y, finalmente, a bajas dosis puede tener un efecto analgesico importante per se.
Potenciacion cognitiva
Como se ha mencionado anteriormente, el sistema opioide participa en diferentes funciones cognitivas superiores tales como la memoria y el aprendizaje [133, 134]. De hecho, las estructuras cerebrales encargadas del procesamiento de la memoria estan compuestas por neuronas que sintetizan opioides endogenos, expresan sus receptores y ademas modifican su plasticidad sinaptica de acuerdo con una activacion diferencial de dichos receptores [93, 94, 135, 136]. Estudios clasicos con animales de experimentacion han reportado un incremento en la ejecucion de tareas de memoria tras la administracion tanto central como periferica de antagonistas opiaceos [137, 138]. Al parecer, la inactivacion del sistema opioide facilita la activacion del sistema noradrenergico central por el complejo amigdalino, y dicha activacion incrementa el procesamiento cognitivo [139, 140]. Ademas, los antagonistas opioides pueden incrementar la actividad sinaptica del hipocampo directamente. Estudios in vitro indican que la administracion de naloxona prolonga la potenciacion a largo plazo (long term potentiation-LTP) de la colateral de Schaffer a CA1 [141], cambios a su vez asociados con un incremento en la ejecucion de la memoria espacial. Acorde con los anteriores resultados, diferentes estudios indican que la administracion de los agonistas opioides tiene efectos amnesicos [142, 143] y, por tanto, soporta el papel de potenciador cognitivo de los antagonistas. Sin embargo, algunos estudios indican que en el caso de la memoria espacial los antagonistas pueden mejorar [141, 144] o deteriorar [145] la ejecucion de dicho tipo de memoria, dependiendo de la especificidad y la reversibilidad de dichos antagonistas. Estudios en primates han reportado un patron en U invertida para los efectos de la naloxona, donde bajas dosis tienen pocos efectos, dosis intermedias mejoran y dosis altas deterioran las tareas de memoria de reconocimiento visual [146]. Estudios clinicos indican que dichos efectos duales pueden ser dependientes del grado de activacion emocional, y por tanto, la naltrexona puede desplazar dicha curva de U invertida descrita anteriormente [147]. De esta manera, el efecto de los antagonistas sobre el procesamiento de la memoria tiene efectos variados dependiendo de la dosis, del estado emocional de los sujetos y del grado de especificidad y reversibilidad del antagonista.
Trastornos psiquiatricos y del comportamiento
Existe una gran diversidad de trastornos psiquiatricos que tienen componentes afectivos y emocionales que involucran el sistema opioide [148, 149]. Dentro de dichas patologias se encuentran los trastornos alimentarios, y, precisamente, el que mas se ha estudiado en relacion con el sistema opioide es el trastorno por atracon (binge eating disorder) [150]. Se ha descrito que el principal receptor opioide involucrado en este trastorno es el receptor µ, el cual se ha visto que participa en la mediacion de respuestas hedonicas [151, 152]. Los primeros estudios que demostraron el efecto de los antagonistas opioides en la respuesta a la ingesta de alimentos, datan desde 1986, donde se demostro que incluso en poblaciones de sujetos sanos, los sujetos que recibian naltrexona preferian concentraciones mas bajas de azucar en comparacion con los sujetos que recibian placebo [153]. De igual manera, estudios en pacientes bulimicos demostraron una disminucion en la cantidad de comida ingerida y del tiempo del episodio de atracon, despues de la administracion durante seis semanas de naltrexona [154]. En una paciente con trastorno alimentario de atracon con dosis de 100 mg de naltrexona al dia se reporto mejoria en 14 dias de tratamiento [155]. Se han descrito mejorias del 5% hasta al 10% de reduccion de peso en pacientes obesos en manejo dietario, asociado a bupropion (360 mg/dia) junto con naltrexona (32 mg/dia) [156]. Recientemente, se utilizo un antagonista especifico para µ (GSK1521498) en el tratamiento del trastorno por atracon, donde se evidencio una disminucion significativa de los episodios de atracon y de la ingesta de comida a comparacion del placebo, sin ningun efecto adverso sobre la memoria o la cognicion [157].
Por otro lado, dado el poco margen terapeutico para el manejo farmacologico de los trastornos del espectro autista [158], los antagonistas opioides se convierten en una buena opcion. Estudios en animales han demostrado que las relaciones sociales, en parte, podrian estar mediadas por neurotransmisores como la serotonina, la melatonina y los opioides [157]. Basados en dichos modelos, se ha planteado la hipotesis de que el autismo pudiera ser consecuencia de una actividad excesiva opioide durante el periodo neonatal [159]. Asimismo, se han reportado niveles elevados tanto en plasma como en liquido cefalorraquideo de peptidos opioides, que contribuyen aun mas a la hipotesis de la sobreactivacion del sistema opioide en el autismo [86]. De esta manera, se ha utilizado la naltrexona en dosis de 0,5 hasta 2 mg/kg/dia, en el tratamiento del autismo y se ha visto que es especialmente eficaz en la disminucion en comportamientos de autolesion [160].
Teniendo en cuenta la importancia del papel del sistema opioide endogeno en muchas funciones cognitivas, se cree que una funcion aberrante de este, podria ser un factor etiologico importante en el desarrollo de indiferencia social, y la incapacidad de generar enlaces sociales estables, como en el caso del trastorno de la personalidad limite [161]. Dicha afirmacion es respaldada por el hecho de que la mayoria de los pacientes con este trastorno, tienden a usar sustancias cuyas dianas son los receptores µ [162] y, ademas, presentan variantes geneticas del receptor D2 de dopamina [163], lo que en consecuencia genera mayor riesgo de dependencia y de abuso de opioides en tales pacientes [164]. Algunos sintomas disociativos en pacientes con trastorno de personalidad limite y con despersonalizacion cronica, pueden ser manejados con antagonistas opioides tipo naltrexona y naloxona [165, 166]. Ademas, la naltrexona ha sido utilizada en el manejo sintomatico de pacientes con trastorno obsesivo compulsivo [167, 168], en sujetos con conductas autolesivas [169] y como coadyuvante del trastorno por estres postraumatico [43, 170].
Finalmente, dada la participacion del sistema opioide en la regulacion del eje hipotalamo- hipofisis-adrenal y de su expresion en estructuras del sistema limbico, el uso de antagonistas opioides puede ser utilizado como regulador de los efectos cognitivos del estres [105], el cual, a su vez, esta relacionado con el desarrollo de multiples trastornos psiquiatricos y del comportamiento.
Utilidad de los antagonistas opiaceos en dependencia por etanol y opioides
El alcohol induce la liberacion de opioides endogenos en los sistemas de recompensa (el tegmento ventral y nucleo accumbens), facilita la neurotransmision dopaminergica y controla los efectos euforicos y placenteros del etanol. En 1994, la Food and Drug Administration (FDA) aprobo naltrexona para el tratamiento de la dependencia a etanol, con el objetivo de reducir el riesgo de recaidas, mantener la abstinencia y reducir el deseo por el consumo durante las fases iniciales de la recuperacion. Una revision sistematica de Cochrane apoya la eficacia del uso de naltrexona, ya que se asocia con la disminucion en la cantidad y frecuencia de consumo, un mayor numero de dias de abstinencia de consumo y mayor numero de dias de consumo pesado frente a placebo [171].
A pesar de la evidencia a favor de su efectividad, el uso clinico de la naltrexona ha estado limitado por la heterogeneidad en la respuesta al tratamiento, influenciada, entre otros factores, por el grado de motivacion del paciente por el abandono del consumo y por la pobre adherencia a la terapia en el esquema de administracion diaria. Para mejorar la adherencia al tratamiento, se diseno naltrexona en forma farmaceutica inyectable de larga accion para aplicacion mensual, que demostro ser bien tolerada y efectiva despues de seis meses de tratamiento en un ensayo clinico aleatorizado, doble ciego, controlado por placebo, publicado en JAMA en 2005. En este estudio, la naltrexona inyectable de larga accion disminuyo 25% la tasa de dias de abstinencia frente al placebo (P = 0,03) y el sexo masculino mostro mayor efecto del tratamiento. La tasa de descontinuacion del tratamiento fue similar en los sujetos que recibieron naltrexona y placebo [172].
Nalmefeno es otro antagonista opioide aprobado para el manejo de dependencia a etanol, con la ventaja que no exhibe hepatotoxicidad dependiente de dosis, como lo puede hacer la naltrexona, lo que aumenta su perfil de seguridad en pacientes con disfuncion hepatica alcoholica. El tratamiento con naltrexona administrada solo en situaciones de riesgo de consumo, ha mostrado ser mas eficaz que la administracion diaria, disminuyendo el numero promedio de bebidas diarias, con mayor efecto en el genero masculino, y mejorando las pruebas de funcion hepatica en pacientes con enfermedad hepatica asociada al consumo [173].
El tratamiento de la dependencia a opioides es otra indicacion aprobada para el uso de antagonistas opioides. La exposicion prolongada a los opioides genera hipersensibilizacion del sistema de recompensa del cerebro, de tal manera que el individuo puede experimentar un deseo patologico por consumir la sustancia (craving), independiente de la aparicion de los sintomas de abstinencia. Antagonistas opioides, como la naltrexona, bloquean los efectos euforicos de los opioides y de esta manera disminuyen el refuerzo positivo del consumo. Los antagonistas opioides no tienen potencial adictivo y no inducen la tolerancia. Al igual que en la dependencia a etanol, los estudios clinicos han demostrado que las formulaciones de liberacion sostenida de la naltrexona son mas eficaces que el placebo en terminos de reduccion del craving y reduccion de consumo de opioides [174].
Estatus de desarrollo clinico de los antagonistas opioides en usos terapeuticos potenciales
A pesar de la evidencia preclinica experimental y pese al conocimiento cada vez mas profundo de la fisiopatologia de las entidades clinicas mencionadas anteriormente, no hay evidencia clinica del papel de la naloxona, o de la naltrexona en la enfermedad de Alzheimer, amenorrea, disquinesia o epilepsia [34]. Con respecto a esta ultima indicacion, hay un estudio clinico de fase III en curso, dirigido a establecer la eficacia de la naloxona en disfuncion respiratoria postictal en pacientes con crisis tonico-clonicas generalizadas (NCT02332447) [34].
La mayor evidencia clinica se encuentra con el uso de la naloxona y la naltrexona como coadyuvantes en diferentes tipos de dolor, generalmente en combinacion con la oxicodona, en la que el uso de estos compuestos podria reducir las reacciones adversas derivadas del uso de agonistas opioides, y a la vez mejorar el efecto analgesico [34, 175]. Gran parte de la evidencia clinica para el uso de naltrexona en diferentes tipos de dolor esta actualmente en estudio: dolor secundario a osteoartritis (NCT00420992); dolor regional complejo (NCT02502162), y fibromialgia (NCT00568555), entre otros [34]. Recientemente, la FDA aprobo una preparacion de liberacion extendida de naloxona/oxicodona para dolor severo que requiere manejo de opioides por horario a largo plazo [176].
En un estudio aleatorizado, doble ciego, la naltrexona mostro seguridad y eficacia al reducir la actividad inflamatoria, asi como una mejoria de los sintomas (principalmente dolor) en pacientes con enfermedad de Crohn [177]. Aunque dichos resultados han sido controversiales debido al tamano de la muestra [47], un nuevo estudio se esta realizando (NCT01810185) [34].
De igual manera, el efecto de la naltrexona en el control de impulsos de pacientes con enfermedad de Parkinson ha mostrado resultados prometedores. Sin embargo, se han controvertido los resultados basados en la aplicacion de escalas, debido a la falta de eficacia en la respuesta clinica global de estos pacientes [178].
Ademas, se esta desarrollando un estudio clinico de fase III para evaluar la eficacia de un espray nasal de naloxona para el manejo de pacientes con sindrome del atracon (binge eating disorder) (NCT01567670) [34].
Finalmente, no existe experiencia clinica para la combinacion de ciprodime/naltrindol [34].
Conclusion
El sistema opioide tiene una amplia distribucion en el sistema nervioso central y, por ende, participa en diferentes funciones nerviosas superiores. La interaccion de los opioides endogenos con sus respectivos receptores modula la funcion celular de dichas regiones centrales. Asimismo, el sistema opioide participa en la fisiopatologia de diferentes trastornos endocrinos, neuronales, inmunologicos y, finalmente, comportamentales. Los efectos de los farmacos antagonistas son evidentes en aquellos sistemas de neurotransmision que estan activos en condiciones basales y el sistema opioide forma parte de dichos sistemas de neurotransmision; por este motivo, los antagonistas opioides pueden generar diferentes efectos fisiologicos en sujetos sanos. Sin embargo, el sistema opioide puede estar sobreactivado en diferentes trastornos, revisados anteriormente, y por tanto, su modulacion mediante antagonistas podria tener utilidad terapeutica. De estos usos novedosos, el mas importante es el del control de los efectos adversos y el favorecimiento de la analgesia por agonistas opioides, que ha dado lugar a la inclusion de esta combinacion (agonista mas antagonista opioide) en el arsenal terapeutico para el manejo del dolor. Finalmente, dados los efectos adversos y en algunos casos idiosincraticos de los antagonistas opioides inespecificos, el uso de antagonistas especificos para los receptores opioides (µ, κ y δ), asi como de los ORL, puede ser una estrategia terapeutica futura. Es necesario realizar mas estudios clinicos para determinar la eficacia, asi como el perfil de seguridad de muchos de los antagonistas opioides que se encuentran en las fases experimentales en indicaciones tan variadas como la enfermedad de Parkinson, el sindrome del atracon y el manejo de dependencia por cocaina.
Agradecimientos
A Jessica Mendez Garzon (q.e.p.d.), quien colaboro con la parte introductoria del presente articulo.
Referencias
1. Laux-Biehlmann, J. Mouheiche, J. Veriepe, Y. Goumon, Endogenous morphine and its metabolites in mammals: History, synthesis, localization and perspectives, Neuroscience, 13, 233 (2013). [ Links ]
2. A. Corbett, S. McKnight, G. Henderson, Opioids receptors. Advancing research for the life scientist. TOCRIS. URL: http://www.tocris.com/pdfs/oprev.pdf, octubre, 2014. [ Links ]
3. R.J. Bodnar, Endogenous opiates and behavior: 2012, Peptides, 38, 2 (2013). [ Links ]
4. M.J. Brownstein, A brief history of opiates, opioid peptides, and opioid receptors, Proc. Natl. Acad. Sci. USA, 90, 12 (1993). [ Links ]
5. M. Waldhoer, S.E. Bartlett, J.L. Whistler, Opioid receptors, Ann. Rev. Biochem., 73, 953-990 (2004). [ Links ]
6. A.M. Trescot, S. Datta, M. Lee, H. Hansen, Opioid pharmacology, Pain Physician, 11, S133 (2008). [ Links ]
7. M.J. Christie, Cellular neuroadaptations to chronic opioids: Tolerance, withdrawal and addiction, Br. J. Pharmacol., 154, 2 (2008). [ Links ]
8. H.Y. Wang, E. Friedman, M.C. Olmstead, L.H. Burns, Ultra-low-dose naloxone suppresses opioid tolerance, dependence and associated changes in mu opioid receptor-G protein coupling and Gbetagamma signaling, Neuroscience, 135, 1 (2005). [ Links ]
9. C. Harrison, D. Smart, D.G. Lambert, Stimulatory effects of opioids, Br. J. Anaesth., 81, 1 (1998). [ Links ]
10. K. Takahama, T. Shirasaki, Central and peripheral mechanisms of narcotic antitussives: Codeine-sensitive and -resistant coughs, Cough, 9, 3 (2007). [ Links ]
11. M. Sobczak, M. Sa.aga, M.A. Storr, J. Fichna, Physiology, signaling, and pharmacology of opioid receptors and their ligands in the gastrointestinal tract: Current concepts and future perspectives, J. Gastroenterol., 49, 1 (2014). [ Links ]
12. R. Labianca, P. Sarzi-Puttini, S.M. Zuccaro, P. Cherubino, R. Vellucci, D. Fornasari, Adverse effects associated with non-opioid and opioid treatment in patients with chronic pain, Clin. Drug Investig., 32, 53 (2012). [ Links ]
13. S. Mercadante, E. Arcuri, Opioids and renal function, J. Pain, 5, 1 (2004). [ Links ]
14. N.A. Francisco, Control of breathing: How to better understand the respiratory effects of opioids, Eur. J. Pain Supplem., 5, 1 (2004). [ Links ]
15. M.K. Pugsley, The opioid receptor independent actions of kappa receptor agonists in the cardiovascular system, Curr. Pharm. Des., 10, 20 (2004). [ Links ]
16. T.B. Strouse, Pharmacokinetic drug interactions in palliative care: Focus on opioids, Palliat. Med., 12, 11 (2009). [ Links ]
17. T.L. Yaksh, M.S. Wallance, ÂgGoodman & GilmanÂfs. The pharmacological basis of therapeuticsÂh, Ed. L. Brunton, B. Chabner, B. Knollman, McGraw-Hill, San Diego, 2012. [ Links ]
18. P.S. Portoghese, R. el Kouhen, P.Y. Law, H.H. Loh, B. Le Bourdonnec, Affinity labels as tools for the identification of opioid receptor recognition sites, Farmaco, 56, 3 (2001). [ Links ]
19. V. Barnett, R. Twycross, M. Mihalyo, A. Wilcock, Opioid antagonists, J. Pain Symptom. Manag., 47, 2 (2014). [ Links ]
20. M. Urbano, M. Guerrero, H. Rosen, E. Roberts, Antagonists of the kappa opioid receptor, Bioorg. Med. Chem. Lett., 1, 24 (2014). [ Links ]
21. W.D. Chey, L. Webster, M. Sostek, J. Lappalainen, P.N. Barker, J. Tack, Naloxegol for opioid-induced constipation in patients with noncancer pain, N. Engl. J. Med., 370, 25 (2014). [ Links ]
22. G. Becker, H.E. Blum, Novel opioid antagonists for opioid-induced bowel dysfunction and postoperative ileus, Lancet, 373, 9670 (2009). [ Links ]
23. G. Becker, D. Galandi, H.E. Blum. Peripherally acting opioid antagonists in the treatment of opiate-related constipation: A systematic review, J. Pain Symptom. Manag., 34, 5 (2007). [ Links ]
24. Clinical Key. Agents, nalmefene, drug monograph. URL: https://www.clinicalkey. com.ezproxy.unisabana.edu.co/#!/ContentPlayerCtrl/doPlayContent/6-s2.0-424/{%22scope%22:%22all%22,%22query%22:%22nalmefene%22}, accesado en octubre, 2014. [ Links ]
25. K. Bui, F. She, M. Sostek, The effects of renal impairment on the pharmacokinetics, safety, and tolerability of naloxegol, J. Clin. Pharmacol., 54, 1375 (2014). [ Links ]
26. X. Dai, H.J. Song, S.G. Cui, T. Wang, Q. Liu Q, R. Wang, The stimulative effects of endogenous opioids on endothelial cell proliferation, migration and angiogenesis in vitro, Eur. J. Pharmacol., 628, 42 (2010). [ Links ]
27. J.L. Martin, L. Koodie, A.G. Krishnan, R. Charboneau, R.A. Barke, S. Roy, Chronic morphine administration delays wound healing by inhibiting immune cell recruitment to the wound site, Am. J. Pathol., 176, 2 (2010). [ Links ]
28. N. El-Hage, S.M. Dever, E.M. Podhaizer, C.K. Arnatt, Y. Zhang, K.F. Hauser. A novel bivalent HIV-1 entry inhibitor reveals fundamental differences in CCR5-µ-opioid receptor interactions between human astroglia and microglia, AIDS, 27, 14 (2013). [ Links ]
29. C.S. Wong, The mechanisms of ultra-low dose opioid agonist-antagonist, J. Formos. Med. Assoc., 110, 10 (2011). [ Links ]
30. S.L. Lin, R.Y. Tsai, C.H. Shen, F.H. Lin, J.J. Wang, S.T. Hsin, C.S. Wong, Coadministration of ultra-low dose naloxone attenuates morphine tolerance in rats via attenuation of NMDA receptor neurotransmission and suppression of neuroinflammation in the spinal cords, Pharmacol. Biochem. Behav., 96, 236 (2010). [ Links ]
31. M.R. Hutchinson, Y. Zhang, M. Shridhar, J.H. Evans, M.M. Buchanan, T.X. Zhao, P.F. Slivka, B.D. Coats, N. Rezvani, J. Wieseler, T.S. Hughes, K.E. Landgraf, S. Chan, S. Fong, S. Phipps, J.J. Falke, L.A. Leinwand, S.F. Maier, H. Yin, K.C. Rice, L.R. Watkins, Evidence that opioids may have toll-like receptor 4 and MD-2 effects. Brain Behav. Immun., 24, 1 (2010). [ Links ]
32. S.L. Lin, R.Y. Tsai, Y.H. Tai, C.H. Cherng, C.T. Wu, C.C. Yeh, C.S. Wong, Ultra-low dose naloxone upregulates interleukin-10 expression and suppresses neuroinflammation in morphine-tolerant rat spinal cords, Behav. Brain Res., 207, 1 (2010). [ Links ]
33. W.C. Jan, C.H. Chen, K. Hsu, P.S. Tsai, C.J. Huang. L-type calcium channels and µ-opioid receptors are involved in mediating the anti-inflammatory effects of naloxone, J. Surg. Res., 167, 2 (2011). [ Links ]
34. RTI International, National Institute on Drug Abuse (NIDA). Clinicaltrials.gov. URL: https://clinicaltrials.gov/ct2/show/NCT01431586?term=jdtic&rank=1, accesado en octubre, 2014. [ Links ]
35. L.G. Maxwell, S.C. Kaufmann, S. Bitzer, E.V. Jr Jackson, J. McGready, S. Kost-Byerly, L. Kozlowski, S.K. Rothman, M. Yaster, The effects of a small-dose naloxone infusion on opioid-induced side effects and analgesia in children and adolescents treated with intravenous patient-controlled analgesia: A doubleblind, prospective, randomized, controlled study, Anesth. Analg., 100, 4 (2005). [ Links ]
36. S. Okie, A flood of opioids, a rising tide of deaths, N. Engl. J. Med., 363, 21 (2010). [ Links ]
37. L.J. Paulozzi, D.S. Budnitz, Y. Xi, Increasing deaths from opioid analgesics in the United States, Pharmacoepidemiol. Drug Saf., 15, 9 (2006). [ Links ]
38. E.W. Boyer, Management of opioid analgesic overdose, N. Engl. J. Med., 367, 2 (2012). [ Links ]
39. J. Prudic, L. Fitzsimons, M.S. Nobler, H.A. Sackeim, Naloxone in the prevention of the adverse cognitive effects of ECT: A within subject, placebo controlled study, Neuropsychopharmacology, 21, 2 (1999). [ Links ]
40. P. Rapeli, C. Fabritius, H. Alho, M. Salaspuro, K. Wahlbeck, H. Kalska, Methadone vs. buprenorphine/naloxone during early opioid substitution treatment: A naturalistic comparison of cognitive performance relative to healthy controls, BMC Clin. Pharmacol., 12, 7 (2007). [ Links ]
41. R.D. Weiss, M.L. Griffin, J.S. Potter, D.R. Dodd, J.A. Dreifuss, H.S. Connery, K.M. Carroll, Who benefits from additional drug counseling among prescription opioid-dependent patients receiving buprenorphine-naloxone and standard medical management? Drug Alcohol Depend., 1, 140 (2014). [ Links ]
42. D.M. Hartung, D. McCarty, R. Fu, K. Wiest, M. Chalk, D.R. Gastfriend, Extended-release naltrexone for alcohol and opioid dependence: A meta-analysis of healthcare utilization studies, J. Subst. Abuse Treat., 47, 2 (2014). [ Links ]
43. I.L. Petrakis, J. Poling, C. Levinson, C. Nich, K. Carroll, E. Ralevski, B. Rounsaville, Naltrexone and disulfiram in patients with alcohol dependence and comorbid post-traumatic stress disorder, Biol. Psychiatry, 1, 60 (2006). [ Links ]
44. I.L. Petrakis, E. Ralevski, N. Desai, L. Trevisan, R. Gueorguieva, B. Rounsaville, J.H. Krystal, Noradrenergic vs. serotonergic antidepressant with or without nalUsos terapeuticos potenciales de antagonistas opioides trexone for veterans with PTSD and comorbid alcohol dependence, Neuropsychopharmacology, 37, 996 (2012). [ Links ]
45. A. Garg, P. Sinha, P. Kumar, O. Prakash, Use of naltrexone in ketamine dependence, Addict. Behav., 39, 8 (2014). [ Links ]
46. J.P. Smith, H. Stock, S. Bingaman, D. Mauger, M. Rogosnitzky, I.S. Zagon, Lowdose naltrexone therapy improves active CrohnÂfs disease, Am. J. Gastroenterol., 102, 820 (2007). [ Links ]
47. D. Segal, J.K. Macdonald, N. Chande, Low dose naltrexone for induction of remission in CrohnÂfs disease, Cochrane Database Syst. Rev., 21, 2 (2014). [ Links ]
48. J. Younger, N. Noor, R. McCue, S. Mackey, Low-dose naltrexone for the treatment of fibromyalgia: Findings of a small, randomized, double-blind, placebo-controlled, counterbalanced, crossover trial assessing daily pain levels, Arthritis Rheum., 65, 529 (2013). [ Links ]
49. M. Gironi, F. Martinelli-Boneschi, P. Sacerdote, C. Solaro, M. Zaffaroni, R. Cavarretta, L. Moiola, S. Bucello, M. Radaelli, V. Pilato, M. Rodegher, M. Cursi, S. Franchi, V. Martinelli, R. Nemni, G. Comi, G. Martino, A pilot trial of low-dose naltrexone in primary progressive multiple sclerosis, Mult. Scler., 14, 8 (2008). [ Links ]
50. B.A. Cree, E. Kornyeyeva, D.S. Goodin, Pilot trial of low-dose naltrexone and quality of life in multiple sclerosis, Ann. Neurol., 68, 2 (2010). [ Links ]
51. T. Frech, K. Novak, M.P. Revelo, M. Murtaugh, B. Markewitz, N. Hatton, M.B. Scholand, E. Frech, D. Markewitz, A.D. Sawitzke, Low-dose naltrexone for pruritus in systemic sclerosis, Int. J. Rheumatol., 2011, Epub, Sep. 12 (2011). [ Links ]
52. B. Bihari, Low-dose naltrexone for normalizing immune system function, Altern. Ther. Health Med., 19, 2 (2013). [ Links ]
53. J. Younger, L. Parkitny, D. McLain, The use of low-dose naltrexone (LDN) as a novel anti-inflammatory treatment for chronic pain, Clin. Rheumatol., 33, 4 (2014). [ Links ]
54. M.O. Nava-Mesa, R. Lopez, Efectos del sistema opioide sobre el procesamiento de la memoria. Evidencia clinica y experimental, Rev. Colomb. Med. Fis. Rehabil., 19, 55 (2009). [ Links ]
55. T.L. Coventry, D.S. Jessop, D.P Finn, M.D. Crabb, H. Kinoshita, M.S. Harbuz, Endomorphins and activation of the hypothalamo-pituitary-adrenal axis, J. Endocrinol., 169, 185 (2001). [ Links ]
56. J.E. Zadina, L. Hackler, L.J. Ge, A.J. Kastin, A potent and selective endogenous agonist for the mu-opiate receptor, Nature, 3, 386 (1997). [ Links ]
57. G.A. Carrasco, L.D. Van de Kar, Neuroendocrine pharmacology of stress, Eur. J. Pharmacol., 463, 235 (2003). [ Links ]
58. R.J. Bodnar, Endogenous opiates and behavior: 2011, Peptides, 38, 463 (2012). [ Links ]
59. P.J. Brunton, S.L. Meddlem, S. Ma, T. Ochedalski, A.J. Douglas, J.A. Russell, Endogenous opioids and attenuated hypothalamic-pituitary-adrenal axis responses to immune challenge in pregnant rats, J. Neurosci., 25, 5117 (2005). [ Links ]
60. B. Singh, V. Dixit, P. Singh, G. Georgie, V. Dixit, Effect of naloxone on the plasma levels of LH, FSH, prolactin and testosterone in Beetal bucks, Small Rumin. Res., 37, 51 (2000). [ Links ]
61. C.A. Villanueva-Diaz, R. Pineda-Viedas, M.G. Echavarria-Sanchez, A. Juarez- Bengoa, Change of pulsatile release and luteinizing hormone response to naloxone related to testicle damage, Ginecol. Obstet. Mex., 75, 200 (2007). [ Links ]
62. P. Palta, T. Chandrasekhar, B.S. Prakash, M.L. Madan, Effect of naloxone on GnRH-induced LH and FSH release in buffalo, Bubalus bubalis, Indian J. Exp. Biol., 38, 390 (2000). [ Links ]
63. J. Buvat, M. Buvat-Herbaut, Ovulation disturbances in athletes and their mechanisms, J. Gynecol. Obstet. Biol. Reprod. (Paris), 20, 899 (1991). [ Links ]
64. M.P. Warren, N.E. Perlroth, The effects of intense exercise on the female reproductive system, J. Endocrinol., 170, 3 (2001). [ Links ]
65. M.H. Samuels, C.F. Sanborn, F. Hofeldt, R. Robbins, The role of endogenous opiates in athletic amenorrhea, Fertil. Steril., 55, 507 (1991). [ Links ]
66. G. Dixon, P. Eurman, B.E. Stern, B. Schwartz, R.W. Rebar, Hypothalamic function in amenorrheic runners, Fertil. Steril., 42, 377 (1984). [ Links ]
67. G. Botticelli, A. Bacchi- Modena, D. Bresciani, P. Villa, L. Aguzzoli, P. Florio, R.E. Nappi, F. Petraglia, A.R. Genazzani, Effect of naltrexone treatment on the treadmill exercise-induced hormone release in amenorrheic women, J. Endocrinol. Invest., 15, 839 (1992). [ Links ]
68. F. Fruzzetti, C. Bersi, D. Parrini, C. Ricci, A.R. Genazzani, Effect of long-term naltrexone treatment on endocrine profile, clinical features, and insulin sensi tivity in obese women with polycystic ovary syndrome, Fertil. Steril., 77, 936 (2002). [ Links ]
69. J.D. Belluzzi, L. Stein, Enkephalin may mediate euphoria and drive-reduction reward, Nature, 266, 556 (1977). [ Links ]
70. C. Gianoulakis, Endogenous opioids and addiction to alcohol and other drugs of abuse, Curr. Top. Med. Chem., 9, 999 (2009). [ Links ]
71. P. Piccini, R.A. Weeks, D.J. Brooks, Alterations in opioid receptor binding in ParkinsonÂfs disease patients with levodopa-induced dyskinesias, Ann. Neurol., 42, 720 (1997). [ Links ]
72. H. Koizumi, R. Morigaki, S. Okita, S. Nagahiro, R. Kaji, M. Nakagawa, S. Goto, Response of striosomal opioid signaling to dopamine depletion in 6-hydroxydopamine-lesioned rat model of ParkinsonÂfs disease: A potential compensatory role, Front. Cell. Neurosci., 7, 74 (2013). [ Links ]
73. G.B. Stefano, K.J. Mantione, M. Krali.kova, R. Ptacek, H. Kuzelova, T. Esch, R.M. Kream, ParkinsonÂfs disease, L-DOPA, and endogenous morphine: A revisit, Med. Sci. Monit., 18, RA133 (2012). [ Links ]
74. G. Fabbrini, J.M. Brotchie, F. Grandas, M. Nomoto, C.G. Goetz, Levodopainduced dyskinesias, Mov. Disord., 22, 1379 (2007). [ Links ]
75. B. Henry, S.H. Fox, A.R. Crossman, J.M. Brotchie, Mu- and delta-opioid receptor antagonists reduce levodopa-induced dyskinesia in the MPTP-lesioned primate model of ParkinsonÂfs disease, Exp. Neurol., 171, 139 (2001). [ Links ]
76. S.H. Fox, A.E. Lang, J.M. Brotchie, Translation of nondopaminergic treatments for levodopa-induced dyskinesia from MPTP-lesioned nonhuman primates to phase IIa clinical studies: Keys to success and roads to failure, Mov. Disord., 21, 1578 (2006). [ Links ]
77. J.B. Koprich, S.H. Fox, T.H. Johnston, A. Goodman, B. Le Bourdonnec, R.E. Dolle, R.N. DeHaven, D.L. DeHaven-Hudkins, P.J. Little, J.M. Brotchie, The selective mu-opioid receptor antagonist ADL5510 reduces levodopa-induced dyskinesia without affecting antiparkinsonian action in MPTP-lesioned macaque model of ParkinsonÂfs disease, Mov. Disord., 26, 1225 (2011). [ Links ]
78. F.C. Tortella, Endogenous opioid peptides and epilepsy: Quieting the seizing brain?, Trends Pharmacol. Sci., 9, 366 (1988). [ Links ]
79. K. Ramabadran, M. Bansinath, Endogenous opioid peptides and epilepsy, Int. J. Clin. Pharmacol. Ther. Toxicol., 28, 47 (1990). [ Links ]
80. H. Frenk, Pro- and anticonvulsant actions of morphine and the endogenous opioids: Involvement and interactions of multiple opiate and non-opiate systems, Brain Res., 287, 197 (1983). [ Links ]
81. H. Van Praag, M. Falcon, D. Guendelman, H. Frenk, The development of analgesic, pro- and anti-convulsant opiate effects in the rat, Ann. Ist. Super. Sanita, 29, 419 (1993). [ Links ]
82. C.M. McDermott, L.A. Schrader, Activation of κ opioid receptors increases intrinsic excitability of dentate gyrus granule cells, J. Physiol., 589, 3517 (2011).
83. C.R. Houser, J.E. Miyashiro, B.E. Swartz, G.O. Walsh, J.R. Rich, A.V. Delgado-Escueta, Altered patterns of dynorphin immunoreactivity suggest mossy fiber reorganization in human hippocampal epilepsy, J. Neurosci., 10, 267 (1990). [ Links ]
84. E. Schunk, C. Aigner, N. Stefanova, G. Wenning, H. Herzog, C. Schwarzer, Kappa opioid receptor activation blocks progressive neurodegeneration after kainic acid injection, Hippocampus, 21, 1010 (2011). [ Links ]
85. G. Armagan, E. Bojnik, E. Turunc, L. Kanit, O. Gunduz Cinar, S. Benyhe, A. Borsodi, A. Yalcin, Kainic acid-induced changes in the opioid/nociceptin system and the stress/toxicity pathways in the rat hippocampus, Neurochem. Int., 60, 555 (2012). [ Links ]
86. M.S. Nandhu, G. Naijil, S. Smijin, S. Jayanarayanan, C.S. Paulose, Opioid system functional regulation in neurological disease management, J. Neurosci. Res., 88, 3215 (2010). [ Links ]
87. H. Homayoun, S. Khavandgar, A.R. Dehpour, The involvement of endogenous opioids and nitricoxidergic pathway in the anticonvulsant effects of foot-shock stress in mice, Epilepsy Res., 49, 131 (2002). [ Links ]
88. S. Caldecott-Hazard, Y. Shavit, R.F. Ackermann, J. Engel, R.C. Frederickson, J.C. Liebeskind, Behavioral and electrographic effects of opioids on kindled seizures in rats, Brain Res., 251, 327 (1982). [ Links ]
89. P.A. Bartenstein, J.S. Duncan, M.C. Prevett, V.J. Cunningham, D.R. Fish, A.K. Jones, S.K. Luthra, G.V. Sawle, D.J. Brooks, Investigation of the opioid system in absence seizures with positron emission tomography, J. Neurol. Neurosurg. Psychiatry, 56, 1295 (1993). [ Links ]
90. R.S. Fisher, S.C. Schachter, The postictal state: A neglected entity in the management of epilepsy, Epilepsy Behav., 1, 52 (2000). [ Links ]
91. J. Ma, R. Boyce, L.S. Leung, Nucleus accumbens mu opioid receptors mediate immediate postictal decrease in locomotion after an amygdaloid kindled seizure in rats, Epilepsy Behav., 17, 165 (2010). [ Links ]
92. L. Velisek, P. Mares, Differential effects of naloxone on postictal depression, Epilepsy Res., 12, 37 (1992). [ Links ]
93. B.J. Morris, H.M. Johnston, A role for hippocampal opioids in long-term functional plasticity, Trends Neurosci., 18, 350 (1995). [ Links ]
94. Y. Shirayama, H. Ishida, M. Iwata, G.-I. Hazama, R. Kawahara, R.S. Duman, Stress increases dynorphin immunoreactivity in limbic brain regions and dynorphin antagonism produces antidepressant-like effects, J. Neurochem., 90, 1258 (2004). [ Links ]
95. H. Moreno, W.E. Wu, T. Lee, A. Brickman, R. Mayeux, T.R. Brown, S.A. Small, Imaging the Abeta-related neurotoxicity of Alzheimer disease, Arch. Neurol., 64, 1467 (2007). [ Links ]
96. K.-S. Hui, Brain-specific aminopeptidase: From enkephalinase to protector against neurodegeneration, Neurochem. Res., 32, 2062 (2007). [ Links ]
97. M. Diez, J. Koistinaho, K. Kahn, D. Games, T. Hökfelt, Neuropeptides in hippocampus and cortex in transgenic mice overexpressing V717F beta-amyloid precursor protein-initial observations, Neuroscience, 100, 259 (2000). [ Links ]
98. Z. Cai, A. Ratka, Opioid system and AlzheimerÂfs disease, Neuromolecular Med., 14, 91 (2012). [ Links ]
99. M. Diez, S. Danner, P. Frey, B. Sommer, M. Staufenbiel, K.-H. Wiederhold, T. Hokfelt, Neuropeptide alterations in the hippocampal formation and cortex of transgenic mice overexpressing beta-amyloid precursor protein (APP) with the Swedish double mutation (APP23), Neurobiol. Dis., 14, 579 (2003). [ Links ]
100. W.J. Meilandt, G.-Q. Yu, J. Chin, E.D. Roberson, J.J. Palop, T. Wu, K. Scearce-Levie, L. Mucke, Enkephalin elevations contribute to neuronal and behavioral impairments in a transgenic mouse model of AlzheimerÂfs disease, J. Neurosci., 28, 5007 (2008). [ Links ]
101. K. Leung, [4-O-methyl-11C]-8-[(E)-2-(3,4-Dimethoxyphenyl)ethenyl]-1,3- diethyl-7-methylpurine-2,6-dion. Molecular imaging and contrast agent database (MICAD) - NCBI Bookshelf. URL: http://www.ncbi.nlm.nih.gov/books/NBK22976/?report=reader, accesado en octubre, 2014. [ Links ]
102. B.T. Hyman, P.J. Eslinger, A.R. Damasio, Effect of naltrexone on senile dementia of the Alzheimer type, J. Neurol. Neurosurg. Psychiatry, 48, 1169 (1985). [ Links ]
103. V.W. Henderson, E. Roberts, C. Wimer, E.L. Bardolph, H.C. Chui, A.R. Damasio, P.J. Eslinger, M.F. Folstein, L.S. Schneider, E.L. Teng, Multicenter trial of naloxone in AlzheimerÂfs disease, Ann. Neurol., 25, 404 (1989). [ Links ]
104. R. Zhang, G. Xue, S. Wang, L. Zhang, C. Shi, X. Xie, Novel object recognition as a facile behavior test for evaluating drug effects in AÆÃPP/PS1 AlzheimerÂfs disease mouse model, J. Alzheimers. Dis., 31, 801 (2012). [ Links ]
105. M.O. Nava-Mesa, M.R. Lamprea, A. Munera, Divergent short- and long-term effects of acute stress in object recognition memory are mediated by endogenous opioid system activation, Neurobiol. Learn. Mem., 106, 185 (2013). [ Links ]
106. M.O. Nava-Mesa, L. Jimenez-Diaz, J. Yajeya, J.D. Navarro-Lopez, GABAergic neurotransmission and new strategies of neuromodulation to compensate synaptic dysfunction in early stages of AlzheimerÂfs disease, Front. Cell. Neurosci., 8, 167 (2014). [ Links ]
107. M.H. Ossipov, G.O. Dussor, F. Porreca, Central modulation of pain, J. Clin. Invest., 120, 3779 (2010). [ Links ]
108. P. Petrovic, E. Kalso, K.M. Petersson, M. Ingvar, Placebo and opioid analgesiaimaging a shared neuronal network, Science, 295, 1737 (2002). [ Links ]
109. J.-K. Zubieta, J.A. Bueller, L.R. Jackson, D.J. Scott, Y. Xu, R.A. Koeppe, T.E. Nichols, C.S. Stohler, Placebo effects mediated by endogenous opioid activity on mu-opioid receptors, J. Neurosci., 25, 7754 (2005). [ Links ]
110. Y. Hosobuchi, J.E. Adams, R. Linchitz, Pain relief by electrical stimulation of the central gray matter in humans and its reversal by naloxone, Science, 197, 183 (1977). [ Links ]
111. B. Nicholson, Responsible prescribing of opioids for the management of chronic pain, Drugs, 63, 17 (2003). [ Links ]
112. R.K. Fine, P. Perry, Opioid analgesia, URL: http://www.stoppain.org/pcd/content/forpros/opioidbook.asp, accesado en octubre, 2014. [ Links ]
113. F. Porreca, M.H. Ossipov, Nausea and vomiting side effects with opioid analgesics during treatment of chronic pain: Mechanisms, implications, and management options, Pain Med., 10, 654 (2009). [ Links ]
114. R. Benyamin, A.M. Trescot, S. Datta, R. Buenaventura, R. Adlaka, N. Sehgal, S.E. Glaser, R. Vallejo, Opioid complications and side effects, Pain Physician, 11, S105 (2008). [ Links ]
115. A. DuPen, D. Shen, M. Ersek, Mechanisms of opioid-induced tolerance and hyperalgesia, Pain Manag. Nurs., 8, 113 (2007). [ Links ]
116. J.S. Goldberg, Chronic opioid therapy and opioid tolerance: A new hypothesis, Pain Res. Treat., Article ID 407504 (2013). [ Links ]
117. M.S. Cepeda, D. Fife, Q. Ma, P.B. Ryan, Comparison of the risks of opioid abuse or dependence between tapentadol and oxycodone: Results from a cohort study, J. Pain, 14, 1227 (2013). [ Links ]
118. G.K. Gourlay, Advances in opioid pharmacology, Support. Care Cancer, 13, 153 (2005). [ Links ]
119. J. Jage, Opioid tolerance and dependence -Do they matter?, Eur. J. Pain, 9, 157 (2005). [ Links ]
120. R.B. Raffa, J.V. Pergolizzi, Opioid-induced hyperalgesia: Is it clinically relevant for the treatment of pain patients, Pain Manag. Nurs., 14, e67 (2013). [ Links ]
121. C. Zollner, Do opioids induce hyperalgesia?, Anaesthesist, 59, 983 (2010). [ Links ]
122. D. Aguado, M. Abreu, J. Benito, J. Garcia-Fernandez, I.A. Gomez de Segura, Effects of naloxone on opioid-induced hyperalgesia and tolerance to remifentanil under sevoflurane anesthesia in rats, Anesthesiology, 118, 1160 (2013). [ Links ]
123. R.A. Cruciani, D. Lussier, D. Miller-Saultz, D.M. Arbuck, Ultra-low dose oral naltrexone decreases side effects and potentiates the effect of methadone, J. Pain Symptom Manag., 25, 491 (2003). [ Links ]
124. V.L. Chindalore, R.A. Craven, K.P. Yu, P.G. Butera, L.H. Burns, N. Friedmann, Adding ultralow-dose naltrexone to oxycodone enhances and prolongs analgesia: A randomized, controlled trial of Oxytrex, J. Pain, 6, 392 (2005). [ Links ]
125. L.R. Webster, P.G. Butera, L.V. Moran, N. Wu, L. Burns, N. Friedmann, Oxytrex minimizes physical dependence while providing effective analgesia: A randomized controlled trial in low back pain, J. Pain, 7, 937 (2006). [ Links ]
126. L.R. Webster, Oxytrex: An oxycodone and ultra-low-dose naltrexone formulation, Expert Opin. Investig. Drugs, 16, 1277 (2007). [ Links ]
127. P. Sloan, S. Hamann, Ultra-low-dose opioid antagonists to enhance opioid analgesia, J. Opioid Manag., 2, 295 (2006). [ Links ]
128. R. Kariv, E. Tiomny, R. Grenshpon, R. Dekel, G. Waisman, Y. Ringel, Z. Halpern, Low-dose naltreoxone for the treatment of irritable bowel syndrome: A pilot study, Dig. Dis. Sci., 51, 2128 (2006). [ Links ]
129. S.B. Leavitt, Opioid antagonists in pain management, practical pain management, URL: http://www.practicalpainmanagement.com/treatments/pharmacological/opioids/opioid-antagonists-pain-management, accesado en octubre, 2014. [ Links ]
130. P. Mannelli, E. Gottheil, E.J. Van Bockstaele, Antagonist treatment of opioid withdrawal translational low dose approach, J. Addict. Dis., 25, 1 (2006). [ Links ]
131. J. Van Bockstaele, C. Rudoy, P. Mannelli, V. Oropeza, Y. Qian, Elevated muopioid receptor expression in the nucleus of the solitary tract accompanies attenuated withdrawal signs after chronic low dose naltrexone in opiate-dependent rats, J. Neurosci. Res., 83, 508 (2006). [ Links ]
132. J. Zalewska-Kaszubska, D. Gorska, W. Dyr, E. Czarnecka, Effect of acute administration of ethanol on beta-endorphin plasma level in ethanol preferring and non-preferring rats chronically treated with naltrexone, Pharmacol. Biochem. Behav., 85, 155 (2006). [ Links ]
133. L. Jamot, H.W.D. Matthes, F. Simonin, B.L. Kieffer, J.C. Roder, Differential involvement of the mu and kappa opioid receptors in spatial learning, Genes. Brain. Behav., 2, 80 (2003). [ Links ]
134. J.L. Martinez, H. Rigter, Endorphins alter acquisition and consolidation of an inhibitory avoidance response in rats, Neurosci. Lett., 19, 197 (1980). [ Links ]
135. G.W. Terman, J.J. Wagner, C. Chavkin, Kappa opioids inhibit induction of longterm potentiation in the dentate gyrus of the guinea pig hippocampus, J. Neurosci., 14, 4740 (1994). [ Links ]
136. J.J. Wagner, L.R. Etemad, A.M. Thompson, Opioid-mediated facilitation of long-term depression in rat hippocampus, J. Pharmacol. Exp. Ther., 296, 776 (2001). [ Links ]
137. J.L. McGaugh, Hormonal influences on memory, Annu. Rev. Psychol., 34, 297 (1983). [ Links ]
138. R.B. Messing, R.A. Jensen, J.L. Martinez, V.R. Spiehler, B.J. Vasquez, B. Soumireu-Mourat, K.C. Liang, J.L. McGaugh, Naloxone enhancement of memory, Behav. Neural. Biol., 27, 266 (1979). [ Links ]
139. J.L. McGaugh, I.B. Introini-Collison, A.H. Nagahara, Memory-enhancing effects of posttraining naloxone: Involvement of beta-noradrenergic influences in the amygdaloid complex, Brain Res., 446, 37 (1988). [ Links ]
140. B. Ferry, B. Roozendaal, J.L. McGaugh, Involvement of alpha1-adrenoceptors in the basolateral amygdala in modulation of memory storage, Eur. J. Pharmacol., 372, 9 (1999). [ Links ]
141. H. Zhao, H. Xu, X. Xu, Effects of naloxone on the long-term potentiation of EPSPs from the pathway of Schaffer collateral to CA1 region of hippocampus in aged rats with declined memory, Brain Res., 996, 111 (2004). [ Links ]
142. J. Sandin, I. Nylander, J. Georgieva, P.A. Schott, S.O. Ogren, L. Terenius, Hippocampal dynorphin B injections impair spatial learning in rats: A kappa-opioid receptor-mediated effect, Neuroscience, 85, 375 (1998). [ Links ]
143. S. Daumas, A. Betourne, H. Halley, D.P. Wolfer, H.-P. Lipp, J.-M. Lassalle, B. Frances, Transient activation of the CA3 Kappa opioid system in the dorsal hippocampus modulates complex memory processing in mice, Neurobiol. Learn. Mem., 88, 94 (2007). [ Links ]
144. M. Gallagher, R.A. King, N.B. Young, Opiate antagonists improve spatial memory, Science, 221, 975 (1983). [ Links ]
145. W.J. Meilandt, E. Barea-Rodriguez, S.A.K. Harvey, J.L. Martinez, Role of hippocampal CA3 mu-opioid receptors in spatial learning and memory, J. Neurosci., 24, 2953 (2004). [ Links ]
146. T.G. Aigner, M. Mishkin, Improved recognition memory in monkeys following naloxone administration, Psychopharmacology (Berl), 94, 21 (1988). [ Links ]
147. K.R. Katzen-Perez, D.W. Jacobs, A. Lincoln, R.J. Ellis, Opioid blockade improves human recognition memory following physiological arousal, Pharmacol. Biochem. Behav., 70, 77 (2001). [ Links ]
148. J.M. Witkin, M.A. Statnick, L.M. Rorick-Kehn, J.E. Pintar, M. Ansonoff, Y. Chen, R.C. Tucker, R. Ciccocioppo, The biology of nociceptin/orphanin FQ (N/OFQ) related to obesity, stress, anxiety, mood, and drug dependence, Pharmacol. Ther., 141, 283 (2014). [ Links ]
149. E.M. Goldner, A. Lusted, M. Roerecke, J. Rehm, B. Fischer, Prevalence of axis-1 psychiatric (with focus on depression and anxiety) disorder and symptomatology among non-medical prescription opioid users in substance use treatment: Systematic review and meta-analyses, Addict. Behav., 39, 520 (2014). [ Links ]
150. N.T. Bello, Z.W. Patinkin, T.H. Moran, Opioidergic consequences of dietaryinduced binge eating, Physiol. Behav., 104, 98 (2011). [ Links ]
151. C. Giuliano, T.W. Robbins, P.J. Nathan, E.T. Bullmore, B.J. Everitt, Inhibition of opioid transmission at the µ-opioid receptor prevents both food seeking and binge-like eating, Neuropsychopharmacology, 37, 2643 (2012). [ Links ]
152. A. Mansour, M.T. Hoversten, L.P. Taylor, S.J. Watson, H. Akil, The cloned mu, delta and kappa receptors and their endogenous ligands: Evidence for two opioid peptide recognition cores, Brain Res., 700, 89 (1995). [ Links ]
153. M. Fantino, J. Hosotte, M. Apfelbaum, An opioid antagonist, naltrexone, reduces preference for sucrose in humans, Am. J. Physiol., 251, R91 (1986). [ Links ]
154. J.M. Jonas, M.S. Gold, The use of opiate antagonists in treating bulimia: A study of low-dose versus high-dose naltrexone, Psychiatry Res., 24, 195 (1988). [ Links ]
155. A. Neumeister, A. Winkler, C. Wober-Bingol, Addition of naltrexone to fluoxetine in the treatment of binge eating disorder, Am. J. Psychiatry, 156, 797 (1999). [ Links ]
156. T.A. Wadden, J.P. Foreyt, G.D. Foster, J.O. Hill, S. Klein, P.M. OÂfNeil, M.G. Perri, F.X. Pi-Sunyer, C.L. Rock, J.S. Erickson, H.N. Maier, D.D. Kim, E. Dunayevich, Weight loss with naltrexone SR/bupropion SR combination therapy as an adjunct to behavior modification: The COR-BMOD trial, Obesity (Silver Spring), 19, 110 (2011). [ Links ]
157. S.R. Chamberlain, K. Mogg, B.P. Bradley, A. Koch, C.M. Dodds, W.X. Tao, K. Maltby, B. Sarai, A. Napolitano, D.B. Richards, E.T. Bullmore, P.J. Nathan, Effects of mu opioid receptor antagonism on cognition in obese binge-eating individuals, Psychopharmacology (Berl), 224, 501 (2012). [ Links ]
158. S. Mohiuddin, M. Ghaziuddin, Psychopharmacology of autism spectrum disorders: A selective review, Autism, 17, 645 (2013). [ Links ]
159. M. Leboyer, M.P. Bouvard, J.M. Launay, C. Recasens, M.H. Plumet, D. Waller-Perotte, F. Tabuteau, D. Bondoux, M. Dugas, Opiate hypothesis in infantile autism? Therapeutic trials with naltrexone, Encephal., 19, 95 (1993). [ Links ]
160. G.M. Elchaar, N.M. Maisch, L.M.G. Augusto, H.J. Wehring, Efficacy and safety of naltrexone use in pediatric patients with autistic disorder, Ann. Pharmacother., 40, 1086 (2006). [ Links ]
161. A.R. Prossin, T.M. Love, R.A. Koeppe, J.-K. Zubieta, K.R. Silk, Dysregulation of regional endogenous opioid function in borderline personality disorder, Am. J. Psychiatry, 167, 925 (2010). [ Links ]
162. M.J. Smoski, N. Salsman, L. Wang, V. Smith, T.R. Lynch, S.R. Dager, K.S. LaBar, M.M. Linehan, Functional imaging of emotion reactivity in opiate-dependent borderline personality disorder, Personal. Disord., 2, 230 (2011). [ Links ]
163. T.-Y. Wang, S.-Y. Lee, S.-L. Chen, S.-Y. Huang, Y.-H. Chang, N.-S. Tzeng, C.-L. Wang, I. Hui Lee, T.L. Yeh, Y.K. Yang, R.-B. Lu, Association between DRD2, 5-HTTLPR, and ALDH2 genes and specific personality traits in alcohol- and opiate-dependent patients, Behav. Brain Res., 250, 285 (2013). [ Links ]
164. S.L. Tragesser, R.E. Jones, R.J. Robinson, A. Stutler, A. Stewart, Borderline personality disorder features and risk for prescription opioid use disorders, J. Pers. Disord., 27, 427 (2013). [ Links ]
165. Y.L. Nuller, M.G. Morozova, O.N. Kushnir, N. Hamper, Effect of naloxone therapy on depersonalization: A pilot study, J. Psychopharmacol., 15, 93 (2001). [ Links ]
166. D. Simeon, M. Knutelska, An open trial of naltrexone in the treatment of depersonalization disorder, J. Clin. Psychopharmacol., 25, 267 (2005). [ Links ]
167. A. Bystritsky, B.P. Strausser, Treatment of obsessive-compulsive cutting behavior with naltrexone, J. Clin. Psychiatry, 57, 423 (1996). [ Links ]
168. K. Gade, C. Häussinger, B. Bandelow, Atypical anorexia in a male patient accompanied by strong obsessive-compulsive symptoms successfully treated with naltrexone, Pharmacopsychiatry, 42, 164 (2009). [ Links ]
169. C.A. Sandman, J.L. Barron, H. Colman, An orally administered opiate blocker, naltrexone, attenuates self-injurious behavior, Am. J. Ment. Retard., 95, 93 (1990). [ Links ]
170. E.B. Foa, D.A. Yusko, C.P. McLean, M.K. Suvak, D.A. Bux, D. Oslin, C.P. OÂfBrien, P. Imms, D.S. Riggs, J. Volpicelli, Concurrent naltrexone and prolonged exposure therapy for patients with comorbid alcohol dependence and PTSD: A randomized clinical trial, JAMA, 310, 488 (2013). [ Links ]
171. M.J. Niciu, A.J. Arias, Targeted opioid receptor antagonists in the treatment of alcohol use disorders, CNS Drugs, 27, 777 (2013). [ Links ]
172. J.C. Garbutt, H.R. Kranzler, S.S. OÂfMalley, D.R. Gastfriend, H.M. Pettinati, B.L. Silverman, J.W. Loewy, E.W. Ehrich, Efficacy and tolerability of long-acting injectable naltrexone for alcohol dependence: A randomized controlled trial, JAMA, 293, 1617 (2005). [ Links ]
173. K.S. Simojoki, V.A. Rosberg, M. Loyttyniemi, T. Nurminen et al., Targeted nalmefene with simple medical management in the treatment of heavy drinkers: A randomized double-blind placebo-controlled multicenter study, Alcoholism: Clinical and Experimental Research, 31, 1179 (2007). [ Links ]
174. Disease Management. Pharmacological options for maintenance treatment of opioid dependence include opioid agonists and antagonists, Drugs & Therapy Perspectives, 28(8), 11 (2012). [ Links ]
175. L.R. Webster, R. Brewer, C. Wang, D. Sekora, F.K. Johnson, D. Morris, J. Stauffer, Long-term safety and efficacy of morphine sulfate and naltrexone hydrochloride extended release capsules, a novel formulation containing morphine and sequestered naltrexone, in patients with chronic, moderate to severe pain, J. Pain Symptom. Manag., 40, 734 (2010). [ Links ]
176. Food and Drug Administration (FDA), URL: http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm406407.htm, accesado en octubre, 2015. [ Links ]
177. J.P. Smith, S.I. Bingaman, F. Ruggiero, D.T. Mauger, A. Mukherjee, C.O. McGovern, I.S. Zagon, Therapy with the opioid antagonist naltrexone promotes mucosal healing in active CrohnÂfs disease: A randomized placebo-controlled trial, Dig. Dis. Sci., 56, 2088 (2010). [ Links ]
178. K. Papay, S.X. Xie, M. Stern, H. Hurtig, A. Siderowf, J.E. Duda, J. Minger, D. Weintraub, Naltrexone for impulse control disorders in Parkinson disease: A placebo-controlled study, Neurology, 83, 826 (2014). [ Links ]














