Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.45 no.1 Bogotá Jan./Apr. 2016
https://doi.org/10.15446/rcciquifa.v45n1.58023
DOI: http://dx.doi.org/10.15446/rcciquifa.v45n1.58023
Validación de una metodología analítica para la cuantificación de polifenoles totales, en procesos de extracción asistida por microondas sobre frutos de la especie colombiana Vaccinium meridionale
Validation of an analytical method for quantification of total polyphenols in microwave-assisted extraction processes for the Colombian species Vaccinium meridionale
Wilfred E. Espinosa Manrique1*, Luis C. A. Garzón Salcedo2, Oscar J. Medina Vargas1**
1 Grupo de Investigación en Química y Tecnología de Alimentos, Facultad de Ciencias, Universidad Pedagógica y Tecnológica de Colombia, Avenida Central del Norte 39–115, Código postal 150003, Tunja, Boyacá, Colombia.
2 Grupo de Investigación Núcleo, Facultad de Ciencias e Ingeniería, Universidad de Boyacá, Carrera 2ª Este No. 64–169, Código postal 150003, Tunja, Boyacá, Colombia. Correo electrónico: lcgarzon@uniboyaca.edu.co
* Correo electrónico: wilfred.espinosa@uptc.edu.co
** Correo electrónico: oscar.medina@uptc.edu.co
Recibido para evaluación: 18 de octubre de 2015. Aceptado para publicación: 8 de febrero de 2016.
Resumen
En este trabajo se muestra el desarrollo y la validación de un método analítico para la cuantificación de polifenoles totales con el reactivo de Folin-Ciocalteu (F–C),en procesos de extracción asistida por microondas (MAE), sobre frutos de la especie colombiana Vaccinium meridionale. Los resultados obtenidos en los parámetros selectividad, linealidad, repetibilidad y exactitud muestran que la metodología propuesta es confiable para evaluar el efecto de las condiciones de extracción sobre la cantidad de polifenoles removidos.
Palabras clave: Validación de métodos analíticos, extractos vegetales, polifenoles, reactivo de Folin-Ciocalteu, Vaccinium meridionale, extracción asistida por microondas.
Summary
In this work, we show the development and validation of an analytical method for quantification of total polyphenols with Folin-Ciocalteu reagent (F–C) in microwave-assisted extraction processes for Colombian species Vaccinium meridionale. Experimental results of selectivity, linearity, repeatability and accuracy evidence that the methodology proposed is reliable to evaluate the effect of the extraction conditions over the quantity of polyphenols removed.
Keywords: Validation of analytical methods, Plant extracts, Polyphenols, Folin-Ciocalteu reagent, Vaccinium meridionale, Microwave-assisted extraction.
Introducción
Actualmente, existe un notable interés de la comunidad científica por conocer y aplicar las propiedades benéficas de alimentos naturales con actividad antioxidante. La evaluación de esta actividad biológica es de naturaleza compleja, ya que los alimentos están constituidos por una gran variedad de compuestos químicos, y se torna difícil el estudio farmacológico de las distintas interacciones moleculares que tienen lugar al interior de un organismo luego de su ingesta; en particular, el conocimiento de posibles efectos sinérgicos.
Las moléculas con capacidad antioxidante han sido clasificadas en cuatro grandes grupos [1]: enzimas (superóxidodismutasa, glutatión peroxidasa, catalasa, ferroxidasa); macromoléculas (albúmina, ferritina); moléculas pequeñas (ácido ascórbico, glutatión, ácido úrico, tocoferol, caroteniodes, polifenoles) y hormonas (estrógenos, angiotensina, melatonina). Estos compuestoscontribuyen a la prevención de enfermedades relacionadas con fenómenos de estrés oxidativo [2].
Por su parte, los metabolitos secundarios denominados polifenoles son considerados los compuestos antioxidantes más importantes de la dieta, contienen grupos funcionales hidroxilo sobre anillos aromáticos. Son una gran familia conformada por un conjunto muy variado de moléculas, desde las más simples (como lo es un anillo aromático con uno o más grupos hidroxilos), hasta las más complejas (como polímeros de alto peso molecular). A estos compuestos no solo se les ha atribuido propiedades antioxidantes, existen también entre otros, reportes de actividad antinflamatoria y antimicrobiana [3-9].
Aunque los polifenoles se han extraído tradicionalmente con solventes acuosos y no acuosos en reflujo a 90 °C, durante 24 horas [10], en las últimas décadas se han implementado otras técnicas para su extracción. Se destaca la extracción asistida por microondas, conocida por sus siglas en inglés como MAE. En dicha técnica, una muestra de material vegetal y un solvente se exponen a radiación microondas bajo condiciones controladas de temperatura y presión; las moléculas de agua presentes en los sistemas vasculares de las plantas rompen los tejidos, liberan las biomoléculas allí contenidas y se incorporan al solvente. En estas condiciones, el solvente puede incluso alcanzar temperaturas superiores a su punto de ebullición [11]. Comparado con los métodos tradicionales, la técnica MAE ofrece muchas ventajas, como son los cortos tiempos de extracción, un menor consumo de solvente, extractos de mejor calidad, disminución en los costos, entre otras. Existen muchos factores que influyen sobre el proceso de extracción: potencia, temperatura, tiempo de extracción, naturaleza del solvente, relación sólido-solvente, tiempo de contacto del material vegetal con el solvente y tamaño de partícula [12].
Los frutos del género Vaccinium (Ericaceae) contienen gran cantidad de compuestos polifenólicos, y han sido empleados tradicionalmente por muchas comunidades indígenas con fines nutricionales y terapéuticos. En el presente, varias especies de este género tienen gran importancia en la actividad económica mundial. En Estados Unidos, por ejemplo, son comercializadas de manera significativa las especies Vaccinium corymbosum L., V. angustifolium Ait., V. asheireade y V. macrocarpon. Dentro del conjunto de suplementos dietarios, el extracto de V. macrocarpon que, frecuentemente, es usado para mantener en buen estado el tracto urinario, ocupa el puesto 14 en popularidad; mientras que el extracto de V. myrtillus L. (similar al V. angustifolium), se ubica en el puesto 21, gracias a sus efectos benéficos sobre el sistema vascular y la retina. En el 2006 había más de 180 productos fitofarmacéuticos en el mercado con extractos de frutos de este género [13].
Estudios realizados con el uso de algunas especies del género Vaccinium han mostrado inhibición de crecimiento de células cancerígenas, mejoramiento de la visión, efectos benéficos sobre desórdenes cardiovasculares, enfermedades degenerativas y estrés oxidativo inducido por la edad, entre otros [14-17]. En Colombia es particular el caso de la especie Vaccinium meridionale (su fruto de color rojo oscuro de diámetro entre 5 y 10 mm [18] que se conoce en el altiplano cundiboyacense como "agraz" o "mortiño"), que habita en la zona Andina entre los 2600 y 4000 m.s.n.m. Un estudio de investigación realizado por Lopera y colaboradores con extractos no alcohólicos de fermentos de este fruto, permitió observar un efecto cardioprotector en ratas [19]. Por su parte, Maldonado y colaboradores encontraron una marcada actividad antioxidante, efectos citotóxicos y antiproliferativos en líneas celulares de cáncer de colon con extractos acuosos de Vaccinium meridionale [20].
Con base en lo anterior, y con el ánimo de obtener extractos del fruto Vaccinium meridionale con mejores propiedades antioxidantes, nos propusimos estudiar, en procesos de extracción asistida por microondas, el efecto de las condiciones experimentales sobre la cantidad de polifenoles totales removidos a través de su cuantificación, con el método de Folin–Ciocalteu (F–C), siendo el ácido gálico (AG) la molécula de referencia. El reactivo de F–C es una solución acuosa de color amarillo que contiene fosfotungstatos-molibdatos capaces de capturar uno o dos electrones en reacciones redox y formar especies de color azul (por ejemplo, el (PMoW11O40)4-), con un máximo de absorción a 760 nm de longitud de onda. En el caso particular de los compuestos fenólicos, el medio se ajusta con bicarbonato de sodio hasta un pH ≈ 10 para que los fenolatos formados reduzcan el reactivo de F–C. Las especies coloreadas resultantes son independientes de la estructura de los compuestos fenólicos [2].
La revisión de los antecedentes permitió determinar las siguientes condiciones experimentales [10,11, 21–24]: potencia (300–900 W), temperatura (70–110 °C), relación solvente:fruto seco (Fs) (30:1–70:1 p/p), tiempo (5–15 min) y sistema solvente H2O – EtOH (0 – 80% EtOH). El análisis de las variables experimentales sobre la eficiencia del proceso extractivo, así como el establecimiento de las mejores condiciones, se efectuará por medio de la metodología de la superficie de respuesta [25, 26].
En ese sentido, el diseño y la validación de una metodología analítica que permita demostrar la confiabilidad de los resultados experimentales, con respecto a la cuantificación de polifenoles totales con el reactivo de F–C en cada uno de los extractos objeto de estudio, es imprescindible. Este artículo muestra los resultados obtenidos en la fase de validación, y en particular, la evaluación de los parámetros selectividad, linealidad, repetibilidad y exactitud.
Metodología
Instrumentos y equipos
Balanza analítica Ohaus Explorer EX 224, capacidad 220 g, incertidumbre ± 10-4 g. Espectrofotómetro Hach DR 5000, rango de longitud de onda: 190-1100 nm, precisión de longitud de onda: ± 1 nm entre 200 y 900 nm, precisión fotométrica: 1% entre 0,50-2,0 de absorbancia. Sistema microondas de digestión/extracción Sineo MDS-8G, control de presión al interior del sistema: 0,0-10,0 ± 0,01 MPa, control de temperatura: 0-300 ±1 °C, frecuencia de microonda: 2450 ± 50 MHz. Centrífuga Hettichrotina 46 S, 4000 rpm máximo. Molino analítico IKAA 11. Sonicador Branson CPX 5800H. Estufa de secado Memmert UM400.
Reactivos
Reactivo del fenol según Folin–Ciocalteu 2N, Merck. Ácido gálico monohidratado Panreac, pureza ≥ 0,99 en fracción másica (No. CAS: 149-91-7). Agua desgasificada ultrapura (tipo I), sistema Pall Corporation Cascada LS®, conductividad: 0,056 µS∙cm-1. Etanol absoluto para análisis EMSURE®, Merck, (No. CAS: 64-17-5). Carbonato de sodio monohidratado Mallinckrodt R.A., pureza ≥ 0,999 en fracción másica (No. CAS: 497-19-8).
Material vegetal
Los frutos frescos de la especie Vaccinium meridionale fueron obtenidos de un hábitat nativo ubicado en el municipio de Chiquinquirá (Boyacá) de altitud entre 2500-2600 m.s.n.m, precipitación media de 990 mm anuales, temperatura media de 12,9 °C (máxima de 19,3 °C y mínima de 7,4 °C). Una vez colectados, se llevaron inmediatamente al Laboratorio de Química y Tecnología de Alimentos de la Universidad Pedagógica y Tecnológica de Colombia (Tunja, Boyacá). Allí se efectuó una remoción manual de hojas y tallos, y se hicieron varios lavados con agua desgasificada ultrapura (tipo I). Los frutos limpios se ingresaron a una estufa para su deshidratación.
Obtención del fruto seco
El fruto fresco de Vaccinium meridionale se secó en una estufa Memmert UM400 a 40 °C hasta que su peso se mantuviera constante por 12 h. Posteriormente, el fruto seco se trituró con un molino analítico IKAA 11, y la muestra se pasó por un tamiz de 0,5 mm. Las partículas que atravesaron el tamiz fueron almacenadas en un desecador y puestas en un congelador a –4 °C.
Obtención de los extractos del fruto Vaccinium meridionale
Se pesó 400,0 ± 0,1 mg de fruta seca (Fs) y se mezcló con 20,0000 ± 0,0001 g de sistema solvente (EtOH 0%, EtOH 40% y EtOH 80%). La mezcla obtenida se expuso a ultrasonido por 5 minutos en un sonicador Branson CPX 5800H para su homogenización. Posteriormente, se llevó al sistema microondas de digestión/extracción Sineo MDS-8G, según las condiciones de extracción requeridas. Finalmente, se agitó la mezcla por 15 min y se centrifugó a 4000 rpm, por espacio de 20 min, en una Centrífuga Hettichrotina 46 S. Se le denominó extracto al sobrenadante obtenido. Los extractos totalmente acuosos se almacenaron en un refrigerador a 4 °C, y los extractos con etanol en un congelador a –4 °C. En cualquier caso, el tiempo transcurrido entre la obtención del extracto y su cuantificación no superó las 24 horas.
Curva de calibración para el ácido gálico
Las soluciones estándar de AG fueron preparadas por pesada. El AG fue puesto en el desecador por lo menos 72 h antes de su uso. La masa se midió con una balanza analítica Ohaus Explorer EX 224, de capacidad 220 g e incertidumbre ± 10-4 g. En cada réplica se pesó un equivalente de 43 mg de AG y se mezcló con agua ultrapura hasta obtener una masa final de 49,8 g. De allí se pesaron seis muestras diferentes, con masas desde 25 hasta 65 mg de solución de AG y se llevaron a un balón aforado de 5 mL. Al balón se le agregaron 125 µL de reactivo de F–C 2N y se homogenizó por 1 min. Después se adicionaron 400 µL de solución de carbonato de calcio al 10% (p/p) y se llevó al aforo con agua. Se homogenizó por 30 s y se dejó en un sitio oscuro por 1 h. La solución se llevó a un espectrofotómetro Hach DR 5000 y se midió su absorbancia a 760 nm de longitud de onda.
Cuantificación de polifenoles totales en los extractos
Se pesó una muestra de extracto y se llevó a un balón aforado de 5 mL. A partir de allí se realizó el mismo procedimiento del apartado anterior. La cantidad de polifenoles totales contenidas en el extracto, expresada en mg AG/g Fs (mg de AG por g de fruta seca), se calculó a partir de cada valor de absorbancia, mediante la curva de calibración para el AG y considerando la dilución realizada; y esta fue como se indica en la ecuación 1:

Donde mgste es la masa (mg) del solvente empleada para producir el extracto, A la absorbancia de la solución diluida, b es el intercepto de la curva de calibración, m es la pendiente de la curva de calibración, mgext.es la alícuota de extracto (mg), y gFs es la masa de fruto seco (g) empleada para producir el extracto.
Selectividad
Estudios anteriores han reportado fenómenos de interferencia para la cuantificación de polifenoles totales con el reactivo de F–C. Entre la familia de compuestos se destacan algunos ácidos orgánicos, bases nitrogenadas, aminoácidos, aminas aromáticas, azúcares, proteínas y cationes metálicos (hierro (II), cobre (I)). Pese a dichos inconvenientes, el método de F–C ha sido ampliamente empleado y recomendado por ser simple y reproducible [1, 2, 9].
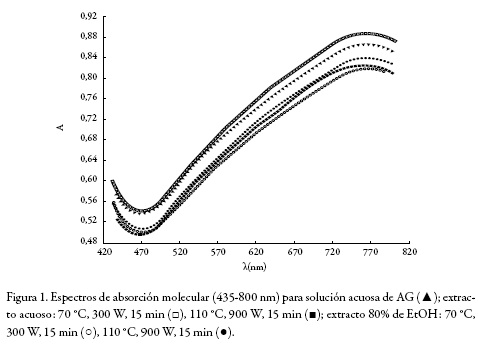
Con el objeto de evaluar el efecto del proceso de extracción sobre la cuantificación de polifenoles totales con el reactivo de F–C, se compararon los espectros de absorción molecular de una solución acuosa de AG con extractos acuosos de Vaccinium meridionale, empleando el mayor tiempo de extracción (15 min) y los límites superiores e inferiores para concentración de EtOH, temperatura y potencia; esto es: 0% y 80% de EtOH; 70 y 110 °C; 300 y 900 W. Para facilitar la comparación, en cada sistema se empleó la cantidad adecuada para que la absorbancia en la región de máxima absorción se encontrara entre 0,8 y 0,9.
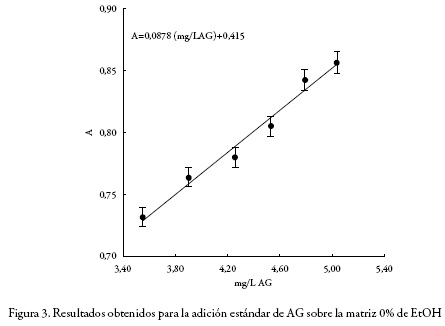
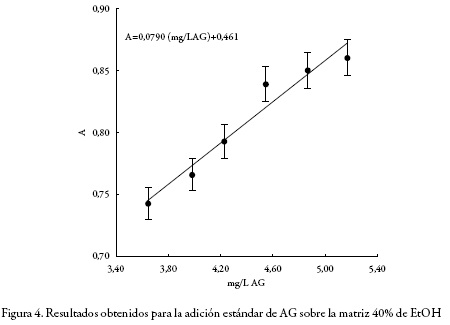
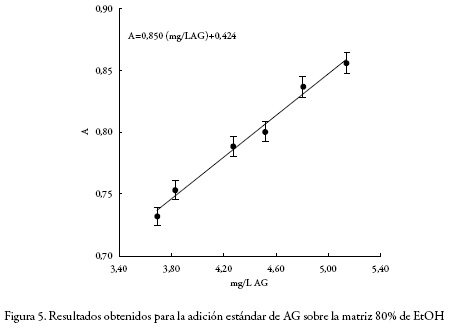
Dado que un extracto vegetal como sistema es una matriz compleja, y además, que no es posible obtener la matriz sin el analito (polifenoles), la selectividad debe ser evaluada por medio de la comparación de pendientes entre curvas de adición estándar [27-28]. En este trabajo se emplearon 4 muestras, en cada una de ellas se adicionó la misma cantidad de estándar (AG) para cada nivel de concentración. Se realizaron seis adiciones consecutivas, desde una concentración equivalente a 3,6 mg/L AG hasta una concentración de 5,1 mg/L AG. La muestra 1 no incluye matriz, la muestra 2 es el extracto obtenido con agua pura como solvente (0% EtOH): la muestra 3 es el extracto obtenido con la mezcla (agua 60%:EtOH 40%) y la muestra 4 es el extracto obtenido con la mezcla (agua 20%: EtOH 80%). Las tres matrices (muestras 2, 3 y 4) fueron obtenidas en las condiciones máximas de extracción definidas para la temperatura, potencia y tiempo; esto es: 110 °C, 900 W y 15 min, respectivamente. Las cuatro curvas fueron comparadas a partir de los valores de sus pendientes por medio de un análisis de varianza (ANOVA). Si las cuatro curvas son paralelas dentro de la incertidumbre experimental, se demuestra que el método es selectivo, ya que el efecto de la matriz sobre la respuesta instrumental es producido únicamente por la presencia del analito en la misma.
Linealidad
Para la evaluar este parámetro se siguieron los lineamientos establecidos por la guía ICH Q2(R1) [29]. Se prepararon seis soluciones de AG con concentraciones 3,9; 5,1; 6,3; 7,5; 8,7; 9,9 mg/L, y se midió la absorbancia de cada una de ellas a 760 nm. En total se emplearon cuatro réplicas. A los resultados experimentales se le aplicaron las pruebas estadísticas C de Cochran, ANOVA y t de Student para la linealidad, con un nivel de confianza del 95%.
Límites de detección y de cuantificación
Los límites de detección y de cuantificación fueron determinados por medio de la desviación estándar del blanco [29]. Se midió la absorbancia del reactivo de F–C a 760 nm siete veces en días diferentes. El límite de detección fue calculado con el valor promedio de la absorbancia más tres veces la desviación estándar del blanco, y el límite de cuantificación con el valor promedio de la absorbancia más diez veces la desviación estándar del blanco.
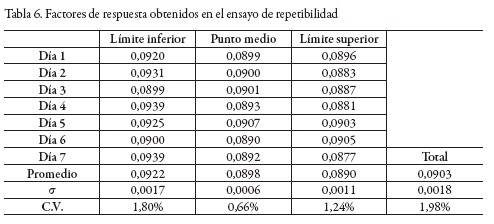
Precisión: repetibilidad
La repetibilidad se evaluó a partir del coeficiente de variación del factor de respuesta [30]. Se realizaron siete réplicas en días diferentes en los límites superior e inferior (9,9 y 3,9 mg/L AG), y en el punto medio del rango (6,9 mg/L AG).
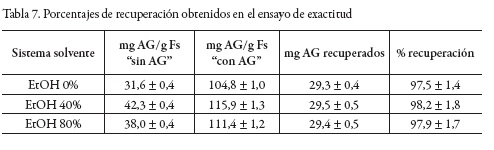
Exactitud
La evaluación de la exactitud se realizó a través del porcentaje de recuperación [27]. Se emplearon tres sistemas solventes: EtOH 0%, EtOH 40% y EtOH 80%. Con tres réplicas, se pesó en cada sistema 400,0 ± 0,1 mg de fruta seca (Fs) y se mezcló con 20,0000 ± 0,0001 g de solvente. Posteriormente, se llevó a cabo el proceso de extracción con microondas bajo las máximas condiciones definidas (110 °C, 900 W y 15 min), y se determinó la cantidad de polifenoles extraídos en mg AG/g Fs. A este conjunto de ensayos se les denominó "sin AG". Adicionalmente, se construyó otro conjunto de ensayos en condiciones similares al anterior, y fue denominado "con AG", al que se le adicionó previamente un equivalente de 30,0 ± 0,1 mg de AG al sistema solvente. Con base en los resultados obtenidos se calculó el porcentaje de recuperación, como se muestra a continuación:
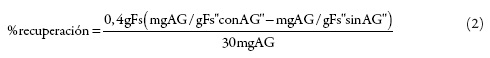
Resultados y discusión
Selectividad
La figura 1 muestra los espectros de absorción molecular obtenidos para la solución patrón de AG y los extractos de Vaccinium meridionale. Desde el punto de vista cualitativo, no se apreciaron diferencias significativas entre el espectro de absorción del AG y los espectros de los polifenoles presentes en cada extracto. De allí se puede deducir que las condiciones de extracción seleccionadas no afectan el proceso de cuantificación de polifenoles totales con el reactivo de F–C.
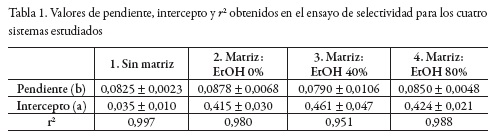
Por su parte, en las figuras 2, 3, 4 y 5 se muestra el comportamiento obtenido luego de realizar la adición estándar de AG en cada uno de los sistemas considerados: sin matriz, matriz 0%, matriz 40% y matriz 80% de EtOH, respectivamente; y en la tabla 1 se presentan los valores de r2, intercepto y pendiente para cada sistema estudiado, junto con sus respectivas desviaciones estándar calculadas con el software LAB fit [31].
Se realizó la prueba ANOVA para evaluar la igualdad de los valores de la pendiente obtenido en cada uno de los sistemas estudiados. Como se puede observar en la tabla 2, y con un nivel de confianza del 95%, no se encontraron diferencias estadísticamente significativas. Por lo anterior, se infiere que el método es selectivo.
Linealidad
La figura 6 muestra los resultados obtenidos en la cuantificación de polifenoles totales con el reactivo de F–C y AG como molécula de referencia. Allí se presenta la ecuación de la recta, el coeficiente de correlación y la desviación estándar del intercepto y la pendiente.
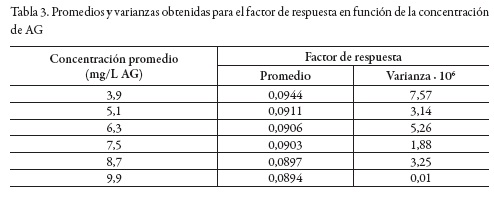
En la tabla 3 se muestran los promedios y varianzas obtenidos para el factor de respuesta en función de la concentración de analito de la curva de calibración. Los resultados encontrados en el test C de Cochran fueron 0,359 para Cexp. y 0,532 para Ctabla. De allí se puede inferir que la variabilidad de los resultados no depende de la concentración de AG, es decir, se presenta una distribución homocedástica [32].
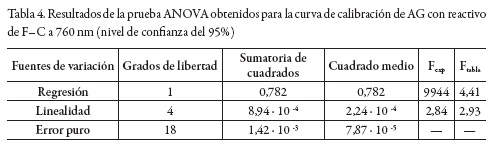
Los resultados obtenidos en la prueba ANOVA se presentan en la tabla 4, con un nivel de confianza del 95%. Como se puede observar, existe una diferencia estadísticamente significativa de absorbancia para cada valor de concentración de AG (regresión), indicando que el método es sensible a los cambios de concentración; y no se encuentran diferencias estadísticamente significativas entre los resultados de las réplicas para cada una de las concentraciones (linealidad).
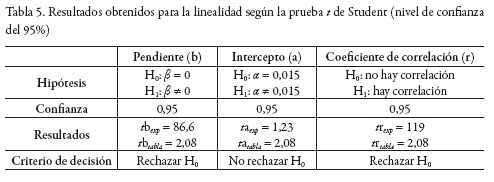
Por su parte, en la tabla 5 se muestran los resultados encontrados para la linealidad según la prueba t de Student. Con un nivel de confianza del 95%, y n-2 grados de libertad, se encuentra una relación directamente proporcional entre la concentración de AG y la respuesta analítica (A), para el rango comprendido entre 3,9 y 9,9 mg/L AG. La pendiente es estadísticamente diferente de 0 (β ≠ 0), y el intercepto no es estadísticamente diferente del valor encontrado para el blanco (α = 0,015), como se muestra en la sección límite de detección y de cuantificación. De acuerdo con esto se puede inferir que los errores sistemáticos no afectan la linealidad del método [33].
Límite de detección y de cuantificación
La medida de la absorbancia del blanco con siete réplicas presentó una respuesta de 0,015 ± 0,005. Con base en lo anterior, y empleando la curva de calibración, se encontró para el AG un límite de detección de 0,34 mg/L y un límite de cuantificación de 0,42 mg/L.
Precisión: repetibilidad
En la tabla 6 se presentan los resultados obtenidos para el factor de respuesta, medidos en los límites superior e inferior, y en el punto medio del rango. El método es preciso al nivel de la repetibilidad, dado que el coeficiente de variación procedente de todos los puntos es inferior al 2% [27].
Exactitud
En la tabla 7 se muestran los resultados obtenidos para el recobro del AG en el proceso de extracción y de cuantificación de polifenoles totales con el reactivo de F–C. En general, se encontraron porcentajes de recuperación superiores al 97%.
Conclusiones
Los resultados obtenidos para la selectividad, linealidad, repetibilidad y exactitud demuestran que la metodología propuesta es confiable, a un nivel del 95%, para cuantificar polifenoles totales del fruto Vaccinium meridionale con el reactivo de Folin–Ciocalteu. De esta manera, puede ser empleada para evaluar la influencia de las condiciones de extracción asistidas por microondas, sobre la cantidad de polifenoles extraídos.
Agradecimientos
Los autores agradecen a la Universidad Tecnológica y Pedagógica de Colombia (UPTC) y a la Universidad de Boyacá (UB) por la disponibilidad de laboratorios, instrumentos y reactivos requeridos para la realización de este trabajo.
Referencias
1. R.L. Prior, X. Wu, K. Schaich, Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements, J. Agric. Food Chem., 53, 4290 (2005). [ Links ]
2. D. Huang, B. Ou, R.L. Prior, The chemistry behind antioxidant capacity assays, J. Agric. Food Chem., 53, 1841 (2005). [ Links ]
3. M.D. dos Santos, M.C. Almeida, N.P. Lopes, G.E. Petto, Evaluation of the anti-inflammatory, analgesic, and antipyretic activities of the natural polyphenol chlorogenic acid, Biol. Pharm. Bull., 29, 2236 (2006). [ Links ]
4. M. Kratchanova, P. Denev, M. Ciz, A. Lojek, A. Mihailov, Evaluation of antioxidant activity of medicinal plants containing polyphenol compounds. Comparison of two extraction systems, Acta Biochim. Pol., 57, 229 (2010). [ Links ]
5. N.C. Gordon, D.W. Wareham, Antimicrobial activity of the green tea polyphenol (-)-epigallocatechin-3-gallate (EGCG) against clinical isolates of Stenotrophomonas maltophilia, Int. J. Antimicrob. Agents, 36, 129 (2010). [ Links ]
6. J.M. Leiro, M. Varela, M.C. Piazzon, J.A. Arranz, M. Noya, J. Lamas, The anti-inflammatory activity of the polyphenol resveratrol may be partially related to inhibition of tumour necrosis factor-alpha (TNF-alpha) pre-mRNA splicing, Mol. Immunol., 47, 1114 (2009). [ Links ]
7. R. China, S. Mukherjee, S. Sen, S. Bose, S. Datta, H. Koley, S. Ghosh, P. Dhar, Antimicrobial activity of Sesbania grandiflora flower polyphenol extracts on some pathogenic bacteria and growth stimulatory effect on the probiotic organism Lactobacillus acidophilus, Microbiol. Res., 167, 500 (2012). [ Links ]
8. A. Grigore, S. Colceru-Mihul, S. Litescu, M. Panteli, I. Rasit, Correlation between polyphenol content and anti-inflammatory activity of Verbascum phlomoides (mullein), Pharm. Biol., 51, 925 (2013). [ Links ]
9. L.Y. Chen, C.W. Cheng, J.Y. Liang, Effect of esterification condensation on the Folin-Ciocalteu method for the quantitative measurement of total phenols, Food Chem.,170, 10 (2015). [ Links ]
10. C. Proestos, M. Komaitis, Application of microwave-assisted extraction to the fast extraction of plant phenolic compounds, LWT - Food Sci. Technol., 41, 652 (2008). [ Links ]
11. L. Zhang, Y. Wang, D. Wu, M. Xu, J. Chen, Microwave-assisted extraction of polyphenols from Camellia oleifera fruit hull, Molecules, 16, 4428 (2011). [ Links ]
12. S. Jokíc, M. Cvjetko, D. Bozic, S. Fabek, N. Toth, J. Vorkapic-Furac, I.R. Redovnikovic, Optimisation of microwave-assisted extraction of phenolic compounds from broccoli and its antioxidant activity, Int. J. Food Sci. Tech., 47, 2613 (2012). [ Links ]
13. L.J. Cseke, A. Kirakosyan, P.B. Kaufman, S.L. Warber, J.A. Duke, H.L. Brielmann, "Natural Products from Plants", CRC Press, Boca Ratón, 2006, p. 528. [ Links ]
14. I.A.L. Persson, K. Persson, R.G.G. Andersson, Effect of Vaccinium myrtillus and its polyphenols on angiotensin-converting enzyme activity in human endothelial cells, J.Agric. Food Chem., 57, 4626 (2009). [ Links ]
15. G.A. Garzón, C.E. Narváez, K.M. Riedl, S.J. Schwartzb, Chemical composition, anthocyanins, non-anthocyanin phenolics and antioxidant activity of wild bilberry (Vaccinium meridionale Swartz) from Colombia, Food Chem., 122, 980 (2010). [ Links ]
16. M. Kondo, S.L. MacKinnon, C.C. Craft, M.D. Matchett, R.A. Hurta, C.C. Neto, Ursolic acid and its esters: occurrence in cranberries and other Vaccinium fruitand effects on matrix metalloproteinase activity in DU145 prostate tumor cells, J. Sci. Food Agric., 91, 789 (2011). [ Links ]
17. J. Ferrier, S. Djeffal, H.P. Morgan, S.P.V. Kloet, S. Redžić, A. Cuerrier, M.J. Balick, J.T. Arnason, Antiglycation activity of Vaccinium spp. (Ericaceae) from the Sam Vander Kloet collection for the treatment of type II diabetes, Botany, 90, 401 (2012). [ Links ]
18. C. Gaviria, C. Ochoa, N. Sánchez, C. Medina, M. Lobo, P. Galeano, A. Mosquera, A. Tamayo, Y. Lopera, B. Rojano, Actividad antioxidante e inhibición de la peroxidación lipídica de extractos de frutos de mortiño (Vaccinium meridionale SW), Bol. Latinoamer. Caribe Plant. Med. Aromát., 8, 519 (2009). [ Links ]
19. Y.E. Lopera, J. Fantinelli, L.F. González, B. Rojano, J.L. Ríos, G. Schinella, S. Mosca, Antioxidant activity and cardioprotective effect of a nonalcoholic extract of Vaccinium meridionale Swartzduring ischemia-reperfusion in rats, Evid.-Based Complement. Alternat. Med., 2013, ID 516727 (2013). [ Links ]
20. M.E. Maldonado, S.S. Arango, B.A. Rojano, Free radical scavenging capacity and cytotoxic and antiproliferative effects of Vaccinium meridionale Sw. against colon cancer cell lines, Rev. Cubana Plant. Med., 19, 172 (2014). [ Links ]
21. E. Karimi, H.Z.E. Jaafar, HPLC and GC-MS determination of bioactive compounds in microwave obtained extracts of three varieties of Labisia pumila Benth., Molecules, 16, 6791 (2011). [ Links ]
22. A. Fernández-Agulló, E. Pereira, M.S. Freire, P. Valentão, P.B. Andrade, J. González-Álvarez, J.A. Pereira, Influence of solvent on the antioxidant and antimicrobial properties of walnut (Juglans regia L.) green husk extracts, Ind. Crop. Prod., 42, 122 (2013). [ Links ]
23. P. García, A. Morales, A. Segura, A. Fernández, Phenolic-compound-extraction systems for fruit and vegetable samples, Molecules, 15, 8813 (2010). [ Links ]
24. A. Khoddami, M.A. Wilkes, T.H. Roberts, Techniques for analysis of plant phenolic compounds, Molecules, 18, 2328 (2013). [ Links ]
25. E. Karacabey, G. Mazza, Optimisation of antioxidant activity of grape cane extracts using response surface methodology, Food Chem., 119, 343 (2010). [ Links ]
26. K.N. Prasad, F.A. Hassan, B. Yang, K.W. Kong, R.N. Ramanan, A. Azlan, A. Ismail, Response surface optimisation for the extraction of phenolic compounds and antioxidant capacities of underutilised Mangifera pajang Kosterm. Peels, Food Chem., 128, 1121 (2011). [ Links ]
27. P. Bruce, P. Minkkinen, M.L. Riekkola, Practical method validation: Validation sufficient for an analysis method, Mikrochim. Acta, 128, 93 (1998). [ Links ]
28. A. Blainski, G.C. Lopes, J.C. Palazzo de Mello, Application and analysis of the Folin Ciocalteu method for the determination of the total phenolic content from Limonium Brasiliense L., Molecules, 18, 6852 (2013). [ Links ]
29. ICH Harmonised Tripartite Guideline, ICHQ2(R), Validation of analyticalprocedures: Text and methodolgy Q2(R1), International Conference on Harmonisation of Technical Requirements for registration pharmaceuticals for human use, 1994, pp. 1-12. [ Links ]
30. F.T. Peters, O.H. Drummer, F. Musshoff, Validation of new methods, Forensic Sci. Int., 165, 216 (2007). [ Links ]
31. W.P. Silva, C.M.D.P. Silva, LAB Fit Curve Fitting Software (Nonlinear Regression and Treatment of Data Program) V 7.2.48 (1999-2011). URL: http://www.labfit.net, consultado en agosto de 2015. [ Links ]
32. J.N. Miller, J.C. Miller, "Estadística y quimiometría para química analítica", Prentice Hall, Madrid, 2002, pp. 97-98. [ Links ]
33. A. Álvarez, M. Trujillo, Desarrollo y validación de un método analítico indicativo de estabilidad por HPLC para la cuantificación de Rosuvastatina cálcica, Rev. Colomb. Cienc. Quím. Farm., 43, 69 (2014). [ Links ]