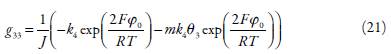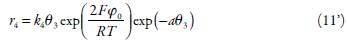INTRODUCCIÓN
Procarbacina, o sea, el hidrocloruro de N-isopropilo-α-(2-metilhidracino)-p-toluamida (IUPAC: \V-isopropil-4-[(2-metilhidrazino)metil] benzamida, CAS: 671-16-9) es uno de los agentes de quimioterapia usados en el tratamiento de varias formas de cáncer [1-3].
El mecanismo exacto de su acción anticancerígena aún no ha sido descubierto, pero ya hay evidencias de que muchos compuestos presentes en el organismo humano, como enzimas y complejos de metales de transición, pueden llevar a la procarbacina a su transformación en compuestos tóxicos, como aldehídos, hidracinas y radicales libres que pueden conducir a los problemas de hígado, renales y hasta a la modificación del ADN [4-8]. En este orden de ideas, el desarrollo de un método, capaz de detectar, de manera rápida, precisa y exacta, la concentración de procarbacina en el cuerpo, sea por una metodología in vivo o in vitro, es, sin duda, una tarea actual [9].
Los métodos electroquímicos, hoy en día, han obtenido su popularidad en el análisis farmacéutico y toxicológico, no solo de fármacos, sino también de otras sustancias biológicamente activas (empleando, en muchos casos, electrodos químicamente modificados), por poseer una rapidez, precisión, sensibilidad y exactitud excelentes [10-14]. Sin embargo, hay varios problemas enfrentados por el desarrollo de tales metodologías, como los siguientes:
- alto potencial de oxidación de algunos fármacos, como la gabapentina [10], requiriendo la aplicación de sobrevoltajes altos, o modificación de electrodos por sustancias exóticas, inestables o difíciles de obtener [11];
- aparición de inestabilidades electroquímicas, como oscilaciones en corriente y potencial, características para la electrooxidación de pequeñas moléculas orgánicas e hidrógeno [15-18] (incluyendo la electropolimerización de compuestos heterocíclicos;
- desconocimiento del mecanismo más probable de oxidación electroquímica de cierto compuesto en ciertas condiciones (que puede correr para una sustancia de forma diferente en varias condiciones, por ejemplo, para compuestos indólicos [19]), como el caso de procarbacina, de cuyo comportamiento electroquímico todavía hay pocos relatos [9].
La interpretación mecanística empírica y fenomenológica del sistema, aunque se esté basando en argumentos lógicos de datos experimentales, carece de un fundamento rígido teórico, que solo se ofrece mediante el desarrollo y análisis de un modelo matemático, capaz de describir adecuadamente el comportamiento del sistema.
Otro beneficio, ofertado por este modelaje, es la posibilidad de comparar, mediante el cotejo de modelos respectivos, el comportamiento del sistema con los semejantes sin ensayos experimentales. El modelaje y el análisis del modelo también pueden usarse como una herramienta de previsión, analizando el comportamiento de sistemas que aún no se han investigado experimentalmente.
Así, este trabajo tiene como objetivo general el ahondamiento teórico de la investigación mecanística del proceso de la electrooxidación de procarbacina. Su realización requiere el alcance de los siguientes objetivos específicos:
- el desarrollo y la exposición del modelo matemático, correspondiente al mecanismo propuesto de la electrooxidación del fármaco;
- el análisis de estabilidad de estado estacionario en el sistema, mediante la teoría de estabilidad linear y de bifurcaciones;
- comparación y superposición teórica del comportamiento de este sistema con el de los semejantes [20,21].
EL SISTEMA Y SU MODELO
Según las observaciones experimentales [9], para la electrooxidación del fármaco, puede ser postulado el mecanismo de cuatro etapas como se menciona a continuación. En la primera etapa, el fármaco adsorbido en la superficie del ánodo es oxidado hasta su correspondiente diazocompuesto, según:
Este compuesto después se isomeriza, formando la base de Schiff, o sea, el compuesto azometínico, conforme:
Por contener un enlace azometínico, fácilmente polarizado, la base de Schiff se hidroliza en medio acuoso, formando el aldehído correspondiente:
Este a su vez, sufre la oxidación sucesiva hasta su ácido carbónico (o su sal, en presencia del catión del electrólito de soporte):
El aldehído y el ácido pueden ser usados para la obtención de polímeros conductores conjugados, colorantes (usando la condensación con los derivados α- y γ-metílicos [o metilénicos] de compuestos heterocíclicos con nitrógeno piridínico) u otras sustancias con aplicación semejante.
Como se trata de un proceso completamente superficial, o mejor, superficial con la participación del medio de reacción, que emplea cuatro etapas, matemáticamente será capaz de describirse (suponiendo que, al comienzo del proceso, el fármaco cubra el ánodo entero) con tres variables:
θ 1 - el grado de recubrimiento del ánodo por el diazocompuesto;
θ 2 - el grado de recubrimiento del ánodo por la base de Schiff;
θ 3 - el grado de recubrimiento del ánodo por el aldehído.
El diazocompuesto se forma durante la oxidación del azocompuesto y después se isomeriza, formando la base de Schiff. Puesto así, la ecuación de balance de su concentración superficial será descrita conforme:
en que r 1 y r 2 son velocidades de las reacciones (1) y (2) y G, la concentración máxima superficial de diazocompuesto en la superficie anódica.
La base de Schiff se obtiene cuando se isomeriza el diazocompuesto. Esta base después se hidroliza y, así siendo, su ecuación de balance será descrita como:
en que H es la concentración máxima superficial de la base de Schiff en el ánodo y r3 , la velocidad de la hidrólisis.
El aldehído se obtiene mediante la reacción (3) y se oxida hasta el ácido correspondiente, por medio de la reacción (4). En este orden de ideas, la ecuación de balance del aldehído se describirá como:
siendo J la concentración máxima superficial del aldehído y r4 , la velocidad de la reacción (4).
Las velocidades de las respectivas reacciones se pueden calcular como:
Como se puede ver, se trata de un proceso de naturaleza completamente superficial, donde las ecuaciones correspondientes se asemejan a las referentes a procesos superficiales en [20,21]. Los trazos comunes y las diferencias entre los procesos mencionados se discuten a continuación.
RESULTADOS Y DISCUSIÓN
Con el fin de investigar la electrooxidación de procarbacina desde el punto de vista de la búsqueda del mecanismo más probable, analizamos el conjunto de ecuaciones (5-7), teniendo en cuenta las relaciones algébricas (8-11) mediante la teoría de estabilidad lineal. La matriz funcional de Jacobi, cuyos elementos se calculan para el estado estacionario, se ve como:
en que:
Siendo j, / y m los parámetros que describen la dependencia de las capacitancias y estructuras de la doble capa eléctrica (DCE) y las concentraciones superficiales de las sustancias.
Una simple observación de los elementos del jacobiano da posibilidad de ver que el comportamiento oscilatorio en este caso es posible, porque se satisface la condición de la bifurcación de Hopf, que requiere la presencia de elementos positivos en la diagonal principal de la matriz del jacobiano. Los elementos 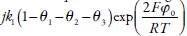 y
y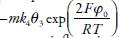 tienen valores positivos, cuando en la doble capa eléctrica (DCE) aparecen influencias que promueven la formación del hidrazocompuesto y del ácido en la superficie. Este factor es común para tales sistemas y también puede ser causa del comportamiento oscilatorio en [20,21]. Ya la frecuencia y la amplitud de oscilaciones van a depender del medio de la síntesis.
tienen valores positivos, cuando en la doble capa eléctrica (DCE) aparecen influencias que promueven la formación del hidrazocompuesto y del ácido en la superficie. Este factor es común para tales sistemas y también puede ser causa del comportamiento oscilatorio en [20,21]. Ya la frecuencia y la amplitud de oscilaciones van a depender del medio de la síntesis.
Para investigar la estabilidad de estado estacionario, se utiliza el criterio Routh-Hurwitz. Para simplificar los cálculos, evitando la aparición de grandes expresiones, podremos introducir nuevas variables, de modo que el determinante de la matriz se describe como:
Abriendo los paréntesis y teniendo en cuenta la condición de estabilidad Det J < 0, que se obtiene del criterio de Routh-Hurwitz, podemos obtener la condición en la forma:
Como las constantes de reacciones pueden tener únicamente positivas, se puede concluir que la inecuación (23) se satisfará en el caso de la positividad de los parámetros de la influencia de las reacciones electroquímicas a la DCE Ф, k1 Π, Θ y K, lo que hará dislocar la expresión al lado izquierdo de la inecuación a la región de parámetros más negativos, es decir, para más lejos del cero. Todos los parámetros mencionados tienden a tener valores positivos (simultáneamente), siendo ausentes o frágiles las influencias del proceso electroquímico a la DCE.
Tal factor es característico para sistemas de este tipo [20,21]. Sin embargo, al contrario de lo que se observa en los trabajos mencionados, las velocidades de los procesos son prácticamente iguales. Tal situación se mantiene, cuando la concentración superficial de procarbacina es mantenida establemente alta (y el modelo describe el caso del electrodo, completamente rellenado, en el inicio del proceso, por el fármaco). El único medio de la llegada de moléculas del fármaco a la superficie es su adsorción en el electrodo. Así, se puede concluir que el proceso será controlado por ella, lo que está de acuerdo con las observaciones experimentales [9].
En el caso de la igualdad de influencias estabilizadoras de estado estacionario a las des-estabilizadoras, ocurre la inestabilidad monotónica, cuya aparición tiene la condición de Det J = 0, o para el caso de este sistema:
La disolución de/producto fina/puede ocurrir cuando en la solución hay sustancias químicas, cuya presencia aumenta la disolución del ácido (4) en el agua. Para este caso, el modelo se modifica y la expresión de la velocidad de la oxidación del aldehído se describirá como:
En el que la variable α describe la interacción entre partículas adsorbidas de aldehído.
En este caso, existe otro factor del comportamiento oscilatorio, que es la atracción de partículas adsorbidas. Este factor también es causa del comportamiento oscilatorio en sistemas de electropolimerización de compuestos heterocíclicos y de electrosíntesis de monómeros [21].
La estabilidad del estado estacionario en este caso será regulada también por la disolución del ácido.
En este sistema no hay etapas autocatalíticas, pero, en el caso de su aparición, se modificará el modelo. La autocatálisis también será responsable por el comportamiento oscilatorio, lo que ocurre en [20,21].
CONCLUSIONES
En términos generales, el modelo matemático confirma el mecanismo, postulado experimentalmente:
- La estabilidad de estado estacionario es garantizada por la ausencia de influencias fuertes de los procesos electroquímicos a la doble capa eléctrica. La reacción es controlada por la adsorción del fármaco.
- La inestabilidad oscilatoria, en este caso, es posible, siendo causada por las fuertes influencias de los procesos electroquímicos a la doble capa eléctrica. Ya la amplitud y la frecuencia de las oscilaciones dependerán del medio de la síntesis. Así, se puede confirmar la presencia de estructuras disipativas temporales, cuya existencia se mantiene por la adsorción del fármaco y la formación del ácido como producto final.
- La inestabilidad monotónica también es posible, en el caso de igualdad entre influencias estabilizadoras e inestabilizadoras en la DCE.
- En el caso de la disolución del producto final, que, en este caso es el ácido, el comportamiento oscilatorio es más probable, siendo también causado por la atracción de partículas adsorbidas. La estabilidad de estado estacionario será controlada también por la repulsión de estas partículas.