INTRODUCCIÓN
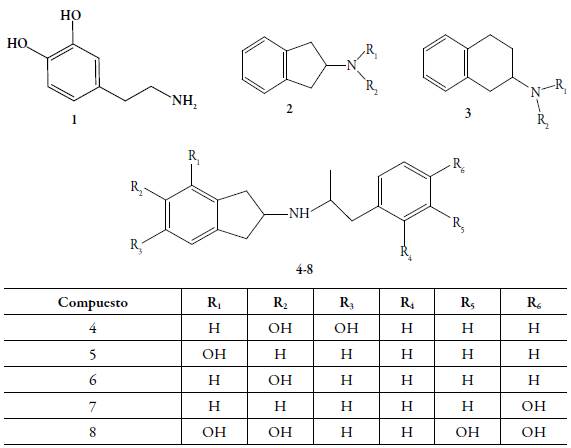
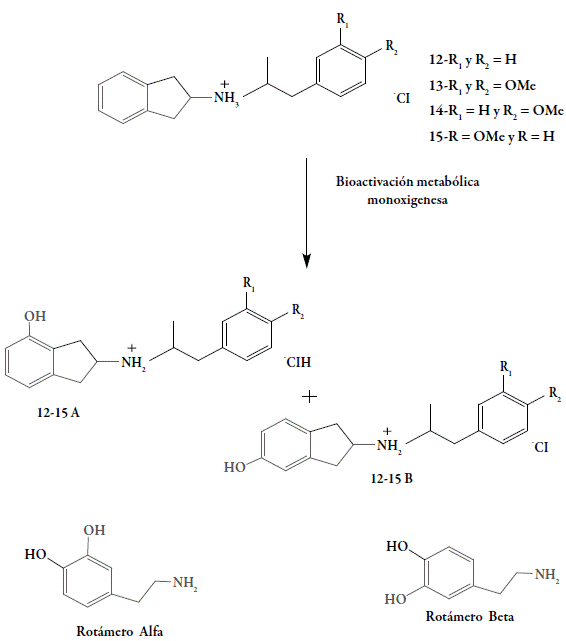
Es bien conocido que la dopamina (DA) es un neurotransmisor esencial del funcionamiento del sistema nervioso central (SNC), e interviene en los mecanismos que involucran los procesos motores, cognoscitivos, conductuales y neurocrinos [1]. Las neuronas dopaminérgicas ubicadas principalmente en la sustancia negra, el cuerpo estriado y en el sistema límbico son relacionadas directa o indirectamente con múltiples trastornos neurodegenerativos, como la enfermedad de Parkinson (EP) y la enfermedad de Huntington (EH) [2-4]. En la EP ocurre un déficit de DA ocasionada por la degeneración progresiva de las vías dopaminérgicas nigroestriadas [5-7], mientras que en la EH se caracteriza por un desequilibrio en el control del movimiento en los ganglios basales, debido a la degeneración de la mayor parte de los cuerpos neuronales secretores de GABA en el núcleo caudado, putamen y de las neuronas secretoras de acetilcolina de diferentes regiones del encéfalo [8,9]. Con el propósito de encontrar una solución terapéutica a estas patologías, se han diseñado y sintetizado numerosos compuestos, análogos del 2-aminoindano 2 y 2-aminotetralina 3 a los cuales se les ha incorporado aproximaciones farmacofóricas necesarias para interactuar en los blancos de acción dentro del sistema dopaminérgico central (figura 1).
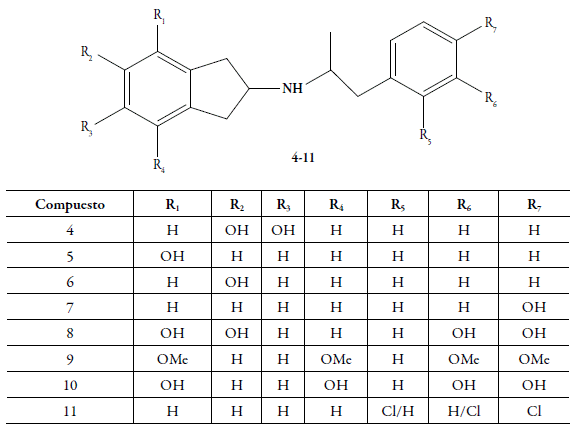
En publicaciones anteriores hemos reportado la síntesis, la evaluación farmacológica y el estudio teórico computacional de los análogos mono y dihidroxilados (sobre el anillo indano) del N-aralquil-2-aminoindano 4-8. Estas sustituciones se realizaron sobre ambos anillos bencénicos y, en especial, se observó que la incorporación al menos de un grupo OH sobre el fragmento aralquil, modificaba la actividad dopaminérgica central desde las respuestas agonísticas hacia las antagónicas, es decir, se obtenían compuestos que ejercían su actividad como antagonistas [10-14]. Asimismo, se encontraron actividades similares en los análogos 4,7-dimetoxi-2-aminoindano-N-aralquil, bajo sus formas metoxiladas sobre el anillo bencénico del fragmento aralquil 9 y el derivado fenólico 10, respectivamente [15]. Por otro lado, cuando se incorporan los átomos de cloro sobre el anillo bencénico del N-aralquil, en los derivados del 2-aminoindano 11 se consiguieron actividades agonísticas (figura 2) [16].
En el presente trabajo se sintetizaron los clorhidratos del 2-aminoindano-N-[2-(mono o dimetoxi)-fenil)-1-metil-etil] 12-15 y su evaluación farmacológica mostró una respuesta agonística a través de mecanismos dopaminérgicos centrales. Esta investigación es un importante aporte para el desarrollo de nuevos fármacos, capaces de restablecer la homeostasis de la transmisión dopaminérgica en las enfermedades de Parkinson o Huntington (figura 3).
METODOLOGÍA
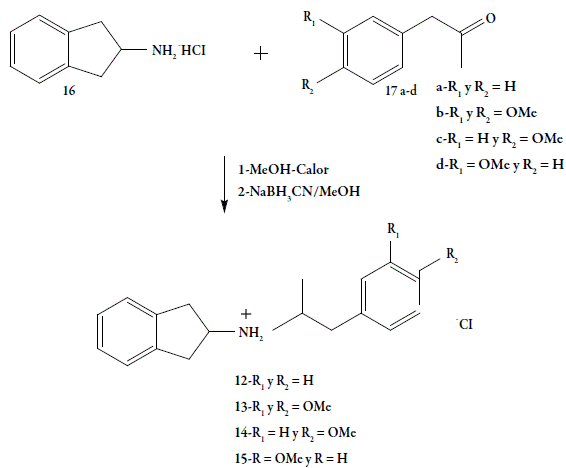
La síntesis de los productos finales 12-15 (figura 4), se realizó a través de la reacción de aminación reductiva, entre los intermediarios claves 16 y 17a-d, previamente sintetizados [14-18]. La existencia de los intermediarios claves y los productos finales, se confirmaron por medio de sus datos espectroscópicos de RMN de 1H, 13C, HETCOR, COSY y DEPT.
Sección química
Todos los reactivos y solventes utilizados en la síntesis fueron de grado analítico; en los casos necesarios, los solventes se sometieron a procesos previos de secado mediante métodos estándar. Se emplearon los siguientes solventes y reactivos: metanol R. A. Merck (Alemania), cianoborohidruro de sodio SIGMA-ALDRICH (E. U.), ácido clorhídrico SIGMA-ALDRICH (E. U.), éter etílico SIGMA-ALDRICH (E. U.) y sulfato de sodio anhidro SIGMA-ALDRICH (E. U.). Los espectros de resonancia magnética nuclear de 1H y 13C se realizaron en un espectrómetro Jeol de 270 MHz (E. U.) ubicado en la Facultad de Farmacia-UCV. Los desplazamientos químicos son reportados en partes por millón (ppm). Los puntos de fusión se determinaron en un aparato Stuart Scientific SIGMA-ALDRICH (E. U.). El análisis elemental se realizó en un equipo Perkin Elmer 2400 CHN elemental analyzer (E. U.), los resultados están en el rango de ± 0,4% de su valor teórico.
Síntesis de los análogos clorhidratos del2-aminoindano-N-[2-(mono o dimetoxi)-fenil)-1-metil-etil] 12-15
Se sometió a reflujo una mezcla del compuesto 16 (0,41 mmol) disuelto 20 mL de metanol con el compuesto 17 a-d (0,82 mmol), por 6 horas. Posteriormente, se añadió cianoborohidruro de sodio (3,5 mmol) y se dejó a temperatura ambiente en agitación por 72 horas. Al cabo de este período se trató la mezcla con 2 mL de HCl (concentrado) y las sustancias volátiles se eliminaron bajo presión reducida. La mezcla resultante se trató con agua destilada (20 mL) y se extrajo con éter etílico. La fase acuosa fue llevada a pH 10 con granallas de hidróxido de sodio y se extrajo nuevamente con éter etílico. Los extractos orgánicos se lavaron con agua, se secaron con sulfato de sodio anhidro, se filtraron y el solvente se evaporó a presión reducida. El producto final, de aspecto aceitoso, se trató con éter etílico-HCl para obtener un sólido que fue recristalizado en isopropanol-éter.
Clorhidrato deN-[2-(fenil)-1-metil-etil]-2-aminoindano 12
Sólido blanco, pf.: 182-184 °C (pf.: 195-198 °C) [18], 0,070 g (58,54%). RMN 1H (DMSO-d6, 270 MHz) d (ppm): 1,29 (3H, d, J = 6,4 Hz, CH3); 2,75 (1H, dd, J = 10,1 Hz y 13,1 Hz, CH2 Ar,); 3,18 (2H, dd, J = 7,2 Hz, CH2 (C1 o C3 pseudoecuatoriales)); 3,32 (1H, dd, J = 4,4 Hz y 11,8 Hz, CH2-Ar); 3,41 (2H, ddd, J = 4,2 Hz y 7,9 Hz, CH2 (C1 o C3 pseudoaxiales)); 3,63 (1H, m, J = 5,9 Hz, CH (aralquil)); 4,29 (1H, m, J = 7,9 Hz y J = 7,4 Hz, CH C2-indano); 7,28 (9H, m, ArH). RMN 13C (D2O, 67,5 MHz) δ (ppm): 15,0 (CH3-aralquil); 35,8 (CH2 (C1 o C3-indano)); 39,1 (CH2Ar-aralquil); 48,6 (CH-aralquil); 54,4 (CH (C2-indano)); 124,4; 127,1; 127,2; 128,6; 129,1; 135,9; 138,8 carbonos aromáticos. RMN-COSY: A 1,29 (3H, d, J = 6,4 Hz, CH3) se correlaciona con la señal a 3,63 (1H, m, CH (aralquil)). Anal. calcd. C18H22ClN (287,14): C, 75,11; H, 7,70; N, 4,87; encontrado: C, 75,17; H, 7,75; N, 5,02%.
Clorhidrato de N-[2-(3,4-dimetoxi-fenil)-1-metil-etil]-2-aminoindano 13
Sólido blanco, pf.: 176-178 °C, 0,110g (78,05%). RMN 1H (MeOH-d3, 270 MHz) δ (ppm): 1,29 (3H, d, J = 6,4 Hz, CH3); 3,04 (1H, dd, J = 4,4 Hz y 16,5 Hz, CH2 Ar); 3,21 (2H, dd, J = 6,7 Hz y 6,9 Hz, CH2 (C1 o C3 pseudoaxiales)); 3,36 (1H, dd, J = 4,4 Hz y 16,5 Hz, CH2-Ar); 3,41 (2H, ddd, J = 4,2 Hz y 7,4 Hz, CH2 (C1 o C3 pseudoecuatoriales)); 3,84 (3H, s, OCH3); 3,87 (3H, s, OCH3); 4,02 (1H, m, CH, (aralquil)), 4,25 (1H, m, CH, C2-indano); 7,01 (1H, d, J = 8,2 Hz y J = 1,9 Hz, ArH5-aralquil); 7,10 (1H, dd, J = 1,8 Hz y 8,2 Hz, ArH6-aralquil); 7,26 (5H, m, ArH4-indano y H2-aralquil). RMN 13C (MeOH-d3, 67,5 MHz) δ (ppm): 15,0 (CH3-aralquil); 35,7 (CH2 (C1 o C3-indano); 38,8 (CH2Ar-aralquil); 49,8 (CH (C2-indano); 51,0 (CH-aralquil); 55,4 y 55,4 (OCH3); 111; 113; 123; 124; 124,6; 127,2 carbonos aromáticos. RMN-HETCOR δ (ppm): la señal a 1,29 (3H, d, J = 6,4 Hz, CH3) se correlaciona con 15,0 (CH3-aralquil); las señales a 3,04 (1H, dd, J = 16,5 Hz y J = 4,4 Hz, CH2 Ar) y 3,36 (1H, dd, J = 16,5 Hz y 4,5 Hz, CH2-Ar) se correlacionan con 38,78 (CH2Ar-aralquil); las señales a 3,21 (2H, dd, J = 6,9 Hz y 6,7 Hz, CH2 (C1 o C3 pseudoaxiales)) y 3,41 (2H, ddd, J = 4,2 Hz y 7,4 Hz, CH2 (C1 o C3 pseudoecuatoriales)) se correlacionan con la señal a 35,7 (CH2 (C1 o C3-indano); las dos señales a 3,84 (3H, s, OCH3) y 3,87 (3H, s, OCH3) se correlacionan con las señales a 55,4 y 55,4 (OCH3); la señal a 4,02 (1H, m, CH-aralquil)) se correlaciona con la señal a 51,0 (CH-aralquil); el multiplete a 4,25 (1H, m, CH C2-indano) se correlaciona con la señal a 49,8 (CH (C2-indano); la señal a 7,01 (1H, d, J = 8,2 Hz y J = 1,9 Hz, ArH5-aralquil) se correlaciona con la señal a 127,2 (ArCH (C5-aralquil); a 7,10 (1H, dd, J = 8,2 Hz, ArH6-aralquil) se correlaciona con la señal a 111 (ArCH (C6-aralquil) y, finalmente, la señal a 7,26 (5H, m, ArH 4H-indano y H2-aralquil) se correlaciona con las señales a 113, 123, 124, 124,6 (Ar CH (C2-aralquil) y 127,2. Anal. calcd. C20H26ClNO2 (347,17): C, 69,05; H, 7,53; N, 4,03; encontrado: C, 69,03; H, 7,60; N, 4,19%.
Clorhidrato de N-[2-(4-metoxi-fenil)-1-metil-etil]-2-aminoindano 14
Sólido amarillo pálido blanco, pf.: 185-187 °C, 0,110 g (85,37%). RMN 1H (DMSO-d6, 270 MHz) d (ppm): 1,16 (3H, d, J = 6,4 Hz, CH3); 2,61 (1H,pseudot, CH2 Ar); 3,27 (2H, dd, CH2 C1 o C3 pseudoecuatoriales); 3,31 (1H,pseudot, CH2-Ar); 3,33 (2H, dd, CH2 (C1 o C3 pseudoaxiales); 3,35 (1H, m, CH, (aralquil)); 3,73 (3H, s, OCH3); 4,23 (1H, m, J = 7,9 Hz, CHC2-indano,); 6,90 (4H, d, ArH (aralquil)); 7,22 (5H, m, ArH (indano)). RMN 13C (DMSO-d6, 67,5 MHz) d (ppm): 15,9 (CH3-aralquil); 36,2 (CH2 (C1 o C3 indano)); 38,2 (CH2-Ar-aralquil); 54,2 (CH-aralquil); 55,0 (OCH3); 55,6 (CH (C2-indano)); 114,5; 125,0; 127,5; 129,1; 130,9; 140,1; 158,7 carbonos aromáticos. RMN-DEPT (DMSO-d6,) d (ppm): 15,9 (CH3-aralquil); 36,2 (CH2 (C1 o C3-indano)); 38,2 (CH2-Ar-aralquil); 54,2 (CH-aralquil); 55,0 (OCH3); 55,6 (CH (C2-indano)); 114,5; 125,0; 127,5; 129,1; 130,9; 140,1; 158,6 carbonos aromáticos (CH). RMN-COSY (DMSO-d6) d (ppm): A 1,16 (3H, d, J = 6,4 Hz, CH3) se correlaciona con las señales a 3,35 ppm (1H, m, CH2-Ar) y 3,31 (1H, pseudot, CH2-Ar). Por último, la señal a 4,23 (1H, m, J = 7,90 Hz, CH C2-indano) se correlaciona con las señales a 3,27 (2H, dd, CH2 C1 o C3 pseudoecuatoriales) y 3,33 (2H, dd, CH2 (C1 o C3 pseudoaxiales). Anal. calcd. C19H24ClNO (317,15): C, 71,80; H, 7,61; N, 4,41; encontrado: C, 71,83; H, 7,62; N, 4,67%.
Clorhidrato deN-[2-(3-metoxi-fenil)-1-metil-etil]-2-aminoindano 15
Sólido blanco, pf.: 181-182 °C, 0,117 g (90,24%). RMN 1H (MeOH-d4, 270 MHz) d (ppm): 1,29 (3H, d, J = 6,4 Hz, CH3); 2,75 (1H, dd, J = 13,1 Hz y 4,4Hz, CH2Ar); 3,22 (2H, dd, J = 7,4 Hz, CH2 C1 o C3 pseudoaxiales); 3,32 (1H, dd, J = 13,1 Hz, CH2-Ar); 3,44 (2H, dd, J = 7,4 Hz, CH2 C1 o C3 pseudoecuatoriales); 3,64 (1H, m, CH (aralquil)); 3,80 (3H, s, OCH3); 4,27 (1H, p, CH C2-indano); 6,85 (1H, dd, J = 8,1 Hz y 2,4 Hz, ArH6'-aralquil); 6,87 (1H, dd, J = 6,1 Hz y 2,5 Hz, ArH4'-aralquil); 6,88 (1H, dd, J = 1,1 Hz y 3,0 Hz, ArH2'-aralquil); 7,22 (4H, m, ArH-indano); 7,27 (1H, pseudot, J = 7,3 Hz, ArH5'-aralquil). RMN 13C (MeOH-d4, 67,5 MHz) δ (ppm): 15,0 (CH3-aralquil); 35,7 (CH2 (C1 o C3-indano)); 39,1 (CH2Ar, aralquil); 47,7 (OCH3); 55,0 ((CH-aralquil); 56,0 (CH (C2-indano)); 112,3; 114,9; 121,3; 129,6; 137,5 (cuaternario) y 160,2 (cuaternario) carbonos aromáticos aralquílicos; 124,4; 127,2; 138,8 (cuaternario) carbonos aromáticos del indano. RMN-HETCOR δ (ppm): a 1,29 (3H, d, J = 6,4 Hz, CH3) se correlaciona con la señal a 15,0 (CH3-aralquil); la señal a 2,75 y 3,32 (1H, dd, CH2Ar) se correlacionan con la señal a 39,12 (CH2Ar-aralquil); la señal a 3,22 y 3,44 (2H, dd, CH2 (C1 o C3-indano)) se correlacionan con la señal a 35,95 (CH2 (C1 o C3-indano)); la señal a 3,80 (3H, s, OCH3) se correlaciona con la señal a 47,7 (OCH3); la señal a 3,64 (1H, m, CH, (aralquil)) se correlaciona con la señal a 55,0 (CH-aralquil); la señal a 4,27 (1H, p, CH (C2-indano)) se correlaciona con la señal a 56,0 (CH (C2-indano)); la señal a 6,85 (1H, dd, J = 8,1 Hz y 2,5 Hz, ArH (H6'-aralquil)) se correlaciona con la señal a 121,3 (ArCH (C6'-aralquil)); la señal 6,87 (1H, dd, J = 6,1 Hz y 2,5 Hz, ArH4'-aralquil) se correlaciona con la señal a 114,9 (ArCH (C4 '-aralquil)); la señal a 6,88 (1H, dd, J = 1,1 Hz y 3,1 Hz, ArH (H2'-aralquil)) se correlaciona con la señal a 112,37 (ArCH (C2'-aralquil)); la señal a 7,22 (4H, m, ArH (H-indano)) se correlaciona con las señales a 124,4 y 127,2 (ArCH (C4 y C5-indano)); y, finalmente, la señal a 7,27 (1H, pseudot, J = 7,4 Hz, ArH5 '-aralquil) se correlaciona con la señal a 129,6 (ArCH (C5 '-aralquil)). Anal. calcd. C19H24ClNO (317,15): C, 71,80; H, 7,61; N, 4,41; encontrado: C, 71,91; H, 7,67; N, 4,71%.
Sección farmacológica
Se utilizaron ratas machos de la cepa Sprague-Dawley de 150 a 250 g de peso corporal, mantenidas bajo períodos alternativos de luz y oscuridad, con libre acceso al agua y alimento estándar (Ratarina®, Protinal). Cinco días antes del experimento se les implantó a las ratas, bajo anestesia con xilacina (Setton® al 2%) (1 mg/Kg.; i.p.) y relajación con ketamina, una cánula metálica en el ventrículo lateral-derecho y en el estriado anterior derecho, según las coordenadas: antero-posterior -0,40 mm del Bregma; 1,2 mm lateral (ICV) (14) y anteroposterior + 1,2; lateral = +2,8; ventral = -5,5 (IE) [19,20]. Las cánulas, empleadas como guía para la introducción de la aguja de inyección ICV e IE, se fabricaron utilizando inyectadoras 20G con un largo inferior a 4 mm, fijadas al cráneo permanentemente mediante acrílico y cemento plástico. Para las pruebas de estereotipia se preparó una solución de las drogas patrones de apomorfina (APO-go PEN 10 mg/mL, solución inyectable), haloperidol (Haldol 50 mg/mL, solución inyectable, JANSSEN PHARMACEUTICA) y ziprasidona (Geodon, polvo para solución inyectable, laboratorios Pfizer), disueltas en solución salina e inyectadas por vía intraperitoneal a la dosis de 1 mg/Kg de peso corporal. Los compuestos 12-15 se disolvieron en solución isotónica de NaCl y se inyectaron 5 μL en el ventrículo lateral derecho (ICV) y en el estriado anterior derecho (IE); para ello se empleó una jeringa Hamilton de 10 μL provista de un tope, para aplicación precisa del compuesto. A un grupo de ratas canuladas se le realizó una lesión con 6-hidroxidopamina (6-OHDA) (Sigma Aldrich, Saint Louis, MO) (112 mM, pH = 7,4). La solución neurotóxica fue infundida en el ventrículo lateral-derecho (ICV), con la ayuda de una inyectadora Hamilton de 10 μL a una dosis de 200 μg/5μL. Para conocer si los compuestos 12-15 inducen en las ratas conductas estereotipadas, es decir, una actividad motora repetitiva y sin propósito, las observaciones se realizaron introduciendo a cada animal en una caja de observación de acrílico transparente con las dimensiones: 32 χ 28 x 28 cm. Para cada una de las pruebas se utilizaron grupos de cuatro animales, y se evaluaron las siguientes conductas: lamidas, roídas (mordidas), olfateos y acicalamientos. Antes de la medición de la conducta estereotipada, los animales se introdujeron en la caja de observación y se dejaron por un período de 15 minutos para que se habituaran a la misma. Los datos recolectados se registraron empleando una computadora dotada de un software para contar el número de movimientos estereotipados. Las observaciones se hicieron por 60 minutos, divididos en 10 intervalos de 6 minutos cada uno [14-16]. Los compuestos en estudio se inyectaron de manera individual para cada grupo de prueba, a las dosis de 50 μg/5μL. Posteriormente, se evaluó la conducta estereotipada inducida por estos compuestos, en los grupos de ratas pretratadas con haloperidol (0,2 mg/Kg. PC., i.p.), un conocido antagonista de los receptores dopaminérgicos y con la ziprasidona (dosis de 1 mg/Kg. PC., i.p.) un antipsicótico atípico; para lo cual, se procedió a inyectar cada una de estas drogas 15 minutos antes de la administración (ICV) del compuesto evaluado. Con respecto al grupo de ratas canuladas a las cuales se les practicó la lesión con 6-hidroxidopamina (6-OHDA) a nivel (ICV) e (IE) [19,20], se le administró por estas vías los compuestos 12-15 a la dosis de 50 μg/5μL.
Análisis estadístico
Los resultados se expresaron como la media + E.E.M. La significancia de los resultados se analizó mediante el análisis de varianza de una vía (ANOVA) y la prueba de Newman-Keul [21]. Un valor de p < 0,05 fue considerado significativo. El análisis de los resultados y la elaboración de los gráficos se realizaron empleando el programa GraphPad Prism versión 5.1.
RESULTADOS Y DISCUSIÓN
En el presente estudio se demuestra que la administración ICV de los compuestos 12, 13, 14 y 15 como mezclas racémicas, bajo la dosis de 50 μg/5μL, incrementaron significativamente las conductas estereotipadas de lamidas, olfateos y acicalamientos, mientras que el compuesto 15 se aumentó únicamente las lamidas y los acicalamientos. Las conductas estereotipadas mostradas en todos los compuestos fueron bloqueadas por el antipsicótico típico haloperidol. El pretratamiento con la ziprasidona, incrementó significativamente las lamidas y los acicalamientos inducidos por los compuestos 12, 13, 14 y 15; mientras que, por el contrario, las roídas fueron bloqueadas. La desnervación química mediante el uso de la neurotoxina 6OH-dopamina (6OHDA) se realizó a nivel ICV e IE, y se observó un incremento significativo en lamidas, olfateos y acicalamientos en los cuatro compuestos evaluados; sin embargo, el compuesto 15 mostró un aumento significativo en las roídas (figuras 5-8). Es bien conocido que la estereotipia es el principal componente de varios desórdenes psiquiátricos, incluidos el autismo infantil [22] y la esquizofrenia [23]. Se ha establecido que la estereotipia (olfateos y roídas) es un comportamiento dependiente de la dopamina y el sustrato neural del comportamiento estereotipado inducido por la apomorfina en animales, se debe a las proyecciones dopaminérgicas de la región de los núcleos caudado y putamen [24]. La apomorfina es conocida por ser un agonista mixto de los receptores de dopamina D1-D2. La activación de los receptores de dopamina D1-D2 sobre el núcleo estriado es expresada como la respuesta de un comportamiento excesivo y repetitivo (estereotipia) [22-26]. Es decir, que la activación de los receptores dopaminérgicos en el sistema límbico expresa la conducta estereotipada de lamidas y acicalamientos, mientras que los olfateos y las roídas son respuestas a la activación de los receptores en el sistema extrapiramidal.
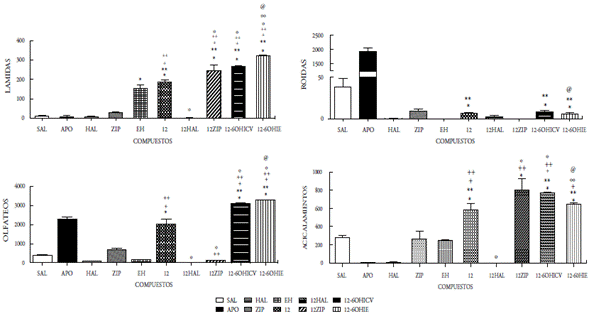
Figura 5 Efecto del compuesto 12 a la dosis de 50mg/5ml sobre la conducta esteriotipada en ratas. En las ordenadas, la sumatoria de las conductas medidas. En las abscisas, los compuestos probados. Las observaciones se realizaron por 1 hora. Los resultados se expresaron como promedio±eep de cuatro mediciones independientes. Los datos fueron analizados mediante el análisis de varianza (ANOVA) de una vía y la prueba de Newman Keuls. * diferencia significativa (ds) vs sal; ** ds vs apomorfina (APO); + ds vs haloperidol (HAL); ++ ds vs ziprasidona (ZIP); º ds vs 12; ºº ds vs 12-60HICV; @ ds vs Enfermedad de Huntington (EH). p<0,001.
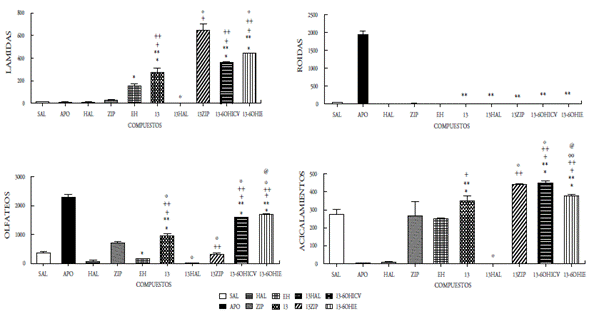
Figura 6 Efecto del compuesto 13 a la dosis de 50mg/5ml sobre la conducta esteriotipada en ratas. En las ordenadas, la sumatoria de las conductas medidas. En las abscisas, los compuestos probados. Las observaciones se realizaron por 1 hora. Los resultados se expresaron como promedio±eep de cuatro mediciones independientes. Los datos fueron analizados mediante el análisis de varianza (ANOVA) de una vía y la prueba de Newman Keuls. * diferencia significativa (ds) vs sal; ** ds vs apomorfina (APO); + ds vs haloperidol (HAL); ++ ds vs ziprasidona (ZIP); º ds vs 13; ºº ds vs 13 -6OHICV; @ ds vs Enfermedad de Huntington (EH). p<0,001.
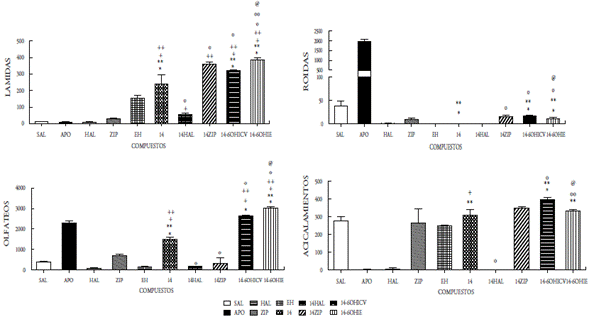
Figura 7 Efecto del compuesto 14 a la dosis de 50mg/5ml sobre la conducta esteriotipada en ratas. En las ordenadas, la sumatoria de las conductas medidas. En las abscisas, los compuestos probados . Las observaciones se realizaron por 1 hora. Los resultados se expresaron como promedio±eep de cuatro mediciones independientes. Los datos fueron analizados mediante el análisis de varianza (ANOVA) de una vía y la prueba de Newman Keuls. * diferencia significativa (ds) vs sal; ** ds vs apomorfina (APO); + ds vs haloperidol (HAL); ++ ds vs ziprazidona (ZIP); º ds vs 14; ººds vs 14-6OHICV; @ ds vs Enfermedad de Huntington (EH). p<0,001.
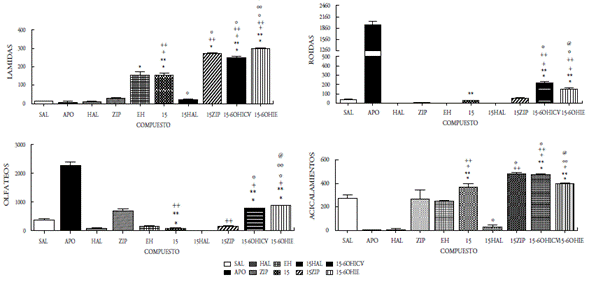
Figura 8 Efecto del compuesto 15 a la dosis de 50mg/5ml sobre la conducta esteriotipada en ratas. En las ordenadas, la sumatoria de las conductas medidas. En las abscisas, los compuestos probados. Las observaciones se realizaron por 1 hora. Los resultados se expresaron como promedio±eep de cuatro mediciones independientes. Los datos fueron analizados mediante el análisis de varianza (ANOVA) de una vía y la prueba de Newman Keuls. * diferencia significativa (ds) vs sal; ** ds vs apomorfina (APO); + ds vs haloperidol (HAL); ++ ds vs ziprasidona (ZIP); º ds vs 15; ºº ds vs 15-60HICV; @ ds vs Enfermedad de Huntington (EH). p<0,001.
Nuestros resultados parecen indicar que la acción central de los compuestos 12-15 involucra la participación de mecanismos dopaminérgicos cerebrales. En efecto, la administración ICV de dichos compuestos produjo respuestas estereotipadas significativas, indicando una posible acción agonística de estos compuestos. Dicha acción agonística se ratifica por el hecho de que el pretratamiento con haloperidol fue capaz de bloquear completamente las conductas estereotipadas inducidas por los compuestos en estudio. Por otra parte, la observación de que los compuestos 12-15 inducen en el pretratamiento con ziprasidona un incremento significativo en las lamidas, los acicalamientos y bloqueo en los olfateos, indica un comportamiento similar a los reportados para otros agonistas dopaminérgicos al ser coadministrados con ziprasidona o la clozapina en ratas [22,23]. Es bien conocido que la ziprasidona incrementa selectivamente la liberación de dopamina en la región de la corteza prefrontal (sistema mesocortical), cuando se activan los receptores 5HT1a y bloquean los 5HT2a. También la ziprasidona bloquea al receptor D2. Fundamentados en esto inferimos que los compuestos evaluados que actúan como agonistas dopaminérgicos, interactúan con sus receptores en el sistema límbico (acicalamientos y lamidas) y en los ganglios basales (olfateos). Desde que la ziprasidona ejerce un aumento del tono dopaminérgico sobre las neuronas de la corteza prefrontal, se asocia dicha acción con el incremento significativo de las conductas estereotipadas propias del sistema límbico observado cuando los compuestos 12-15 interactúan en este sistema. Contrariamente, la activación de los receptores dopaminérgicos en los ganglios basales inducida por los compuestos 12-15 (conducta olfateos) fue bloqueada, posiblemente debido a la acción inhibidora del receptor D2 de la ziprasidona. Estos resultados están en concordancia con los reportados previamente por nuestro grupo, en otros compuestos sintetizados y evaluados farmacológicamente donde la coadministración con ziprasidona aumentó las lamidas y los acicalamientos [14-16].
La respuesta estereotipada de los compuestos 12-15 podría ser el resultado de una acción presináptica (indirecta) o postsináptica (directa). En la acción presináptica de los compuestos, podrían involucrar la depleción del neurotransmisor o el bloqueo de algún receptor dopaminérgico presináptico que regule la secreción del neurotransmisor; mientras que la acción postsináptica implicaría la interacción con su propio receptor. Con el fin de tener una aproximación sobre el posible mecanismo de acción de los compuestos 12-15, se procedió a la desnervación química de las neuronas dopa-minérgicas mediante el uso de una neurotoxina, la 6-OHDA al administrarse por vía ICV [15,16,20,27]. Nuestros hallazgos demuestran que la desnervación dopaminérgica central incrementa significativamente la acción agonista ejercida por los compuestos evaluados en las tres conductas (lamidas, olfateos y acicalamientos) y solo las roídas se incrementaron por la acción del compuesto 15, lo que parece indicar que los mismos son mecanismos dopaminérgicos independientes de su acción presináptica, es decir, actúan a nivel postsináptico, tanto en los ganglios basales como en el sistema límbico.
Por otro lado, la acción de los compuestos 12-15 cuando se administraron por vía intraestriatal (IE) en el grupo de ratas enfermas (EH), mostraron cambios significativos sobre las alteraciones conductuales y locomotoras propias de la enfermedad, ya que se observaron aumentos significativos en las tres conductas evaluadas (lamidas, olfateos y acicalamientos), y solo las roídas aumentaron para el compuesto 15, al compararse con el grupo de ratas enfermas. Este grupo de ratas con EH, antes de recibir el tratamiento de los compuestos 12-15, mostraron cambios significativos en las cuatro conductas estereotipadas estudiadas, observándose un aumento significativo en las lamidas y disminución en las tres conductas restantes. Con esto se demostró el daño estriatal ocasionado por la 6-hidroxidopamina, al provocar la degeneración neuronal que conlleva daños motores y cognitivos, comparables a los que se reportan en pacientes con la enfermedad de Huntington. Cuando las ratas se aislaron en su hábitat se observaron daños motores y cognitivos, los primeros produjeron temblor, acinesia, rigidez, postura en flexión y alteración de los reflejos posturales, mientras que los segundos se manifestaron con agresividad, temor y pérdida de la memoria. Además, se observó la reducción de la capacidad de supervivencia al no mostrar interés en la ingesta de alimento y agua. Estos síntomas son el resultado de las alteraciones ejecutivas y organizativas donde se altera la capacidad de planificación, organización, la toma de decisiones y la flexibilidad mental.
Es bien conocido que las alteraciones que conducen a la EH, se producen por un desequilibrio entre las vías (directa e indirecta) que controlan el movimiento en los ganglios basales. La vía directa activa los movimientos voluntarios, mientras que la vía indirecta inhibe la aparición de los componentes involuntarios en el movimiento. Un adecuado equilibrio entre las dos vías, producen los movimientos normales. En la EH ocurre la degeneración de las neuronas estriatopalidales en los circuitos de los ganglios basales en la fase hipercinética, prevaleciendo así la vía directa sobre la vía indirecta [8,9]. Este desequilibrio observado en nuestros experimentos fue contrarrestado cuando se les administró a las ratas enfermas la dosis estudiada de los compuestos 12-15, lográndose así desaparecer los síntomas cognitivos y motores de la enfermedad (después de la inyección intraestriatal). La supervivencia de este grupo de ratas tratadas fue de 15 días, y mostraron un comportamiento de ratas normales. Estos resultados están en concordancia con otros compuestos sintetizados y evaluados por nosotros [19].
La actividad farmacológica mostrada por los compuestos 12-15 se debe a la incorporación de las estrategias del diseño de profármacos, al hibridar la molécula base con dos fragmentos que contengan el farmacóforo parcial del receptor dopaminérgico, a través de un enlace covalente. En una porción está presente el fragmento del 2-aminoindano 16 y en la otra, están presentes las fenilacetonas 17 a-d sustituidas sobre el anillo aromático bajo las formas mono y dimetoxiladas. Los resultados farmacológicos nos permiten proponer que los compuestos 12-15, al ser administrados ICV, podrían sufrir una activación metabólica, por medio de una reacción de hidroxilación aromática sobre el núcleo 2-aminoindano y el producto metabólicamente activo guardaría una estrecha relación con el farmacóforo dopaminérgico (fragmento m-hidroxifeniletilamina), necesario para ejercer la actividad farmacológica (figura 9). Cabe destacar que los productos finales solo poseen el farmacóforo parcial dopaminérgico (fragmento feniletilamino) sobre el anillo indano y bajo esta forma no son capaces de interactuar directamente sobre su receptor, por lo que estos compuestos para ejercer su actividad postsináptica agonística, deben activarse enzimáticamente y así dar origen a la forma activa para interactuar sobre sus receptores. Por otro lado, el fragmento N -aralquil, en los compuestos estudiados, puede sustituirse o no por grupos no hidroxílicos, ya que la sola incorporación de al menos un grupo OH sobre el anillo bencénico del fragmento aralquil generaba compuestos con actividad dopaminérgica central como antagonistas [10-14]. Es decir, nuestros resultados están en concordancia con lo antes expuesto, ya que la incorporación de los grupos metoxi, sobre el anillo aromático del grupo N-aralquil o la no incorporación de algún grupo funcional, facilitan la interacción hacia su receptor y desencadenan una respuesta agonística. Iguales resultados se observaron con los compuestos 9 y 11 [15,16].
De acuerdo con los resultados farmacológicos, los compuestos estudiados se comportan como profármacos, ya que una vez administrados se requiere un tiempo de espera para iniciar la evaluación. Durante ese lapso, las formas inactivas de los compuestos 12-15 dentro del organismo o sistema biológico, sufren una reacción metabólica (enzimática) capaz de incorporar el grupo OH (fenólico) en las posiciones 4 (análogo del rotámero alfa) 12-15 A y 6 (análogo del rotámero beta) 12-15 B del anillo indano, formándose así dos posibles metabolitos activos que contienen el farmacóforo total dopaminérgico (fragmento m-hidroxifeniletilamino). Los resultados experimentales confirman su acción agonista a través de mecanismos dopaminérgicos postsinápticos, con previa bioactivación metabólica que estaría en concordancia con nuestros resultados ya reportados (figura 8) [11-14,16]. De hecho, la incorporación del fragmento farmacofórico "m-hidroxifeniletilamino" en el núcleo indano, permite que interactúe en el receptor postsináptico, tal y como lo demuestra el aumento significativo en las cuatro conductas estereotipadas en las ratas desnervadas con 6-OHDA.
En resumen, los compuestos 12-15 se diseñaron mediante las estrategias químico-medicinales, que contienen las aproximaciones farmacofóricas de los profármacos. Su obtención se realizó por medio de las rutas clásicas contenidas en la síntesis orgánica y su evaluación farmacológica reveló que poseen actividad agonística a través de la activación de los mecanismos dopaminérgicos centrales, como potenciales antihuntington y antipárkinson.