INTRODUCCIÓN
Durante las últimas décadas, el cáncer se ha convertido en un problema de salud pública en aumento, encontrándose dentro de las primeras causas de muerte. En Colombia, por ejemplo, según el informe de Enfermedades Crónicas no Transmisibles del Observatorio Nacional de Salud, durante el periodo comprendido entre 2010 y 2014 se registraron un total de 132.799 casos nuevos de cáncer en mujeres y 174.638 en hombres. El cáncer se suma a otras enfermedades asociadas a factores hereditarios, tales como hipertensión arterial, diabetes mellitus y Alzheimer, que presentan altos niveles de incidencia y frente a las cuales no se dispone de tratamientos efectivos [1,2].
La terapia génica figura como una de las alternativas más promisorias para el tratamiento de estas enfermedades y para el mejoramiento de las condiciones de vida de los pacientes [3]. Cuando se emplea este método, se libera material genético terapéutico, generalmente, plásmidos en el núcleo celular, permitiendo así corregir la pérdida de una función por una mutación o expresar el producto de un gen deficiente a nivel fisiológico. La terapia génica inicia con la identificación del gen causante de la enfermedad, seguido de la clonación del gen sano, el cual se carga en un vector que debe tener la capacidad de ser captado por las células blanco, para finalmente liberar el material genético y producir una proteína en particular [4].
Durante los últimos años se han realizado más de 2000 ensayos clínicos empleando este tipo de terapia, en su mayoría, estos están direccionados al tratamiento de diferentes tipos de cáncer [5]. Dentro de las estrategias empleadas en la terapia génica de esta enfermedad se destacan la corrección de mutaciones, la supresión de la angiogénesis y el mejoramiento en la supresión tumoral [6].
Es necesario el uso de vehículos, conocidos como vectores, [7] debido a que los ácidos nucleicos libres presentan baja estabilidad química por su degradación enzimática y su eliminación por el sistema fagocítico. Consecuentemente, la selección del vector es uno de los parámetros que determina la eficacia de la terapia génica, ya que este debe ser biocompatible, soluble en medios acuosos, presentar tamaño nanométrico, poseer baja citotoxicidad y alta eficiencia de transfección [8].
En los comienzos de la terapia génica se empleaban vectores virales, como retrovirus y adenovirus, los cuales tienen una alta eficiencia de transfección; sin embargo, presentan varias limitaciones tales como toxicidad, inmunogenicidad y difícil producción, principalmente, a gran escala, requisito para su aplicación a nivel clínico [9]. Esto ha motivado el desarrollo de vectores tales como polímeros catiónicos sintéticos capaces de condensar moléculas de ácidos nucleicos a través de interacciones electrostáticas, formando partículas que protegen el material genético. Cuando se emplean vectores sintéticos, su desempeño depende de la estructura, composición y peso molecular del precursor polimérico, así como del tamaño de los agregados que forma con las cadenas de los ácidos nucleicos.
El polímero más empleado como vector génico y considerado como "estándar de oro" es la polietileneimina (PEI) debido a su alta eficiencia de transfección y habilidad de escape de los endosomas; sin embargo, su citotoxicidad y su baja biodegradabilidad limitan su aplicación [10]. De otro lado, como una alternativa, el polimetacrilato de N, N-dimetilaminoetilo (PDMAEMA, por sus siglas en inglés) -pese a presentar desventajas similares- es derivado de un monómero acrílico, lo que permite controlar de manera precisa su arquitectura y peso molecular y por ende, atenuar su toxicidad y baja biodegradabilidad, manteniendo así un desempeño comparable al PEI [11].
Dada la eficiencia de estos polímeros como vectores de ácidos nucleicos, se han estudiado varias estrategias para mejorar su actividad de transfección y reducir su toxicidad.
De estas se destaca el uso de arquitecturas ramificadas y la copolimerización con segmentos hidrofóbicos; varias investigaciones han mostrado que este tipo de estructura posee una mayor capacidad de internalización celular y una disminución significativa en la citotoxicidad [12,13].
Por su parte, la copolimerización con segmentos hidrófobos conlleva a la obtención de materiales anfifílicos, que se autoensamblan en medio acuoso dando lugar a la formación de nanopartículas tipo micela. Este tipo de estructura, además de aumentar la estabilidad de los complejos polímero/ácido nucleico, ofrece la posibilidad de controlar propiedades como tamaño y carga de las partículas a través de la composición del copolímero. Adicionalmente, las nanopartículas pueden actuar como reservorios de fármacos con baja solubilidad en agua permitiendo la coliberación tanto del fármaco como del ácido nucleico terapéutico [7].
En las siguientes secciones se describe la aplicación de materiales basados en PEI y PDMAEMA como vectores para la transfección de ácidos nucleicos, enfatizando en la aplicación de copolímeros anfifílicos formados con poliésteres alifáticos en el campo de la terapia génica.
VECTORES EN TERAPIA GÉNICA
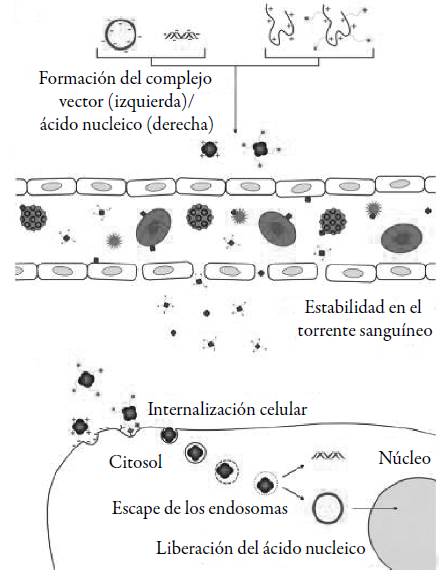
La terapia génica es un método experimental para el tratamiento de varias enfermedades que consiste en reemplazar o anular genes defectuosos por genes normales, a través de la transfección de ácidos nucleicos en células específicas. Generalmente, la información genética se encuentra codificada en un plásmido, aunque también se pueden utilizar otras formas de ADN o ARN. El principal requisito para el uso terapéutico de estas sustancias es su entrega en los compartimientos celulares donde cumple su función y para que esto ocurra, deben superar una serie de barreras extra e intracelulares. Sin embargo, esto es poco probable debido a que los ácidos nucleicos sufren una degradación enzimática rápida [7]. Por esta razón, es necesario el uso de vehículos de entrega (vectores), que deben transportar los ácidos nucleicos hasta su sitio de acción (ver figura 1) [14].
Varios sistemas de transporte han sido desarrollados entre los que se destacan los vectores virales y los vectores no virales. Los sistemas virales consisten en virus recombinantes, el ácido nucleico terapéutico se inserta en su genoma y se aprovecha la vía de infección para su transfección; en este caso, se evita la expresión de genes que conducen a la replicación y la toxicidad, suprimiendo las regiones que codifican para estas funciones. A pesar de que estos vectores ofrecen mayores eficiencias de transfección, sus limitaciones en cuanto a toxicidad, respuesta inmune severa, cantidad de ADN insertado y dificultad en su producción han restringido su aplicación en terapia génica [15]. Por su parte, los vectores no virales son sistemas de entrega de genes formados por la combinación de ácidos nucleicos con lípidos catiónicos, llamados lipoplejos o con polímeros catiónicos, también denominados poliplejos. Estos materiales catiónicos se ensamblan con los ácidos nucleicos para formar partículas que facilitan su internalización en la célula vía endocitosis [16].
Los lípidos catiónicos han sido usados como agentes de transfección debido a su capacidad de internalización celular y desestabilización de los endosomas; al entrar en la célula neutralizan las cargas del complejo, debido a una reorganización de los fosfolí-pidos, causando la liberación del ADN en el citoplasma [3]. Estas sustancias constan de una cabeza cargada positivamente, un segmento hidrófobo y un grupo enlazante; la cabeza positiva puede ser monovalente o multivalente, dependiendo de la cantidad de grupos amina que contenga. Se han estudiado varias modificaciones tanto de la naturaleza y densidad de los grupos catiónicos, como del segmento hidrófobo para mejorar su desempeño en la entrega de ácidos nucleicos [17]. En la figura 2 se muestran las estructuras de los lípidos catiónicos más utilizados en este campo [18]. Aunque algunas modificaciones estudiadas han mejorado el desempeño de estas sustancias en la entrega de ADN, problemas como la baja especificidad, la inestabilidad frente a algunos componentes de la sangre, la generación de respuesta inmune y la necesidad de emplear lípidos auxiliares han limitado su empleo como vectores [6].
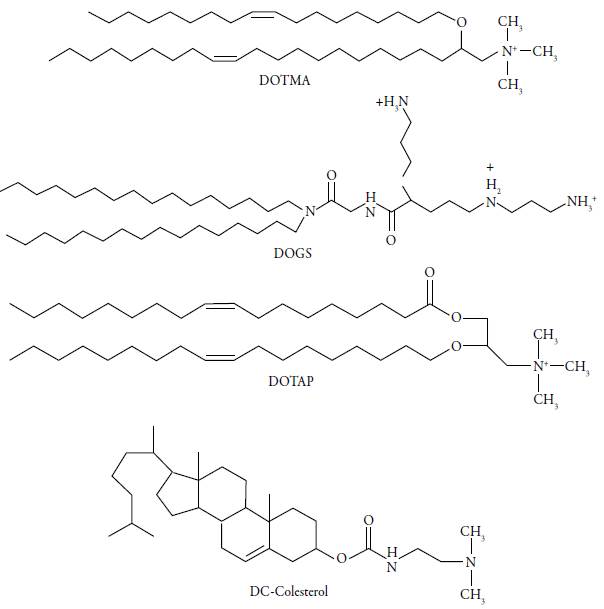
Figura 2 Estructuras de algunos lípidos catiónicos empleados en terapia génica. DOTMA: cloruro de N [1-(2,3-dioleiloxi propil]- N N, N-trimetilamonio; DOGS: Dioctadecilamido glicil esper-mina; DOTAP: 1,2-dioleil-3-trimetilamonio-propano; DC-Colesterol: [N- (N, N-dimetilamino etano)-carbamoil] colesterol.
En cuanto a los tipos de ácido nucleico, los más utilizados para formar complejos con los diferentes vectores son el ADN plasmídico (ADNp) y el ARN pequeño de interferencia (siRNA, por sus siglas en inglés). Los ADNp son moléculas circulares de doble cadena que tienen un tamaño estándar entre 4-10 kilos de pares de bases, los cuales codifican para la expresión de proteínas específicas. Los ADNp presentan ventajas como estabilidad, facilidad de manipulación y bajo costo en comparación con los otros tipos de ácidos nucleicos, además han sido usados en el desarrollo de vacunas para enfermedades como la malaria y el síndrome de inmunodeficiencia adquirido [19]. Sin embargo, se ha demostrado que la eficiencia de transfección del ADNp es menor porque se requiere la entrada de las moléculas al interior del núcleo celular. Por esta razón se han estudiado varias modificaciones en los plásmidos para mejorar su internalización celular y posterior expresión del gen como: la producción de nuevas topologías (como la superenrollada), el empleo de nuevos promotores y la generación de plásmidos sin genes de resistencia a antibióticos [6].
De otro lado, los siRNA son moléculas cortas de doble cadena compuestas de 21-23 nucleótidos, las cuales degradan selectivamente ARN mensajero de secuencia complementaría, inhibiendo su traducción a proteína [7]. Este proceso de interferencia ocurre en el citoplasma, lo que hace a estos sistemas más versátiles que el ADNp, eliminando la necesidad de llevar el material genético al núcleo celular, además pueden ser sintetizados químicamente y no se integran al genoma, ofreciendo una mayor seguridad. El empleo de este tipo de ácido nucleico tiene desventajas como la supresión de genes diferentes al blanco y el reconocimiento por inmunoreceptores, lo que conlleva a alteraciones en la expresión de los genes y respuesta del sistema inmune innato [20,21]. Además, por su tamaño y estructura, la habilidad de formar complejos es menor ya que se presentan menos interacciones electrostáticas con el vector, lo cual puede afectar la estabilidad del polielectrolito [7].
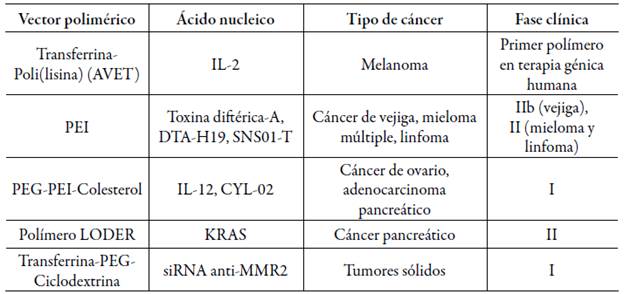
En el tratamiento del cáncer se han explorado diferentes estrategias, empleando tanto vectores virales como no virales, tales como la supresión y el reemplazo de genes [22], el uso de material genético para la inducción de muerte celular [23], la inhibición de factores de transcripción [24] y la estimulación de la respuesta inmune contra tumores [25], las cuales han permitido lograr efectos anticancerígenos significativos. Debido a las limitaciones de los sistemas virales y lipídicos, la investigación de vectores poliméricos aplicados en el tratamiento de esta enfermedad ha traído consigo grandes avances, los cuales han permitido un mejor entendimiento de las propiedades que deben tener tanto para atravesar las barreras sistémicas y celulares, como para entregar de manera eficiente el material genético dentro de la célula. Esto ha posibilitado que varios vectores poliméricos hayan sido aplicados en la transfección de ácidos nucleicos en ensayos clínicos mostrando resultados exitosos en la terapia del cáncer (ver tabla 1).
Los avances en terapia génica, tanto del cáncer como de otras enfermedades de origen genético, dependen del desarrollo de materiales poliméricos capaces de vectorizar el ADN/ARN con toxicidad e inmunogenicidad reducida; ello se logra controlando su estructura, composición, arquitectura y peso molecular como se discutirá más adelante.
VECTORES POLIMÉRICOS
Durante los últimos años, algunos polímeros catiónicos han sido estudiados como vectores no-virales en el tratamiento de enfermedades como fibrosis quística, virus de inmunodeficiencia humana y cáncer [27-29]. Estos vectores son interesantes porque ofrecen ventajas tales como menor riesgo inmunogénico, además, se obtienen por procesos más sencillos y su estructura es modificable [30]. Se caracterizan por poseer grupos funcionales amina que pueden protonarse parcialmente a pH fisiológico lo que les permite interactuar electrostáticamente con el ácido nucleico.
Los vectores poliméricos se pueden clasificar en naturales y sintéticos. Los polímeros catiónicos naturales han sido empleados como transportadores de genes debido a su capacidad de formar complejos con ácidos nucleicos, presentando biocompatibilidad y biodegradabilidad. Materiales como el quitosano, la gelatina, el dextrano, la celulosa y las ciclodextrinas han mostrado la habilidad de condensar el material genético y entregarlo dentro de la célula con baja toxicidad e inmunogenicidad, sin embargo, se han evidenciado problemas de solubilidad y baja eficiencia de transfección, lo que hace que se encuentren en desventaja con respecto a los polímeros sintéticos [10].
El quitosano es el polímero catiónico natural más empleado debido a su baja cito-toxicidad y alta densidad de grupos funcionales; es un polisacárido compuesto por D-glucosamina y N-acetil-glucosamina, cuya eficiencia de transfección depende del grado de deacetilación, el peso molecular y el pH (pKa 6,5) [31]. Sin embargo, su baja solubilidad en medios acuosos a pH fisiológico, tendencia a la agregación y baja estabilidad hacen que su manejo y aplicabilidad siga siendo limitada [32].
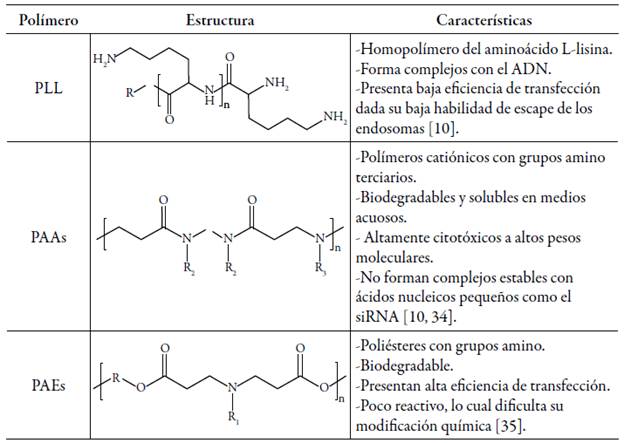
El uso de polímeros catiónicos sintéticos ha permitido superar los inconvenientes encontrados con los materiales naturales debido a que puede ejercerse un mejor control sobre sus propiedades a partir de modificaciones en su estructura. Por ejemplo, la introducción de grupos funcionales y segmentos, el empleo de homopolímeros o copolímeros, la variación en la arquitectura molecular (lineal, injertada, tipo estrella, entre otras) y el control del peso se puede lograr mediante el seguimiento de rutas sintéticas predeterminadas [33]. Entre los polímeros estudiados como vectores sintéticos se incluyen: poli-L-lisina (PLL), poliamido aminas (PAAs), poliamino ésteres (PAEs), PEI y PDMAEMA. Las características generales de los primeros tres polímeros se muestran en la tabla 2. Dadas las desventajas que presentan -como toxicidad, baja eficiencia de transfección o dificultades desde el punto de vista sintético- es necesario el uso de polímeros más versátiles como el PEI y el PDMAEMA, los cuales serán objeto de revisión en las secciones siguientes.
VECTORES BASADOS EN PEI
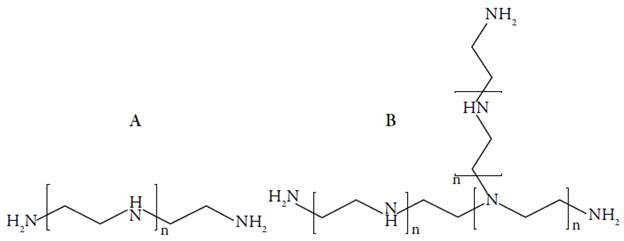
El PEI es uno de los polímeros catiónicos sintéticos más estudiados como agente de transfección de ácidos nucleicos debido a su alta eficiencia y habilidad de escape de los endosomas. Este puede ser sintetizado en forma lineal (lPEI), la cual contiene solo aminas secundarias o en la forma ramificada (bPEI) que contiene grupos amino primarios, secundarios y terciarios (figura 3) [10].
El uso de homopolímeros de PEI en la transfección de ácidos nucleicos ha sido objeto de diversas investigaciones, las cuales han mostrado que al incrementar el peso molecular del polímero aumenta la eficiencia de transfección, pero también se presenta un incremento en la citotoxicidad [36,37]. Se ha encontrado que los homopolímeros de PEI de alto peso molecular y alto grado de ramificación forman complejos estables con ácidos nucleicos, presentando buenas eficiencias de transfección; sin embargo, la forma lineal los libera más fácilmente, entregándolos de forma más efectiva al citoplasma o al núcleo [27]. Pese a la eficiencia del PEI como vector génico su carácter no degradable y citotoxicidad asociada ha limitado sus aplicaciones terapéuticas [15].
Para superar estos inconvenientes, uno de los enfoques que ha mostrado mejores resultados es su copolimerización con segmentos biocompatibles, tales como polietilenglicol (PEG), dextrano y quitosano. La pegilación es una estrategia muy empleada en el desarrollo de vectores ya que les provee mayor biocompatibilidad y estabilidad; el PEG es un segmento hidrofílico protector que previene interacciones indeseables con componentes de la sangre u otras biomoléculas; adicionalmente, le confiere estabilidad coloidal a las partículas que forma cuando el polímero interacciona con el ADN o ARN [14,38].
Por ejemplo, Merdan et al. [39] encontraron que la pegilación del PEI reduce la interacción de los complejos resultantes con las proteínas del plasma y los eritrocitos, lo que repercute en un incremento en su biocompatibilidad. Resultados similares son reportados por Mao et al. [40] quienes encontraron que los poliplejos, obtenidos a partir de PEI-g-PEG, copolimero injertado (g= graft, del inglés), presentan mayores tiempos de circulación y menor toxicidad que el PEI homopolímero y que a su vez, la eficiencia de transfección depende de la longitud de las cadenas de PEG y la densidad de injerto.
Por otro lado, Fischer et al. [41] investigaron las propiedades de copolímeros de dextrano-g-PEI, y encontraron que el dextrano aumenta la habilidad de complejación y estabilización del ADN, además de producir materiales no tóxicos. También se ha reportado la síntesis de copolímeros de PEI-quitosano para la formación de complejos con ADN, los cuales mostraron mayores eficiencias de transfección y menor citotoxicidad que el complejo PEI/ADN, además de mostrar una reducción en las interacciones con eritrocitos [42].
COPOLÍMEROS ANFIFÍLICOS DE PEI
Una de las estrategias que ha mostrado ser efectiva para disminuir la toxicidad y aumentar la eficiencia de transfección del PEI es el empleo de copolímeros con sustancias hidrófobas como los poliésteres alifáticos. Estos polímeros se caracterizan por su biocompatibilidad y biodegradabilidad; dentro de los más empleados se encuentran la poli(s-caprolactona) (PCL) y la polilactida (PLA), sustancias aprobadas por la agencia americana de regulación de medicamentos y alimentos, la FDA (Food and Drug Administration) para aplicaciones biomédicas [43,44]. De esta manera se obtienen materiales anfifílicos que se caracterizan por su capacidad de autoensamblarse con el ADN/ARN y formar nanopartículas como micelas.
Se han estudiado copolímeros basados en PCL y PEI con diferente arquitectura. Cao et al. [45] reportaron el uso de micelas obtenidas a partir de PCL-b-lPEI, copolimero en bloque (b= block, del inglés), como vectores de siRNA y doxorrubicina (Dox) en células de cáncer hepático humano, estos materiales exhibieron alta eficiencia de trans-fección y liberación controlada del fármaco. Asimismo, se han obtenido nanopartículas micelares basadas en copolímeros de injerto PEI-g-PCL (PEC) de diferentes pesos moleculares aplicadas en la entrega de ADNp y Dox; los complejos obtenidos mostraron baja citotoxicidad en células HepG2 a una relación nitrógeno/fósforo (N/P) de 10, tal como se deduce de los valores de viabilidad celular presentados en la figura 4 en función de la concentración del complejo. De acuerdo con Qiu et al. [46], los copo-límeros estudiados presentan mejores eficiencias de transfección que el PEI 25 kDa.
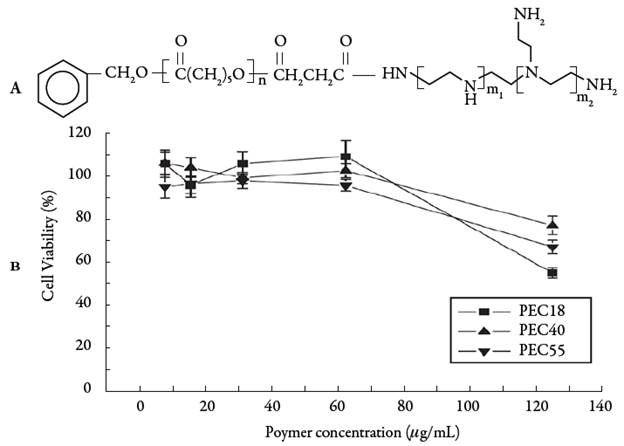
Figura 4 A. Estructura de los copolímeros PEC. B. Viabilidad de células HepG2 tras adición de concentraciones crecientes de PEC acomplejado con ADN a una relación N/P 10, luego de 4 horas de incubación (n=6) [46].
La incorporación de un segmento hidrófilo de PEG es una estrategia empleada para mejorar el desempeño de los copolímeros anfifílicos como vectores. Endres et al. [47] reportan la síntesis de copolímeros tribloque anfifílicos mPEG-¿-PCL-b-1PEI (m=metoxi) y su aplicación como nanotransportadores de siRNA; sus resultados indican una mejor eficiencia de transfección cuando se emplean segmentos cortos de PEG. Zheng y Liu et al. [48-50] obtuvieron micelas basadas en copolímeros ramificados de PEI-g-PCL-b-PEG, encontrando que la longitud de los segmentos poliméricos y la densidad de grafting afectan las propiedades de los complejos con ADN y con siRNA. Adicionalmente, establecieron relaciones entre la composición de los copolímeros y su eficiencia de transfección, tal como se muestra en la figura 5, además, se presenta el efecto de la relación N/P sobre cada una de las composiciones estudiadas. También se ha reportado la síntesis de copolímeros PEG-b-(PCL-g-PEI)-b-PCL para la formación de micelas aplicadas en la coliberación de siRNA y Dox; los resultados mostraron que las nanopartículas pueden entregar de manera efectiva estas sustancias inhibiendo el crecimiento de tumores resistentes a múltiples fármacos, específicamente en células de cáncer de mama resistentes a Dox [51].
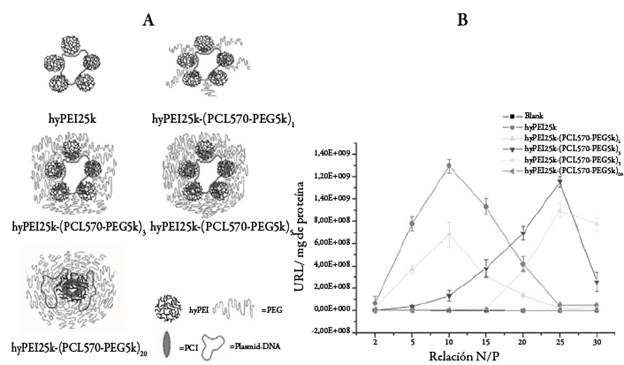
Figura 5 A. Conformación de los poliplejos hyPEI-g-PCL-b-PEG. B. Eficiencias de transfección de los polímeros evaluados en células de melanoma humano (MeWo) empleando ADNp que contiene el gen reportero de luciferasa en función de la relación N/P [48].
Además de PCL como segmento hidrófobo, también se han reportado materiales que contienen PLA, como en la investigación realizada por Coulembier et al. [52], donde se obtuvieron copolímeros de injerto PEI-g-PLA para la formación de nanopartículas, las cuales mostraron una buena penetración celular y podrían tener potencial aplicación en la entrega de genes. Igualmente, Gaspar et al. [53] estudiaron la coliberación de ADN y Dox mediante el uso de micelas basadas en copolímeros en bloque de poli(2-etil-2-oxazolina)-b-poli(L-lactida)-g-polietilenimina bioreducible (PEOz-b-PLA-g-PEI-SS), estas nanopartículas mostraron captación celular favorable y expresión de genes que codifican para luciferasa de luciérnaga y proteína verde fluorescente (PVF), tanto en pruebas in vitro como in vivo.
VECTORES BASADOS EN PDMAEMA
Los vectores basados en PDMAEMA han despertado gran interés por su alta eficiencia de transfección y fácil disociación del ácido nucleico dentro de la célula. Este polímero catiónico se caracteriza por poseer grupos amino terciarios parcialmente protonados a pH fisiológico (pKa ~ 7,5), lo que le permite actuar como agente de transfección de ADN/ARN [54]. Generalmente se sintetiza mediante metodologías de polimerización radicalaria controlada, tales como polimerización radicalaria por transferencia de átomo (ATRP) (ver figura 6).
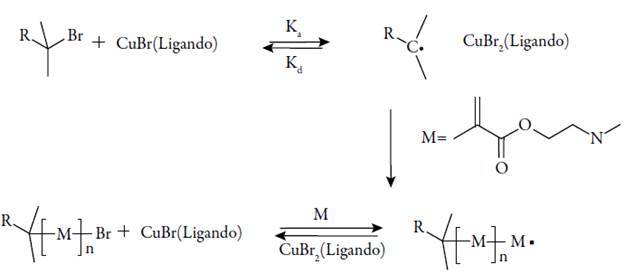
Figura 6 Síntesis de PDMAEMA vía ATRP. En este tipo de polimerización un haluro de alquilo actúa como iniciador, generando radicales libres a partir de una ruptura homolítica del enlace C-X, dicho proceso es reversible y presenta constantes cinéticas de activación (kj y desactivación (k,).
La estructura de varios homopolímeros de PDMAEMA y su influencia en la eficiencia de transfección de ácidos nucleicos ha sido objeto de diversas investigaciones, donde se han abordado aspectos como el efecto del peso molecular, tamaño de las partículas, pH, temperatura y relación polímero/plásmido, expresada como relación N/P [55]. Para el PDMAEMA lineal como vector de ADN se ha determinado que al incrementar el peso molecular del polímero se presenta mayor eficiencia de transfección, pero también incrementa la citotoxicidad [56].
Müller et al. [57] compararon el desempeño de muestras de PDMAEMA con arquitecturas diferentes: lineal y tipo estrella de tres y cinco brazos con diferente peso molecular; de acuerdo con sus resultados, la citotoxicidad es menor a bajos pesos y cuando incrementa el número de brazos. Sin embargo, las mejores eficiencias de transfección se obtienen para polímeros de alto peso molecular. De acuerdo con este estudio, polímeros con una estructura ramificada y pesos intermedios (mayor a 20 kDa) son los que presentan mejores resultados como sistemas de transfección de genes. Aunque los homopolímeros poseen alta eficiencia de transfección, su toxicidad sigue siendo un parámetro crítico que limita su aplicación.
Como en el caso del PEI, la copolimerización es una de las estrategias utilizadas para aumentar la eficiencia de transfección y reducir la toxicidad de los vectores basados en PDMAEMA. Se han reportado diversos estudios que incluyen su copolimerización con sustancias como PEG [58], poli(2-hidroxietil metacrilato) (pHEMA) [59], poli(iV-vinilpirrolidona) (PVP) [60] e hidroxipropil celulosa (HPC) [61], para ser aplicados en la entrega de diferentes tipos de ácidos nucleicos.
La pegilación del PDMAEMA conlleva a disminuir su citotoxicidad, aunque también se reduce su eficiencia de transfección debido a una menor captación celular de los complejos [58]. En tanto, en el estudio realizado por Jiang et al. [59] los vectores obtenidos a partir de copolímeros de injerto pHEMA-g-PDMAEMA presentan mejor desempeño que el correspondiente homopolímero, mientras que se reduce su toxicidad. Resultados similares son obtenidos para la copolimerización con PVP y HPC [60,61].
COPOLÍMEROS ANFIFÍLICOS DE PDMAEMA
La copolimerización del PDMAEMA con segmentos hidrofóbicos biodegradables también ha mostrado ser una herramienta útil para optimizar las propiedades de estos sistemas. Estos segmentos, dado su carácter biodegradable, facilitan la descomposición del vector al interior de la célula, generando moléculas de menor peso que son menos citotóxicas y que pueden ser fácilmente depuradas.
En la aplicación como vectores, la copolimerización con segmentos hidrófobos de PCL y PLA ha sido ampliamente estudiada. Guo et al. [62] reportan la obtención de copo-límeros PCL-g-PDMAEMA, los cuales se autoensamblan para formar nanopartículas tipo core-shell capaces de encapsular moléculas de paclitaxol y ADN. Estas nanopartículas mostraron eficiencias de transfección in vitro comparables con la Lipofectamina, una formulación comúnmente empleada en experimentos de transfección; sin embargo, este tipo de estructuras no mostraron reducciones significativas en la cito-toxicidad. La modificación superficial con cadenas de poli(ácido glutámico)-g-PEG es una estrategia reportada por Huang et al. [63] para reducir la citotoxicidad del PDMAEMA y mejorar la estabilidad de sus complejos con ADN.
También, trabajando con paclitaxol, Zhu et al. [64] sintetizaron copolímeros tri-bloque PDMAEMA-b-PCL-b-PDMAEMA, empleándolos como precursores de micelas poliméricas, a las cuales se les evaluó la eficiencia de transporte y entrega del medicamento. Se observó que la presencia de PCL copolimerizado con segmentos de PDMAEMA de bajo peso molecular disminuye la citotoxicidad de los vectores resultantes, tal como se muestra en la figura 7. Adicionalmente, mejoró la eficiencia en el silenciamiento de genes en comparación con los homopolímeros de PEI 25 kDa y PDMAEMA 20 kDa. Este comportamiento fue corroborado por Yue et al. [65], quienes emplearon nanopartículas basadas en mPEG-b-PCL-b-PDMAEMA como vectores de ADNp y encontraron que la inclusión del segmento hidrofóbico aumenta significativamente la eficiencia de transfección.
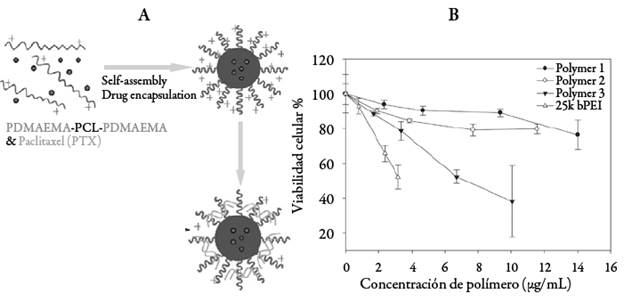
Figura 7 A. Formación de los poliplejos cargados con paclitaxol. B. Citotoxicidad de las micelas PDMAEMA-b-PCL-b-PDMAEMA en células de cáncer de mama humano MDA-MB-435-GFP. Las células fueron tratadas por 24 horas y se midió la actividad metabólica (n=3). Polymer 1, Polymer 2y Polymer 3 hacen referencia a distintas relaciones molares de los monómeros en los bloques constituyentes DMAEMA:CL:DMAEMA de 2,7-3,6-2,7; 5,8-3,6-5,8 y 9,1-3,6-9,1, respectivamente [64].
Además de la composición de los copolímeros, su arquitectura molecular también juega un papel importante, tal como se demostró en el estudio realizado por Lin et al. [12], en el que compararon copolímeros en bloque lineales y de injerto basados en mPEG, PCL y PDMAEMA como vectores de siRNA. Sus resultados mostraron que los copolímeros de injerto presentan mayor captación celular en comparación con el copolímero en bloque, lo cual se atribuyó a que las nanopartículas que forma presentan valores más altos de potencial zeta y por lo tanto mayor carga superficial. Un copolímero similar, mPEG-b-PCL-g-PDMAEMA (PECD), fue sintetizado por Guo et al. [13] con el fin de obtener nanopartículas micelares para la entrega de plásmidos que codifican tanto para luciferasa como para PVF, obteniendo mejores eficiencias de transfección que el PEI y la lipofectamina en células HepG2, tal como se muestra en la figura 8B y se deduce de la imágenes de microscopía de fluorescencia en la figura 8C.
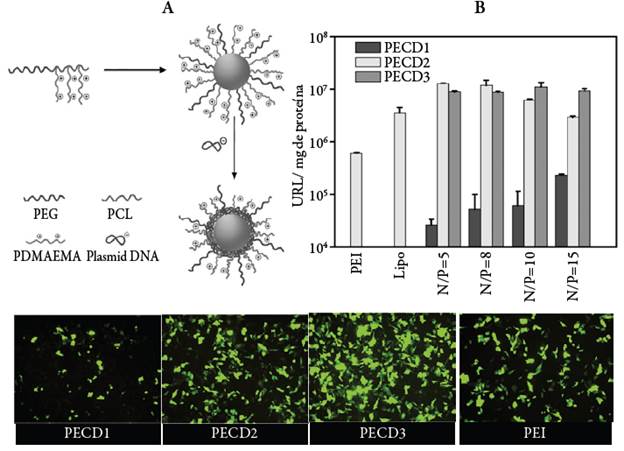
Figura 8 A. Representación esquemática de la preparación de los complejos PECD/ADNp. B. Eficiencias de transfección in vitro de nanopartículas PECD complejadas con ADNp (luciferasa) a varias relaciones N/P. C. Imágenes de fluorescencia de células transfectadas con complejos PECD/ ADNp (PVF) a una relación N/P = 10 (escala 30 μm). Composición de los copolímeros: PECD1: mPEG45-P(CL104-co-(BMPCL-g-PDMAEMA11)4); PECD2: mPEG45-P(CL104-co-(BMPCL-g-PDMAEMA23)4); PECD3: mPEG45-P(CL104-co-(BMPCL-g-PDMAEMA39)4) [13].
De manera similar, Kang et al. [66] trabajando con PLA y PDMAEMA sintetizaron copolímeros anfifílicos en forma de estrella los cuales fueron estudiados para la coentrega de RNA y Dox. Sus resultados mostraron que la eficiencia en la transfección de las nanopartículas micelares resultantes depende de la arquitectura molecular, donde los copolímeros con mayor número de ramificaciones exhibieron las eficiencias más altas.
CONCLUSIONES
La implementación de vectores génicos basados en polímeros sintéticos tales como PEI y PDMAEMA ha tenido un gran desarrollo durante las últimas décadas, ya que pese a su citotoxicidad y baja biodegradabilidad presentan alta eficiencia de transfección.
Se ha demostrado que modificaciones químicas, tales como la introducción de segmentos poliméricos biodegradables y la obtención de estructuras moleculares ramificadas, permiten mejorar su eficiencia en la transfección de material genético y reducir su citotoxicidad. Aunque este tipo de materiales son promisorios para su aplicación en el campo de la terapia génica, es necesario adelantar estudios interdisciplinarios con el fin de caracterizar los fenómenos involucrados en la entrega de los ácidos nucleicos, además de establecer relaciones entre la estructura de los polímeros y sus propiedades como vectores, con el fin de optimizar su desempeño en el campo de la terapia génica.