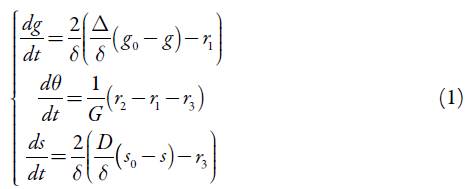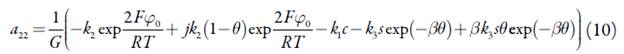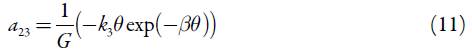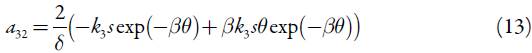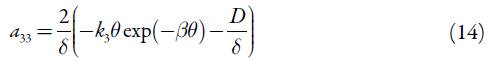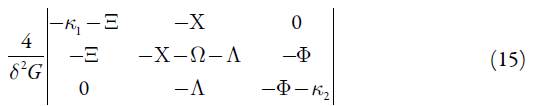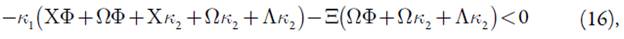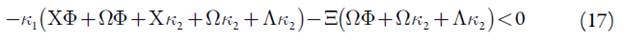INTRODUÇÃO
A alfarrobeira (Ceratonia siliqua), também conhecida como pão-de-São-João, figueira-de-Pitágoras ou figueira-do-Egito, é uma planta nativa da região mediterrânica (incluindo Espanha e Portugal), cuja fruta é alfarroba. A alfarrobeira sói utilizar-se na produção de alimentos e bebidas [1-2] e na medicina popular.
Além dos polissacarídeos, que compõem a sua goma (E410), a alfarroba contém outros compostos, dentre os quais se destacam a tanina e outros ésteres do ácido gálico (ver figura 1) [3-4]. São compostos com alto poder antioxidante, haja vista a presença dos fragmentos quinônicos nas suas formas oxidadas, permitindo o seu uso como conservante na produção tanto de alimentos, como de fármacos e até de biodiesel. No entretanto, quando em excesso, estes ésteres podem causar reações alérgicas, associadas ao ácido gálico (dores nas costas, hiperatividade, nariz entupido, dificuldades na aprendizagem) [5]. Outrossim, estes ésteres não são recomendados em produtos, que requerem emprego de forno [6]. Foi provada, ademais, a sua capacidade antagonista aos estrogênios [7]. Destarte, o desenvolvimento dos métodos da detecção analítica destes compostos é, deveras, uma tarefa atual [8-9], e os métodos eletroquímicos, envolvendo elétrodos quimicamente modificados, ser-lhe-iam uma resposta interessante.
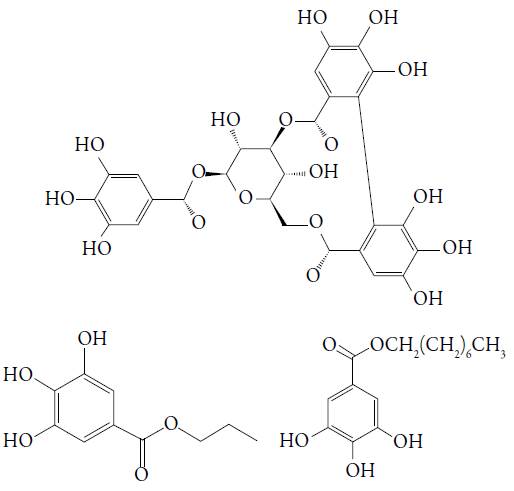
Figura 1 Os derivados importantes do ácido gálico. Galotanina, galato de propila (E310) e galato de octila (E311).
Para a detecção eletroquímica dos ésteres do ácido gálico e outros compostos quinô-nicos foram utilizadas várias metodologias eletroquímicas, envolvendo os materiais modificadores como líquidos iónicos [10], polímeros condutores [11], éster específico do ácido molibdênico [12] e até a casca de banana [13]. No entanto, existe, também, a possibilidade de uso de outros tipos de modificadores, como o oxihidróxido de cobalto (teoricamente previsto em [14]) e, também, os novos derivados orgânicos.
Em [15], foi descrita a síntese de um novo derivado orgânico, com possibilidades para ser aditivo fluorescente ao polímero condutor ou monômero para uso eletroanalítico e conversor em pilhas solares. Contendo um sistema conjugado, substituído por um doador forte de elétrons pi, ele pode ser eletroquimicamente ativo. No entretanto, o uso de novos modificadores e processos eletroanalíticos pode acarretar a resolução de novos problemas, como:
- A indecisão acerca do mecanismo de interação entre o modificador e o analito.
- A possível incompatibilidade do modificador do elétrodo para análise in vivo.
- A possibilidade da realização das instabilidades eletroquímicas, características para a eletrooxidação dos compostos orgânicos [16-21], inclusive a eletropolimerização de compostos heterocíclicos.
Destarte, o desiderato deste trabalho é a investigação mecanística teórica do desempenho do novo derivado acridínico, cuja síntese foi descrita no nosso trabalho anterior, para a determinação do conteúdo total do ácido gálico em alfarroba. Para alcançá-lo, é-nos preciso realizar os seguintes objetivos específicos:
- Propor o mecanismo do processo eletroanalítico.
- Desenvolver e analisar o modelo matemático, que lhe é correspondente.
-Da análise do modelo, julgar acerca da possibilidade da realização da quantificação eletroquímica do conteúdo do ácido gálico, mediante a aplicação do elétrodo, dopado pelo composto acridínico.
- Comparar o comportamento deste sistema com o dos semelhantes [22-24].
O SISTEMA Ε O SEU MODELO
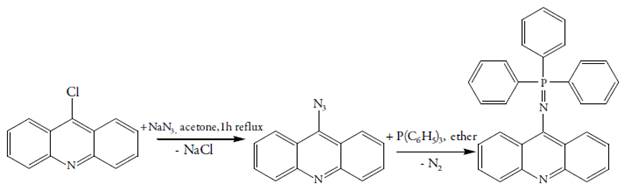
A síntese da nova (9-trifenilfosfazo)acridina tem sido descrita em [15] e é apresentada na figura 2:
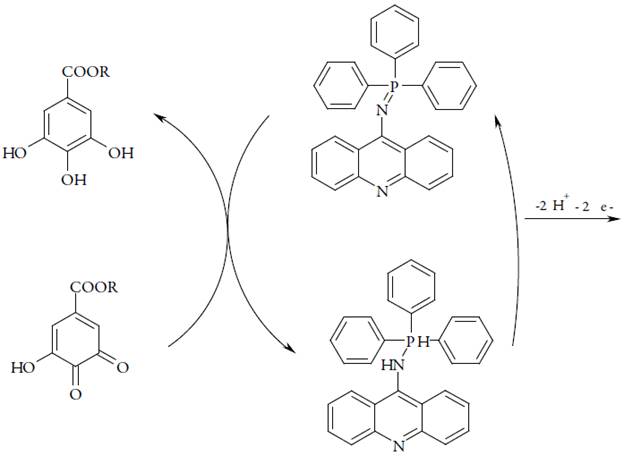
A presença do grupo trifenilfosfazoico, que consegue doar 20 elétrons pi ao sistema conjugado acridínico, diminui o seu potencial da eletrooxidação, fazendo possível, até a polimerização deste composto, ou a introdução do fragmento dentro de uma cadeia polimérica condutora. Destarte, o mecanismo do processo eletroanalítico para derivados do ácido gálico dar-se-á conforme a figura 3:
Tomando em conta a possibilidade da reação lateral do composto fosfazoico com o um composto, presente no meio reacional (podendo ou não dissolver o composto fosfazoico) e incapaz de reagir com o ácido gálico, introduzimos as três variáveis:
g: a concentração do derivado do ácido gálico em meio pré-superficial;
θ: o grau de recobrimento da área do elétrodo pelo derivado fosfazoico inicial;
s: a concentração da substância, capaz de reagir com o modificador do elétrodo, na camada pré-superficial.
Para simplificar a modelagem, supomos que o reator esteja agitando-se intensamente, de modo que possamos menosprezar o fluxo de convecção, que o eletrólito de suporte esteja em excesso, para menosprezar o fluxo de migração. Também supomos que a camada pré-superficial esteja de espessura constante, igual a δ, e que o perfil concentracional dos dois analitos seja linear.
É possível mostrar que, haja vista o supracitado, o comportamento do sistema poder-se-á descrever pelo conjunto de equações diferenciais, representado como:
em que Δ e D são coeficientes de difusão dos derivados do ácido gálico e da substância interferente, g0 e s0 são as suas concentrações no interior da solução e os parâmetros r são as velocidades das respectivas reações, que se podem calcular conforme:
em que os parâmetros k são constantes das respectivas reações, F é o número de Faraday, φ 0 é o salto do potencial, relativo ao potencial de carga zero, R é a constante universal de gases, T, a temperatura absoluta e β o parâmetro, que descreve a interação entre as partículas do fosfazocomposto da acridina durante a sua dissolução e igal a 0, quando esta não ocorre.
O comportamento do sistema mostra-se parecido aos já descritos em [22-24]. No entretanto, a presença de uma reação lateral dinamiza, de maneira significante, o comportamento do sistema, o que se mostrará abaixo.
RESULTADOS Ε DISCUSSÃO
Para investigar o comportamento do sistema com a detecção eletroquímica do conteúdo total do ácido gálico em alfarroba, assistida pelo derivado fosfazoico da acridina, analisamos o conjunto de equações diferenciais (1) mediante a teoria de estabilidade linear. Os elementos estacionários da matriz funcional de Jacobi descrever-se-ão como:
em que:
Analisando as equações (6), (10) e (14), que representam os elementos da diagonal principal, é possível mostrar que o comportamento oscilatório é possível neste sistema. De qualquer maneira, quando o parâmetro j, que descreve as influências da etapa ele-troquímica na capacitância da dupla camada elétrica, tem valores positivos, o adendo 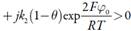 é positivo, descrevendo, destarte, a positiva conexão de retorno. Assim, ele descreve o comportamento oscilatório, causado por essas influências e característico para os sistemas semelhantes [22-24].
é positivo, descrevendo, destarte, a positiva conexão de retorno. Assim, ele descreve o comportamento oscilatório, causado por essas influências e característico para os sistemas semelhantes [22-24].
Quanto à influência das instabilidades superficiais, elas só se realizam, havendo dissolução do composto fosfazoico. Assim, 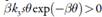 , descrevendo a atração entre as partículas adsorvidas do composto fosfazoico como causa do comportamento oscilatório. Não havendo dissolução, o fator da atração das partículas do composto será desprezível; β=0, e o elemento supracitado anular-se-á. Destarte, é possível ver que a presença do fator superficial como causa do comportamento oscilatório dependerá da característica da reação lateral.
, descrevendo a atração entre as partículas adsorvidas do composto fosfazoico como causa do comportamento oscilatório. Não havendo dissolução, o fator da atração das partículas do composto será desprezível; β=0, e o elemento supracitado anular-se-á. Destarte, é possível ver que a presença do fator superficial como causa do comportamento oscilatório dependerá da característica da reação lateral.
A fim de investigar a estabilidade do estado estacionário, aplicamos o critério de Routh -Hurwitz. Simplificando o determinante da matriz, introduzimos as novas variáveis, de modo que este se descreve como:
Abrindo os colchetes, e aplicando a condição Det J<0, saliente do critério, obtemos o requisito de estabilidade do estado estacionário, descrito como:
Requisito fácil de satisfazer, não havendo influências superficiais e eletroquímicas na dupla camada elétrica. Deveras, se não houver as influências supracitadas, os parâmetros X e Λ manter-se-ão positivos, e as expressões do lado esquerdo da inequação (16), deslocar-se-ão para valores mais negativos, e o estado estacionário far-se-á mais estável. A expressão (16) tem aparência de uma expressão, característica para um processo ele-troanalítico, controlado por difusão do analito e da substância interferente.
Sem embargo, como se sói acontecer, neste sistema, a estabilidade do estado estacionário não garantirá a sua eficiência eletroanalítica. Decerto, havendo reação lateral rápida do composto fosfazoico da superfície do elétrodo, o material modificador não poderá mais assistir o processo eletroanalítico, embora o estado estacionário permaneça estável. Assim sendo, faz-se um requisito específico de estabilidade relativa do composto fosfazoico em meio à reação lateral.
Satisfeito este requisito, a estabilidade do estado estacionário descreverá a linearidade da dependência entre o parâmetro eletroquímico e a concentração do analito e corres-ponder-se-lhe-á. Destarte, é possível concluir que, não havendo reações laterais rápidas, o fosfazocomposto da acridina será um modificador eficiente para a detecção do conteúdo do ácido gálico.
A instabilidade monotônica correspondente ao limite de detecção, neste sistema se realiza no caso da nulidade do determinante da matriz de Jacobi, e a sua condição de aparição é:
Se a substância, presente na solução, não reagir com o fosfazocomposto, nem com o ana-lito, considerar-se-á indiferente, e a variável s excluir-se-á do conjunto de equações diferenciais (1), e o conjunto transformar-se-á no descrito, por exemplo, em [15] e em [22].
Na alfarroba, não existem substâncias, capazes de provocar a modificação e dissolução do fosfazocomposto de acridina. Destarte, o seu uso é compatível com a análise do conteúdo de alfarroba em soluções neutras.
CONCLUSÕES
A avaliação teórica do comportamento do composto fosfazoico da acridina na detecção eletroquímica do conteúdo total do ácido gálico em alfarroba deixou concluir que:
- A estabilidade do estado estacionário é fácil de manter. O processo eletroanalítico é controlado pela difusão.
- Desde que não haja reações laterais rápidas, o estado estacionário estável manter-se-á eficiente do ponto de vista eletroanalítico e correspondente à dependência linear entre o parâmetro eletroquímico e a concentração do analito.
- O comportamento oscilatório, neste caso, é possível, sendo causado pelas influências da etapa eletroquímica na capacitância da dupla camada elétrica e, se for o caso, pelos efeitos superficiais da dissolução do composto fosfazoico.