INTRODUCCIÓN
Cavendishia compacta es un arbusto epifito de 4 metros de altura aproximadamente, con tallo estriado, glabro y de color café. Presenta hojas coriáceas y elípticas, su ápice es acuminado, glabro o con pelos dispersos a lo largo de la nervadura central [1]. Comúnmente es conocida como camarero grande; es una especie endémica de Colombia que se distribuye a lo largo de las laderas occidentales y estribaciones de la Cordillera Occidental, en el bosque húmedo, en elevaciones de 5-1800 m s.n.m. A esta especie se la da un uso ornamental, ya que hace parte de la vegetación de la zona y sus flores son de gran atractivo para las personas por su color vivo.
Aunque no existen reportes de sus estudios químicos, se han logrado identificar en el género Cavendishia flavonoides de diferentes tipos como: flavonas (luteolina, chrysoeriol y tricina), flavonoles como quercetina, kaempferol y miricetina, dihidro-flavonoles y proantocianidinas. También se han reportado compuestos fenólicos como el ácido elágico y el ácido salicílico [2]. En Cavendishia endresii y Cavendishia grandifolia se ha reportado la presencia de resveratrol y estilbenos, en extractos de esta última especie se presentan derivados del ácido cinámico y en sus frutos, grandes contenidos de ácido clorogénico como constituyente químico más abundante en esta especie [3].
Es importante resaltar que, aunque Colombia posee gran número de especies pertenecientes al género Cavendishia, estas no cuentan con estudios químicos o biológicos reportados en la literatura, razón por la cual el presente trabajo se orientó al estudio químico de las hojas de la especie vegetal Cavendishia compacta y la evaluación de su actividad antiinflamatoria.
METODOLOGÍA
El material vegetal fue recolectado en el corregimiento Virolin, finca la Sierra, camino el Olival del municipio de Charalá, Santander, Colombia (Coordenadas geográficas: 6° 06' 31.0" N, 73° 11' 54.1 " W). Una muestra testigo fue enviada al Herbario Nacional de Colombia para su determinación taxonómica la cual fue clasificada bajo el número de colección COL 574699 como Cavendishia compacta. Se tomaron (300 g) de hojas de la especie las cuales se secaron a temperatura ambiente y fueron reducidas de tamaño para su posterior extracción.
Obtención de extractos y fracciones
Las hojas una vez secas y trituradas en molino fueron sometidas a una extracción con etanol (EtOH) por el método de extracción soxhlet; el extracto obtenido (E.EtOH.H, 22,6 g) fue floculado con agua en relación 1:0,5mL y filtrado posteriormente. Al E.EtOH.H se le realizó un estudio fitoquímico preliminar [4] con el propósito de reconocer los posibles grupos de metabolitos presentes en el mismo. Para el fraccionamiento del E.EtOH.H se empleó el método de extracción líquido-líquido continuo con solventes de polaridad creciente obteniendo las fracciones de hexano (F.HEX.CcH, 9,57% p/p), diclorometano (F.CH2Cl2.CcH, 6,62% p/p), acetato de etilo (F.AcOEt. CcH, 22,64% p/p) y un residuo hidroalcohólico (R.H.CcH, 60,36% p/p).
Se tomaron 4 g de F.HEX.CcH y se fraccionaron por cromatografía en columna (CC) empleando como fase móvil hexano: cloroformo 6:4, obteniendo 8 fracciones. Las fracciones 1 (F.HEX.CcHF1) y 4 (F.HEX.CcHF4) fueron subfraccionadas nuevamente por CC. Para 0,66g de F.HEX.CcHF1 se empleó como fase móvil diclorometano: acetona 9:1, obteniendo 5 subfracciones. En las subfracciones 2 (F.HEX.CcHF1.2) y 4 (F.HEX.CcHF1.4) se obtuvo 9,2 mg de un sólido de color blanco denominado mezcla CcH1 y 21,6 mg de un sólido de color verde denominado mezcla CcH2, respectivamente. Para 0,60 g de (F.HEX.CcHF4) se empleó como fase móvil diclorometano: acetona 8:2, obteniendo 5 subfracciones. En la subfracción 1 (F.HEX.CcHF4.1) se obtuvo 30 mg de un sólido de color blanco denominado mezcla CcH3.
Se tomaron 0,07g de F.CH2Cl2.CcH y se fraccionaron por CC empleando como fase móvil diclorometano: acetato de etilo 1:1, obteniendo 10 fracciones. En la fracción 2 (F.CH2Cl2.CcHF2) precipitó un sólido de color amarillo (87 mg) denominado compuesto CcH4 y en la fracción 3 (F.CH2Cl2.CcHF3) se obtuvo un sólido de color amarillo-verdoso (120mg) denominado compuesto CcH5.
A partir de 1g de (F.AcOEt.CcH) se fraccionó por CC empleando como fase móvil cloroformo: metanol 6:4, obteniendo 5 fracciones. La fracción 1 (F.AcOEt.CcHF1), fue fraccionada por CC empleando como fase móvil cloroformo: metanol 7:3, obteniendo 12 subfracciones. En la subfracción 1 (F.AcOEt.CcHF1.1) precipitó un sólido (40mg) de color amarillo-verdoso, este después de ser analizado resulto ser el mismo compuesto denominado CcH5.
Evaluación de la actividad antiinflamatoria
La evaluación de la actividad antiinflamatoria del extracto y de las fracciones obtenidas se realizó mediante el ensayo in vivo de edema inducido en oreja de ratón por TPA, empleando 36 ratones albinos machos de 32 a 38 g, entre doce a catorce semanas de nacidos, mantenidos en condiciones estándar los cuales fueron suministrados por el Bioterio de la facultad de Farmacia de la Universidad Nacional de Colombia. Se administró el irritante 13-acetato 12-tetradecanoilforbol (TPA, 2,5 μg/oreja) junto con indometacina 500 μg/oreja como patrón y la sustancia a evaluar (E.EtOH.H, F.HEX. CcH, F.CH2Cl2.CcH y F.AcOEt.CcH 500 μg/oreja) disueltas en EtOH-acetona vía tópica en la oreja derecha (volumen total: 20 μL/oreja, 10 μL/cara), la oreja izquierda se empleó como control. Transcurridas 4 horas se sacrificaron los animales por dislocación cervical y se obtuvieron muestras de cada pabellón auricular por sacabocado de 6mm de diámetro. Finalmente se calculó la diferencia de peso entre oreja tratada y no tratada expresando los resultados como porcentaje de inhibición del edema. Para el análisis se consideró como actividad antiinflamatoria moderada la inhibición del edema del 35 al 65% y como buen efecto antiinflamatorio un valor mayor de 65% [5]. Finalmente, se realizó un análisis estadístico de varianza de un solo factor, mediante el software Minitab 16.2.3 seguido de una prueba Dunnett para comparaciones múltiples.
Técnicas para la elucidación estructural y caracterización de los compuestos aislados
Para la determinación de las mezclas se empleó un cromatógrafo de gases con detector selectivo de masas SHIMADZU QP2010 plus, ubicado en el laboratorio de química de la Universidad Distrital Francisco José de Caldas. La separación se realizó en una columna capilar SHRXI-5MS (J & W Scientific, Folsom, CA, EE.UU.) de 30 m x 0,25 mm x 0,25 μm con una inyección en modo Split (10:0), el gas de arrastre utilizado fue helio (grado 5,0) con flujo constante de 1,2 mL/min. La programación de la temperatura del horno fue de 50 °C (2 min), incremento de 15 °C/min, hasta 200 °C (2 min), incremento de 10 °C/min, hasta 300 °C (10 min) para un tiempo total de análisis de 34 minutos, las temperaturas de la cámara de ionización y de la línea de transferencia fueron de 230 °C y 275 °C, respectivamente.
Los espectros de masas de las sustancias aisladas fueron tomados en un equipo SHI-MADZU MS QP2010 dotado con sonda de inserción directa y analizador de masas cuadrupolar. El modo de ionización fue ionización electrónica (IE) a 70eV y la temperatura de la cámara de ionización fue de 230 °C.
Los espectros de RMN 1H fueron tomados en un espectrómetro Bruker Avance. Los análisis se realizaron a 300 MHz para RMN 1H, empleando como solvente CDCl3, con tetrametilsilano (TMS) como referencia interna.
RESULTADOS
Análisis fitoquímico preliminar
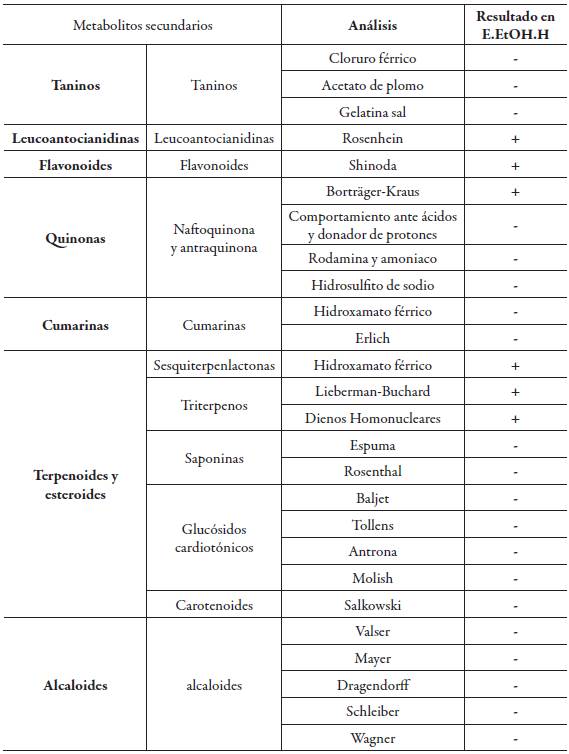
Los resultados de los ensayos químicos preliminares realizados al extracto etanólico de hojas (E.EtOH.H) de la especie Cavendishia compacta se encuentran en la tabla 1.
Metabolitos secundarios aislados
Mezcla CcH¡
La mezcla CcH1 se obtuvo como un sólido (9,2 mg) de color blanco. En el análisis por cromatografía de gases acoplada a espectrometría de masas (CG-EM) de la mezcla CcH1 se obtuvieron tres señales en la corriente iónica total (TIC). La comparación de los espectros de masas con los de la librería NIST 08 confirma la presencia Rimueno, Biformeno y Kaurano.
Mezcla CcH 2
La mezcla CcH2 se obtuvo como un sólido (21,6 mg) de color verde. En el análisis por cromatografía de gases acoplada a espectrometría de masas (CG-EM) de la mezcla CcH2 se obtuvieron dos señales en la corriente iónica total (TIC). La comparación de los espectros de masas con los de la librería NIST 08 confirma la presencia de Acetofenona y Benzaldehído.
La mezcla CcH3 se obtuvo como un sólido (30 mg) de color blanco. En el análisis por cromatografía de gases acoplada a espectrometría de masas (CG-EM) de la mezcla CcH3 se obtuvieron dos señales en la corriente iónica total (TIC). La comparación de los espectros de masas con los de la librería NIST 08 confirma la presencia de α- amirina y β- amirina.
Compuesto CcH 4 T3
El compuesto CcH4 se obtuvo como un sólido (87 mg) de color amarillo, el cual fue analizado a través de espectrometría de masas por inserción directa. En el espectro de masas se observa el ion molecular a m/z 302, el pico base m/z 285 (M-OH) y señales en m/z 153, 134, 121, 108 resultantes del mecanismo Retro Diel Alder (RDA) el cual corresponde al flavonol morina [6]. El espectro RMN 1H del compuesto CcH4 muestra dos singletes en δ 3,90 y 3,93 ppm correspondientes a grupos hidroxilos en la posición C-2' y C-4' del anillo B; dos dobletes en δ 5,93 ppm (2 Hz, 1H) y 6,43 ppm (2 Hz, 1H), que corresponden a protones acoplados en posición meta (C-6 y C-8) del anillo A; un doblete en δ 6.59 ppm (2 Hz, 1H) ubicado en C-3' y un doble doblete en 6,95 ppm (C-5') (8 Hz, 2 Hz, 1H) que corresponden a protones del anillo B y un último doblete en δ 7,53 ppm (C-6') (8 Hz, 1H), todos ellos característicos de hidrógenos aromáticos.
Luego del análisis de los datos de RMN 1H, EM y de la comparación con datos reportados en la literatura (ver tabla 2), se asignaron los desplazamientos químicos para cada uno de los hidrógenos de la molécula la cual se identificó como morina.
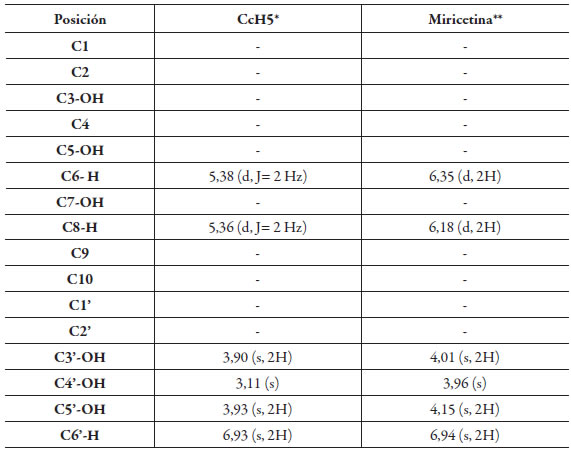
Tabla 2 Comparación de los desplazamientos químicos RMN 1H del compuesto CcH4 con el de morina.
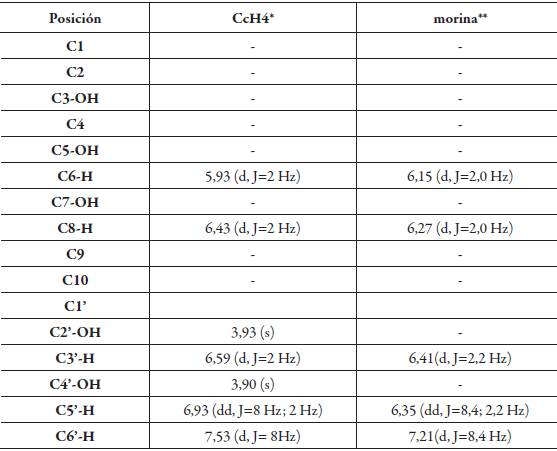
*Datos obtenidos a 300MHz para RMN 1H (solvente: CDCl3).
** Datos obtenidos a 200 MHz para RMN 1H (solvente: CD3OD) [7].
Compuesto CcH 5
El compuesto CcH5 obtenido como un sólido de color verde (160 mg) fue analizado a través de espectrometría de masas por inserción directa. En el espectro de masas se muestra el ion molecular a m/z 318 y señales en m/z 317 (M-H), 302, el pico base en m/z 179 (M-138), 136 y 138 el cual corresponde al flavonol Miricetina [8]. El espectro de RMN 1H del compuesto CcH5, muestra tres singletes en δ 3,90; 3,11 y 3,93 ppm correspondientes a grupos hidroxilos ubicados en las posiciones C-3', C-4' y C-5' [9], dos dobletes en δ 5,36 ppm (2 Hz, 1H) y 5,38 ppm (2 Hz, 1H) correspondientes a protones unidos en las posiciones C-8 y C-6 respectivamente, finalmente un singlete en δ 6,93 ppm que corresponde a dos protones unidos al C-2' C-6' [10].
Luego del análisis de los datos de RMN 1H, EM y de la comparación con datos reportados en la literatura (ver tabla 3), se asignaron los desplazamientos químicos para cada uno de los hidrógenos de la molécula la cual se identificó como Miricetina.
Actividad antiinflamatoria
El extracto etanólico (E.EtOH.H) y las fracciones de Hexano (F.HEX.CcH), diclorometano (F.CH2Cl2.CcH) y acetato de etilo (F.AcOEt.CcH) fueron evaluadas mediante el ensayo in vivo de edema inducido en oreja de ratón por TPA. Los metabolitos aislados no fueron evaluados en este modelo por la cantidad de sustancia requerida para el análisis. Los datos analizados estadísticamente fueron los deltas de peso, ya que estos son los que determinan el edema o la inflamación, de esta manera, se efectuó un análisis de varianza de un solo factor (ANOVA).
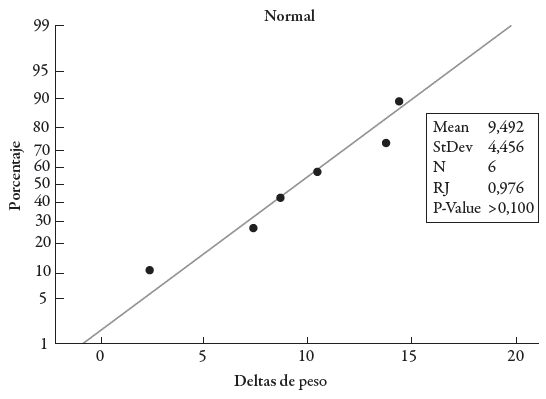
Se realizaron dos pruebas para comprobar la distribución normal y la homogeneidad de varianzas de la población. La distribución normal se evaluó mediante una prueba de Ryan-Joiner con un nivel de confianza del 95%, esto implicó contrastar siguientes hipótesis: H o : la población sigue una distribución normal, H 1 : la población no sigue una distribución normal.
Posteriormente, la prueba de Ryan-Joiner indicó que la población de datos seguía una distribución normal ya que el p-valor= >0,1 fue mayor que el α =0,05, por lo tanto, hay argumentos suficientes para aceptar la hipótesis nula (ver figura 1).
La homogeneidad de varianzas se evaluó mediante una prueba de Levene con un nivel de confianza del 95%, la cual pone en contraste las dos siguientes hipótesis: H o : en la población no hay homogeneidad de varianzas, H 1 : en la población hay homogeneidad de varianzas.
Así, la prueba de Levene indicó que hay homogeneidad de varianzas en la población ya que el p-valor=0.0 fue menor que el α=0,05, por lo que, no hay argumentos suficientes para aceptar la hipótesis nula (ver figura 2).
Después de comprobar los parámetros requeridos para el análisis de varianza, se procedió a calcular el estadístico ANOVA para un solo factor con un nivel de confianza del 95%, el cual pone a prueba las dos siguientes hipótesis: H o : al menos uno de los tratamientos es diferente, H 1 : no existen diferencias significativas entre los tratamientos.
El ANOVA para un solo factor fue calculado con el software Minitab 16.2.3 y el resultado obtenido fue que si existen diferencias significativas entre los tratamientos, ya que el p-valor=0,315 fue mayor que el α=0,05, por lo cual, hay argumentos suficientes para aceptar la hipótesis nula (ver figura 3).
Como el análisis de varianza se evidenció que hay diferencias significativas entre los tratamientos, se realizó una prueba de comparación múltiple para averiguar cuáles eran los tratamientos más significativos. La prueba de comparación múltiple que se escogió para analizar los datos fue la prueba de Dunnett, ya que esta prueba compara las medias de cada uno de los tratamientos contra el control, lo cual permite observar que tan buena fue la respuesta de cada uno de ellos con respecto a la respuesta del control. La prueba de Dunnett se calculó con el software Minitab 16.2.3 con un nivel de confianza del 95%. Este estadístico pone a prueba las siguientes hipótesis: H o : la media del tratamiento x es igual a la media del control, H 1 : la media del tratamiento x es diferente a la media del control.
Esta prueba indicó que los tratamientos más significativos obtenidos de las hojas de Cavendishia compacta fueron el extracto E.EtOH.H con un p-valor=0,00 y la fracción F.CH2Cl2.CcH con un p-valor= 0,00. Al ser estos dos valores menores que el α=0,05 no hay argumentos suficientes para aceptar la hipótesis nula (ver figura 4).
Los tratamientos 2 (indometacina), 3 (E.EtOH.H) y 5 (F.CH2Cl2.CcH) que no están etiquetados con la letra A son significativamente diferentes a la media del control (ver figura 5).
En la figura 6 están los intervalos de confianza a un nivel del 95% para la media, al menos, las medias procedentes de los tratamientos 2 (1,366); 3 (2,793) y 5 (2,613) son significativamente diferentes a las del control:
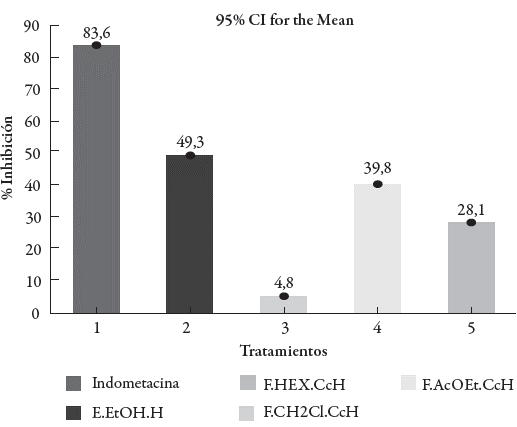
De otro lado, la tabla 4 muestra los resultados del efecto del extracto y las fracciones evaluadas sobre el edema producido por la aplicación del TPA, encontrándose, que el extracto E.EtOH.H y la fracción F.CH2Cl2.CcH exhibieron una actividad antiinflamatoria moderada respecto al control con un porcentaje de inhibición del edema de 49,3% y 39,8%, respectivamente, mientras que la indometacina mostró una inhibición del edema de 83,6% a la misma dosis, con lo que se confirma la validez del ensayo y los resultados mostrados por el extracto y las fracciones evaluadas. Las fracciones F.HEX. CcH y F.AcOEt.CcH presentan un efecto antiinflamatorio nulo ya que sus porcentajes de inhibición fueron del 4,8% y 28,1% respectivamente.
Tabla 4 Efectos del extracto y las fracciones evaluadas de Cavendishia compacta sobre el edema auricular inducido por TPA.
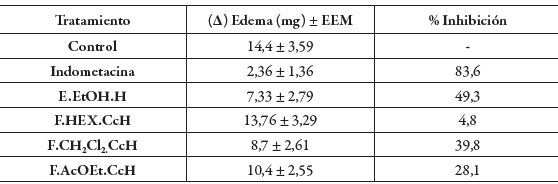
* Datos expresados como la media ±error estándar de la media (E.E.M); n=6.
Los valores obtenidos para los tratamientos, el control y la indometacina se analizaron de forma gráfica (ver figura 7), lo cual corroboro los resultados del análisis estadístico, ya que los tratamientos que presentaron una acción antinflamatoria moderada fueron aquellos que tuvieron un porcentaje de inhibición de la inflamación entre 35-65%.
DISCUSIÓN
El estudio fitoquímico preliminar indica la presencia de metabolitos secundarios como fla-vonoides y terpenoides en la planta lo cual confirma lo encontrado por varios autores que destacan la presencia de estos compuestos en especies de la familia Ericaceae [8,11,12].
Este es el primer estudio fitoquímico realizado a la especie vegetal Cavendishia compacta. Como resultado del mismo se aislaron e identificaron tres mezclas conformadas por diterpenos, aldehídos aromáticos y triterpenos, así como dos sustancias que corresponden a flavonoides. De acuerdo con los antecedentes descritos en la bibliografía, los constituyentes químicos mayoritarios presentes en la familia Ericaceae y particularmente en el género Cavendishia son los flavonoides y terpenos, y los resultados del presente estudio demuestran que Cavendishia compacta no es la excepción, ya que la gran mayoría de los compuestos aislados pertenecen a esta categoría de metabolitos secundarios.
Los diterpenos identificados en la mezcla CcH1 han sido aislados de otras familias de especies vegetales; para el caso del Rimueno ha sido reportado en: Cupressinum dacrydium (Podocarpaceae), Thujopsis dolabrata, Thuja standishii (Cupressaceae), Illiciumgriffithii (Illiciaceae) [13]; El Biformeno ha sido aislado previamente de la especie Helianthus Decapetalus (Asteraceae) [14] y también ha sido encontrado en especies como Pinus contorta perteneciente a la familia Pinaceae [15]; el Kaurano ha sido ampliamente estudiado en varias familias como las Asteraceas principalmente especies del género Pentacalia tales como Pentacalia corymbosa, Pentacalia ledifolia y Pentacalia pulchella, [16]. En la familia Ericaceae no se han reportado estudios acerca de la presencia de Rimueno, Biformeno y Kaurano siendo este el primer reporte para el género Cavendishia y para la especie Cavendishia compacta.
Los compuestos identificados como aldehídos aromáticos en la mezcla CcH2 no se han reportado para la familia Ericaceae, el estudio indica la presencia de benzaldehído y acetofenona, siendo este es el primer reporte para el género Cavendishia y para la especie Cavendishia compacta.
Los compuestos identificados como triterpenos para la mezcla CcH3 han sido identificados en familias como la Asclepiadaceae específicamente en la especie Hemidesmus indicus [17] y en la familia Burseraceae en las especies Protium kleinii y Protium heptaphyllum [18]. Para la familia Ericaceae se han encontrado estudios en especies como Craibiodendron yunnanense [19]; el género Rhododendron también reporta la presencia de esta mezcla de triterpenos en la especie Rhododendron dauricum [20], Rhododendron canescens [21], Rhododendrom Tormetosum [11] y en la especie Vaccinium macrocarpon [22] y las especies Bejaria congesta, Bejaria aestuans y Bejaria resinosa [23]. En el género Cavendishia no se han reportado estudios acerca de la presencia de α-amirina y β-amirina siendo este el primer reporte para la especie Cavendishia compacta.
El compuesto CcH4 identificado como morina se ha reportado como un flavonoide de pigmento amarillo en la familia Moraceae [24, 25] y se ha identificado en frutas, verduras, té, vino y en muchas plantas medicinales orientales, entre ellas se encuentra en las hojas de guayaba, cebolla y manzana [25]. En la familia Ericaceae no se han reportado estudios acerca de la presencia de morina, este es el primer reporte para el género Cavendishia y para la especie Cavendishia compacta.
El compuesto CcH5 identificado como miricetina según B. Sultana y Anwar en 2008 [26] se ha reportado en órganos de plantas medicinales como en la corteza de Acacia nilotica (Fabaceae), en hojas de Moringa oleífera (Moringaceae) y aloe vera (Xanthorrhoeaceae), en raíces de Moringa oleífera (Moringaceae) y en el fruto del Ficus religiosa (Moraceae), así como en muestras de Laurel o Laurus nobilis (Lauraceae), hierba de san Juan o Hypericum perforatum (Hypericaceae) y té verde, y en el extracto de la Eugenia (Mirtaceae).
En la familia Ericaceae se ha reportado la presencia de miricetina en el género Rhododendron en las especies Rhododendron dauricum [20], Rhododendron tormetosum [11], Rhododendron mucrunulatum [10] y Rhododendron naamkwanense [27]. En el género Cavendishia no se han reportado estudios acerca de la presencia de miricetina siendo este el primer reporte para la especie Cavendishia compacta.
En la familia Ericaceae se han reportado estudios relacionados con la actividad antiinflamatoria en varias especies como Arctostaphylos uva-ursi la cual presenta actividad inflamatoria en el extracto etanólico de sus hojas [28], la especie Bejaria resinosa cuyos extractos de hojas, flores y frutos presentan actividad antiinflamatoria moderada [23]. La especie Calluna vulgaris en los extractos de n-hexano, cloroformo, acetato de etilo, n-butanol y residuo hidroalcohólico [29]. El extracto metanólico de las hojas y ramas de la especie Ledum groenlandicum han sido empleados para tratar diversas patologías inflamatorias como el asma, reumatismo y quemaduras obteniendo un alto porcentaje de inhibición [30] y en el género Rhododendron como el extracto de hojas y flores de Rhododendron brachycarpum y la fracción de acetato de etilo de Rhododendronponticum las cuales presentan alta respuesta antiinflamatoria [31].
CONCLUSIONES
El trabajo fitoquímico desarrollado en hojas de Cavendishia compacta permitió el aislamiento e identificación de una mezcla de diterpenos (rimueno, biformeno y kaurano); una mezcla de triterpenos (α y β amirina); una mezcla de compuestos aromáticos (benzaldehido y acetofenona) y dos compuestos de tipo flavonoide, morina y miricetina, los cuales se reportan por primera vez para la especie.
La determinación de la actividad antiinflamatoria en el modelo in vivo permitió establecer que el extracto E.EtOH.H y la fracción F.CH2Cl2.CcH exhibieron una actividad antiinflamatoria moderada con porcentajes de inhibición de 49,3% y 39,8% respectivamente, pues redujeron significativamente el edema causado por el TPA en la oreja del ratón con porcentajes de inhibición menores a los presentados por el fármaco de referencia, indometacina.
El presente estudio es un aporte a las investigaciones fitoquímicas de la familia Ericaceae en Colombia y en particular del género Cavendishia, ya que este es el primer reporte reciente en cuanto a la constitución de metabolitos fijos de un género que cuenta con escasos estudios químicos y biológicos.