INTRODUCCIÓN
La papa (Solanum tuberosum, es actualmente el cuarto cultivo alimentario más importante del mundo después del maíz, el trigo y el arroz. Ocupa el tercer lugar después del arroz y el trigo en términos de consumo [1, 2]. La papa proporciona fuente de energía debido a sus niveles de carbohidratos y también contiene proteínas de alto valor. Sin embargo, su contenido de proteína es generalmente bajo. Es rica en micronutrientes como la vitamina C y algunas vitaminas B, también contiene niveles apreciables de minerales como potasio. El contenido de grasa de la papa cruda y cocida es muy bajo [3, 4].
La papa es un cultivo de origen montañoso y se ha domesticado en los altos Andes de Sudamérica [1]. La mayoría de las variedades cultivadas pertenecen a la especie S. tuberosum. Sin embargo, se cultivan otras especies de Solanum, las cuales se denominan especies silvestres o nativas (PN) [5] y presentan una gran diversidad genética. PN son de formas y tamaños variados, colores llamativos y exóticos. Existen papas de formas aplanadas, redondas, comprimidas, alargadas, con ojos profundos; de colores de piel y pulpa amarilla, roja, rosada o morada [6], entre esta gran diversidad, se encuentra la papa nativa ratona morada, una variedad de papa muy cultivada en la zona rural del departamento de Nariño. Además, PN son un aporte a la seguridad alimentaria y la nutrición de las poblaciones vulnerables de las zonas rurales de los habitantes de los Andes [7].
La transformación de la papa en productos con valor agregado ha aumentado para satisfacer la demanda de los consumidores, lo que trae consigo que el consumo de papa fresca está disminuyendo continuamente. El procesamiento de esta, conduce a la generación de cantidades significativas de residuos, los cuales pueden comprender entre el 40 al 50 % de peso fresco del tubérculo, siendo la cáscara la fracción principal de los residuos de procesamiento [4]. Pese a que las cáscaras se consideran residuos pueden ser aprovechados para la obtención de productos de interés generando un valor agregado y mitigando la contaminación ambiental, que estas pueden generar cuando no son manejados adecuadamente. La cáscara de papa contiene ingredientes funcionales, que tienen particular interés en la industria farmacéutica, después de su extracción y purificación [4, 8, 9].
Si bien las papas son una fuente alimenticia rica en nutrientes, también poseen un grupo de sustancias tóxicas, compuestos llamados glicoalcaloides (GA) que se encuentran predominantemente en la piel [8]. Los glicoalcaloides son metabolitos secundarios en Solanum y otros miembros de la familia Solanaceae, que sirven como defensa química contra hongos, nematodos, herbívoros y otras condiciones de estrés, de los cuales la α-solanina y la α-chaconina son las más abundantes en los tubérculos de papa, representando más del 95 % [10]. Se componen de una cadena lateral hidrofílica de hidratos de carbono unida en la posición C3-OH de la parte esteroidal, solanidina (ver figura 1). La proporción de α-chaconina es mayor con respecto a α-solanina, que varía de 1,8:1 a 7:1 para papas frescas sin pelar [8]. Sus concentraciones son generalmente más altas en partes de plantas con una alta tasa de metabolismo, como hojas jóvenes y flores, con una disminución subsiguiente en partes con baja actividad metabólica en la madurez [11].
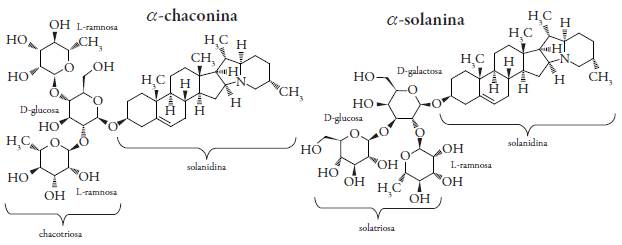
Figura 1 Estructuras químicas de los glicoalcaloides de la papa α-chaconina y α-solanina. Fuente: Máder et al. (2009) [8].
El interés en los GA de la papa surge del hecho de que diferentes estudios evidencian los efectos adversos de los mismos en altas concentraciones que pueden ser potencialmente dañinos para humanos y, a su vez estos poseen propiedades beneficiosas para la salud que los hace convenientes para su uso en la industria farmacéutica [12]. Se ha demostrado que los GA poseen propiedades antialérgicas, antipiréticas, antiinflamatorias, hiperglucémicas y antibióticas [11], anticancerígenas beneficiosas [12, 13]. Se ha observado que los GA de especies de Solanum podrían ser útiles contra la infección por virus de inmunodeficiencia humana (VIH) y también contra las infecciones intestinales relacionadas con el síndrome de inmunodeficiencia adquirida (SIDA), pero son pocos los artículos que aborden este tema [14].
Los GA se extraen utilizando técnicas tradicionales como lo son extracción Soxhlet y extracción sólido-líquido a presiones atmosféricas, usando una gran cantidad de solventes orgánicos los cuales suelen tener altos costos de adquisición y para ser descartados, además de su impacto ambiental negativo y otros problemas de salud humana emplean largos tiempos. Frente a esta problemática, en los últimos años, han surgido técnicas de extracción respetuosas con el medio ambiente como formas eficientes de aumentar la automatización, acortar el tiempo de extracción, reducir la cantidad de solventes orgánicos, al igual que la obtención de extractos más limpios debido a la baja o nula presencia de solventes. Estas técnicas se denominan "técnicas verdes de extracción". La extracción con líquidos presurizados (ELP), especialmente con el uso de agua como solvente, es una tecnología emergente más ecológica en comparación con las técnicas de extracción convencionales [15, 16].
ELP es un proceso que combina temperatura y presión controladas con solventes líquidos para lograr una extracción rápida y eficiente de compuestos bioactivos de varias matrices de origen natural. Un beneficio importante ELP es que los solventes presurizados permanecen en estado líquido, incluso por encima de sus puntos de ebullición [17]. La alta presión, la temperatura o su combinación de las mismas aumentan la solubilidad de los compuestos, la velocidad de difusión del solvente y la transferencia de masa, mientras que la viscosidad del solvente y la tensión superficial disminuyen. En muchos casos, estas técnicas presentan algunas ventajas sobre técnicas convencionales, como el uso de menores cantidades de solventes, requieren tiempos de extracción más cortos con una mayor selectividad o altos rendimientos de extracción [18].
En este contexto, el objetivo del presente estudio fue la extracción de glicoalcaloides de cáscara de papa nativa (Solanum phureja) var. ratona morada con líquidos presurizados (ELP) utilizando agua como solvente, evaluando el efecto de la presión y la temperatura en la extracción, sobre el rendimiento y la composición, mediante la metodología de superficie de respuesta para optimizar los parámetros de extracción.
(Latitud 1°837.19י" N, Longitud 77°107.3י" W) a 2791 m s.n.m, municipio de Pasto-Colombia. Se realizó un proceso de adecuación y secado por liofilización alcanzando una humedad de 5,19% b.s. Previo al proceso de extracción, la materia prima se molió en un molino de discos (Imusa), luego se pasó 100 g por un tamiz (modelo PS-35 serie 1182) en la serie de tamices (10-80, A.S.T.M.E-11.) por espacio de 10 minutos, de acuerdo a la norma ASTME 11-95 [19]. Se realizó el análisis granulométrico y se determinó el diámetro medio de las partículas (0,427 mm).
Los glicoalcaloides estándares fueron α-solanina 98 % pureza (Sigma-Aldrich, USA) y α-chaconina 99, 1 % pureza (Indofine, USA). Los solventes metanol 99,9 %, cloroformo 99,2 % y acetonitrilo 99, 9 %; fueron de grado HPLC (Merck, Alemania), ácido clorhídrico 37,0 % e hidróxido de amonio (Merck, Alemania); las sales fosfato mono-potásico 99,7 % y fosfato dipotásico 99,8 % (Merck, Alemania).
Extracción con líquidos presurizados (ELP)
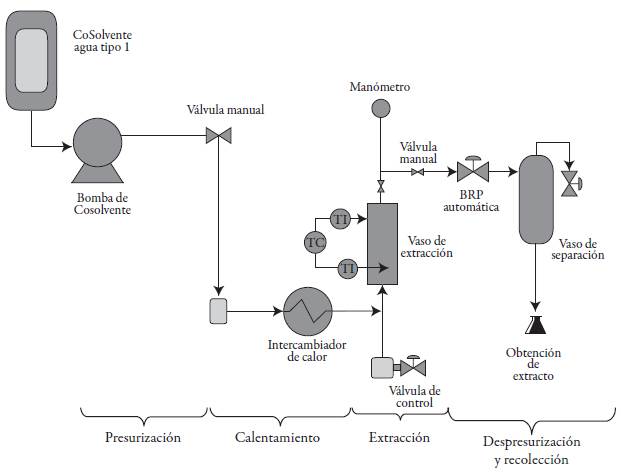
Para la extracción de GA se utilizó agua tipo I; las extracciones se realizaron en un equipo de extracción SFE-100 (Waters, USA) de 100 mL de capacidad. El diagrama del proceso se indica en la figura 2. Se utilizó un diseño experimental tipo central compuesto, empleando la metodología de superficie de respuesta, en la que se consideraron dos factores: presión y temperatura sobre la influencia de las condiciones de extracción en el rendimiento y la composición, al igual que se determinó los puntos óptimos. Se evaluaron rangos de presión entre 60-100 bar y temperaturas entre 60-100 °C, cada extracción se realizó durante 40 minutos y se utilizaron 10 g de cáscara de papa seca y molida. Las variables presión y temperatura se controlaron a través de un sistema de regulación que opera mediante el software Process Suite (versión 5.9).
METODOLOGÍA
Materiales y reactivos
El material utilizado para la extracción fue cáscara de papa (Solanum phureja) de la variedad ratona morada, proporcionada por un productor del corregimiento del Encano (Latitud 1º8`37.19” N, Longitud 77º10`7.3” W) a 2791 m s.n.m, municipio de Pasto- Colombia. Se realizó un proceso de adecuación y secado por liofilización alcanzando una humedad de 5,19% b.s. Previo al proceso de extracción, la materia prima se molió en un molino de discos (Imusa), luego se pasó 100 g por un tamiz (modelo PS-35 serie 1182) en la serie de tamices (10-80, A.S.T.M.E-11.) por espacio de 10 minutos, de acuerdo a la norma ASTME 11-95 [19]. Se realizó el análisis granulométrico y se determinó el diámetro medio de las partículas (0,427 mm).
Los glicoalcaloides estándares fueron α-solanina 98 % pureza (Sigma-Aldrich, USA) y α-chaconina 99, 1 % pureza (Indofine, USA). Los solventes metanol 99,9 %, cloroformo 99,2 % y acetonitrilo 99, 9 %; fueron de grado HPLC (Merck, Alemania), ácido clorhídrico 37,0 % e hidróxido de amonio (Merck, Alemania); las sales fosfato monopotásico 99,7 % y fosfato dipotásico 99,8 % (Merck, Alemania).
Extracción con líquidos presurizados (ELP)
Para la extracción de GA se utilizó agua tipo I; las extracciones se realizaron en un equipo de extracción SFE-100 (Waters, USA) de 100 mL de capacidad. El diagrama del proceso se indica en la figura 2. Se utilizó un diseño experimental tipo central compuesto, empleando la metodología de superficie de respuesta, en la que se consideraron dos factores: presión y temperatura sobre la influencia de las condiciones de extracción en el rendimiento y la composición, al igual que se determinó los puntos óptimos. Se evaluaron rangos de presión entre 60-100 bar y temperaturas entre 60-100 °C, cada extracción se realizó durante 40 minutos y se utilizaron 10 g de cáscara de papa seca y molida. Las variables presión y temperatura se controlaron a través de un sistema de regulación que opera mediante el software Process Suite (versión 5.9).
El extracto obtenido, se almacenó en un vial ámbar en congelación a -18 °C, para posterior secado por liofilización y análisis del contenido GA. El rendimiento se calculó como peso de extracto liofilizado obtenido sobre el peso de cáscara de papa seca utilizada en términos porcentuales (% p/p), mediante la ecuación 1:
Dónde: RE: rendimiento de extracto (% p/p)
PE: peso del extracto obtenido (g)
PC: peso total de cáscara utilizada para cada extracción (g)
Extracción sólido-líquido (ESL)
Para determinar el contenido de GA totales en papa se realizaron extracciones sólido-líquido con solvente. Las extracciones se hicieron a cáscara y brotes de papa fresca, pulpa de papa y papa liofilizada (cáscara). Para determinar la presencia de GA en las matrices mencionadas, se siguió la metodología Hellenás (1986) [20], con algunas modificaciones. Como solvente de extracción se utilizó una mezcla de metanol: clorofomo (2:1 v/v) en agitación magnética durante 1 hora, adición de ácido clorhídrico 0,2 N en agitación magnética durante 20 minutos, filtración, adición de hidróxido de amonio (25 %) para ajustar el pH a 11 y finalmente centrifugación para descartar el sobrenadante y obtener los GA.
Análisis de glicoalcaloides (GA) por cromatografía líquida de alta resolución (HPLC-PDA)
Se empleó la metodología planteada por la AOAC Oficial Method 997.13 (Glycoalka-loids α-Solanine and α-Chaconina in Potato Tubers) [21] para analizar glicoalcaloides en los extractos. La fase móvil fue una mezcla de acetonitrilo, agua y solución buffer de fosfato (pH=7,6) (60 %, 30 %, 10 % v/v). Las condiciones de análisis fueron: temperatura de 40 °C, flujo de fase móvil 1,5 mL/min, longitud de onda de absorción a 205 nm y la separación se realizó en modo isocrático, el tiempo de análisis fue de 20 minutos. Se utilizó un cromatógrafo líquido HPLC Waters modelo Breeze, acoplado a un detector de arreglo de fotodiodos PAD 2998 Scan (200-500 nm), en fase reversa con una columna Hypersil Gold C18 (250 mm* 4,6 mm ID* 5,0 μm Dp), marca Thermo Scientific. El equipo consta de un inyector marca Rheodyne lopp de 20 μL.
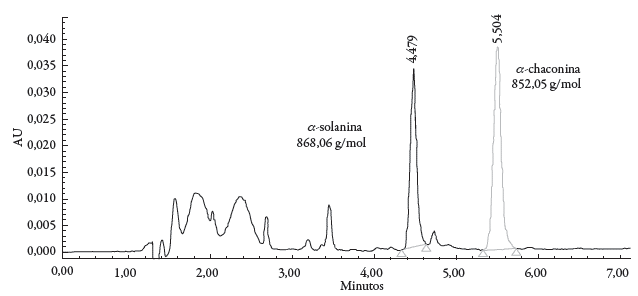
Mediante el método de patrón externo se determinó la concentración de GA en muestras de papa, utilizando curvas de estándares α-solanina y α-chaconina, con las correspondientes curvas de calibrado. Las curvas de los estándares, fueron realizadas a diferentes concentraciones (1, 5, 10, 25 y 50 ppm), con coeficientes de correlación de 0,998 para α-solanina y de 0,997 para α-chaconina. Los tiempos de retención (TR) de los estándares fueron TR= 4,47 min para α-solanina y TR= 5,5 min para α-chaconina (ver figura 3). El contenido de GA se calculó a partir de las áreas de los picos. El factor de resolución (α) de α-solanina frente a α-chaconina se calculó en 1,33. El límite de detección (LOD) fue de 0,003 mg/ml y 0,004 mg/ml para α-solanina y α-chaconina respectivamente, mientras que los límites de cuantificación (LOQ) fueron de 0,011 mg/ml para α-solanina y de 0,017 mg/ml para α-chaconina. LOD y LOQ se determinaron como 3 y 10 veces la desviación estándar en la intersección con el eje y de las líneas de regresión estándar [22].
Análisis estadístico
La matriz de los diseños de experimentos y el análisis estadístico de los datos se llevó cabo con el software estadístico Statgraphics Centurion XV® (StatPoint Technologies, Inc., Warrenton, gVA, USA). Se realizó el análisis de varianza para determinar la significancia del (p <0,05) de los factores sobre la variable respuesta.
RESULTADOS Y DISCUSIÓN
Rendimiento de las extracciones ELP
Los rendimientos de extracción de papa seca y molida obtenidos mediante ELP se presentan en la tabla 1; las condiciones que optimizan el rendimiento son: 55,6 bar y 100 °C, obteniendo un valor óptimo de 5,62 % p/p. El análisis de varianza (ANOVA) determinó que la temperatura tuvo un efecto estadísticamente significativo (p <0,05). La figura 4 presenta la gráfica de superficie de respuesta que muestra el efecto de los factores evaluados en ELP. Se observa que el incremento de la temperatura conlleva a un aumento en el rendimiento.
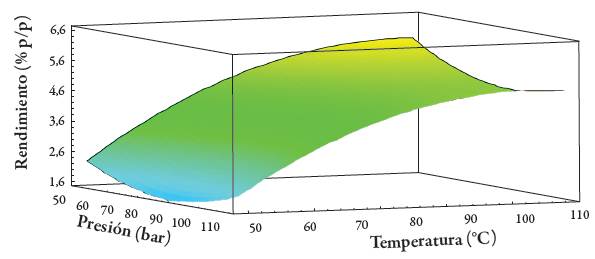
Figura 4 Gráficas de superficie de respuesta para rendimiento de extractos de papa (S. phureja) var. ratona morada obtenidos por ELP.
Tabla 1 Resultados de rendimientos de extracción y contenido de GA y GAT en extractos de papa ( S. phureja) var. ratona morada, obtenidos mediante ELP.
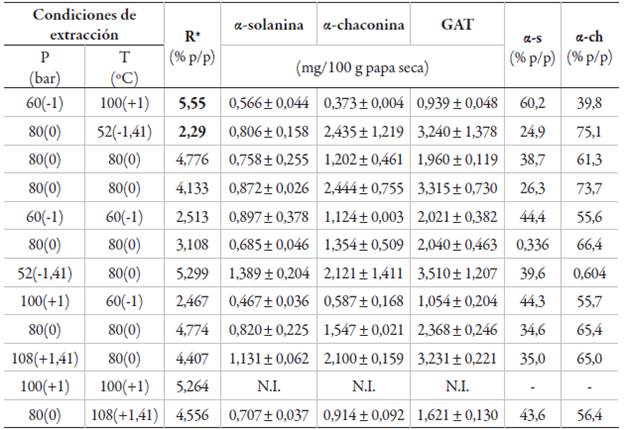
*R: rendimiento; GAT: suma de α-solanina y α-chaconina; % p/p α-s: fracción de masa α-solanina; % p/p α-ch: fracción de masa α-chaconina; N.I.: no identificado.
Las altas temperaturas favorecen la eficiencia de extracción al disminuir la viscosidad del solvente, lo que conduce a una mejor penetración dentro de la matriz que contiene los solutos de interés. Una ventaja importante de usar temperaturas más altas, es la mejora de la velocidad de difusión, es decir, la transferencia de masa de la molécula en el disolvente permite extracciones más rápidas [16,17,23].
Glicoalcaloides (GA) en ELP
Los resultados de GA y GAT en extractos obtenidos con ELP, bajo diferentes condiciones de presión y temperatura de extracción se muestran en la tabla 1, así como los niveles de las variables en unidades reales y codificadas entre paréntesis. Se observa que en la mayoría de las extracciones la fracción en masa es mayor para α-chaconina es siempre superior al de α-solanina, excepto a 60 bar - 100 °C y en la extracción de 100 bar - 100 °C, donde no se identificaron los compuestos bajo estudio. Para papa nativa (S. phureja) var. ratona morada se obtuvieron rangos de 24 a 60 % α-solanina y de 39 a 75 % de α-chaconina, estos resultados están de acuerdo con los obtenidos por otros estudios, quienes afirman que, en la mayoría de los casos, α-chaconina está presente en una cantidad ligeramente más alta [24, 25, 26]. Las condiciones que optimizan el contenido de GA y GAT son: 80 bar y 80 °C obteniendo un valor óptimo de 0,784; 1,637 y 2,420 mg/g de papa seca para α-solanina, α-chaconina y GAT respectivamente.
Hossain et al. (2015) [18] extrajeron alcaloides esteroidales (α-solanina, α-chaconina, solanidina y demissidina) de cáscaras de papa usando líquidos presurizados y entre los cuatro alcaloides encontrados, α-chaconina fue el más abundante seguido por α-solanina, con valores de 87,3 y 59,7 mg/g cáscara seca respectivamente. En la investigación mencionada se usó como liquido presurizado metanol al 89 % v/v a diferentes temperaturas con presión constante de 100 bar. Estos resultados son mayores a los obtenidos en el presente estudio; lo cual puede explicarse a la diferencia entre las muestras de papa, debido a la diversidad y variedad genética, condiciones de crecimiento y el almacenamiento poscosecha.
La significancia estadística de los factores evaluados y sus interacciones sobre el rendimiento de extracción, el contenido de α-solanina, α-chaconina y GAT se muestra en la tabla 2. También se observa que la temperatura (B) fue estadísticamente significativa (p <0,05) sobre las variables de respuesta bajo estudio. La presión (A) solo fue significativa en α-solanina; sin embargo, los efectos cuadráticos de la presión y la temperatura; las interacciones entre estos factores no presentaron efectos estadísticamente significativos (p >0,05).
Tabla 2 Significancia estadística de los factores sobre GA y GAT en extractos de papa (S. phureja) var. ratona morada.
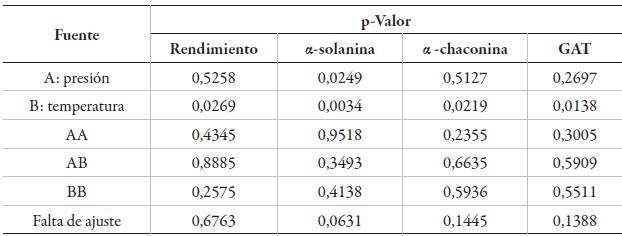
La figura 5 presenta los gráficos de superficie de respuesta que muestran el efecto de la presión y la temperatura sobre el contenido de α-solanina, α-chaconina y GAT en ELP de cáscara de papa liofilizada. Como se puede observar, las concentraciones de los compuestos bajo estudio en los extractos de papa, se incrementan significativamente al disminuir la temperatura y la presión.
La temperatura y la presión son parámetros importantes relacionados con la optimización de ELP. Las temperaturas más altas disminuyen la viscosidad de los solventes líquidos, lo que permite una mejor penetración de las partículas de la matriz y mejora la extracción. Además de reducir la viscosidad, las altas temperaturas también disminuyen la tensión superficial del solvente, los solutos y la matriz, permitiendo que el solvente "moje" la matriz de la muestra más a fondo. Se espera que la temperatura tenga un efecto pronunciado en obtención de GAT, debido a la importancia de la cinética de transferencia de masa y la solubilidad. Las temperaturas más usadas en la ELP están entre 80-100 °C; se ha reportado que la presión tiene poco efecto sobre la eficiencia de ELP [15, 27].
La temperatura máxima está limitada por la temperatura de degradación de cada analito. Sin embargo, un aumento de temperatura puede causar que algunas interferencias se extraigan conjuntamente con los analitos objetivos y disminuya la selectividad de la extracción, es por ello que temperaturas más bajas se utilizan comúnmente para evitar la degradación del analito o la coextracción de interferencias [28]. Sin embargo, los resultados obtenidos en este estudio, presentaron un comportamiento contrario, ya que a menores temperaturas y presiones se obtuvo mayor cantidad GA y GAT; esto puede explicarse debido a que el calor y la presión tienen efectos similares; si son suficientemente altos, ambos inducen la gelatinización del almidón en exceso de agua, lo que da como resultado una transición de la estructura granular nativa a una pasta o gel de almidón de la papa [28].
Extracción sólido-líquido de GA
La tabla 3 muestra los resultados obtenidos de la extracción sólido-líquido de diferentes partes del tubérculo. Los niveles más altos de GA se encuentran en los brotes y la cáscara, en menor cantidad en la pulpa; mientras que la papa liofilizada (materia prima utilizada en este estudio) presenta valores altos de GA y GAT, comparados con diferentes partes del tubérculo. De acuerdo a Milner et al. [29], la mayoría de las partes de la planta poseen GA. Las concentraciones en cultivos comerciales generalmente están en el rango de 0,0011 a 0,15 mg/100 g de peso fresco ; sin embargo, en cultivares silvestres se observa una diferencia sustancial, con un contenido que oscila entre 6 y 432 mg/100 g peso fresco. Para el caso de papa nativa (S. phureja) var. ratona morada, las diferentes partes se encuentran dentro del rango reportado para papas silvestres, a excepción de la pulpa. Sin embargo, una variedad de factores ambientales, genéticos y de estrés, como el ataque de insectos, enfermedades, luz, madurez, daños mecánicos y temperaturas de almacenamiento causan contenidos elevados de GA en los tubérculos [30].
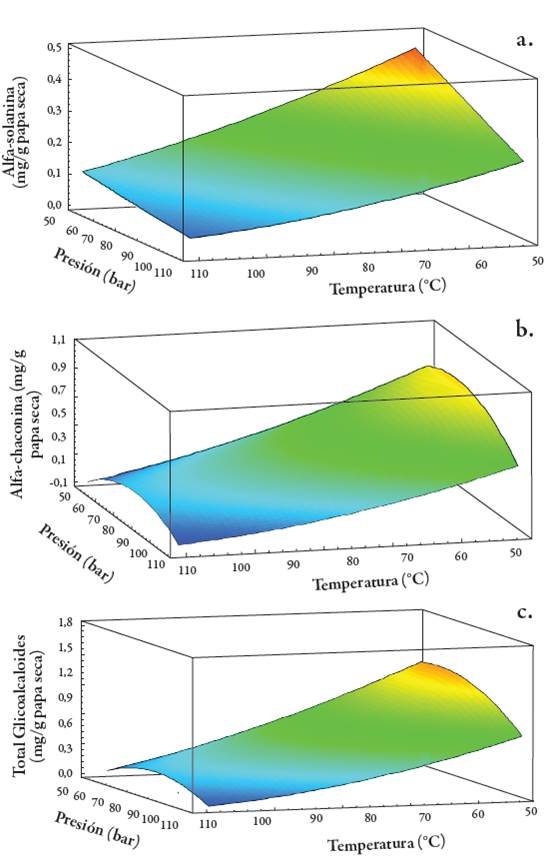
Figura 5 Gráficas de superficie de respuesta de extractos de papa (S. phureja) var. ratona morada con ELP que muestran el efecto de la presión y la temperatura en el contenido de α-solanina (a), α-chaconina (b) y glicoalcaloides totales (c).
Tabla 3 GA en extracción sólido-líquido de diferentes muestras de papa nativa (S. phureja) var. ratona morada.
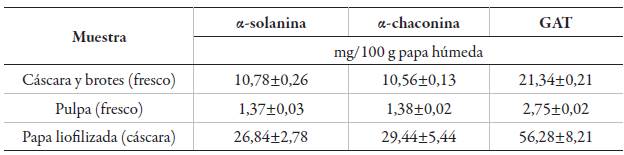
GA contribuyen a la defensa contra el ataque de plagas, de insectos o microorganismos al igual que la resistencia a las enfermedades; también pueden afectar la calidad del producto (sabor) y su seguridad para el consumo humano, si están presentes a niveles elevados. GA no se distribuyen uniformemente a través del tubérculo, las altas concentraciones generalmente se asocian con áreas que están experimentando una alta actividad metabólica, como brotes, cáscaras y el área alrededor de los "ojos" de la papa. La mayoría se encuentra dentro del primer 1 mm de la superficie externa del tubérculo, con concentraciones que disminuyen hacia el centro del tubérculo [11, 30, 32], tal como se evidencia en los resultados obtenidos (ver tabla 3).
El contenido de GAT en las variedades de papa disponibles comercialmente, en tubérculos de papa no procesados para consumo humano debe ser inferior a 200 mg/kg de peso fresco, este nivel es recomendado por la FAO [29, 33]. Para el caso de papa nativa ureja) var. ratona morada, los niveles obtenidos para pulpa, cáscara y brotes fresco, se encuentran dentro de lo recomendado por la FAO. La dosis letal humana estimada por ingesta oral es de 3-6 mg de GA de papa por kilogramo de peso corporal [31]. Por otro lado, los resultados de glicoalcaloides totales obtenidos para papa liofilizada superaron el nivel recomendado por la FAO; datos reportados por Sotelo y Serrano [34] para 12 variedades de papa en México, obtuvieron un rango de 2,90-91,63 mg/100 g de papa húmeda para glicoalcaloides totales; de esta manera el resultado obtenido en el presente estudio, se encuentra dentro del rango obtenido por los autores mencionados.
De acuerdo a lo reportado por Handling et al.(1996) [35] y Sánchez et al. [36], las muestras de papa secas tienen un contenido de glicoalcaloides (α-solanina y α-chaconina) más altos, que las muestras frescas. Para papa liofilizada, se observa que la fracción en masa es mayor para α-chaconina que de α-solanina, reafirmando así que, en la mayoría de los casos, α-chaconina está presente en una cantidad ligeramente más alta [24, 25, 26].
CONCLUSIONES
Se extrajeron glicoalcaloides a partir de cáscara de papa, utilizando agua presurizada como solvente de extracción. Solamente la temperatura tuvo un efecto estadísticamente significativo (p <0,05) sobre el rendimiento, el contenido de α-solanina y α-chaconina. La técnica de optimización mediante superficie de respuesta, permitió predecir los parámetros de extracción óptimos dentro de los parámetros experimentales, siendo 55,6 bar-100 °C para rendimiento y 80 bar-80 °C para glicoalcaloides. Los extractos presentaron como glicoalcaloide mayoritario α-chaconina. La extracción sólido-líquido permitió constatar la mayor concentración de glicoalcaloides en cáscara y brotes. Los extractos obtenidos pueden ser de interés para la industria farmacéutica por la presencia de glicolcaloides.