INTRODUCCIÓN
Según la Organización Mundial de la Salud, la reacción adversa a medicamentos se define como cualquier respuesta a un fármaco que es nociva, no intencionada y que se produce a dosis habituales para la profilaxis, diagnóstico o tratamiento. Estas pueden clasificarse como no alérgicas, relacionadas directamente con las propiedades del fármaco o tipo A (no mediadas inmunológicamente) o de etiología inmunológica, tipo B [1].
A nivel mundial las reacciones adversas a medicamentos aumentan la morbimortalidad [2]; en Europa se estima que el 5% de todas las hospitalizaciones son secundarias a una reacción farmacológica y cerca del 5% de los pacientes hospitalizados presentan algún tipo de respuesta a medicamentos durante su estancia hospitalaria, cerca de 197.000 muertes anuales en la unión europea atribuidas al uso de medicamentos [2].
De otro lado, el número de reportes de posibles reacciones adversas a medicamentos para el 2016 en la Unión Europea fue de 1.238.178 eventos; 1% más alto a lo descrito para el año 2015 [3]. En EUA para el 2014 se registraron 770.000 eventos adversos reportados por la FDA, para el primer trimestre del 2015 se reportaron 257.000 casos [4].
En Colombia durante el primer bimestre del 2016 se gestionaron 4016 reportes de problemas relacionados con el uso de medicamentos, los cuales contenían 5850 reacciones adversas a fármacos, el 18,8% clasificados como eventos serios (de los cuales 55% se asociaron a relación de causalidad posible), el 81,2% clasificados como no serios; con un subregistro de eventos serios que asciende hasta el 40% [5]. Para el quinto bimestre del 2016 se reportaron 14.964 problemas relacionados con el uso de medicamentos, de los cuales 13.982 corresponden a reacciones adversas a fármacos, el 35,9% eventos serios (de los cuales 86% tenía relación de causalidad posible), y el 64% clasificados como no serios [6].
METODOLOGÍA
Se realiza la búsqueda en las bibliotecas de literatura médica MedLine, Pubmed, SciELO utilizando las palabras clave Neurotoxicity Syndromes [All Fields] AND ("Cephalosporins" [MeSH Terms] OR ("Cephalosporins" [All Fields] AND "Side Effects ofDrugs" [All Fields]) OR "Side Effects of Drugs" [MeSH Terms]) y "Cefepima" [All Fields] OR "Neurotoxicity Syndromes" [MeSH Terms] OR "Cefepima" [All Fields]. Además, se realizó la búsqueda en institutos especializados en vigilancia farmacológica, sociedades de farmacovigilancia con las restricciones definidas como adulto que corresponde a edad igual o mayor de 18 años, publicada en inglés o español.
PRESENTACIÓN DEL CASO
Paciente femenina de 81 años quien ingresa al servicio de urgencias remitida de consulta externa por nefrología para iniciar terapia de remplazo renal. Antecedente de hipertensión arterial y diabetes mellitus desde hace 36 años, enfermedad renal crónica secundaria, sometida a colecistectomía e histerectomía abdominal por prolapso uterino, historia ginecológica con 12 embarazos y 10 partos. Al ingreso presentó enfermedad renal crónica en estadio 5 con TFGc 9-10 ml/min. Desde 15 días previos con anorexia, oliguria, edema de miembros inferiores que progresa hasta anasarca, neurológicamente alerta, orientada, pensamiento lógico y coherente, signos vitales con tensión arterial de 150/80 mm/Hg, frecuencia cardiaca de 80 lpm, saturación de oxígeno de 96%, FIO2 0,21, glucometría 141 mg/dl.
Esta paciente procedente de área rural, se considera terapia remplazo renal tipo diálisis peritoneal; implante de catéter abdominal realizado por cirugía general. Al tercer día, y posterior al implante del catéter peritoneal de diálisis se inician lavados y curaciones del mismo, al octavo día inician recambios peritoneales con solución dextrosada al 1,5% con 1000 cc de solución, drenaje de 200 cc de líquido turbio sanguino purulento, se considera catéter disfuncional con efecto de válvula, adicional a ello se registra T°> 38,3 °C, dolor abdominal predominio en hipogastrio con sensibilidad a la palpación, anorexia e hiporexia. El estudio citoquímico de líquido peritoneal fue compatible con peritonitis (ver tabla 3), se inicia cubrimiento antibiótico con vancomicina 500 mg cada 12 horas y Pipe-racilina Tazobactam 2,25 gramos cada 6 horas. Aislamiento de Acinobacter baumannii en cultivo del líquido peritoneal que confirma el diagnóstico, se ajusta soporte antibiótico e inicia cefepima 1 gramo cada 12 horas por vía intravenosa e intraperitoneal.
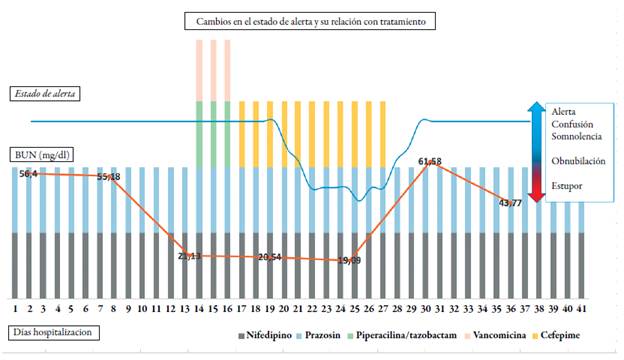
Al cuarto día del cambio de antibiótico, la paciente refiere somnolencia, desorientación, con náuseas frecuentes e hiporexia marcada. Al quinto día presentó un mayor decaimiento, sin aceptar alimentos o medicamentos, no se moviliza, ni habla; los para-clínicos reportan hipocalemia severa (K: 2,1 meq/l) para lo cual, se inicia reposición. Al sexto día persiste la somnolencia afásica, pobre interacción con el examinador; corrección parcial de la hipocalemia (K: 2,9 meq/l), en la tomografía cerebral simple se observa una leve disminución en el volumen del parénquima cerebral secundario a cambios atróficos, focos malásicos subcorticales y periventriculares, la región ganglio basal y talámica presenta coeficiente de atenuación normal, sin lesiones ocupantes de espacio (ver figura 1).
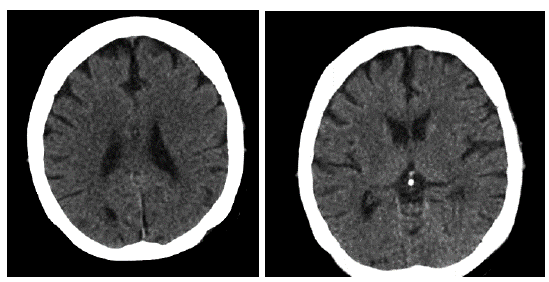
Figura 1 Tomografía axial computarizada de cerebro, sin evidencia de lesiones isquémicas o hemorrágicas.
Al séptimo día continuó sin cambios clínicos, postrada en cama, somnolienta, sin recibir medicamentos ni comida y sin interacción con sus familiares. El cuadro clínico se interpreta como delirium hipoactivo sin documentarse una causa estructural.
Al octavo día se torna inquieta durante la noche, golpea la pared con sus manos, durante el día está somnolienta. Al noveno día del tratamiento con cefepima continuó en malas condiciones generales, estado de estupor, con movimientos mioclónicos de cintura escapular bilateral. Al décimo día, sin interacción con el examinador, agitación motora, movimientos bruscos similares a balismo. Se considera mal pronóstico funcional y vital a corto plazo, se limita el esfuerzo terapéutico, se retira el antibiótico y la terapia de remplazo renal.
Durante los dos primeros días de retiro de terapia, ella permaneció sin cambios neurológicos, al 3er día un familiar refiere verla en mejores condiciones, más alerta, apenas recibe medicamentos y escasos alimentos por vía oral, persiste con los movimientos bruscos. Dada la progresión a la mejoría se considera reiniciar diálisis peritoneal tipo APD (automated peritoneal dialysis) por nefrología. 4° día, en mejores condiciones generales interactuando y respondiendo adecuadamente al interrogatorio, tolerando parcialmente la vía oral. El 5° día continuó alerta, episodios desorientación y agitación intermitente durante el día. Al 6° día alerta, con lenguaje lógico y coherente, moviliza extremidades inferiores, no presenta movimientos involuntarios en miembros superiores. Al día 13° posterior a retiro de soporte antibiótico, paciente con recuperación completa, se encuentra alerta, orientada, lógica y coherente, con preservación del apetito (ver figura 2), egresó de la institución en buenas condiciones generales con plan ambulatorio de diálisis peritoneal.
DISCUSIÓN
Las reacciones adversas a medicamentos representan un problema importante para la salud en pacientes de manejo hospitalario y ambulatorio. Se clasifican de forma general como predecibles (tipo A) o no predecibles (tipo B) dependiendo de su origen, las reacciones predecibles son dosis dependiente, relacionadas con el mecanismo de acción del medicamento y se presentan en individuos previamente sanos, de otro lado, las reacciones tipo B no están asociadas a la dosis y se presenta en personas susceptibles, independiente de su mecanismo de acción; estas últimas incluyen intolerancia, reacción idiosincrática, alergia y pseudoalergia [7]. Los betalactámicos son una de las causas más frecuentes de reacción adversa asociada a medicamentos de origen inmediata y no inmediata [8]. Un estudio en pacientes de manejo hospitalario evidencio 25% de reacciones adversas asociada a uso de antibióticos, de las cuales el 24% se clasificaron como tipo A, siendo los betalactámicos el responsable del 54% de los casos [9]. Una cohorte retrospectiva, con 232.616 pacientes documento 15,6% de reacciones adversas asociadas a betalactámicos, de los cuales, el 1,5% fue atribuido a cefalosporinas [10]. Las cefalosporinas están asociadas a reacciones de tipo alérgicas [8, 10, 11], sin embargo, reacciones tipo A son reportadas de forma regular [12-15]. En nuestro caso se documentó neurotoxicidad asociada al uso de cefepima en paciente con enfermedad renal crónica avanzada, con una dosis no ajustada a función renal. Dentro de los diagnósticos diferenciales considerados por el equipo de trabajo se incluyó el delirium no orgánico, encefalopatía séptica, enfermedad cerebrovascular y síndrome urémico.
Delirium
El delirium es un problema frecuente en el ámbito hospitalario, que compromete a pacientes críticamente enfermos [16], según la V edición del Manual diagnóstico y estadístico de enfermedades mentales (DSM-V), este se define como alteración en la atención y la conciencia, que se desarrolla en cortos periodos de tiempo (horas a pocos días) con fluctuaciones en la severidad durante el curso del día. Puede incluir compromiso cognitivo (desorientación, déficit de memoria, compromiso del lenguaje, capacidad visuoespacial o percepción) que no es explicado por otro trastorno neurocognitivo pre-existente, establecido o en desarrollo [17]. Existen factores de riesgo asociados que pueden facilitar el delirium; edad y el género (frecuente en hombres (70%), edad media de 68,9 años) son los principales factores descritos, sin embargo, existen otros como: niveles séricos de creatinina, bun, albumina, sodio; historia previa de delirium, isquemia cerebral, hipertensión, ventilación mecánica, infección y uso de medicamentos antipsicóticos [18], que a su vez se asocia a un mayor riesgo de complicaciones durante la hospitalización [16].
En nuestro caso encontramos una paciente con factores de riesgo para desarrollar delirium (edad, compromiso de la función renal, peritonitis asociada a uso de catéter, polifarmacia y uso de derivados opioides (ver tabla 1), con cuadro clínico de instauración progresiva, compromiso del lenguaje (afasia), sin alucinaciones y con deterioro del estado de alerta, que no responde al manejo médico convencional de delirium.
Tabla 1 Medicamentos administrados.
| Medicamento | Dosis | Días administrados |
|---|---|---|
| Nifedipino | 30 mg BID VO | 37 |
| Prazosin | 2 mg TID VO | 37 |
| Losartan | 50 mg BID VO | 24 |
| Vancomicina | 500 mg BID IV | 3 |
| Pip-tazo | 2,25 g QID IV | 3 |
| Cefepima | 1 g BID IV-IP | 10 |
| Tramadol | 50 mg BID SC | 1 |
| Tramadol | 25 mg BID SC | 2 |
| Hidromorfona | 0,4 mg TID IV | 3 |
| Haloperidol | 0,5 mg BID VO | 6 |
| Quetiapina | 12 mg OD VO | 3 |
OD: una vez al día, BID: dos veces al día, TID: tres veces al día, QID: cuatro veces al día, mg: miligramo, g: gramo, VO: vía oral, IV: intravenoso, SC: subcutáneo, IP: intraperitoneal.
Dentro de los mecanismos asociados al aumento de actividad excitatoria epileptiforme cerebral por uso de antibióticos betalactámicos se describen la inhibición de unión del ácido gamma amino butírico (GABA) al receptor GABA A, un canal de cloro asociado a ligando que transmite señales inhibitorias. El cefepima reduce el efecto inhibidor de GABA al limitar el influjo de cloro, con ello desencadena activación cortical y del sistema nervioso central [19].
Está demostrado que la penicilina reduce el tiempo de apertura de los canales iónicos del receptor GABA A; efecto dependiente de concentración. Otra posible explicación no asociado a GABA es un efecto mecánico de la penicilina, la cual ocluye el canal de cloruro y mantiene el receptor en una conformación abierta, sin conducción iónica [19].
Síndrome urémico
Los cambios neurológicos asociados a la uremia incluyen somnolencia, temblor, disfunción cognitiva y encefalopatía [20], síntomas asociados a la retención de productos nitrogenados de desecho. Se han descrito dos presentaciones clínicas de compromiso de SNC, incluyen cambios neuropsicológicos y del estado mental que inicialmente compromete el ánimo, causa irritabilidad, trastorno del lenguaje, disminución del estado de conciencia hasta coma metabólico. En segundo lugar, se describe trastorno motor: temblor, hiperreflexia, hemiparesia, fasciculaciones, mioclonías y convulsiones generalizadas [21].
En nuestro caso se evidencia descenso progresivo de nitrogenados con el inicio de diálisis peritoneal, siendo su nivel más bajo durante la mayor expresión de síntomas neurológicos, como se ve en la figura 2. De igual forma una vez suspendida la terapia de remplazo renal se presentó un ascenso del nitrógeno urémico y creatinina sérica, que coincide con mejoría en el estado de alerta del paciente. Dado este comportamiento de los azoados y la sintomatología neurológica, no se encontró una asociación de causalidad (ver tabla 2).
Tabla 2 Datos de laboratorio.
| Día hospitalización | Leucocitos (cel/mm3) | Hb (g/dl) | Plaquetas (cel/mm3) | Creatinina (g/dl) | BUN (g/dl) | Na mmol/l | K (mmol/l) | Ca (mmol/l) | Albumina (g/dl) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 8610 | 10,8 | 260.000 | 4,15 | 56,4 | 8,6 | |||
| 10 | 7620 | 9,4 | 247.000 | 4,91 | 55,18 | 4,4 | |||
| 21 | 5690 | 8,6 | 378.000 | 2,81 | 21,13 | 2,4 | |||
| 23 | 6420 | 10,1 | 449.000 | 3,73 | 20,5 | 137 | 2,1 | 8,4 | |
| 27 | 13.210 | 11,9 | 345.000 | 3,73 | 19 | 142 | 3,1 | 2,8 | |
| 31 | 12.450 | 10,4 | 216.000 | 7,76 | 61,58 | 150 | 3,2 | ||
| 35 | 4,4 | ||||||||
| 37 | 7660 | 9,9 | 145.000 | 7,51 | 30,1 | 141 | 4,5 | 8,1 |
Hb: hemoglobina, Na: sodio, K: potasio, Ca: calcio, Cel/mm3: células por milímetro cúbito.
Encefalopatía por sepsis
La respuesta del sistema nervioso central ante la sepsis es de origen multifactorial, y clínicamente se manifiesta por alteración del estado de conciencia (delirium, coma) o síndrome convulsivo, como consecuencia de disfunción neuronal por compromiso del microambiente neuronal y la barrera hematoencefálica. Fisiopatológicamente se asocia a neurotoxicidad, isquemia y neuroinflamación [22, 23].
En la literatura médica actual no se cuenta con criterios diagnósticos para esta patología, podríamos considerarlo un diagnóstico de asociación, el cual resuelve al dar tratamiento al foco infeccioso y descartar otras posibles causas que expliquen los síntomas. En nuestro caso clínico, se evidenció deterioro neurológico a pesar de control de foco infeccioso (peritonitis asociada a catéter peritoneal) como se muestra en la tabla 3, existe mejoría del perfil cito químico peritoneal, y normalización de recuento total de leucocitos séricos.
Tabla 3 Estudio de líquido peritoneal.
| Día de hospitalización | Citoquímico leucocitos cel/ mm3 (N%) | Cultivo líquido peritoneal |
|---|---|---|
| Día 15 | 8510 (70) | Acinobacter Baumannii. R/ampicilina, cefalotina, cefuroxima. S/ampicilina sulbactam, cefepima, ceftazidima, ciprofloxacino, gentamicina, norfloxacino. |
| Día 18 | 370 (25) | |
| Día 20 | 1100 (82) | |
| Día 23 | 3 (0) |
Cel/mm3: células por milímetro cubito, N%: porcentaje de neutrófilos, R: resistente, S: sensible.
Enfermedad cerebrovascular
En pacientes con enfermedad renal crónica el riesgo de evento cerebrovascular es alto, y aumenta a medida que la tasa de filtración glomerular desciende, es así que las personas en terapia de remplazo renal tienen 3 veces más posibilidades de desarrollar evento cerebrovascular isquémico y 6 veces más riesgo de presentar evento hemorrágico comparado con la población general [20, 24, 25]. Las manifestaciones clínicas se relacionan con la localización y tamaño de la lesión, incluyen focalización motora, déficit sensorial, afasia, disartria, vértigo entre otras; su instauración es súbita, con deterioro progresivo en el transcurso de horas (>24 horas) asociado a evidencia objetiva (patología, imágenes) de lesión isquémica focal que sigue un territorio vascular o colección de sangre dentro del parénquima cerebral o sistema ventricular de origen no traumático [26]; en nuestro caso no se encontraron lesiones a nivel de SNC de origen isquémico o hemorrágico que explicaran los síntomas (ver figura 1).
CONCLUSIÓN
Una vez descartadas otras causas posibles de encefalopatía en paciente con enfermedad renal crónica, se concluyó que el diagnóstico más probable era una encefalopatía por cefalosporinas, secundario una reacción adversa a medicamento no alérgica, predecible o tipo A, desencadenada por no ajustar dosis de cefepima a función renal [27]. Teniendo en cuenta la recomendación de la Organización Mundial de la Salud, y siguiendo los lineamientos del comité de farmacoterapia para reacciones adversas a medicamentos se aplicó el algoritmo de Naranjo para evaluar la causalidad entre el cuadro neurológico de nuestro paciente y el uso de cefepima, así se obtuvo un puntaje de 7, por lo cual se considera un evento probable (ver tabla 4).
Tabla 4 Evaluación de causalidad para RAM a la cefepima.
| Algoritmo de Naranjo para evaluar la causalidad de una RAM | |||
|---|---|---|---|
| Pregunta | Sí | No | No se sabe |
| ¿Existen informes previos concluyentes acerca de esta reacción? | + 1 | 0 | 0 |
| El acontecimiento adverso ¿Apareció después de que se administrara el fármaco sospechoso ? | +2 | -1 | 0 |
| La reacción adversa ¿Mejoró al interrumpirse el tratamiento o cuando se administró un antagonista específico ? | + 1 | 0 | 0 |
| ¿Reapareció la reacción adversa cuando se volvió a administrar el fármaco? | +2 | -1 | 0 |
| ¿Hay otras causas (distintas de la administración del fármaco) que puedan por sí mismas haber ocasionado la reacción? | -1 | +2 | 0 |
| ¿Se ha detectado el fármaco en sangre (o en otros humores) en una concentración cuya toxicidad es conocida? | + 1 | 0 | 0 |
| ¿Aumentó la gravedad de la reacción al aumentarse la dosis o disminuyó al reducirla? | + 1 | 0 | 0 |
| ¿Había sufrido el paciente una reacción similar al mismo fármaco o a fármacos análogos en alguna exposición previa? | + 1 | 0 | 0 |
| ¿Se confirmó el acontecimiento adverso mediante pruebas objetivas? | + 1 | 0 | 0 |
| Puntuación total | 7 | ||
Las categorías correspondientes a la puntuación total son las siguientes: La RAM es: segura: 9; probable: 5-8; posible: 1-4; improbable: 0.