INTRODUCCIÓN
La vía de administración oral ha sido la ruta de elección por la mayoría de los formuladores y ha predominado sobre otras vías de administración. Esto se debe a que esta vía es más cómoda para el paciente, segura y económica. Sin embargo, para obtener la máxima seguridad y eficiencia del uso de los medicamentos hay que tener en cuenta aspectos como la biodisponibilidad, la tolerancia gastrointestinal, interacciones y efectos adversos [1].
El mayor problema en las formulaciones de medicamentos administrados por vía oral es la baja y errática biodisponibilidad que presentan los fármacos, la cual resulta principalmente de la pobre solubilidad. Aproximadamente el 40% de los nuevos fármacos desarrollados muestran una pobre solubilidad y presentan un mayor reto para los sistemas de liberación de fármacos modernos ya que no permiten una absorción gastrointestinal consistente de una magnitud suficiente para asegurar la eficacia terapéutica [2]. En este sentido, es necesario incluir el ingrediente farmacéutico activo en un sistema de formulación adecuado de tal manera que se pueda modificar su velocidad de disolución y alcanzar el objetivo terapéutico.
Debido a las diferentes características intrínsecas (solubilidad y permeabilidad) que poseen los fármacos, se debe clasificarlos de acuerdo con unos parámetros, tal como lo considera el sistema de clasificación biofarmacéutico (SCB), el cual es un marco científico utilizado para clasificar a los principios activos basándose en su solubilidad acuosa y su permeabilidad intestinal [3]. Dentro de los fármacos pertenecientes a la clase II (baja solubilidad, alta permeabilidad) la velocidad de disolución es el factor limitante para su absorción. Por lo tanto, la disolución del fármaco, en el proceso global de su liberación, es el proceso con mayor trascendencia en su posterior absorción y no la rapidez para atravesar las membranas.
En esta clase de fármacos con esta limitante de la velocidad de disolución se encuentran los antiinflamatorios no esteroideos (AINES), cuya utilización en la terapia medica representa un alto consumo a nivel mundial; se estima que en Estados Unidos se prescriben más de 70 000 000 de AINES anualmente y más de 30 billones de dosis son consumidas sin prescripción, 30 000 000 millones de personas consumen diariamente AINES. En 2004, este fue el sexto grupo farmacológico más importante en volumen de ventas. En investigaciones basadas en la actual definición de solubilidad, 15 de los 18 AINES estudiados pertenecen a la clase II, entre ellos el ibuprofeno [4-8].
El ibuprofeno es uno de los fármacos AINES derivados del ácido propiónico más usado en Colombia, aproximadamente por el 70% de los habitantes lo usan. Está indicado en el tratamiento de las condiciones del dolor y los trastornos reumáticos; es un fármaco perteneciente al grupo II del SCB, de carácter lipofílico y tiene un bajo grado de disolución [9].
En los últimos años, se han tomado medidas para desarrollar sistemas de administración de fármacos que tienen baja solubilidad acuosa para mejorar su biodisponibilidad. Entre las diversas estrategias de formulación empleadas se incluyen la formación de sales, la complejación con ciclodextrinas, la micronización, las dispersiones sólidas y las formulaciones basadas en lípidos [10]. Los enfoques de este tipo de formulaciones, particularmente el sistema de entrega de fármacos autoemulsificables SEDDS, los cuales son mezclas de aceites y tensioactivos, idealmente isotrópicos, que a veces incluyen cosolventes para facilitar la disolución del principio activo, y emulsifican bajo condiciones de agitación suave, similar a aquellos que se podrían encontrar en el tracto gastrointestinal [10].
Estos son bien conocidos por su potencial como estrategias alternativas para el suministro de fármacos hidrófobos, que están asociados con baja solubilidad en agua y baja biodisponibilidad oral [9]; es decir, que este tipo de sistemas de liberación de fármacos es adecuado para aquellos principios activos que se encuentran en la clasificación bio-farmacéutica de tipo II y IV ya que les permite mejorar su solubilidad permitiendo una alta biodisponibilidad de la misma. El uso de un fármaco perteneciente a estos grupos, como el ibuprofeno, constituye hoy en día un reto para la industria farmacéutica, ya que deben desarrollarse diversas estrategias para disminuir estas limitaciones.
En este trabajo se desarrolló un SEDDS líquido con el objetivo de mejorar la solubilidad del ibuprofeno y su posterior conversión en un SEDDS sólido, siendo caracterizado este sistema en lo concerniente a solubilidad, propiedades de autoemulsificación, robustez y capacidad de carga del SEDDS.
MATERIALES Y MÉTODOS
Materiales
Para este estudio, el ibuprofeno (IBU) fue donado por Laboratorios Siegfried; el Neusilin US2(R) donado por Seppic Colombia SAS; los aceites de oliva, coco, canola y soya fueron obtenidos de Alianza Team® Colombia; el aceite de maní, de Amerindias Vital Colombia y aceite de ajonjolí (sésamo, de Morenos S.A.S. Tween 80 (Polisorbato 80), Cremophor RH40 (aceite de castor hidrogenado de polioxil 40), propilenglicol, lactosa spray dried, estearato de magnesio, povidona K-30, glicolato de almidón sódico y otros materiales de grado reactivo fueron suministrados por el almacén de materias primas de la Facultad de Química y Farmacia de la Universidad del Atlántico.
Estudio de solubilidad del ibuprofeno
Los aceites evaluados fueron seleccionados siguiendo diversos criterios, tales como la composición, seguridad y uso común en formulaciones SEDDS tipo III (fase oleosa compuesta de triglicéridos o mezclas de estos, tensioactivos solubles en agua con un valor de HLB>12 y cosolventes hidrofílicos). Estos son: aceite de oliva, aceite de soya [11, 12], aceite de maní, aceite de coco [13, 14], aceite de ajonjolí (sésamo) y aceite de canola [12, 11]. En esta prueba se empleó el método termodinámico para determinar la solubilidad conocido como matraz agitado (shakeflask) [15].
Para realizar la prueba de solubilidad de IBU en los aceites se adicionó una cantidad de este en exceso en cada uno de los solventes: se pesó aproximadamente 3,5 g de IBU dentro de tubos de ensayo de vidrio con tapa rosca y se adicionó 5 g de cada uno de los aceites (oliva, coco, canola, maní, ajonjolí y soya) observándose el exceso en cada una de las muestras. Estas fueron mezcladas por 3 minutos en un equipo vortex, para facilitar la interacción entre los componentes.
Las muestras preparadas se colocaron en un agitador de vaivén con control de temperatura y agitación (marca Rotaterm) a 200 rpm y a una temperatura constante de 40 °C. Posteriormente fueron tomadas y analizadas cada 2, 6 y 24 horas, hasta verificar que se alcanzara un valor constante de absorbancia en las lecturas, y de esta forma el equilibrio de solubilidad. En los tiempos de muestreo previamente mencionados, los tubos de ensayo fueron llevados a centrifugación (3000 rpm durante 10 minutos); se tomaron 0,05 mL del sobrenadante y se diluyó hasta 50 mL con metanol 99,8% (grado reactivo, Merck, Alemania). Las muestras se prepararon por triplicado y fueron leídas en un espectrofotómetro UV-Vis referencia T80+(PG INSTRUMENTS) a una longitud de onda 222 nm utilizando metanol como blanco, siendo previamente filtradas a través de filtrojeringa de 0,22 µm [16].
Selección de tensioactivoy cosolvente
Los tensioactivos y cosolvente fueron seleccionados teniendo en cuenta su uso en la industria farmacéutica en formulaciones de SEDDS y su seguridad clínica [17]. Los tensioactivos seleccionados fueron el Tween 80® (polisorbato 80) y Cremophor RH40 (aceite de castor hidrogenado polioxil 40) debido a que poseen un valor de HLB de 15,0 lo cual les confiere características hidrosolubles y solubilizantes [18]. Además, por su parte, el Tween 80 es uno de los más usados debido a que los emulsificantes derivados de fuentes naturales son más seguros que los sintéticos y el cosolvente fue el propilenglicol, ya que este es ampliamente usado como disolvente en formulaciones farmacéuticas parenterales y no parenterales; además, es un componente relativamente no tóxico [19, 20].
Preparación y evaluación del SEDDS líquido
Basados en los estudios de solubilidad en los diferentes aceites y los estudios preliminares de tensioactivos y solventes fueron mezclados el aceite seleccionado, Tween 80 (T80) o Cremophor RH 40 (CP) y propilenglicol (PPG). Para la preparación del SEDDS líquido se utilizó un diseño factorial 23 (ver tabla 1) en el cual las concentraciones de la fase oleosa, tensioactivo y cosolvente se encuentran en los niveles o porcentajes sugeridos en el sistema de clasificación de formulaciones SEDDS de C.W Pouton [21]. Los factores por su parte estuvieron representados por las sustancias seleccionadas, es decir, aceite, tensioactivo y propilenglicol. La variable de respuesta fue la capacidad autoemulsificadora de cada una de las formulaciones realizadas, en las cuales se evaluaría la formación de una emulsión, microemulsión o nanoemulsión de acuerdo al aspecto formado, es decir, las formulaciones que presentan un aspecto transparente o ligeramente azulado indican la formación de una micro o nanoemulsión [22].
Tabla 1. Composición y relación en peso para el diseño experimental del SEDDS.
| Ingredientes | Formulación | |||||||
|---|---|---|---|---|---|---|---|---|
| F1/F9 | F2/F10 | F3/F11 | F4/F12 | F5/F13 | F6/F14 | F7/F15 | F8/F16 | |
| AC | 33,3 | 22,2 | 22,2 | 50,0 | 36,4 | 16,7 | 36,4 | 28,6 |
| T80/CP | 33,3 | 22,2 | 55,6 | 25,0 | 45,4 | 41,2 | 18,2 | 35,7 |
| PPG | 33,3 | 55,6 | 22,2 | 25,0 | 18,2 | 41,2 | 45,4 | 35,7 |
Todos los valores están expresados en porcentajes (%, w/w).
AC: aceite de coco; T80: Tween 80; CP: cremophor RH 40; PPG: propilenglicol.
Para evaluar el SEDDS líquido empleando T80 y CP se siguieron las formulaciones descritas en el diseño experimental como se muestra en la tabla 1, evaluándose un total de 16 formulaciones, (F1-F8: Tween80; F9-F16: CP RH40). Se pesaron las cantidades correspondientes a cada una de las formulaciones en un mismo orden de adición: aceite, tensioactivo, cosolvente, ya que está demostrado que dicho orden de adición ayuda a la formación de nano emulsiones [22]. Después se tomó 1 mL de cada una de las formulaciones y se adicionó gota a gota en un beacker que contenía 50 mL de agua (bajo agitación constante) para formar el sistema autoemulsificable. Luego, se evaluó la transparencia de la formulación otorgándole una numeración con rangos de 1 a 10, siendo 1 completamente blanco y 10 completamente transparente.
Construcción de los diagramas de fase ternarios
Se construyó un diagrama de fase ternario con los datos obtenidos de la evaluación de la transparencia de cada una de las formulaciones para identificar las proporciones donde se encontraron los sistemas autoemulsificables, sin embargo, la transparencia de estas emulsiones son indicativos de presencia de microemulsiones o nanoemulsiones [22].
Capacidad de carga del sistema
El objetivo de esta prueba fue determinar la cantidad máxima de principio activo que se puede incorporar en el SEDDS y establecer la relación adecuada para evitar que se presente algún tipo de inestabilidad como precipitación y conservar las propiedades autoemulsificables adecuadas. Para realizar la capacidad de carga se preparó aproximadamente 10 gramos de la formulación seleccionada para cada uno de los tensioactivos como se muestra en la tabla 1 y cuyas mezclas se colocaron en agitación constante a una temperatura de 40 °C y se adicionó el principio activo en porciones de 1 g de IBU hasta sobresaturar el sistema, observándose precipitación.
Caracterización del SEDDS líquido
Robustez de la mezcla
Esta fue evaluada como un parámetro de estabilidad que nos indica si la mezcla obtenida sufre cambios a medida que el medio varía. Tomando como referencia otras investigaciones, la robustez del SEDDS se evaluó en 100 mL de 3 medios de disolución a distintos pH (1,2; 4,5; 6,8). [23] Para ello, las muestras se almacenaron durante 2 días en frascos de vidrio sellados herméticamente, protegidos de la luz, a una temperatura de 25 °C, y se reportaron las observaciones obtenidas.
Transformación del SEDDS líquido a sólido
La técnica empleada para lograr dicha transformación fue la adsorción por portador sólido [24]. Se evaluaron dos sustancias con capacidad adsorbente, las cuales fueron aluminometasilicato de magnesio (Neusilin US2®) y lactosa anhidra. Se preparó 25 g de la formulación del SEDDS que había sido seleccionada conteniendo IBU, se le adicionó 25 g del adsorbente a evaluar, manteniendo una relación de 1:1 y se mezclaron los componentes manualmente, tal como fue reportado por Serajuddin et al. en 2013 [25].
Caracterización de las propiedades reológicas del polvo
Densidad aparente y compactada
La densidad fue determinada utilizando un volumenómetro de asentamiento (Tap density Tester ZS-2E). Se pesaron 30 g aproximadamente del polvo y fue colocado en la probeta de 250 mL del equipo completando un volumen total de 82 mL, y fue evaluado de acuerdo al método 1, descrito en la USP para realizar un total de 1250 golpes [26].
Con los datos de densidad se calcularon el índice de Hausner y el índice de Carr. Las ecuaciones involucradas en los diferentes cálculos se presentan a continuación:
Robustez del polvo
Como se indicó en la prueba de robustez para el SEDDS líquido, este parámetro se evaluó en 3 medios de disolución a distintos pH (1,2; 4,5; 6,8) [25]. Para ello, las muestras se almacenaron durante 2 días y las observaciones fueron reportadas.
Tamaño de partícula
Para determinar el tamaño de partícula del SEDDS sólido fue empleada la técnica de difracción de luz láser utilizando un Master Sizer 3000. La muestra se preparó en agua en proporción 1:100; se agitó durante 5 minutos y posteriormente se sometió a ultrasonido, obteniéndose un histograma correspondiente [27].
Desarrollo de los comprimidos
Establecidos los componentes del SEDDS líquido conteniendo IBU con su respectivo porcentaje dentro del sistema, se adicionó el portador seleccionado en proporción 1:1 [25]. Para garantizar la dosis deseada de IBU en la mezcla (200 mg) se requería un peso final de la tableta de 1109 mg, a partir de ello se estableció la formulación propuesta para el comprimido: aglutinante in situ, polivinilpirrolidona k-30 (5%); desintegrante, glicolato de almidón sódico (2%); lubricante, estearato de magnesio (0,5%); SEDDS cargado con ibuprofeno- portador (92,4%). La compresión del polvo obtenido se realizó utilizando una tableteadora marca Rimek Mini Press-II, empleando un punzón redondo de 11 mm.
Incompatibilidades
Para detectar posibles incompatibilidades o interacciones entre los componentes de la formulación se realizado un análisis térmico utilizando un calorímetro diferencial de barrido (Mettler Toledo DSC 823). Siete muestras correspondientes a componentes puros y mezclas binarias en proporción 1:1 fueron analizadas: IBU, Neusilin US2®, Neusilin US2®-IBU, SEDDS-Neusilin®, SEDDS-almidón glicolato de sodio, SEDDS-estearato de magnesio y SEDDS-polivinilpirrolidona k-30. Cada una de estas fue colocada en crisoles de aluminio de 40 µL, sellados y perforados, con un programa de calentamiento desde 50 a 350 °C con una velocidad de calentamiento de 10 °C/min, utilizando una atmosfera inerte de corriente de nitrógeno de 40 mL/min. El equipo fue previamente verificado utilizando un estándar de indio.
Caracterización del comprimido
Análisis de friabilidad y dureza
Para obtener los valores de friabilidad y dureza se utilizó un friabilizador Sotax FT2 y un durómetro Schleuniger Tester 8M. La prueba de friabilidad fue realizada de acuerdo con la USP 37 NF 32 que tiene como límite aceptación una pérdida de peso ≤ 1% [26].
Variación de peso
Para determinar este parámetro de control fue utilizado el método descrito por la USP 37 NF 32, analizando 10 unidades, la cuales deben cumplir un criterio L1%=15, si es mayor deben analizarse las siguientes 20 unidades y cumplir con un criterio L2%= 25 [26].
Valoración del principio activo en las tabletas
Para realizar la valoración fue preparada una muestra estándar en un matraz volumétrico de 100 mL a partir de un estándar secundario de ibuprofeno 99,8% (BASF, Alemania) pesando 100 mg y completando volumen con buffer fosfato pH 7,2. Para preparar la muestra se tomaron 10 tabletas de ibuprofeno, luego se pesaron y se trituraron hasta obtener un polvo fino. Del polvo obtenido se tomó una cantidad equivalente a 100 mg de ibuprofeno y se completó el volumen hasta 100 mL con buffer fosfato pH 7,2 en un matraz volumétrico de 100 mL. Fue realizado un barrido espectral en un espectrofotómetro UV-Vis referencia T80+ de la marca PG Instruments y se calculó la cantidad del ingrediente activo en el comprimido [26].
Perfil de disolución
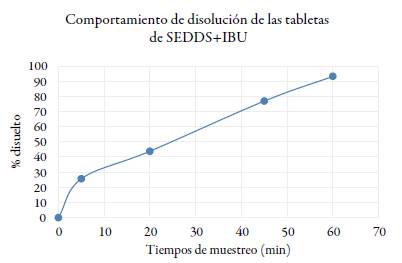
La prueba de disolución se realizó empleando las siguientes condiciones: buffer fosfato pH 7,2; Aparato 2 (paletas, disolutor Agilent 708- DS,) 50 rpm; 37 °C ± 0,1 °C, tiempo total de 60 minutos y 4 tiempos de muestreo: 5, 20, 45 y 60 minutos, tomando una muestra de 5 mL en cada tiempo mencionado y filtrándose antes de ser analizadas en un espectrofotómetro UV-Vis T80+ PG Instruments, debidamente calibrado y verificado para su uso, a una longitud de onda de 222 nm. Esta metodología es resultado de la información disponible en la página del CDER Dissolution Methods para IBU en forma farmacéutica cápsulas para los tiempos de muestreo y las demás condiciones de la prueba son tomadas de la monografía USP de IBU tabletas [26, 28, 29]. El porcentaje de ibuprofeno disuelto de los comprimidos fue calculado utilizando una curva de calibración de 5 niveles para obtener un nivel confianza de 95% y graficado contra cada tiempo de muestreo.
RESULTADOS Y DISCUSIÓN
Estudio de solubilidad
Los datos de concentración presentados en la tabla 2 muestran que la solubilidad más baja se presenta con el aceite de maní y la más alta con el aceite de coco. La mayor solubilidad del IBU hallada en el aceite de coco y oliva coincide con lo reportado por Martin Piest et al., quienes determinaron visualmente que el IBU tienen un rango de solubilidad entre 17-34 mg/mL en el aceite de soya, ajonjolí y maní [29], y con lo reportado por Cao, et al. en 2004, se estableció que la capacidad de los triglicéridos como solvente para fármacos se da principalmente por la concentración de grupos éster en sus estructuras [30]; además, se puede evidenciar cómo la naturaleza del ibuprofeno se relaciona con la de los ácidos grasos (caprilico y caprico) presentes en el aceite de coco lo cual justifica la solubilidad del IBU en este aceite utilizado como solvente. Adicionalmente, es importante señalar que el aceite de coco al estar formado por triglicéridos de cadena media tiene mayor capacidad solvente que aquellos formados por triglicéridos de cadena corta y larga y, adicional a esto, es menos propenso a la oxidación [30].
Tabla 2 Datos de solubilidad de ibuprofeno en los diferentes aceites utilizados como solventes.
| Aceites | [mg/mL]/2 horas | [mg/mL]/6 horas | [mg/ mL]/24 horas |
|---|---|---|---|
| Oliva | 27,41 | 28,80 | 29,66 |
| Coco | 27,23 | 32,84 | 37,63 |
| Soya | 17,56 | 25,36 | 28,12 |
| Maní | 22,18 | 22,93 | 26,55 |
| Ajonjolí | 8,58 | 24,71 | 26,91 |
| Canola | 13,74 | 26,99 | 27,43 |
Los datos de solubilidad del IBU en diferentes aceites, hallados en esta investigación, son similares a los reportados por otros autores. Watkinson et al., quienes demostraron que usando un 100% de aceites minerales como vehículo se obtiene una solubilidad expresada en mg/mL de 31,99 ± 3,44 [31]. Otros estudios realizados muestran datos de solubilidad del aceite de oliva correspondientes a 3,689 %W/V y al aceite de soya con una solubilidad de 17 mg/mL [32, 33].
Selección de tensioactivo y cosolvente
De acuerdo con los resultados anteriores se pudo determinar que en el aceite de coco se presenta la mayor solubilidad del IBU. Sin embargo, uno de los principales problemas de este aceite es que forma una deposición de cera a baja temperatura la cual depende de la cantidad de triglicéridos de los ácidos grasos principalmente laúricos (saturados) [34]. Pero, se ha demostrado que la adición de tensioactivos puede disminuir la formación de cera y permitir la medida de la viscosidad del mismo; Cremophor y Tween 80 respectivamente fueron los que mejor actuaron sobre el aceite reduciendo la formación de cera a bajas temperaturas [35], razón por la cual estos fueron seleccionados como tensioactivos en esta investigación.
Capacidad de autoemulsificación
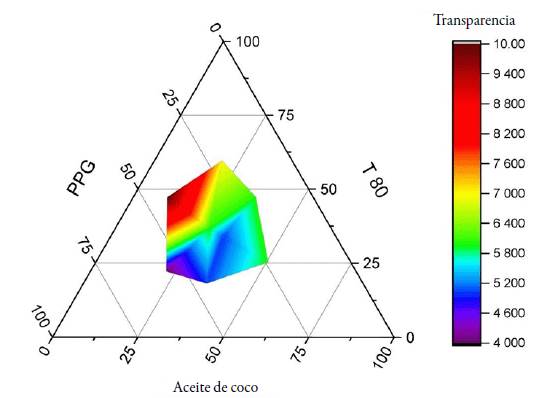
El aceite de coco fue seleccionado para la fase oleosa, propilenglicol como cosolvente y para determinar cuál sería el tensioactivo para complementar el SEDDS, se evaluaron los resultados obtenidos y con ellos se construyeron diagramas de fase ternarios para identificar las zonas de autoemulsificación. Las regiones autoemulsificables son regiones claramente isotrópicas, las cuales pueden ser identificadas por observación visual y ayudan a seleccionar las relaciones o radios más adecuados para el desarrollo de formulaciones SNEDDS, que aseguren la espontaneidad de la formación de una nanoe-mulsión dentro las condiciones del tracto gastrointestinal [36]. De las formulaciones del F1-F8, correspondientes a T80 como tensioactivo, a la fórmula F6 (20% AC; 40% T80; 40% PPG) le fue otorgada un valor de 10, indicando una apariencia completamente transparente y homogénea, dándose la autoemulsificación de forma casi inmediata. En el caso de CP, la fórmula F14 (20% AC; 40 % CP; 40% PPG) coincidió en los porcentajes de los componentes y características de la fórmula F6.
En la figura 1 se puede identificar las proporciones donde se encontraron los sistemas autoemulsificables, la transparencia de estas emulsiones son indicativos de presencia de microemulsiones o nanoemulsiones [22]. Empleando T80 como tensioactivo se identificó el área de máxima transparencia: estas concentraciones se clasifican como formulaciones lipídicas tipo IIIB de acuerdo con Colin W. Pouton en proporciones de 41-52%, mismas proporciones para el PPG, además se observó la tendencia a formar emulsiones transparentes a medida que la concentración del aceite de coco disminuye. Las regiones autoemulsificadoras de color rojo representan formulaciones tipo IIIB.
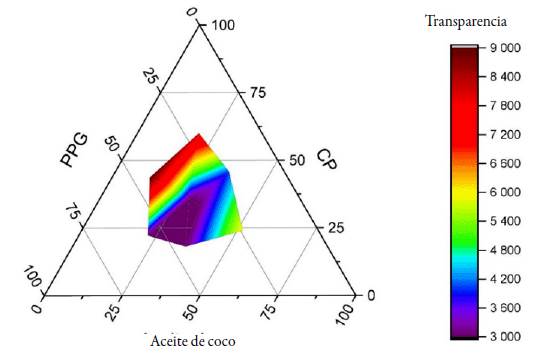
En la figura 2, correspondiente a CP como tensioactivo, se encontró una región de formación de emulsiones transparentes más amplias, así como regiones de formación de emulsiones mucho más opacas que con T80. Con estas pruebas se logró corroborar lo estipulado por Colin W. Pouton donde refiere que las formulaciones lipídicas IIIB son las responsables de la transparencia de la emulsión [37].
Selección de la formulación
De acuerdo a la información obtenida de las formulaciones elaboradas, las pruebas visuales confirman lo mencionado previamente en la bibliografía consultada (formación de microemulsiones y nanoemulsiones en formulaciones de tipo IIIB) [21]. Con ello se seleccionó la formulación F6 y F14 con ambos tensioactivos para seguir evaluando otros aspectos para seleccionar aquella que fuera más apropiada para una formulación final.
Capacidad de carga del sistema
En esta prueba se pudo determinar que la relación existente entre el sistema autoemulsificable conteniendo T80-IBU, capaz de mantener en solución el principio activo corresponde a 1:0,8, dado que, a partir de la novena adición, se observó un precipitado, indicando la sobresaturación de la mezcla. Para el sistema autoemulsificable conteniendo CP-IBU la relación obtenida fue de 1:1,5, respectivamente, indicando una mayor capacidad de carga.
Caracterización del SEDDS líquido
Robustez de la mezcla a la dilución
La robustez a la dilución evalúa la estabilidad de la dispersión sometiéndola al efecto de diversas diluciones que asemejan las condiciones gastrointestinales in vivo con el objetivo de examinar algún cambio físico como coalescencia, precipitación o separación de fases [38, 39]. Los resultados de esta prueba fueron más favorables para la mezcla con T80 como tensioactivo, que con CP y más favorable en términos generales para un pH alcalino (6,8), que para un pH ácido (1,2). En la muestra con CP antes de las 24 horas, en el pH 1,2 se observó un precipitado en gran cantidad y a pH 4,5, algunas partículas en el seno de la solución; este comportamiento puede ser atribuido a la sustancial separación de los tensioactivos hidrofílicos de la fase oleosa después de la dispersión de la formulación en la fase acuosa, reduciendo la solubilidad total de la formulación para el fármaco.
En el buffer fosfato (pH 6,8), después de la dilución no se presentó precipitación, que puede ser atribuible a la alta solubilidad del IBU en este medio comparado con los medios anteriores. Sin embargo, después de las 24 horas de observación, se evidenció la presencia de una cantidad considerable de precipitado en el fondo del beaker. Este evento podría estar relacionado con que el fármaco permanece en un estado supersaturado hasta por 24 horas después del evento inicial de emulsificación [38]. Esto nos llevaría a asumir que la precipitación del fármaco en el intestino antes de la respectiva absorción no se presentaría [37]. En esta prueba de robustez con T80 en los tres medios, el comportamiento antes de las 24 horas fue una solución translucida, indicando un mejor desempeño de este tensioactivo para la solubilización del IBU en diferentes condiciones similares a las que se pueden encontrar en el tracto gastrointestinal.
Después de las 24 horas de observación, en el pH 1,2 se observa un ligero sedimento de partículas de pequeño tamaño. A pH 4,5, la mezcla adquiere un color ligeramente blanquecino indicando posiblemente perdida de solubilidad en este sistema. Para el buffer fosfato pH 6,8 la mezcla se mantuvo inalterada, sin la presencia de precipitado cambio en la transparencia o coloración de la solución. De acuerdo a los resultados obtenidos en las pruebas de capacidad de carga y robustez de la mezcla en la dilución, se decidió seleccionar la formulación con T80, dado que presentó mejores características en los diferentes medios de disolución.
Transformación del SEDDS líquido a sólido
En esta etapa se pudo evidenciar la alta capacidad de Neuslin US2, como portador, dado que se obtuvo un polvo con alta fluidez, de apariencia seca, partículas libres, sin presencia de aglomerado, manteniendo la relación 1:1 propuesta por Gumaste et al. en 2013 [25]. Para el caso de lactosa spray dried fue necesario alcanzar una relación de 1:4, para lograr adsorber el SEDDS líquido, sin embargo, se obtuvo un aglomerado húmedo, sin fluidez.
Densidad aparente, compactada, índice de Carr, índice Hausner
Los datos obtenidos con el volumenómetro dieron como resultado una densidad aparente de 0,3659 g/mL y densidad apelmazada de 0,3704 g/mL. El índice de Carr nos indica que a mayor sea la diferencia de las densidades, mayor será la tendencia del material a apelmazarse y peor será el flujo. El resultado obtenido de la muestra fue de 1,2149, lo cual indica que el polvo obtenido presenta poca tendencia al apelmazamiento y una capacidad de flujo excelente [26].
El resultado obtenido para el índice de Hausner para este polvo fue de 0,9878. Como norma general, los valores del índice de Hausner superiores a 1,5 son indicativos de una fluidez deficiente. Por otra parte, los materiales poco cohesivos apenas se verán modificada su densidad con el apelmazamiento y el IH se aproximará a 1 [27]. Por consiguiente, podemos establecer que el polvo obtenido presenta una buena fluidez.
Robustez de dilución del polvo
A diferencia de los resultados obtenidos de la robustez realizada en el SEDDS líquido, donde se presentaron variaciones en el comportamiento en los distintos pH, para el sistema SEDDS incluido en el portador, la muestra permanece disuelta en los distintos medios durante el tiempo de observación, sugiriendo que la inclusión del Neusilin US2® permite un mejor desempeño del sistema autoemulsificable. Este comportamiento se puede entender dado que el ibuprofeno es un compuesto de carácter ácido y su disolución depende del pH, y se ha visto que la aplicación de un portador solido alcalino, como el Neusilin US2®, puede ser útil para mejorar la disolución del activo a valores de pH bajos [40, 41].
Tamaño de gota
El 90% de las gotas analizadas se encuentran en un rango de 4,12 a 56,8 µm. A pesar que no existe un criterio específico para clasificar una micro o nanoemulsion de acuerdo al tamaño de los glóbulos formados, como ya se ha señalado la transparencia de las soluciones obtenidas en las pruebas de estos sistemas son indicativos de un sistema auto-emulsificable con medidas micrométricas. De acuerdo a las investigaciones el tamaño de gota encontrado posiblemente corresponda al adsorbente Neusilin US2®, como ha sido reportado por Serajuddin et al. Además, estudios realizados previamente sugieren que regiones de la formulación pueden migrar dentro de las redes porosas del Neusilin US2® [25, 41, 42].
Incompatibilidades por DSC de la formulación de comprimidos
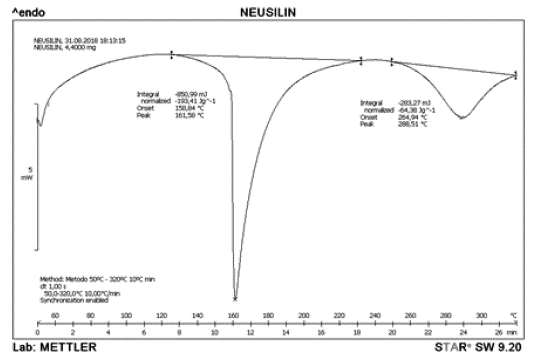
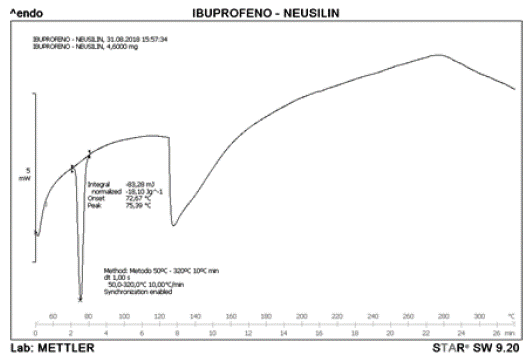
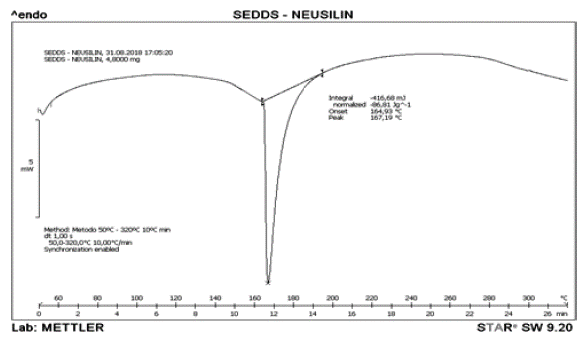
El termograma representado en la figura 3 corresponde a Neusilin US2® el cual exhibe el comportamiento para una sustancia en estado puro. Se puede observar el momento de la transición vitrea la cual indica el cambio inicial en la sustancia sin modificar su estado actual. El punto de fusión determinado por el DSC corresponde a 158,84 °C y es el pico más pronunciado en el termograma. De igual manera, se puede observar otro evento térmico a 264,94 °C el cual puede indicar la formación de otro compuesto o que alguno de los componentes del Neusilin US2® se encuentra en estado oxidativo. En el termograma presentado en la figura 4 correspondiente a la mezcla de Neusilin US2®-IBU en relación 1:1 se puede observar el endoterma de fusión a 72,67 °C característico del IBU en estado puro.
Adicionalmente, algunos autores señalan que existe un tipo de reacción entre el Neusilin® y el IBU cuando se encuentran en estado sólido, lo cual produce un producto en forma de sal denominado ibuprofenato de magnesio Mg (IB)2, el cual se hace más efectivo después de la fusión del fármaco. Sin embargo, este no precipita, sino que se presenta en la mezcla en estado iónico o complejo, es por ello que no se muestra ningún otro pico en el termograma [41].
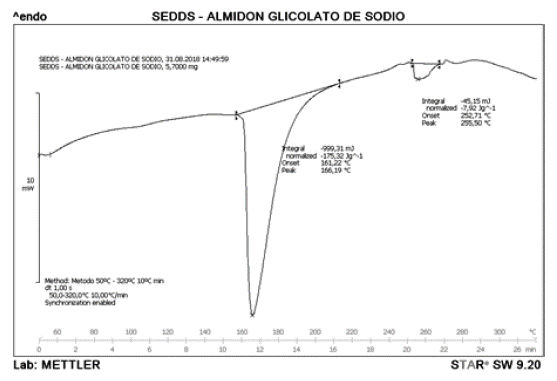
La figura 5 corresponde al termograma de mezcla SEDDS-almidón glicolato de sodio 1:1. Este refleja como la mezcla adopta un comportamiento parecido al del Neusilin® cuando se analiza de manera individual, es decir, mostrando el endoterma de fusión a 161,22 °C, lo cual nos podría indicar que el glicolato de almidón sódico se encuentra de forma disuelta en el silicato. De igual manera, se puede observar la presencia de un pico no tan pronunciado a 255,50 °C el cual es indicativo del estado oxidativo del almidón presente en la muestra.
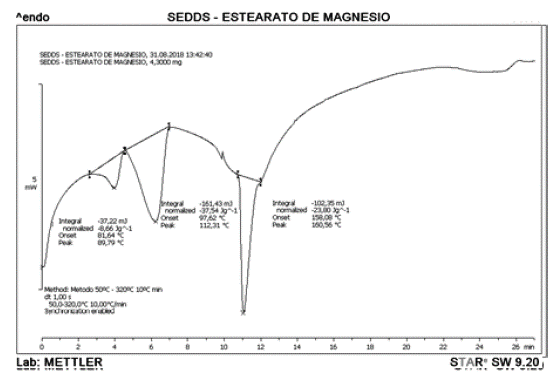
En el termograma representado en la figura 6 se puede observar el comportamiento térmico del SEDDS- estearato de magnesio, mostrando un endoterma de fusión a 160,56 °C. Adicional a esto, se ha reportado en la literatura que el estearato de magnesio exhibe muchas formas polimórficas, y dependiendo del origen existen muchas mezclas con ácidos grasos libres, es por ello que en el termograma se puede observar dos picos adicionales que corresponden a impurezas presentes en el estearato de magnesio, estas se pueden atribuir a la presencia de ácido palmítico en el mismo [43].
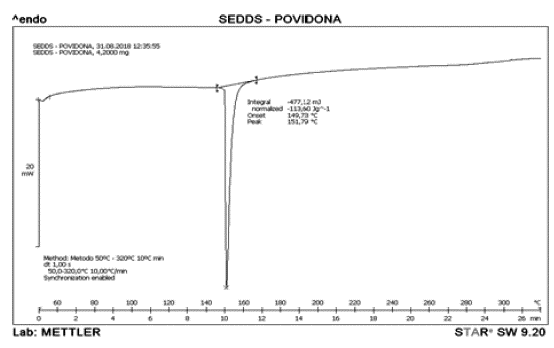
Los termogramas representados en las figuras 7 y 8 exhiben como las mezclas adoptan el comportamiento del Neusilin® cuando se analiza de manera independiente, mostrando un endoterma de fusión cercano a 160 °C. Los resultados en las figuras anteriores indican que probablemente no existe ninguna incompatibilidad en los excipientes empleados para el desarrollo de la formulación del sistema autoemulsificable sólido de IBU.
Obtención de comprimidos
Los comprimidos se obtuvieron empleando un punzón redondo 11 mm, debido a que el uso de un punzón más grande ensayado no permitía la salida de las tabletas y teniendo en cuenta que se ha reportado que las tabletas con Neusilin US2® presentan un ligero desgastamiento en los bordes siendo mayor entre más plana sea la tableta, por tanto, lo ideal es emplear tabletas redondas [44].
Los comprimidos arrojaron un valor de dureza de 19,6 MPa, que se encuentran por fuera del rango reportado y sugerido por Gumaste et al., quienes señalaron que cuando se hace la compresión de tabletas empleando Neusilin US2® y presiones muy bajas (45 a 135 MPa), se da una dispersión del líquido por toda la tableta, dando como resultado una dureza muy baja, este fenómeno de dispersión es posiblemente la causa de que la dureza resultante se encuentre fuera del rango de fuerza de compactación aceptable de 45 a 135 MPa [44].
En cuanto al a valor de friabilidad, se obtuvo un de valor 0,7%: para esta prueba la USP 37 NF 32 tiene como límite aceptación una pérdida de peso ≤ 1%, para este caso entonces, los comprimidos cumplen con la prueba de friabilidad. Para efectos de la medición de variación de peso del comprimido, se obtuvo un peso promedio de 353,11 mg, empleando el método descrito por la USP 37 NF 32, para ello se pesaron individualmente 10 tabletas, y el valor obtenido de AV fue de 4,7 cumpliendo con el primer criterio estipulado de L1%= 15 [26].
Valoración de las tabletas
A través del método espectrofotométrico presentado se obtuvo un porcentaje de principio activo de 100,3 %, cumpliendo con las especificaciones señaladas por la USP 37 NF 32: las tabletas de ibuprofeno contienen no menos de 90% y no más de 110% del contenido principio activo [26]. Es importante resaltar que se logró incorporar una cantidad de ibuprofeno de aproximadamente de 64 de 200 mg, que se intentaba incorporar, pero, como ya se ha mencionado, esto se debe a que las características de compresibilidad del polvo obtenido y el líquido incorporado en este, no permitieron obtener un mayor peso de dosificación. Sin embargo, en comparación con otros estudios de tipo con AINES como naproxeno, en el cual solo se incorporaron 6 mg de 250, la cantidad incorporada en nuestra investigación es considerablemente alta [45].
Perfil de disolución
Los resultados del perfil de disolución in vitro del comprimido de IBU obtenido se muestran en la figura 9 y la tabla 3. El perfil desarrollado en el pH 7,2 con 4 puntos de muestreo (5, 20, 45, 60 minutos), de acuerdo con la USP 37 NF 32 [27] y con algunas modificaciones en lo relativo a estos tiempos, arrojó como resultado un porcentaje disuelto (Q%) de 93,2 % en 60 minutos, cumpliendo con las especificaciones de Q%= 80% y un criterio de aceptación de S1 para las primeras 6 tabletas de Q % de acuerdo con la USP 37 NF 32. En la tabla 3 y la figura 9 se pueden observar que en los tiempos de muestreo del perfil se logra una liberación gradual, que posiblemente se deba a una formación de la microemulsión.
Tabla 3 Absorbancia y porcentaje de disolución de las muestras en los diferentes puntos.
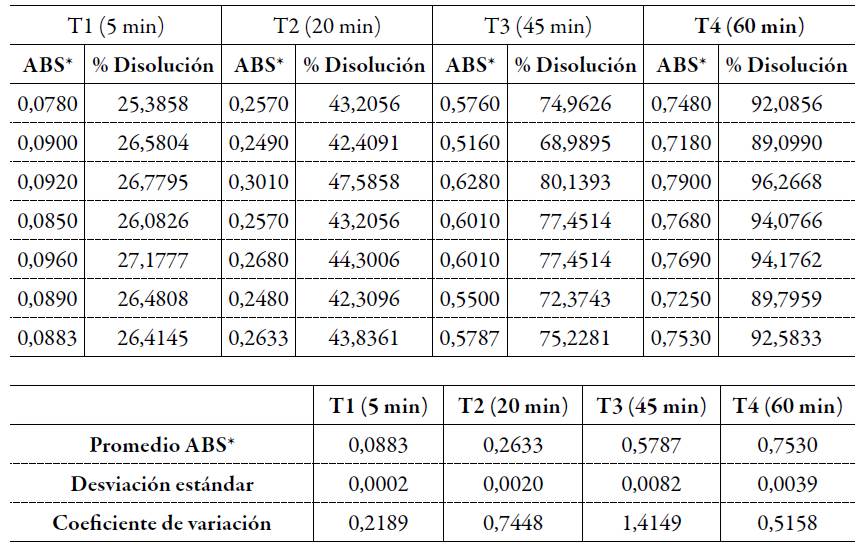
*ABS: absorbancia
CONCLUSIONES
Los estudios de solubilidad para la correcta selección de la fase oleosa, pruebas con tensioactivos, cosolventes y construcción de diagramas ternarios fueron llevados a cabo conduciendo a una fórmula con adecuadas propiedades autoemulsificables compuesta de aceite de coco, Tween 80 y propilenglicol. Esta combinación demostró poseer una alta robustez en tres medios de disolución a distintos pH (1,2; 4,5; 6,8), siendo más estable después de 2 días en el valor más alto de pH, dado que se encuentra en un sistema supersaturado, asegurando la absorción del fármaco.
Además, se incorporó el SEDDS líquido en una forma de dosificación sólida (comprimidos), a través de la adsorción por portador, se escogió aluminometasilicato de magnesio y se obtuvo un polvo con una capacidad de flujo excelente, el cual se mantuvo disuelto en los medios de disolución de pH evaluados, mostrando que la inclusión del Neusilin US2 permite un mejor desempeño del sistema autoemulsificable, por lo cual se vislumbran como una alternativa prometedora para asegurar la entrega de fármacos poco solubles o con poca permeabilidad [46, 47]. El análisis térmico realizado para cada uno de los componentes de la formulación mostró que no existe alguna incompatibilidad apreciable entre ellos, lo cual garantiza un acierto en la elección de cada uno de los excipientes Finalmente, los comprimidos obtenidos presentaron características similares a las reportadas en investigaciones previas y los resultados de los ensayos posteriores a la compresión de las tabletas garantizaron el cumplimiento de las especificaciones dictadas por la normativa que se empleó para el desarrollo de esta investigación.