INTRODUCCIÓN
El Eudragit® E100 (Eu) es un copolímero básico del ácido metacrílico, conformado por grupos dimetilaminoetil metacrilato (DMAE), n-butil metacrilato y metil metacrilato en una proporción molar de 2:1:1; los monómeros se encuentran distribuidos aleatoriamente a lo largo de la cadena del copolímero, como se observa en la figura 1.
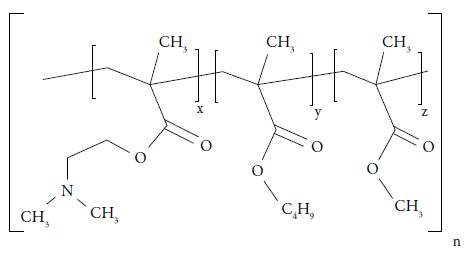
Fuente: tomado de Evonik Industries [1].
Figura 1 Estructura quimica del polielectrolito EudragitR E100.
Debido a que los grupos DMAE son susceptibles a protonación, su interacción iónica con moléculas biológicamente activas (de carácter aniónico) ha sido aprovechada para la obtención de complejos polielectrolito (CPE) con múltiples propósitos, como: aumento de solubilidad aparente, modulación del comportamiento de liberación, incremento de estabilidad de activos y de la permeabilidad intestinal [1-4].
En tales estudios es común neutralizar parte de los grupos DMAE del polímero con un ácido inorgánico, usualmente ácido clorhídrico, con el fin de mejorar la compatibilidad acuosa de los sistemas obtenidos [5], sin embargo, el efecto del ácido fuerte en la estructura del PE no ha sido evaluado a profundidad. En la investigación desarrollada por Villada se evidenció, por primera vez, el fenómeno de hidrólisis de los ásteres del PE como consecuencia de la adición de HCl, no obstante, la reacción fue asociada al método de obtención, ya que se llevó a cabo en medio acuoso [6]. En este estudio se evaluó si se presenta o no la hidrólisis de los ásteres del Eu, en la obtención del CPE, empleando la metodología de evaporación de solvente. Para ello se realizó el análisis de los espectros de FTIR y de los termogramas de DSC, para los sistemas de diferente composición, obtenidos entre el polímero catiónico y los contraiones generados por los ácidos benzoico o clorhídrico; aquellos en los que la neutralización solo fue realizada con el ácido inorgánico se denominaron "ionómeros".
METODOLOGÍA
Materiales
Ácido benzoico (Sigma-Aldrich), Eudragit® E100 (Evonik Industries), etanol al 96% y ácido clorhídrico (Merck). Para la dilución de HCl se empleó agua desionizada.
Obtención de los complejos y de los ionómeros
Se prepararon diez composiciones diferentes de CPE entre Eudragit® E100 (Eu) y ácido benzoico (B) siguiendo la metodología descrita en estudios previos, con algunas modificaciones [3, 7]. Se realizó la dispersión de 3 g de Eu en 15 ml de etanol con posterior adición de B en cantidad correspondiente a la neutralización del 25%, 50%, 75% y 100% de los grupos dimetilaminoetil (DMAE) del polielectrolito, para la obtención de los complejos, denominados respectivamente: EuB25, EuB50, EuB75 y EuB100.
Los otros seis CPE fueron preparados de modo semejante, pero con neutralización adicional (de los grupos DMAE) con HCl al 2,5 M, en proporciones de 25%, 50%, 75%, que permitieran evaluar todas las posibles combinaciones; estos complejos se denominaron: EuB25Cl25, EuB25Cl50, EuB25Cl75, EuB50Cl25,EuB50Cl50 y EuB75Cl25 en función de la composición de contraiones benzoato y cloruro. Los componentes se dejaron interactuar por 5 minutos y para la posterior evaporación del solvente, las dispersiones fueron depositadas en moldes metálicos y secadas hasta peso constante en estufa (Memmert) a 25 °C, a presión ambiente y durante 48 horas. El sólido obtenido se trituró hasta obtener un polvo fino, que se separó por tamices, seleccionando aquel que quedó entre mallas 40/80 (177-420 µm).
Para evaluar el efecto del ácido inorgánico en el PE, se siguió la misma metodología descrita previamente sin la adición de B, para la obtención de los cuatro ionómeros denominados EuCl25, EuCl50, EuCl75 y EuCl100, utilizando la nomenclatura ya mencionada, mediante la neutralización de los grupos DMAE del Eu solamente con HCl 2,5 M.
Caracterización por espectroscopía de infrarrojo (FTIR)
Los diez CPE obtenidos, los cuatro ionómeros, B, Eu y una mezcla física (MF) equivalente a la composición del complejo EuB100 se caracterizaron mediante espectroscopía infrarrojo por transformada de Fourier (espectrofotómetro IRPrestige-21/ATR, Shimadzu) empleando la técnica de muestreo de reflectancia total atenuada (ATR), las muestras analizadas fueron representativas de la cantidad total obtenida. Los espectros fueron analizados haciendo uso del programa espectral LabSolutions-IR®.
Calorimetría diferencial de barrido (DSC)
El comportamiento térmico de las muestras evaluadas por FTIR fue estudiado mediante calorimetría diferencial de barrido (Analizador Mettler Toledo, DSC1-STARe System). El análisis se realizó bajo atmósfera de nitrógeno (flujo 50 ml/min) en un rango de temperatura entre 0 °C y 180 °C, con un pretratamiento a -20 °C por 10 minutos. La rampa de calentamiento utilizada fue de 10 °C/min. Aproximadamente 7 mg de cada muestra de polímero, complejo, ionómero o mezcla física fueron pesados (Balanza Mettler Toledo ME204), mientras que para el ácido benzoico bastó con un peso de 4 mg. Todas las muestras fueron dispuestas en portamuestras de aluminio con tapa, cerradas herméticamente con la prensa (Mettler Toledo).
RESULTADOS Y DISCUSIÓN
Al seguir la metodología de obtención descrita se prepararon de modo satisfactorio los diez CPE y los cuatro ionómeros.
Caracterización por espectroscopia de infrarrojo (FTIR)
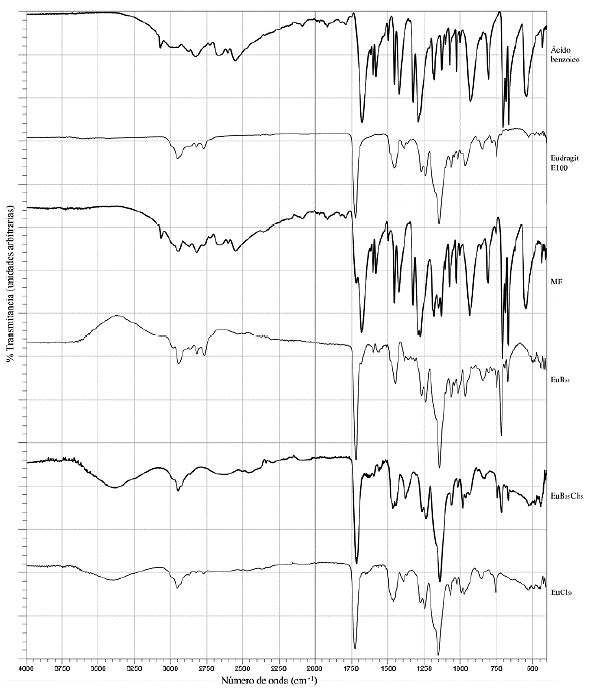
Los resultados de los espectros de infrarrojo se presentan en la tabla 1, en esta se resumen las bandas de absorción de importancia para la formación del complejo: su presencia o número de onda. Adicionalmente, en la figura 2 se observan, a manera de ejemplo, los espectros de absorción para dos de los complejos (EuB25 y EuB25Cl75) y para uno de los ionómeros (EuCl50) cotejados con sus precursores y la mezcla física.
Tabla 1 Bandas de las transiciones vibracionales -de importancia en el proceso de complejación-de los espectros FTIR de los diez complejos obtenidos, los cuatro ionómeros, reactivos de partida y mezcla física (MF).
| COO-H del B (cm-1) | COO-H fuera del plano de B (cm-1) | (COOH) de B (cm-1) | DMAE de Eu (cm-1) | % T de las bandas DMAE de Eu | ||
|---|---|---|---|---|---|---|
| 2770 cm-1 | 2822 cm-1 | |||||
| B | 2554-3070 | 931 | 1676 | --- | --- | --- |
| Eu | --- | --- | --- | 2770-2822 | 92,53 | 93,36 |
| MF | 2556-3073 | 934 | 1682 | 2772-2822 | 82.49 | 79.95 |
| EuB 25 | N.O. | N.O. | N.O. | 2772-2822 | 94,22 | 94,70 |
| EuB 25 Cl 25 | N.O. | N.O. | N.O. | 2772-2824 | 96,25 | 96.43 |
| EuB 25 Cl 50 | N.O. | N.O. | N.O. | 2772-2824 | 96,24 | 96,34 |
| EuB 25 Cl 75 | N.O. | N.O. | N.O. | N.O. | N.A. | NA |
| EuB 50 | N.O. | N.O. | N.O. | 2772-2822 | 95,05 | 95,13 |
| EuB 50 Cl 25 | N.O. | N.O. | N.O. | 2772-2824 | 96,23 | 96,14 |
| EuB 50 Cl 50 | N.O. | N.O. | N.O. | N.O. | N.A. | N.A. |
| EuB 75 | N.O. | N.O. | N.O. | 2772-2824 | 98,03 | 97,90 |
| EuB 75 Cl 25 | N.O. | N.O. | N.O. | N.O. | N.A. | NA |
| EuB 100 | N.O. | N.O. | N.O. | N.O. | N.A. | NA |
| EuCl 25 | N.A. | N.A. | N.A. | 2772-2822 | 95,04 | 95,51 |
| EuC Cl 50 | N.A. | N.A. | N.A. | 2772-2822 | 96,15 | 96,40 |
| EuCl 75 | N.A. | N.A. | N.A. | 2772-2822 | 97,59 | 97,78 |
| Eu C 100 | N.A. | N.A. | N.A. | N.O. | N.A. | NA |
N.O.: no observado, N.A.: no aplica.
En primer lugar, se observó que los resultados de la caracterización por FTIR relacionados con los precursores de los complejos, es decir de B y de Eu, corresponden a lo reportado en la literatura especializada; en la tabla 2 se relacionan las señales de las transiciones vibracionales de las dos moléculas y el número de onda de sus respectivas bandas. Los resultados para Eu están en línea con lo registrado por los estudios de Lin, Juppo y de Villada [6, 8, 9]; de igual modo las señales observadas para ácido benzoico concuerdan con lo reportado por Hayashi y Yariv [10-12].
Tabla 2 Señales de FTIR asociadas a Eudragit® E100 y a ácido benzoico.
| Número de onda de la banda (cm-1) | Transición vibracional asociada | |
|---|---|---|
| Eudragit® E100 | 2949 y 2874 | Estiramiento asimétrico de CH3 y de los grupos CH2 de la cadena principal y del CH2-OR |
| 2822-2770 | Estiramiento simétrico de los grupos CH2 de la cadena ramificada CH2-N-(CH3)2 | |
| 1722 | Estiramiento de C=O | |
| 1454 y 1487 | Flexión de los grupos CH2 de la cadena principal. | |
| 1387 | Estiramiento del grupo CH3 (posiblemente del promedio de las bandas C-CH3 y N-CH3) | |
| 1269 y 1238 | Estiramiento grupo éster C-O. | |
| 1144 | Estiramiento grupo éster C-O y C-N | |
| Ácido benzoico | 2554-3070 | Estiramiento O-H (Bandas C-H solapadas) |
| 1676 | Estiramiento C=O | |
| 1601 y 1582 | Estiramiento C=C aromático. | |
| 1497 y 1452 | C-H del anillo aromático | |
| 1419,1288 y 1323 | Acoplamiento del estiramiento C-O y flexión OH en el plano | |
| 931 | Flexión O-H fuera del plano | |
| 804 | Estiramiento C-C | |
| 704 | Flexión O-H fuera del plano y anillo aromático | |
| 682 y 543 | Flexión en movimiento de tijeras de COO |
En cuanto a los espectros de FTIR de los complejos, los resultados confirman la formación de la interacción iónica entre Eu y B para las diez composiciones distintas, esto debido a los siguientes tres fenómenos:
Desaparición de las bandas asociadas al enlace O-H del ácido benzoico (2557 cm-1, 3070 cm-1, 931 cm-1 y 1685 cm-1), indicando la disociación de la molécula ácida a su equivalente iónico, necesario para la formación del CPE.
Disminución en la intensidad de las bandas de los grupos DMAE no protonados del Eu, revelando el efecto de la protonación de estos. Este comportamiento es corroborado con la proporcionalidad entre el porcentaje de transmitancia (% T) de la banda y el grado de neutralización de los contraiones en cada complejo, puesto que a medida que aumenta el porcentaje de grupos del PE ionizados, mayor es el valor de % T, es decir, la intensidad de la banda es menor.
Es así como para los cuatro complejos que cuentan con la neutralización total de los grupos DMAE del Eu -EuB25Cl75, EuB50Cl5o, EuB75Cl25 y EuB100- no se observan las bandas mencionadas, mientras que, para aquellos complejos con menores porcentajes de interacción con los contraiones, ya sea benzoato o cloruro, sí son evidentes estas bandas (ubicadas en 2771 cm-1 y 2821 cm-1). En la figura 3 se presenta el fenómeno descrito para la serie de complejos con neutralización del 25 % de los grupos DMAE con B, cotejados con el del polímero, en esta se observa que, a mayor porcentaje de contraiones, las bandas son mucho menos pronunciadas.
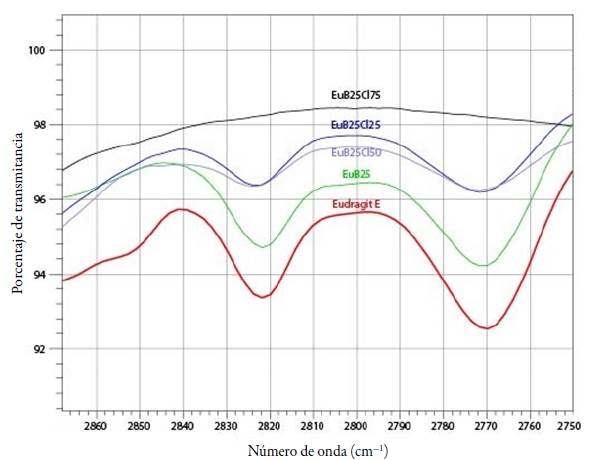
Figura 3 Espectro de FTIR en el rango de 2870 cm-1 a 2750 cm-1 para los complejos con neutralización de B del 25%.
3. El espectro FTIR de la mezcla física equivalente a la composición del complejo EuB100. esta presenta la sumatoria de las bandas de los precursores, tanto las correspondientes al enlace O-H del B, como las de los grupos dimetilamino no protonados del Eu.
Los anteriores hallazgos se encuentran en línea con lo reportado en estudios previos para CPE con Eu como PE [2, 3, 13-15], en todos describen los tres fenómenos mencionados como evidencia inequívoca de la interacción.
Además de la comprobación de la formación de los complejos, los espectros FTIR advirtieron de la presencia de un fenómeno relacionado con la formación de una banda ancha en 3500 cm-1, la cual fue atribuida por Villada J [6] a la aparición de grupos hidroxilo, como resultado de la hidrólisis de los ésteres del polímero por el uso del ácido clorhídrico en el proceso de obtención. En la figura 4 se presenta el fenómeno descrito, ejemplificado con los espectros FTIR de los cuatro complejos con neutralización del 25 % de los grupos DMAE con B, en un rango de número de onda entre 3700 cm-1 a 3080 cm-1, en esta se observa que a mayor porcentaje de neutralización con HCl, la banda se hace más pronunciada, lo cual corrobora la teoría de hidrólisis planteada.
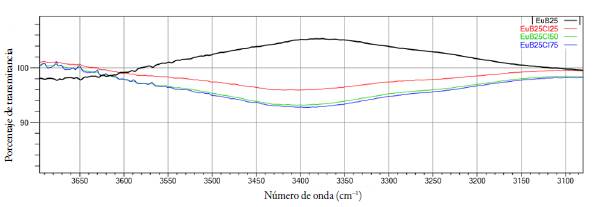
Figura 4 Espectro de FTIR en el rango de 3700 cm-1 a 3080 cm-1 para los complejos con neutralización de B del 25%.
Con el objetivo de comparar el fenómeno de hidrólisis reportado por Villada J. [6], se analizaron los espectros de los ionómeros (EuCl25, EuCl50, EuCl75 y EuCl100), resultados que se presentan en la figura 5, en la que se evidencia un comportamiento semejante al encontrado por Villada aun cuando los métodos de obtención son diferentes, ya que en el estudio previo utilizan agua como solvente y liofilización como método de evaporación.
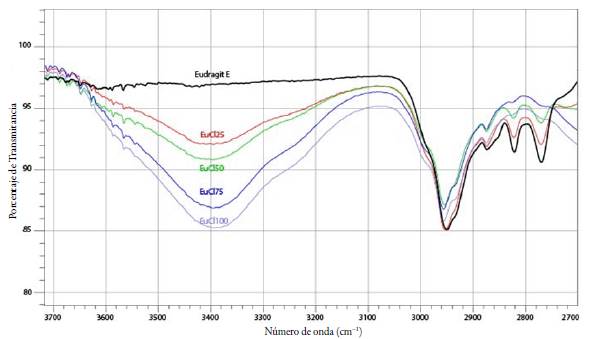
Figura 5 Espectro FTIR en el rango de 3700 cm-1 a 2700 cm-1 para Eu y los ionómeros EuCl25, EuCl50, EuCl75 y EuCl100.
En cuanto a la reducción de las bandas relacionadas con los grupos DMAE no protonados ubicadas en 2771 cm-1 y 2821 cm-1, Villada plantea la hidrólisis de estos grupos como una posible causa para este fenómeno; sin embargo, los espectros FTIR de los complejos EuB75 o EuB100 en los que no se adicionó HCl descartan esta teoría, pues las bandas en 2771 cm-1 y 2821 cm-1 también se reducen, aun cuando el B no favorece la reacción de hidrólisis, como lo evidenció la ausencia de la banda ancha en 3500 cm-1 de los espectros FTIR de EuB25, EuB50, EuB75 y EuB100.
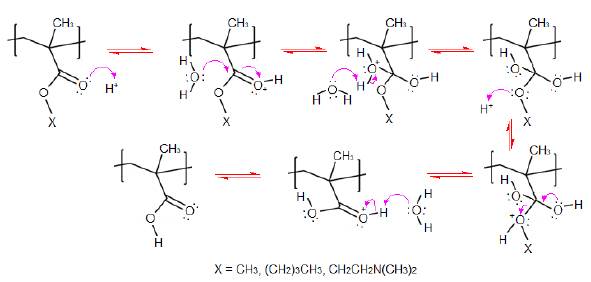
El proceso de hidrólisis de los grupos éster del polímero tiene lugar mediante sustitución nucleofílica, bajo el mecanismo de reacción ilustrado en la figura 6, de este se deduce que la presencia de un ácido fuerte, como el ácido clorhídrico, cataliza la hidrólisis, dando como resultado una mayor cantidad de grupos de ácido carboxílico [6], que se evidencian por la pronunciación de la banda OH en el espectro de FTIR. Para el método de obtención utilizado, se tiene que aquellos con mayor adición de HCl, cuentan con mayor disponibilidad de agua en la reacción, puesto que el volumen de agua involucrado en la metodología proviene únicamente de la solución de HCl (a concentración constante) y del solvente orgánico (etanol al 96 %), el cual fue el mismo en todos los casos.
En cuanto a los productos asociados a la reacción de hidrólisis de los grupos éster del polielectrolito, se deduce la formación de metanol, n-butanol y 2-(dimetilamino)-etanol. Para estos, se presume su evaporación en el posterior proceso de secado, sin embargo, es de suma importancia el desarrollo de los respectivos estudios que determinen o descarten su presencia o efecto en los complejos o ionómeros obtenidos.
Calorimetría diferencial de barrido (DSC)
El comportamiento térmico de todas las muestras se presenta en la figura 7. En el termograma de B se observa un pico bien definido con temperatura de inicio en 118 °C y un máximo de pico a 124,6 °C correspondiente a la transición termodinámica de primer orden debida al proceso de fusión, este resultado está en línea con la temperatura de fusión (Tf) reportada para B (122 °C) [16]; en el rango de temperatura evaluado no se observa ningún proceso de descomposición para el ácido benzoico [17].
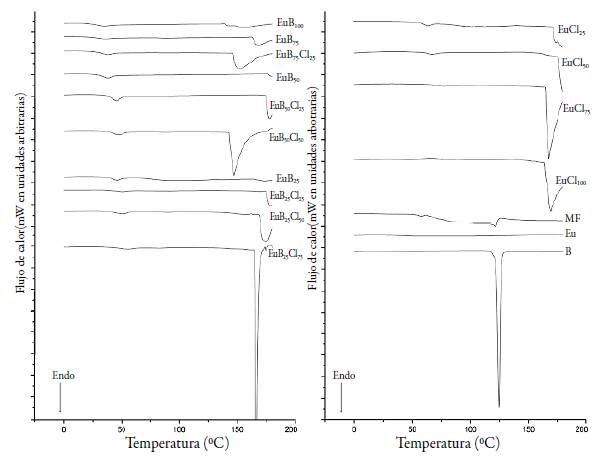
Figura 7 Termogramas de los diez complejos, los cuatro ionómeros, reactivos de partida y mezcla física (MF).
El resultado para el polímero Eu corresponde al segundo ciclo de calentamiento de la muestra, ya que en el primero se observó un pico endotérmico debido a la entalpía de relajación del polímero; fenómeno cinético que refleja el estado de las cadenas poliméricas a condiciones de almacenamiento inferiores a su temperatura de transición vítrea (T g ), en específico para aquellos en los que el enfriamiento del polímero es tan rápido que las cadenas no tienen la oportunidad de encontrar orientaciones energéticamente favorables antes de solidificarse [18]. Para la determinación de la T g se calculó la segunda derivada del flujo de calor, en este caso 42,0 °C, valor que se encuentra dentro del rango declarado por el fabricante (45 °C ± 5 °C) [1]. El perfil de DSC de la mezcla física presentó dos picos endotérmicos: el primero asociado a la T g de Eu a una temperatura de 58,0 °C y el segundo pico a 121,6 °C, relacionado con el proceso de fusión del ácido benzoico, que a diferencia del compuesto puro contó con una base de pico bastante amplia, incluso con temperatura de inicio en 62,0 °C y con una intensidad mucho menor de la esperada, este fenómeno ha sido reportado para mezclas físicas de estudios semejantes [2, 14, 19, 20]; este efecto es atribuido a la interacción in situ entre el polímero y el compuesto activo, favorecida por las condiciones del análisis del DSC que se asemejan a las de obtención de CPE por el método de extrusión por fusión, que ha demostrado gran utilidad en la formación de la interacción iónica [19].
Para todos los termogramas de los complejos se observa un pico endotérmico de baja intensidad a valores de temperatura entre 33 °C y 58 °C asociado al Eu, asimismo se observa la ausencia del evento correspondiente al proceso de fusión de B, evidenciando una distribución a nivel molecular del activo en el polímero. En el fenómeno endotérmico suceden de modo concomitante los eventos de relajación y de transición vitrea del polímero, ya que ocurre un descenso de línea base (típico de la transición vítrea), después del pico endotérmico (asociado a la relajación entálpica), a pesar de ello no se determinó la T g en un segundo ciclo de análisis térmico, puesto que la formación de los CPE se favorece con el aumento de temperatura, de modo que un termograma obtenido en un ciclo adicional de calentamiento puede reflejar los procesos que tienen lugar en el primero y no los resultados asociados a la propia obtención de los complejos.
La determinación de la T g se realizó mediante el cálculo de la segunda derivada, cuyos resultados se presentan en la tabla 3, en la que además se incluye la información para Eu, la mezcla física y la T f relacionada con el ácido benzoico. Como tendencia general se observa que el contraión benzoato genera una disminución del valor de la temperatura de transición vítrea, mientras que el contraión cloruro favorece su aumento. El efecto del contraión benzoato está en línea con lo reportado en estudios previos [2, 21-25], en los que la adición de compuestos orgánicos a polímeros reduce el valor de su temperatura de transición vítrea, fenómeno atribuido a un efecto plastificante que tiene lugar por la ubicación de moléculas del compuesto de bajo peso molecular entre las moléculas del polímero. Esto conlleva a un aumento del volumen libre y al incremento de la movilidad molecular, afectando la disposición "enredada" (entanglement) de las cadenas y las fuerzas cohesivas entre ellas, de modo que una menor transferencia de energía es requerida para el paso del material de "vítreo" a "gomoso".
Tabla 3 Valores de T f y T g asociados a los termogramas obtenidos, para los complejos, compuestos de partida y mezcla física.
| T f (°C) | T g (°C) | |
|---|---|---|
| B | 124,6 | -- |
| Eu | -- | 42,0 |
| Mezcla Física | 121,6 | 58,0 |
| EuB25 | -- | 46,0 |
| EuB25Cl25 | -- | 51,6 |
| EuB25Cl50 | -- | 53,6 |
| EuB25Cl75 | -- | 57,3 |
| EuB50 | -- | 38,3 |
| EuB50Cl25 | -- | 45,0 |
| EuB50Cl50 | -- | 45,0 |
| EuB75 | -- | 36,7 |
| EuB75Cl25 | -- | 38,3 |
| EuB100 | -- | 33,3 |
| EuCl25 | -- | 63,3 |
| EuCl50 | -- | 67,9 |
| EuCl75 | -- | 75,0 |
| EuCl100 | -- | 83,7 |
Incertidumbre reportada para la medición de temperatura: 0,2 °C [26]. 712
La neutralización con ácido clorhídrico genera el efecto opuesto al observado con ácido benzoico: en todos los casos se mantiene o aumenta la temperatura de transición vítrea, comportamiento que está relacionado con el tamaño del contraión. En un estudio de indometacina en estado amorfo [27] se encontró que al aumentar el tamaño del contraión, la fuerza electrostática entre el catión y el grupo carboxilato del principio activo disminuía y a su vez el valor de la T g . Para los complejos obtenidos en este estudio, la neutralización con el ácido inorgánico genera aniones cloruro de bajo tamaño y por tanto con una interacción iónica de mayor fuerza con los grupos DMAE que la producida con los aniones benzoato, tales fuerzas heteromoleculares -de mayor magnitud a las interacciones homomoleculares presentes en el polímero puro- ocasionan un incremento en la densidad del material y reducción del volumen libre, que se reflejan en mayores temperaturas necesarias para superar la transición vítrea.
Para confirmar el efecto del contraión cloruro en la T g , se analizaron los resultados obtenidos para los cuatro ionómeros y se compararon con los reportados en dos estudios previos. En la figura 8 se presentan los datos de las tres investigaciones, en esta se observa que para todos los casos el valor de T g aumenta a medida que se incrementa el grado de neutralización del polímero con ácido clorhídrico, pese a ello, existen diferencias de hasta 50 °C en los resultados. Villada et al. [6] atribuyen la disminución de sus valores, respecto a los de Guzmán et al. [14], a la hidrólisis de los grupos DMAE que conlleva a la disminución en la cantidad de puentes salinos que pueden formar los materiales y sugieren utilizar otra metodología que no promueva la reacción de degradación del polímero, no obstante, en el presente estudio se utilizó la misma metodología de Guzmán y como lo indican los espectros de FTIR la hidrólisis de los grupos DMAE también tuvo lugar, por tanto, se presume que la reacción de hidrólisis en los complejos obtenidos por Guzmán et al. también ocurrió, aunque no fue reportada, de modo que la hipótesis de Villada et al. para explicar las diferencias entre valores de T g es desestimada.
Es importante señalar que la transición vítrea, bien conocida por representar un "salto" en la capacidad calorífica (Cp), es una transición que no va acompañada de una entalpia propia, por ello el fenómeno es similar a una transición termodinámica de segundo orden, pero no es una transición termodinámica verdadera, pues depende del tiempo [28], es así como algunos parámetros de análisis como la velocidad de calentamiento afectan drásticamente el valor de T g , de hecho en el estudio desarrollado por Qi Sheng et al. [24] se observó un aumento de hasta de 20°C en la temperatura de transición vítrea al pasar de 5 °C/min a 100 °C/min, dado que una mayor rampa de calentamiento no proporciona el tiempo suficiente para el movimiento de las cadenas poliméricas y desencadena en valores de Tg mayores.
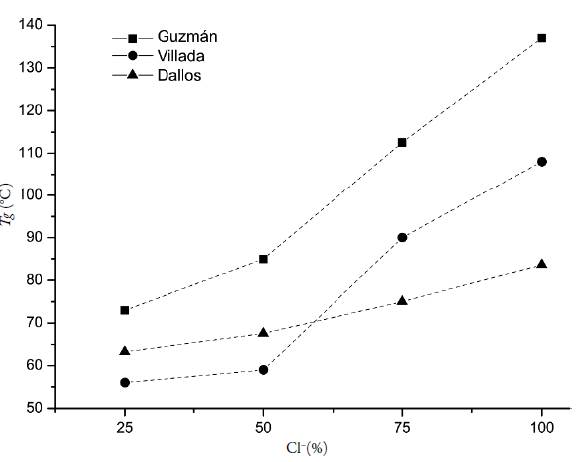
Figura 8 Temperaturas de transición vítrea T g para los ionómeros EuCl(25-100) reportadas por los autores: (■) Guzmán [14], (•) Villada [6] y los obtenidos en el presente estudio (▲) (Dallos).
Asimismo, la técnica de DSC utilizada, juega un papel fundamental en el estudio de la transición vítrea: en el reporte de Villada et al. [6] inicialmente la determinan mediante DSC convencional y obtienen resultados muy similares a los graficados en la figura 8 como "Dallos", pero cuando reproducen los análisis en DSC modulado obtienen valores de mayor magnitud. En este sentido, las diferencias entre los resultados de los tres estudios pueden explicarse como el producto de las divergencias en los análisis, ya sea por rampa de calentamiento, técnica de análisis, número de ciclos calentamiento-enfriamiento, entre otros.
En cuanto a los termogramas presentados en la figura 7, vale la pena señalar una particularidad observada para los complejos y los ionómeros, en los que se presenta un pico endotérmico hacia la parte final de cada análisis, este pico es menos evidente para aquellos complejos en los que la neutralización de los grupos DMAE fue realizada únicamente con ácido benzoico, pero para los termogramas de los sistemas que contaron con una neutralización adicional con HCl el fenómeno endotérmico ocurrió con una mayor intensidad, tal como se observa para el complejo EuB25Cl75 en el que se presenta un pico bien definido y bastante pronunciado.
En la tabla 4 se resume la información de temperatura máxima a la que sucede el evento endotérmico descrito y el valor del flujo de calor registrado para tal temperatura, asimismo en la figura 9 se representan tales resultados de temperatura en función de la composición para los diez complejos en estudio, a partir de estos se puede afirmar que -con la única excepción del complejo EuB25 en el que el fenómeno descrito fue casi imperceptible- a mayor porcentaje de neutralización de los grupos DMAE del polímero el evento endotérmico tuvo lugar a una menor temperatura.
Tabla 4 Valores de temperatura y flujo de calor asociados al evento endotérmico presente la parte final de los termogramas.
| Temperatura del evento endotérmico (°C) | Flujo de calor asociado (mW) | |
|---|---|---|
| EuB25 | 173,0 | -2,26 |
| EUB25C125 | 178,7 | -4,41 |
| EuB25Cl50 | 175,3 | -9,09 |
| EUB25CI75 | 166,3 | -69,77 |
| EuB5o | 180,0 | -2,73 |
| EuB50Cl25 | 177,3 | -7,45 |
| EuB5oCl5o | 147,0 | -12,06 |
| EuB75 | 168,6 | -4,41 |
| EuB75Cl25 | 151,6 | -5,75 |
| EuB100 | 154,3 | -3,28 |
| EuCl25 | > 180 | N. A. |
| EuCl50 | > 180 | N. A. |
| EuCl75 | 167,7 | -19,51 |
| EuCl100 | 169,3 | -13,72 |
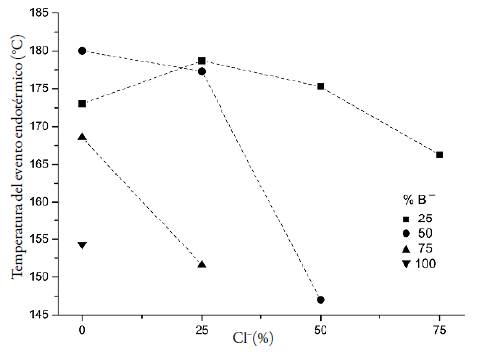
Figura 9 Temperaturas del evento endotérmico para los complejos EuB25Clx(■), EuB50Clx (•), EuB75Clx (▲) y EuB100 (▼). En el eje X se presenta el porcentaje de grupos DMAE neutralizado con ácido clorhídrico.
Generalmente, el evento endotérmico descrito es adjudicado a la presencia de transiciones relacionadas con la mezcla de las diferentes especies del polímero: fracciones de cadena corta, cadenas largas, secciones entrecruzadas, entre otros [15]; en este sentido es posible que la hidrólisis del polímero descrita en el análisis de FTIR de lugar a las especies químicas mencionadas y por ello el pico endotérmico es de mayor intensidad cuando hay una mayor cantidad de ácido clorhídrico involucrado en el proceso de obtención del complejo. Pese a ello, es viable que el fenómeno endotérmico esté relacionado con otra reacción de degradación del polímero como la ciclación; en estudios previos [8, 29] se ha reportado para Eu la formación de un anhídrido cíclico de seis miembros inducido térmicamente a temperaturas superiores a los 180 °C, cuya reacción se presenta en la figura 10.
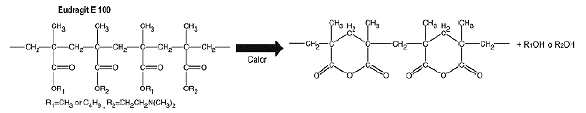
Figura 10 Formación del anhídrido cíclico de seis miembros en Eudragit* E 100. Fuente: adaptado de Shan-Yang Lin [29].
La reacción intramolecular reportada en los estudios de Lin et al. [29] ocurre vía condensación de ésteres sin adición de ningún iniciador o catalizador, únicamente requiere del proceso de calentamiento; su hallazgo fue realizado en un equipo de micro espectroscopía de infrarrojo con transformada de Fourier acoplado a calorimetría diferencial de barrido (FTIR/DSC) y consistió en el rastreo de la desaparición de las bandas de infrarrojo de los grupos de DMAE y la aparición de bandas en 1801 cm-1 y 1763 cm-1 asociadas al grupo carbonilo y de la banda 1007 cm-1 correspondiente al estiramiento asimétrico C-O-C, todas ubicadas a la longitud de onda característica de compuestos anhídridos.
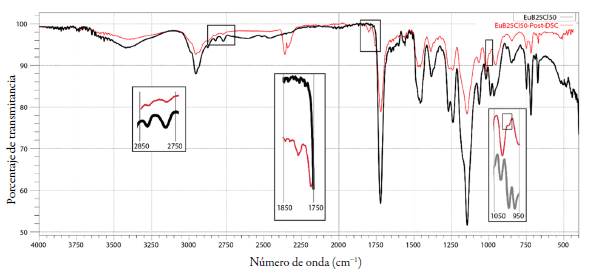
El mecanismo de reacción bajo el cual se rige aún no ha sido caracterizado, sin embargo, por tratarse de un proceso mediado por calor es bastante probable que la reacción sea favorecida si los sustituyentes R1 y R2 de la estructura del Eu son de menor tamaño, es decir para los complejos en los que se demostró mediante FTIR un mayor grado de hidrólisis y en los que algunos de los sustituyentes R1 y R2 han sido reemplazados por el grupo -OH. Para corroborar esta teoría se realizó el análisis de infrarrojo luego de realizado el estudio de DSC para las muestras de los complejos EuB25Cl25, EuB25Cl50 y EuB50CL25.
La selección de estos complejos obedeció a la necesidad de rastrear las bandas en 2822 cm-1 y 2770 cm-1 correspondientes a DMAE, pues en el espectro inicial de FTIR de estos complejos aún se observan estas bandas ya que en su composición no se realiza la neutralización del cien por ciento de los grupos protonables del polímero. El espectro de FTIR de los tres complejos arrojó resultados muy semejantes. En la figura 11 se presentan los resultados para EuB25Cl50, en este se observan los cambios relacionados con la formación del anhídrido cíclico: por un lado, se desvanecen las bandas del DMAE y por otro aparecen aquellas en 1801 cm-1, 1757 cm-1 y 996 cm-1. En este sentido es posible adjudicar el evento endotérmico observado en la parte final de cada termograma a la reacción de ciclación intramolecular, que se favorece para aquellas composiciones en las que ha ocurrido el proceso de hidrólisis, de allí que los complejos con mayor porcentaje de grupos cloruros como contraión presentan el evento a una menor temperatura y con una mayor intensidad.
CONCLUSIONES
El análisis de FTIR de los ionómeros y de los complejos obtenidos entre Eu y B demostró una estrecha relación entre la proporción de ácido clorhídrico adicionada en el proceso de obtención y la formación de la banda -OH, indicadora del proceso de hidrólisis de los grupos ésteres del polímero, aun cuando la preparación se realizó en medio orgánico. Asimismo, el estudio de los resultados de DSC evidenció la presencia de un evento endotérmico entre 147 y 180 °C, el cual fue asociado a la formación del anhídrido cíclico de seis miembros en el polímero, que ocurrió a valores de menor temperatura cuando los sistemas analizados contaban con un proceso de hidrólisis de mayor magnitud (según los espectros de FTIR).
Estos resultados revelan el efecto del contraión cloruro en la estructura del PE, cuando se lleva a cabo la obtención de complejos o ionómeros por la metodología de evaporación de solvente y son de gran importancia debido a que existen múltiples investigaciones de CPE con Eudragit® E 100 en las cuales no se ha tenido en cuenta la posible influencia de la hidrólisis, de los grupos ésteres del polímero, en las diversas variables evaluadas.