INTRODUCCIÓN
La planta del género Cannnabis es utilizada mayoritariamente como droga de consumo por su efecto psicotrópico. Sin embargo, el estudio de los componentes de esta planta ha revelado que también tiene efecto terapéutico; lo cual ha llamado la atención de la comunidad científica a nivel nacional e internacional. De acuerdo con los reportes de diferentes autores se han encontrado alrededor de 500 compuestos orgánicos pertenecientes a la especie Cannabis sativa.
Los compuestos de mayor importancia son los cannabinoides terpenofenólicos, los cuales hacen parte de la secreción resinosa producida por los tricomas de la inflorescencia femenina de la planta [1]. De los metabolitos anteriores han sido aislados alrededor de 70 compuestos [2-4], siendo el A9 -tetrahydrocannabinol (Δ9 -THC) el que presenta mayor efecto alucinógeno, pero también se le ha asociado acción terapéutica sobre algunas enfermedades.
La comercialización de productos farmacéuticos a base de marihuana ha experimentado un aumento significativo en los últimos años debido a las propiedades terapéuticas que presentan estas biomoléculas para tratar diferentes enfermedades y síntomas tales como el dolor, epilepsia, trastornos alimentarios y glaucoma; debido a esto la industria farmacéutica mundial ha realizado numerosos estudios para el desarrollo de fármacos a base de cannabis [6-13]. Canadá, Holanda y otros países europeos aprobaron la distribución de medicamentos (Sativex, Dronabinol) en el tratamiento de enfermedades crónicas como esclerosis múltiple y cáncer [6, 14].
En Colombia mediante Decreto número 613 emitido por la Presidencia de la República y el Ministerio de Salud y Protección Social (10 de abril de 2017) estipula el cultivo, uso, comercialización exportación e importación de productos de cannabis con fines médicos y científicos. En el departamento del Cauca es muy conocido el cultivo de la especie de Cannabis sativa específicamente en los municipios de Corinto, Caloto, Toribio y Jambaló. Esta especie ha mostrado mayor propiedad terapéutica, debido a esto asociaciones indígenas y también vendedores locales comercializan diversos preparados y extractos a base de cannabis. Sin embargo, estos son distribuidos en diferentes presentaciones las cuales no cumplen con los requisitos estipulados por la legislación colombiana para la producción y fabricación de productos de cannabis de acuerdo con la Resolución 1816 de 2016, la cual en el artículo 28 establece que estos deben contar con análisis de THC, CBN y CBD [15, 16].
Por lo anterior se ve reducida la Habilidad sobre el consumo de estos medicamentos al no ser claro su contenido y el posible efecto que puedan tener sobre las patologías para las cuales son formulados. Es por ello que se propone la determinación de dichos componentes mediante técnicas como cromatografía líquida de alta resolución (CLAR) y espectrometría de masas (EM) para identificar mediante estudios previos los diferentes compuestos cannabinoides presentes, lo cual permitirá establecer criterios confiables sobre el uso de estos productos. Los resultados obtenidos buscan potencializar la investigación sobre las propiedades de Cannabis sativa que se produce en el departamento del Cauca.
METODOLOGÍA
Toma de muestras de Cannabis sativa
Las muestras de Cannabis fueron suministradas por asociaciones indígenas del departamento del Cauca [Sannabis, "muestra E (líquida)"] y por el resguardo (huellas). Los cultivos para el procesamiento de estos productos se encuentran ubicados en el municipio de Corinto, Cauca, localización geográfica: latitud: 3.183, longitud: -76.267 3° 10' 59" Norte, 76° 16' 1" Oeste. La muestra D (crema) fue adquirida en las inmediaciones del Puente del Humilladero (Popayán, Cauca, Colombia) la cual fue suministrada por un vendedor local.
Pruebas de solubilidad
Se evaluó la solubilidad de las muestras y su comportamiento en diferentes disolventes (ACN: acetonitrilo, EtOH: etanol, agua, AcOEt: acetato de etilo y MeOH: metanol). Se adicionó 0,05 mg de muestra a cada uno de los solventes.
Preparación de muestras para análisis
Debido al estado físico de la muestra E, la cual presenta una textura viscosa se pesaron 359,9 mg y se solubilizan en 50 mL de ACN, de esta muestra se tomó un volumen de 5 mL y se aforó a 10 mL. Por último, de la anterior solución se tomó una alícuota de 280 µL y se llevaron a un volumen de 10 mL para obtener una concentración final de 100 ppm. La muestra D se preparó a partir de 297,1 mg en 50 mL de ACN, de esta solución 5 mL fueron aforados con ACN a un volumen de 10 mL y como en el caso anterior de esta muestra se tomó una alícuota de 340 µL y se llevó a un volumen final de 10 mL para una solución de cannabis con una concentración de 100 ppm. Cada una de las muestras para el análisis se pasó por un filtro de membrana de 0,22 µm.
Análisis por cromatografía líquida de alta resolución (CLAR)
Para el análisis cromatográfico se utilizó un sistema de cromatografía líquida de alta resolución (CLAR Waters 1325), el cual consta de una bomba binaria y sistema de detección UV-VIS Waters 1320, la adquisición de datos se realizó mediante el software Breeze 2.0. Columna analítica Waters C18 fase reversa, tipo de partícula esférica, Micro Bondapak 3,9 x 150 mm, tamaño de partícula 5 finí, tamaño de poro 100 Å, la fase móvil es una mezcla acetonitrilo-buffer fosfato 65/35, y el volumen de inyección 10 µL [14]. Una vez optimizadas las condiciones cromatográficas para la separación de los componentes de las muestras de cannabis, se realizó la separación por fracciones con el fin de realizar la identificación de sus componentes por espectrometría de masas (MS).
Liofilización de las fracciones obtenidas por CLAR
Las fracciones separadas por CLAR fueron concentradas en un liofilizador Labconco, temperatura de colector -50 °C, capacidad de retención de hielo 2,5 L, desplazamiento de la bomba de vacío 86 L/min. Se tomaron alícuotas de 1,5 mL de cada fracción y se colocaron en recipientes para centrifuga de 2 mL. En este proceso las muestras se dejaron durante dos días hasta obtener un sólido blanco, las condiciones empleadas para el análisis fueron: presión 0,470 mbar y temperatura de -51 °C. Las muestras liofiliza-das fueron disueltas en acetonitrilo y analizadas en el espectrómetro de masas. Para el análisis cromatográfico se adoptó la metodología reportada por Gámbaro et al. [14], los parámetros que se emplean son: composición de la fase móvil, la cual consta de una mezcla de acetonitrilo (ACN) y buffer fosfato (PO4)- a pH 5 en relación 65/35, flujo de fase móvil 1mL/min, presión 800 PSI, columna analítica C18 de fase reversa y la elusión de los analitos se realizó de forma isocrática.
Condiciones para el análisis por espectrometría de masas (MS)
Para el análisis por espectrometría de masas se empleó un sistema LCQ FLET (Thermo scientific), con ionización por Electrospray (ESI), analizador de trampa de iones [17]. Para el proceso de ionización su empleó un modo ESI de ionización positivo, energía de ionización 70 V, se utilizó como agente ionizante ácido fórmico 0,1% y el volumen de inyección de 0,2 µL/min. Fuente de ionización por electro spray 5,89 kV, corriente spray 4,27 µA, flujo de gas argón 31,02 L/min, flujo de gas auxiliar 5,99 L/min, voltaje de capilar 19,97 V, temperatura de 240,03 °C, lentes de tubo 59,97 V. Los datos son obtenidos a través del software Xcalibur 4.0. Los espectros de masas de las fracciones fueron analizados y comparados con la literatura para la identificación de sus componentes.
RESULTADOS Y DISCUSIÓN
Las muestras analizadas mostraron una mayor solubilidad en ACN y metanol, sin embargo, en este último resultaba una mayor cantidad de sólidos, razón por la cual el solvente más adecuado para el análisis de las muestras fue el ACN. Para realizar la determinación y comparación de cannabinoides en muestras de Cannabis sativa se emplearon dos tipos de productos en presentación para uso tópico y sublingual, dichas muestras se presentan como D y E respectivamente.
Para lograr las mejores condiciones de separación por cromatografía líquida de alta resolución, de las muestras, se evaluaron parámetros tales como: composición de la fase móvil ACN/PO4 (75/25, 55/45, 65/35), flujo de la fase móvil (1.5, 1.0, 0.5) mL/min, y longitud de onda (254, 220) nm. Se inyectaron las muestras D y E variando la composición de fase móvil. El aumento de la polaridad de la fase móvil en proporción 55/45 ACN/PO4 produjo la pérdida de algunas señales cromatográficas, también aumentó el tiempo de permanencia de los analitos en la fase estacionaria lo cual pudo ser un indicio de la poca afinidad de los compuestos presentes en la muestra con la fase móvil a estas condiciones de polaridad, presentándose un comportamiento similar en ambas muestras. La relación de fase móvil 75/25 ACN/PO4 permitió observar una mejor resolución de las señales cromatográficas. Con la relación 65/35 de ACN/PO4 se evidenció una mejora de las señales, mayor número de picos, buena separación y resolución de los mismos. Los tiempos de retención y orden de elución son similares a los reportados en el trabajo desarrollado por Gámbaro et al. [16].
Se evaluó el flujo de fase móvil a 1,5 mL/min, 1 mL/min y 0,5 mL/min respectivamente, para las muestras D y E. Para el primer ensayo (1,5 mL/min) se presenta una variabilidad significativa de la señal observándose solapamiento de los picos y poca resolución, la posible razón que se atribuye radica en que los analitos son arrastrados debido al alto flujo de fase móvil lo cual impide que estos interaccionen de forma efectiva con la fase estacionaria y se produzca la proximidad en la elusión y por consiguiente el solapamiento de las señales. El flujo de 0,5 mL/min presentó ensanchamiento de los picos y tiempos de retención demasiado largos. Para el flujo de 1 mL/min, la resolución de los picos mejoró significativamente las señales fueron más claras, lo cual permite identificar algunos picos con base a lo reportado por la literatura y relacionarlos según el orden de elusión con: CBD, CBN y THC.
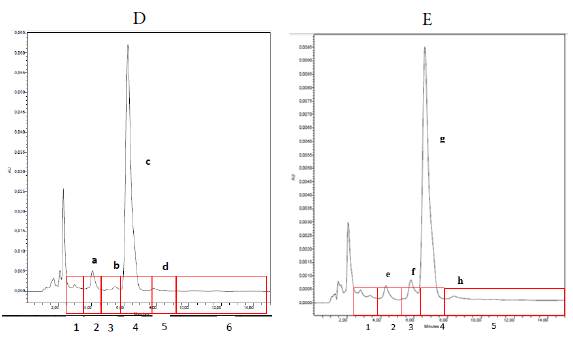
Se evaluó la mejor longitud de onda con la cual las moléculas cannabinoides absorben energía, para ello se trabajó a longitud de onda de 254 nm ya que algunos autores reportan detección de algunos tipos de cannabinoides a esta longitud de onda [18, 19]. La longitud de onda de 254 nm mostró picos cromatográficos simétricos y buena intensidad de las señales. Sin embargo, la longitud de onda de 220 nm mostró la mayor intensidad de los picos cromatográficos, lo cual significa lograr mayor sensibilidad. Según el trabajo de Gámbaro et al. [14], la longitud de onda a 220 nm es la energía óptima para que las moléculas cannabinoides absorban energía, esto se debe a la estructura química de estos compuestos y el tipo de insaturaciones, propias de anillos aromáticos y dobles enlaces en las estructuras de compuestos cannabinoides. Estos ensayos permitieron establecer las mejores condiciones cromatográficas de flujo 1 mL/min, fase móvil de ACN-buffer (PO4) pH 5, 65/35, longitud de onda λ =220 nm, presión 800 PSI, tiempo de corrida de 15 minutos y volumen de inyección de 10 µL. La figura 2 muestra los cromatogramas de las muestras D y E en las mejores condiciones establecidas.
Una vez establecidas las condiciones óptimas de trabajo como flujo, composición de fase móvil, longitud de onda, concentración de la muestra y reproducibilidad de las medidas, se calcularon parámetros cromatográficos con el fin de evaluar las velocidades promedio de migración de soluto, el factor de retención y coeficiente de selectividad de los analitos en la fase estacionara. Estos datos permiten comprender el comportamiento de los analitos durante la separación de los mismos.
El tiempo muerto (tm), el cual se define como el tiempo que tarda un analito no retenido en llegar al detector se determinó utilizando una solución de dicromato de potasio a una concentración de 0,1 N, para el cual se estableció un tiempo de retención tm = 2,029min. La determinación de los factores de retención y selectividad permitieron establecer los tiempos de retención y recolección de fracciones para el posterior análisis de cada una de ellas por espectrometría de masas. La tabla 1 muestra los tiempos de retención de cada compuesto presente en las muestras D y E, los cuales sirvieron como guía para la recolección de cada fracción.
Tabla 1 Resultados: velocidad lineal promedio de migración de los solutos, factor de retención del analito, factor de selectividad muestras D y E.
| Número de pico | Tiempo de retención (min) | Velocidad promedio de migración del soluto (cm/min) | Factor de retención |
|---|---|---|---|
| Muestra D | |||
| a | 4,066 | 3,691 | 0,791 |
| b | 5,450 | 2,753 | 1,412 |
| c | 6,235 | 2,411 | 1,763 |
| d | 7,785 | 1,932 | 2,455 |
| Relación de picos | Factor de selectividad | ||
| αb-a | 1,687 | ||
| αc-b | 1,229 | ||
| a d-b | 1,368 | ||
| Muestra E | |||
| e | 4,271 | 3,512 | 1,105 |
| f | 5,773 | 2,598 | 1,845 |
| g | 6,615 | 2,267 | 2,260 |
| h | 7,361 | 2,037 | 3,120 |
| Relación de picos | Factor de selectividad | ||
| αf-e | 1,669 | ||
| αg-f | 1,224 | ||
| αh-f | 1,381 | ||
La separación de los picos desde el punto de vista cromatográfico es razonable ya que se espera que el factor de selectividad sea superior a la unidad, razón por la cual fue posible separar en fracciones las señales de mayor interés en el cromatograma (figura 2). De acuerdo con los tiempos de retención se establecieron intervalos para la recolección de fracciones según los picos observados en el cromatograma; esto con el fin de poder identificar mediante espectrometría de masas (EM) los compuestos presentes en la muestra.
Se recogieron 6 fracciones cromatográficas a partir de la muestra D de la siguiente manera: fracción 1 (1,5-2,5 min), fracción 2 (2,5-3,5 min), fracción 3 (3,5-4,5 min), fracción 4 (4,5-5,5 min), fracción 5 (5,5 -7,5 min) y fracción 6 (7,5-15 min). En total se realizaron 15 inyecciones de la muestra, cada una con un tiempo de análisis de 15 minutos, recolectando el eluato de forma tal que la temperatura y la luz no afectaran la composición de la muestra. De cada una de las fracciones recolectadas se tomaron alícuotas de 2 mL para el análisis a través de espectrometría de masas, a las cuales se les adicionó ácido fórmico como agente ionizante de forma tal que la concentración de este en la muestra fuera de 0,1%.
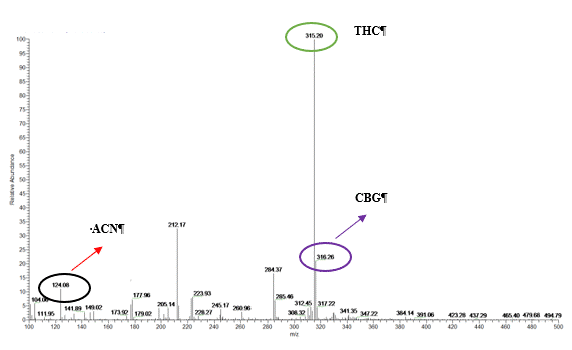
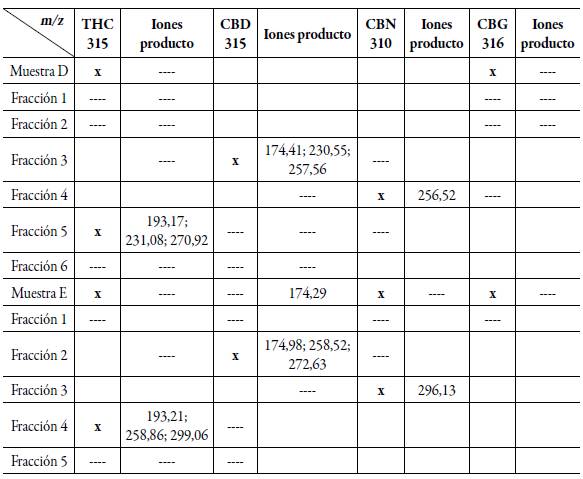
El análisis por (EM) se inició con la inyección de un blanco de ACN con el propósito de descartar todos aquellos posibles interferentes que se puedan dar en el análisis. El espectro obtenido presentó un pico con m/z =124,05 correspondiente a la molécula de ACN. Posteriormente, se inyectó una muestra del extracto de cannabis 10 mg/L (muestra D) con el objetivo de comprobar la presencia de compuestos pertenecientes a cannabis. Esta prueba arrojó resultados claros, se puede apreciar en mayor abundancia un pico con m/z =315,20 (figura 3) el cual posiblemente puede corresponder a los compuestos THC o CBD, también se observó un pico a m/z =316,26, que corresponde probablemente al compuesto CBG, esto de acuerdo con lo reportado por Tassi et al. [20] y otra señal a m/z =124.,08 el cual corresponde al solvente utilizado (ACN).
Como se puede apreciar en el espectro de masas de la figura 3, la muestra D contiene compuestos de tipo cannabinoides, como THC o posiblemente CBD, los cuales por su estructura poseen el mismo peso molecular siendo el patrón de fragmentación el parámetro que permitió diferenciar entre estos dos compuestos o mezcla racémica de los mismos [1, 2, 21, 22].
Las fracciones recolectadas y liofilizadas fueron inyectadas en el espectrómetro de masas desde la fracción 1 hasta la fracción 6 de la muestra D. El espectro de masas para la fracción 1 no mostró señales que pertenezcan a algún cannabinoide. Para la fracción 2 en el cromatograma se observó un pequeño pico, tiempo de retención comprendido entre 2,5-3,5 minutos, su espectro de masas no mostró correspondencia con algún metabolito cannabinoide. El anterior resultado es coherente ya que la intensidad de la señal en el cromatograma es muy poca. Con relación al pico m/z = 370,80 se ha identificado según la base de datos Nist como un posible contaminante presente en la muestra el cual puede tratarse del compuesto LOXYNIL C7H3I2NO, m/z = 370,9138 [23, 24]. Los espectros de las fracciones 3 hasta la 5 se muestran en la figura 4 ya que para la fracción 6 no se encontraron señales que puedan ser asociadas a algún compuesto de cannabis. De acuerdo con el cromatograma de la muestra D, la fracción comprendida en el intervalo entre 3,5-4,5 minutos (fracción 3), aparece un pico el cual puede ser relacionado según el cromatograma reportado para muestras cannabinoides y de acuerdo con el orden de elución de los analitos, con la molécula de CBD.
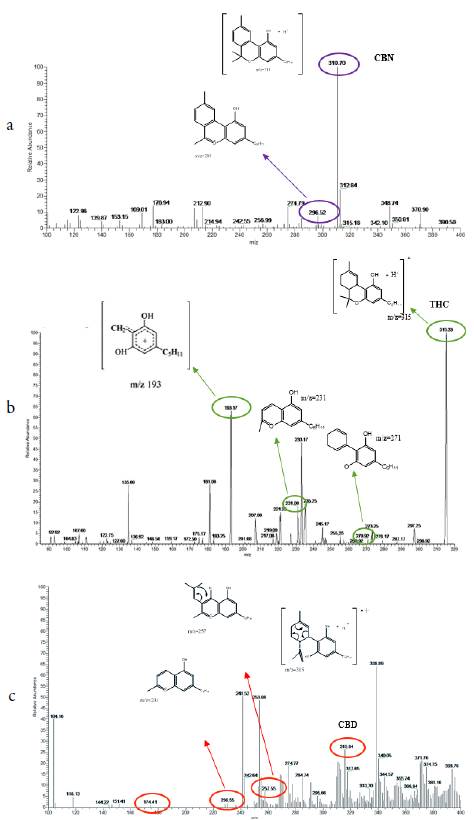
En la figura 4a se muestra el espectro de masas para esta fracción donde se puede apreciar un pico con m/z =315,64 el cual según lo reportado por Tassi et al. [20] puede tratarse de la molécula de THC o CBD. Esta discrepancia puede resolverse desde el punto de vista de los posibles fragmentos que se puedan generar, al analizar este factor se pueden ver picos altos m/z =174,41; 230,55 y 257,56 los cuales corresponden a fragmentos de la molécula de CBD. Este hecho sugiere basado en el patrón de fragmentación para esta molécula [25, 26], que posiblemente en la muestra D se encuentre presente el compuesto CBD en una pequeña cantidad, lo cual está de acuerdo con la baja señal observada en el cromatograma y la pequeña abundancia de los picos en el espectro de masas.
En la fracción 4 del cromatograma hay un pico pequeño el cual puede ser asociado a la molécula de CBN, el espectro de masas de esta muestra (figura 3b) corrobora este hecho ya que se obtiene una señal a m/z = 310,70 y otro pico muy importante para m/z =296,52 que corresponde al patrón de fraccionamiento [3, 27] de la molécula de CBN. Esto concuerda con el cromatograma para esta fracción ya que el pequeño pico correspondiente al tiempo de retención 4,5-5,5 minutos está relacionado con este compuesto. De esta manera se puede establecer la identidad de la molécula CBN y su presencia en la muestra.
También está presente un pico de una abundancia relativamente pequeña m/z =315,18 esto se puede explicar desde el punto de vista de la proximidad de los picos en la separación cromatográfica o también por el hecho que el THC presenta características termolábiles y fotolábiles o puede presentar una disminución del contenido de THC a través de la oxidación a CBN [28]. Para la fracción 5 con tiempo de retención en el intervalo comprendido entre 5,5-7,5 minutos se tiene el pico con mayor intensidad en el cromatograma, y de acuerdo con los trabajos realizados por Gámbaro, Jamwal, Mechtler y sus respectivos colaboradores [14, 29, 30] corresponde a la molécula de THC. Lo anterior se fundamenta en que el componente mayoritario de las muestras de Cannabis es el THC, esto se comprobó con el espectro de masas obtenido para esta fracción (figura 3c) donde se presenta un pico con m/z =315,02. Como ya se mencionó, hay dos alternativas, puede tratarse de THC o CBD.
Como en los casos anteriores, el parámetro que permite identificar la molécula son las fragmentaciones características de cada una de ellas, en este caso para el compuesto THC existen dos tipos de isómeros para este compuesto, uno el Δ 1-2 THC, y el Δ 1-6 THC. Como se puede apreciar en el espectro de masas para esta fracción se presentan picos a m/z =270,92, 231,08 y el más importante a considerar m/z = 193,17, estos se relacionan con el patrón de fragmentación perteneciente a THC [29-34]. Lo anterior permite deducir que en la muestra posiblemente se encuentra presente el isómero Δ 1-6 THC. En la fracción 6 de la separación cromatográfica, comprendida en el intervalo 7,5-15 minutos, no se presentaron compuestos cannabinoides.
De acuerdo con los resultados de cada una de las fracciones, las cuales fueron analizadas por espectrometría de masas, se puede afirmar que la muestra D presenta los metaboli-tos cannabinoides asociados a posibles efectos benéficos sobre la salud en el tratamiento de diferentes patologías como ha sido reportado a través de diversos estudios a nivel mundial [35-41]. En este caso se encontró que la muestra contiene los compuestos CBD, CBN y en mayor cantidad THC como era de esperarse según lo reportado por la literatura, además se verificó en el análisis cromatográfico y en la espectrometría de masas que en la muestra se presenta una mayor abundancia para el compuesto con m/z = 315, el cual corresponde a la molécula de THC. Sin embargo, desde otro punto de vista, esto representaría un punto de controversia ya que el compuesto THC, a pesar de tener efectos beneficiosos sobre la salud, tiene un elevado efecto psicotrópico, esto desde el punto de vista legal podría ser una limitante para la fabricación de este tipo de productos y más aún si estos no cuentan con ningún tipo de prescripción médica ni contenido de la composición detallada de los compuestos de tipo cannabinoides presentes en el producto.
El análisis de la muestra D se hizo empleando las mismas condiciones cromatográficas e inyecciones de la muestra a una concentración de 100 mg/L. El cromatograma (figura 2) de la muestra E presenta características similares al cromatograma de la muestra D, sin embargo, puede apreciarse una diferencia en cuanto a la intensidad de los picos con relación al compuesto CBD, ya que su intensidad es considerablemente más pequeña que la obtenido en la muestra D, esto puede ser indicativo de una menor cantidad de este compuesto en la muestra. Es importante destacar que cada una de las inyecciones para la recolección de las fracciones presentó reproducibilidad de las señales y tiempos de retención, los cuales fueron definidos para la obtención de las fracciones.
De forma similar a lo realizado con la muestra D se calcularon los parámetros cromato-gráficos con base en el cromatograma obtenido para la muestra E (figura 2). Respecto a los datos obtenidos de factor de retención (1,105-3,120) y factor de selectividad (1,224-1,669), estos son muy similares a los de la muestra D en relación a magnitud ya que en ambas muestras los cromatogramas son similares. Sin embargo, se muestra una ligera variación en cuanto a la retención relativa de la muestra E ya que para el último pico este se encontraría más retenido a la fase estacionaria lo cual puede ser explicado de acuerdo con la polaridad de la especie presente en esta parte del cromatograma. Para la muestra E se recogieron las siguientes fracciones: fracción 1 (2,5-3,5 min), fracción 2 (3,5-5,0 min), fracción 3 (5,0-6,0 min), fracción 4 (6,0-8,0 min), fracción 5 (8,0 -15 min). El análisis del espectro de masas de la muestra E se inició con la inyección de un blanco de ACN, esta es la fase móvil de trabajo, en el espectro de masas de dicha muestra no se observan picos de importancia a excepción del pico con m/z = 124,08, el cual como ya se mencionó corresponde al solvente.
Los resultados para esta fracción son los esperados, teniendo en cuenta que el cromatograma de la muestra E (figura 2) los picos son de una intensidad muy baja e incluso menores en intensidad a la señal del solvente. De forma similar a lo experimentado con la muestra D, se efectuó la inyección de una muestra de cannabis (muestra E) con el fin de identificar los componentes presentes, este fue un indicio para la recolección de las fracciones. Los resultados del espectro de masas de esta muestra mostraron picos a m/z =315,72 para el cual existe la posibilidad que se trate de las moléculas THC o CBD. También se observaron picos para m/z =316,79 y 310,80, los cuales están asociados a CBG y CBN respectivamente.
El espectro de masas de la fracción 1 de la muestra E presentó un pico prominente a m/z = 370,55, el cual posiblemente este asociado a un contaminante como se mencionó anteriormente. De acuerdo con los resultados para esta fracción son coherentes con los picos presentes en el cromatograma para la muestra E ya que no se presenta un tipo de pico con una absorción intensa en esta región del cromatograma 2,5-3,5 minutos. El espectro de masas de la fracción 2, para el cual se apareció un pico para m/z = 315, puede estar relacionado con la molécula de THC o CBD, sin embargo, de acuerdo al cromatograma para esta muestra, indica que para la fracción 2 probablemente esté presente el compuesto CBD de acuerdo con la elución analizada. Lo anterior se pudo comprobar al estudiar su espectro de masas ya que se presentan fragmentaciones típicas para este compuesto a m/z = 174,98; 258,52 y 272,63, lo cual permite comprobar la existencia de este compuesto en la muestra de acuerdo con su patrón de fragmentación.
Respecto a los espectros de la fracción 3 muestra D y la fracción 2 muestra E, los cuales están relacionados con la misma molécula CBD se puede apreciar que para el primero aparentemente habría una mayor cantidad del cannabinoide debido a que la señal es más abundante para el pico a m/z = 315, sin embargo, las fragmentaciones de este son de poca intensidad si se relacionan con la muestra E, fracción 2, para la cual la intensidad de m/z = 315 es inferior, esto puede ser indicativo de que la mayor parte de la molécula se rompe para generar este tipo de iones. Al comparar estos resultados se obtiene una mayor abundancia del cannabinoide CBD en la muestra D, esto puede estar asociado a diversos factores como la edad de la planta, condiciones ambientales, condiciones de extracción o el almacenamiento que haya tenido el material vegetal hasta la elaboración del producto.
Desde el punto de vista terapéutico esto es importante ya que la muestra D a pesar del alto contenido de THC tiene mayor cantidad de CBD en comparación con la muestra E; el CBD no presenta efectos de droga sobre el consumidor, pero si presenta efectos beneficiosos sobre pacientes con problemas como falta de sueño, pérdida de apetito y también en enfermedades como la esclerosis múltiple [36, 42]. En la fracción 3 de la muestra E se presentó un pico con m/z = 310,81, que corresponde a la molécula de CBN, y un pico con m/z = 295,13 el cual guarda relación con este compuesto ya que es una fragmentación del mismo, este tipo de comportamiento valida el hecho de que en la fracción obtenida por CLAR en el intervalo de 5-6 minutos se encuentra presente el compuesto CBN. Esta señal cromatográfica está relacionada con esta biomolécula.
En este orden de ideas si se comparan los resultados de las muestras E y D para el compuesto CBN, el cromatograma para la muestra E muestra una mayor intensidad de pico lo cual se ve reflejado en el espectro de masas para la fracción 3, mostrando mayor abundancia del pico característico y la fragmentación perteneciente a este compuesto, esto representa posiblemente una mayor abundancia de CBN en la muestra E.
En la fracción 4 del análisis cromatográfico, en el intervalo de tiempo que abarca de 6-8 minutos, se encontraron picos correspondientes a la molécula de THC con m/z = 315,17 y los tipos de fragmentaciones que confirman la presencia de este compuesto a m/z = 193,21, 258, 66 y 299,06, comprobando de esta manera que en la fracción se encuentra el compuesto THC y que de acuerdo con este patrón de fragmentación se trataría del isómero Δ 1-6 THC [33].
La baja abundancia de los picos puede indicar una menor cantidad del compuesto THC en la muestra E, desde el punto de vista cromatográfico, esto no concuerda con la intensidad de dicho pico en este intervalo de tiempo de retención, ya que se presenta como un pico agudo y de un área relativamente superior al resto de señales, lo cual lleva a pensar la influencia de la estabilidad de la muestra ya que parte del THC se puede transformar a CBN. Esto tendría sentido ya que como se analizó la cantidad de CBN es considerablemente alta para la muestra E si se tiene en cuenta la señal que se presenta, o simplemente la cantidad de este compuesto en la muestra E es inferior al observado en la muestra D.
Lo anterior es una variable de gran importancia a considerar ya que el producto tendría una menor eficiencia sobre el tratamiento para el cual es formulado, teniendo en cuenta que el THC a pesar de su efecto psicoactivo tiene una acción sinérgica con el compuesto CBD sobre el tratamiento de algunas enfermedades específicas como falta de sueño, pérdida del apetito entre otras [43]. De acuerdo con esto representaría una limitante desde el punto de vista que este producto no cumpliría con la acción y efecto con el cual es comercializado. Para la fracción 5 presentó un pico para m/z = 124,02, el cual corresponde a la fase móvil ACN. Partiendo del hecho de que los resultados del análisis espectrométrico sugiere que posiblemente estaría presente el isómero A 1-6 THC en las dos muestras comerciales estudiadas, esto implicaría que dichas muestras tendrían un efecto sobre el tratamiento de patologías cardíacas como también sobre trastornos como la falta de apetito o pérdida del sueño según estudios realizados por Li y Grotenhermen, Russo, Velasco et al. [38, 44, 45], lo cual representa un aspecto positivo sobre el uso de estos productos. Teniendo en cuenta que los cromatogramas obtenidos para las dos muestras analizadas en este estudio son similares en cuanto a variables como intensidad y tiempos de retención, se pudo encontrar a través del análisis de espectrometría de masas que se presentan variaciones en cuanto al contenido de THC, CBD y CBN en las muestras. Con base en los resultados ya mencionados relacionados con la presencia de compuestos de tipo cannabinoides en las dos muestras estudiadas, para hacer más claro el análisis realizado para cada una de las fracciones obtenidas por CLAR en la tabla 2 se presentan las masas específicas y fragmentaciones obtenidas para cada compuesto.
CONCLUSIONES
Se logró identificar mediante la implementación de cromatografía líquida de alta resolución y espectrometría de masas los compuestos THC, CBD, CBN, esto fue posible al comparar los resultados con estudios publicados sobre este tipo de compuestos, lo cual representa una buena aproximación para conocer la composición real en dos muestras comerciales de Cannabis sativa producidos en el departamento del Cauca.
La comparación entre los cromatogramas obtenidos para las dos muestras estudiadas y el reportado en la literatura fue el primer indicio para determinar la identidad de los compuestos cannabinoides, ya que proporcionó las bases que permitieron relacionar datos con los obtenidos experimentalmente y de esta manera poder establecer en primera medida la existencia de estos compuestos.
El análisis por espectrometría de masas fue fundamental para la identificación de los compuestos cannabinoides ya que mostró señales en el espectro de masas características para estos metabolitos, lo cual permitió establecer criterios a partir de la masa específica para cada compuesto y las fragmentaciones que permiten elucidar la estructura de una molécula afirmando su existencia y abundancia de estos compuestos en la muestra. Se pudo determinar cualitativamente de acuerdo con los patrones de fragmentación y la abundancia de los picos para THC, que la muestra D posiblemente presenta un mayor contenido de este cannabinoide, pero en menor proporción CBD. Según los patrones de fragmentación se tiene que en las dos muestras analizadas posiblemente se encuentre el isómero Δ 1-6 THC el cual según estudios reportados presenta actividad sobre enfermedades cardiacas y en específico sobre afecciones sobre el sistema circulatorio, por lo tanto, las muestras analizadas posiblemente tendrían algún efecto sobre el tratamiento de estas enfermedades. Se logró identificar mediante el patrón de fragmentación que el compuesto CBN, al igual que THC y CBD están presentes en ambas muestras, sin embargo, de acuerdo con la abundancia de los picos para CBN este compuesto estaría presente 56 veces en mayor proporción en la muestra E lo que implicaría que esta muestra presente mayor actividad para este metabolito en comparación con la muestra D.