INTRODUCCIÓN
La proteína sericina es un polímero natural producido por el gusano de seda Bombyx mori [1]. Esta glicoproteína es soluble en agua y es 25%-30% del peso del capullo; además actúa como un adhesivo que une dos filamentos de fibroína para formar el hilo de seda [1,2]. La molécula es hidrófila con un peso molecular que varía de 20 a 400 kDa y consta de 18 aminoácidos (incluidos los esenciales). Los grupos polares (grupos carboxilo, hidroxilo y amino) de las cadenas laterales de aminoácidos y su composición orgánica, solubilidad y la organización estructural permite la reticulación, las copolimerizaciones y las combinaciones con otros polímeros, que en conjunto transmiten propiedades únicas a la sericina, que hacen de esta un producto antioxidante, hidratante, cicatrizante, antibacteriano, con protección antimicrobiana, que también protege de la radiación ultravioleta y es antitumoral [3-5].
Con el desarrollo de la sericultura en Cuba, la producción de derivados del gusano de seda está en auge, entre ellos el hidrolizado de sericina, materia prima de la industria cosmética [6]. El Centro Nacional de Sanidad Agropecuaria con la Entidad de Ciencia, Tecnología e Innovación "Sierra Maestra" diseñaron, desarrollaron, registraron y comercializan el hidrolizado de sericina (líquido), que se obtiene a través de un proceso de extracción y purificación de esta proteína presente en el capullo del gusano de seda.
La seguridad y la eficacia de los productos están influenciadas no solo por sus propiedades intrínsecas sino por su estabilidad en el tiempo, por lo cual fue necesario, determinar el tiempo de vida útil e irritabilidad dérmica y oftálmica de este producto para fines cosméticos, lo que constituyó el objetivo de este trabajo.
MATERIALES Y MÉTODOS
Los 3 lotes producidos a escala piloto se identificaron como HS01, HS02 y HS03 y fueron envasados en frascos de 100 mL de polietileno de alta densidad, con tapón de goma y retapa de aluminio, una de las presentaciones en las que se propone para circular en el mercado.
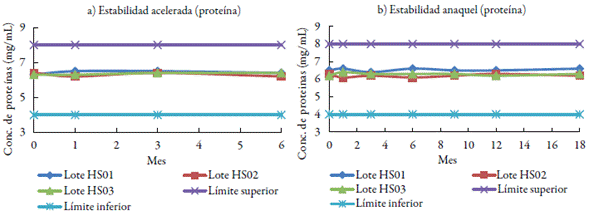
Se tomaron cantidades suficientes de producto de cada lote para evaluar sus características fisicoquímicas y microbiológicas en el tiempo inicial y a los 1, 3 y 6 meses para la estabilidad acelerada en condiciones de temperatura controlada en 40±2 °C. Para la estabilidad en anaquel la condición de almacenamiento fue a temperatura ambiente que en Cuba tiene una media anual de 25 °C. Según las regulaciones vigentes [7] en los productos que no requieren refrigeración, la condición de almacenamiento en anaquel en la zona climática donde se encuentra Cuba es hasta 30 °C. El estudio se realizó durante 18 meses y las evaluaciones fueron en tiempo inicial y a los 1, 3, 6, 9, 12, 18 meses.
Características organolépticas
Se evaluó la apariencia física en cuanto a olor y color, mediante la utilización de los órganos sensoriales [8,9].
Concentración de proteínas
El análisis de la concentración de proteínas se determinó por el método de Lowry [10], que es de tipo colorimétrico. Se utilizó dodecilsulfato de sodio (SDS) al 1% para diluir las muestras y se empleó albúmina de suero bovino (BSA) como patrón [11].
Identidad por electroforesis en geles de acrilamida con dodecilsulfato de sodio (SDS PAGE)
Se determinó la identidad por electroforesis en geles de acrilamida con SDS. El principio del método se basa en que la carga eléctrica que poseen las moléculas de proteínas, las cuales migran a diferentes velocidades cuando se le aplica un campo eléctrico al sistema, a un pH previamente establecido, así se logró la resolución de una mezcla de proteínas [12].
pH
El pH se determinó con un pH-metro marca Mettler-Toledo y se consideró como límite de aceptación entre 4 y 6, según las características propias de la formulación.
Límite microbiano
Se procedió según lo establecido por la The United States Pharmacopeia, USP 41 [13] para determinar el total de microorganismos viables aerobios e identificar las especies de microorganismos aislados [9] por el método de placa vertida o número más probable (NMP).
Irritabilidad
Los estudios de irritabilidad se desarrollaron de acuerdo con las guías generales para los ensayos de sustancias químicas de la Organization for Economic Cooperation and Development (OECD), en los principios de Buenas prácticas de laboratorio (BPL), según las leyes aplicadas al bienestar y cuidado humanitario de animales de laboratorio [14, 15], así como los lineamientos éticos trazados por la Organización Mundial de la Salud [16]. Los procedimientos se refinaron para minimizar la incomodidad, angustia o dolor de los animales.
Oftálmica. Se usaron 3 conejos albinos de Nueva Zelandia, adultos jóvenes de 1,8 a 2 kg de peso. El producto se aplicó con una jeringuilla de 1 mL (0,1 mL, sin aguja), directamente en el borde superior del limbo corneal, se separó el párpado inferior para evitar el derrame del producto, así este quedó en el saco conjuntival. Una vez administrado el compuesto el ojo tratado debió permanecer cerrado por espacio de 15 segundos, para ello se ejerció una ligera presión con los dedos índice y pulgar sobre los párpados. El otro ojo se tomó como control y no recibió tratamiento alguno. Se empleó en el examen de los ojos una solución de fluoresceína de sodio al 2 % para visualizar una eventual degradación de la córnea y un iluminador manual.
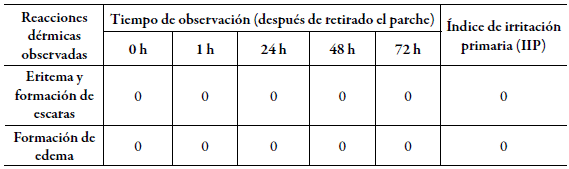
Dérmica. Se emplearon 3 conejos albinos de Nueva Zelandia, adultos jóvenes de 1,8 a 2 kg de peso. El producto se aplicó en una de las dos áreas depiladas de cada animal (6 cm2), la cual se cubrió con un parche de gasa estéril. El área de la piel sin tratar de cada animal se utilizó como control. La sustancia en estudio se mantuvo expuesta en el sitio de la piel cubierto con el parche de gasa estéril durante 4 h.
Al retirarse cada parche se lavó la zona de aplicación con solución de cloruro de sodio 0,9 % estéril. Inmediatamente después de retirar el parche, se examinó a los conejos para detectar signos de eritema o edema, luego a los 60 minutos y a las 24, 48 y 72 h, luego, se registraron las reacciones dérmicas observadas [17]. El periodo de observación se mantuvo durante 14 días después de la administración de la sustancia en estudio.
RESULTADOS
Los resultados de la evaluación inicial realizada a los 3 lotes mostraron una buena reproducibilidad tecnológica. En cuanto a sus características organolépticas no se observaron cambios perceptibles, ni se detectaron signos visuales de inestabilidad física. Todos los lotes tanto en el estudio de estabilidad acelerada como en anaquel mantuvieron las especificaciones de calidad establecidas con una apariencia líquido claro de color amarillo pálido y también se mantuvo su olor característico.
En la figura 1 se puede apreciar que la concentración de proteínas tanto en el estudio de estabilidad acelerada como en el anaquel se mantiene en el intervalo 4-8 mg/mL durante el estudio de estabilidad de los lotes.
En la figura 2 se observa la presencia de la sericina, el hidrolizado de esta proteína obtenido en los 3 lotes evaluados (tanto en anaquel como en estabilidad acelerada) mostró una talla de 40-66 kDa. Donde L1 A: lote 1 estabilidad anaquel y L1 Ac: lote 1 estabilidad acelerada y así sucesivamente con los 3 lotes estudiados.
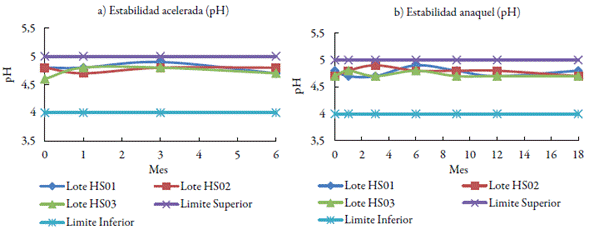
El producto se diseñó con un pH en el intervalo de 4 a 5. En este sentido, tanto en el estudio de estabilidad acelerada y en anaquel, el pH de todos los lotes fue estable y no se manifestaron diferencias significativas entre los lotes durante los diferentes tiempos, lo que se puede apreciar en la figura 3.
Todos los lotes cumplieron con las especificaciones de límite microbiano establecidas, donde el conteo total de bacterias aerobias estuvo por debajo de 103 UFC/mL y el conteo total de hongos no fue superior a 20 UFC/mL, además no hubo presencia de los microrganismos patógenos: Escherichia coli, Staphylococcus aureus, Pseudomona aeruginosa, Salmonella typhi ni de otras enterobacterias [9, 13].
En los ensayos de toxicidad la aplicación dérmica y oftálmica del hidrolizado de sericina hechos en animales de experimentación no provocaron alteraciones dérmicas ni oftálmicas. En ambos ensayos un valor de índice de irritación primario y ocular igual a cero. Como se puede apreciar en las tablas 1 y 2 respectivamente.
Tabla 2 Resultados del ensayo de irritación oftálmica del producto en conejos.
| Tiempo de observación (horas) | Lesiones oculares observadas | ||
|---|---|---|---|
| Córnea | Iris | Conjuntiva | |
| 1 | 0 | 0 | 0 |
| 24 | 0 | 0 | 0 |
| 42 | 0 | 0 | 0 |
| 72 | 0 | 0 | 0 |
| Total (máximo valor 110) | 0 | 0 | 0 |
| Indice de irritación ocular (IIO) | 0 | ||
En ambos ensayos no se observaron otros signos clínicos en los animales. No fue necesaria la toma de muestras de piel para el estudio histopatológico. El producto en estudio se clasifica como no irritante dérmico y ni ocular por los resultados en las condiciones experimentales evaluadas.
DISCUSIÓN
La estabilidad de los productos farmacéuticos depende de factores ambientales como temperatura, humedad, luz, y de factores relacionados con el producto entre los que sobresalen las propiedades fisicoquímicas del principio activo y de los excipientes, la forma farmacéutica y su composición, los procesos de fabricación, la naturaleza y propiedades del envase utilizado. Es por ello que el estudio de estabilidad es la principal herramienta para evaluar la fecha de caducidad y las condiciones de almacenamiento para los productos [18].
En este caso el producto no es un medicamento, pero si una materia prima registrado para elaboración de productos cosméticos. Según los resultados antes expuestos, el producto mantiene sus propiedades fisicoquímicas y sus características en las condiciones y periodo de almacenamiento evaluadas, lo que concuerda con lo que establecen las regulaciones para este tipo de producto, así se definió su periodo de validez [18].
La concentración del ingrediente activo es fundamental porque de esta depende la actividad biológica, con la concentración de proteína de seda (sericina) que posee el producto se pueden fabricar productos cosméticos y farmacéuticos. La sericina de esta formulación se corresponde con la fracción de mayor solubilidad en agua, atendiendo al proceso (altas temperaturas) mediante el cual se obtuvo. Según Kunz et al. [19], los diversos métodos de extracción de sericina, su origen y la variedad de capullo, proporcionan diferentes características y peso molecular, lo que puede reflejarse además en propiedades biológicas.
Como se ha mencionado anteriormente, el peso molecular de la sericina se ve afectado por factores como la temperatura, el pH y el tiempo del proceso de extracción que se utilice, en este caso se obtuvieron dos bandas de aproximadamente de 40 y 60 kDa, respectivamente, esto es similar a lo reportado por Çapar y Aygün [20], quienes determinaron el peso molecular por métodos cromatográficos. Otros autores [21, 22] han obtenido sericina con fracciones de peso molecular entre 12 y 66 kDa; 50 y 150 kDa; 100 y 200 kDa.
La determinación del pH es necesaria para detectar cualquier alteración de este indicador durante el almacenamiento, lo que asegura que el valor de pH del hidrolizado de sericina es compatible con los componentes de la formulación. El pH en todos los lotes fue estable y no se manifestaron diferencias durante el periodo de almacenamiento en los diferentes tiempos evaluados, sin que excediera los límites establecidos para este producto. En este caso el pH se estableció sobre lo ácido y lo más cercano posible al de la piel, ya que uno de los componentes de la formulación es efectivo solo en condiciones ácidas [23].
En ambos estudios de estabilidad, tanto en acelerada como en anaquel, los 3 lotes cumplieron con el límite microbiano, que permiten controlar la carga microbiana en procesos como la purificación, la formulación y el envase. Estos resultados demostraron que la selección del envase final contribuyó a que el producto se mantuviera dentro de las especificaciones establecidas por la USP 41 [13], aunque todas las funciones del acondicionamiento son importantes, puede afirmarse que la protección es el factor crítico ya que incide sobre la estabilidad del producto [24, 25].
En los ensayos de toxicidad, la aplicación dérmica y oftálmica del hidrolizado de sericina, realizados en animales de experimentación no provocaron alteraciones dérmicas ni oftálmicas, por lo que no mostraron signos clínicos que evidenciaran un proceso tóxico.
De forma general, los 3 lotes mantuvieron las especificaciones evaluadas dentro de los límites establecidos, lo que indica que fue certera la selección de los excipientes de la formulación, así como del envase, aspecto fundamental para garantizar la estabilidad del medicamento [24, 25]. Se concluyó que el hidrolizado de sericina en frascos de polietileno de alta densidad es estable a temperaturas hasta 30 °C durante 18 meses y no es irritante.