INTRODUCCIÓN
Diversos tratamientos y terapias con medicamentos combinados se han desarrollado con productos que se utilizaron originalmente como terapias independientes para controlar más rápidamente y de mejor forma las enfermedades. Para el químico analítico, esto presenta un gran desafío. Muchas veces los componentes de estos medicamentos combinados tienen diferencias significativas en sus propiedades físicas (solubilidad, punto de fusión, etc.) y químicas (pKa, máximo de absorción UV, estabilidad en los disolventes etc.) [1]. Por tanto, esto requerirá el desarrollo de métodos analíticos que permitan el análisis de las formulaciones multicomponentes.
La validación es un requisito indispensable para la utilización de los métodos de ensayo en la industria farmacéutica, esta solo será exhaustiva para aquellos métodos no normalizados, los diseñados o utilizados en el laboratorio y los métodos modificados o utilizados fuera de su alcance [2-4].
La validación de los métodos demuestra que los procedimientos analíticos son convenientes para su uso intencional. Es un requisito básico para asegurar la calidad y Habilidad de los resultados de todas las aplicaciones analíticas. Las normas que se refieren a los procedimientos de validación de las técnicas analíticas incluyen lo relacionado con el establecimiento de los límites de detección y cuantificación, la precisión, exactitud, especificidad, rango y robustez [2-5].
Variedad de métodos analíticos han sido desarrollados para la determinación individual o en combinación de mentol [6-16], timol [17-19], ácido benzoico [20-27] y salicilato de metilo [7, 8, 12, 13,16, 28, 29] con el empleo de diferentes formas de preparación de las muestras de acuerdo con el tipo de matriz en donde se encuentren los compuestos de interés.
Las técnicas que más comúnmente se han empleado son la cromatografía líquida de alta resolución y los de cromatografía gaseosa (CG), esta última es uno de los métodos más reportados para la determinación de estos analitos de forma individual o combinada, debido a su alta sensibilidad y versatilidad. La volatilidad de estos compuestos ha hecho que la CG sea una opción para su determinación en materia prima o producto final. Sin embargo, hasta el presente, no existe una metodología específica para determinar estos cuatro compuestos simultáneamente.
El hecho de que la solución antiséptica bucal no aparece en ninguna Farmacopea justifica la necesidad de desarrollar y validar los métodos analíticos empleados en la evaluación de su calidad.
Teniendo en cuenta las interferencias en la cuantificación simultánea de los cuatro analitos fue necesario el desarrollo de un método por CG sencillo y fácil de aplicar; con disolventes orgánicos disponibles y que no fueran agresivos con el material de relleno de las columnas cromatográficas de uso cotidiano. El presente estudio tuvo como objetivo desarrollar y validar un método de cromatografía gaseosa para el análisis simultáneo de mentol, ácido benzoico, salicilato de metilo y ácido benzoico en una solución antiséptica bucal.
MATERIALES Y MÉTODOS
Reactivos químicos
Los reactivos usados fueron timol, material de referencia químico (MRQ) (F0D391, EE.UU.); mentol MRQ (R00640, EE.UU.); ácido benzoico MRQ (H0L534, EE.UU.); salicilato de metilo MRQ (G1L203, EE.UU.) y dietilenglicol MRQ (G0J412, EE.UU.).
Optimización del sistema cromatográfico
Para establecer el sistema cromatográfico a emplear en la determinación simultánea del mentol (MT), salicilato de metilo (SM), timol (TM) y ácido benzoico (AB) se aplicó un diseño multifactorial general de dos bloques, con 72 experimentos completamente aleatorizados. Para el inyector y detector se establecieron dos niveles de temperatura (220 y 250 °C); mientras que para el flujo se propusieron tres velocidades entre 50 y 70 cm/s. Posteriormente, se establecieron tres programas de temperatura (PT):
PT-1: temperatura inicial (Ti) a 60 °C mantenida por 5 min incrementándose hasta 220 °C a razón de 12 °C/min. La temperatura final (Tf ) 220 °C fue mantenida por 5 min.
PT-2: Ti de 60 °C que se incrementó hasta 220 °C a razón de 8 °C/min. La Tf a 220 °C fue mantenida por 5 min.
PT-3: Ti de 80 °C incrementándose hasta 220 °C a razón de 8 °C/min. La Tf a 220 °C fue mantenida por 5 min.
El diseño propuesto se analizó a través del software profesional Design Expert, versión 8.0.6 del 2011, Stat, Ease, Inc. (EE.UU.). Como variables de respuesta se utilizaron: resolución Rs ≥2, factor de cola o asimetría As <2, platos teóricos N >2000, temperatura del inyector y detector, velocidad de flujo y programa de temperatura. Para cada variable se analizaron los niveles de ajuste a través de los coeficientes de determinación (r2 ≥ 0,98), los coeficientes de determinación ajustados (r2 ajustado > 0,98), los coeficientes de determinación predictivos (r2 predictivo > ±0,02 respecto a r2 ajustado) y la precisión adecuada (≥ 4). Se obtuvieron varias propuestas de condiciones cromatográficas seleccionando la de mayor valor de deseabilidad, estadígrafo inferencial de los sistemas multifactoriales mostrado a través de los gráficos de rampas.
El análisis se hizo en un equipo Shimadzu modelo 2010 (Kyoto, Japón) con detector de ionización por llama de hidrógeno. La columna empleada fue DB-WAX de 30 m x 0,32 mm, película 0,25 µm (Agilent, EE.UU.).
Primero, se realizaron dos extracciones con 10 y 5 mL de cloroformo (Merck, Alemania). La muestra fue acidulada con 1 mL de HCl 0,1 mol/L para el aislamiento de los analitos del medio acuoso. El dietilenglicol (Panreac, España) 80 µg/mL fue empleado como estándar interno. Se pesaron con exactitud patrones de mentol, salicilato de metilo, timol y ácido benzoico, las cantidades fueron 40, 50, 60 y 30 mg, respectivamente. Se trasvasaron con ayuda de 60 mL de etanol 96% hacia un matraz de 100 mL. Luego se transfirieron 5 mL hacia un embudo separador de 100 mL y se procedió igual que en la preparación de las muestras.
Posteriormente, alrededor de 100 mg de dietilenglicol se pesaron con exactitud y se trasvasaron hacia un matraz aforado de 50 mL con ayuda de 30 mL de metanol. Se completó volumen con el mismo disolvente y se homogenizó.
Finalmente, 5 mL de la muestra se trasvasaron hacia un embudo separador de 100 mL. Se añadió 1 mL de ácido clorhídrico 0,1 mol/L; se extrajo durante 1 min con 10 mL de cloroformo, se dejó en reposo hasta separación de fases. Luego se trasvasó la fase clorofórmica (abajo) hacia un matraz de 25 mL que contenía 1 mL del estándar interno, a través de un embudo y papel de filtro rápido que contenía 2 g de sulfato de sodio anhidro previamente humedecido con 4 mL de cloroformo. Se realizó una segunda extracción con 5 mL del mismo solvente realizando la misma operación anterior. Por último, se lavó el filtro con 8 mL de cloroformo y se incorporaron al matraz. S e completó volumen con cloroformo y se homogenizó.
Validación del método analítico
De acuerdo con las metodologías descritas [2-5] se desarrollaron los ensayos de especificidad, robustez, estabilidad de las muestras, linealidad, exactitud y precisión (repetibilidad y precisión intermedia) para determinar las tolerancias del método para cada analito de interés. En este estudio fue empleado el lote 6003 de solución antiséptica.
Selectividad. Se comprobó si existía interferencia del placebo analizando los resultados de la muestra, el placebo y el estándar interno con el placebo, al aplicar el procedimiento analítico optimizado. No deben obtenerse señales del placebo en la zona de elusión de los analitos estudiados.
Estabilidad de las muestras. Se realizó la determinación cuantitativa de los analitos al inicio y a 2, 3, 8, 16, 23, 38 y 72 h. Se realizaron análisis durante 3 días, conservando las muestras en frascos ámbar, inyectando la misma disolución y comprobando la ausencia de productos de degradación. Luego se calculó el coeficiente de variación el cual debía ser inferior al 2%, en cuanto al valor de las concentraciones relativas de las inyecciones, como criterio de estabilidad.
Robustez. Para este ensayo se consideraron las posibles variaciones aleatorias de los parámetros como temperatura del inyector y el detector (-5 °C, para ambos), programa de temperatura: tiempo de inicio (+2 °C), tiempo final (-2 °C), velocidad del flujo (2 cm/s) y las columnas DB-WAX y Rext-WAX (Agilent, EE.UU.).
Linealidad. Se utilizó el método de patrones de referencia. Se realizaron las determinaciones correspondientes al 80, 90, 100, 110 y 120%, por quintuplicado. Se calculó, en cada caso, la relación entre la concentración y la respuesta. Luego se hizo un análisis de regresión simple por el método de los mínimos cuadrados, utilizando como variable independiente las concentraciones para cada nivel estudiado y como dependiente las áreas bajo la curva de los picos cromatográficos. Se determinaron los estadígrafos de linealidad (ecuación de la recta, coeficientes de regresión, de determinación, y del factor de respuesta (CVfr%). Se ejecutó la prueba de significación estadística de la desviación estándar de la pendiente y la prueba de proporcionalidad o desviación estándar del intercepto. En ambos casos se analizaron los intervalos de confianza (IC) y la prueba t de Student. Para el primer caso el IC debe incluir el cero y mostrar diferencias estadísticas significativas en el estadígrafo inferencia, mientras que la segunda prueba el IC debe incluir la unidad y la dócima de Student no debe mostrar diferencias significativas. Además, se analizó la autocorrelación de los residuales para la pendiente con el estadígrafo Durbin-Watson.
Exactitud. Se determinaron los porcentajes de recuperación (%Rec), las desviaciones estándar (DS) y el coeficiente de variación (CV), en cada nivel (80, 100 y 120%) y el CVglobal para cada uno de los analitos. Se aplicó la prueba de Cochran para comprobar si la variación de la concentración producía diferencias significativas en la respuesta del método en los diferentes niveles de concentración y la prueba de Student en comparación del porcentaje de recuperación,100%.
Precisión. Para desarrollar este estudio se realizaron las precisiones en condiciones de repetibilidad y precisión intermedia.
Repetibilidad. Se hicieron 10 determinaciones sobre el mismo material de muestra, analizando tres niveles de concentración (80, 100 y 120%). Se calculó el CV y se comparó con el criterio establecido (≤2,0%). Las determinaciones las realizó el mismo analista en las mismas condiciones de trabajo.
Precisión intermedia. Dos analistas evaluaron las concentraciones de 80, 100 y 120% por quintuplicado, en 3 días diferentes. Para cada caso se evaluó la media, DE y el CV. Para el procedimiento se realizaron análisis multifactoriales de las varianzas para las concentraciones de los analitos; se compararon las posibles diferencias entre los días y los analistas y se llevaron a cabo pruebas de contrastes múltiples de rangos y gráficos de medias para determinar si alguno de los factores tenía efectos estadísticamente significativos para cada caso de estudio. También se analizaron las interacciones significativas entre los factores. El método utilizado para discernir entre las medias fue el procedimiento de las menores diferencias significativas de Fisher. Se comprobó, mediante pruebas de análisis de varianzas múltiples (Manova), si había diferencias estadísticas significativas entre los analistas que emplearon igual método, y también, los dos días en que se realizaron los análisis, para obtener resultados con un nivel de confianza del 95%.
Límites de detección (LD) y cuantificación (LC). Estos se determinaron por el procedimiento de la desviación estándar de la respuesta y la pendiente de la recta de calibrado para métodos instrumentales que no corrigen la señal frente a un blanco y el método de extrapolación de la curva de calibración a concentración cero. Las señales a concentración cero se obtuvieron a partir de los interceptos de las curvas de linealidad para cada analito. Se prepararon muestras a concentraciones entre 1,0 y 5,0% respecto a las concentraciones nominales. Cada nivel de concentración se corrió por triplicado, se determinaron los promedios de las áreas y las desviaciones estándar de las respuestas de los blancos (Sbl). Con estos resultados se expresaron las ecuaciones de las rectas de las respuestas del blanco (Ybl) y de las Sbl, para cada uno de los analitos. A partir de los valores de las Ybl y de las Sbl se calcularon los LD y LC teóricos.
Incertidumbre del método de análisis. Las incertidumbres específicas, combinadas y expandidas fueron determinadas a partir de los resultados de las pruebas que miden los errores aleatorios y sistemáticos, estos a su vez determinaron las variabilidades en los resultados para las cuantificaciones de los analitos de interés [30].
Aplicación del método de análisis
El método fue aplicado para las cuantificaciones de los analitos en lotes pilotos de la solución antiséptica recién elaborados. Las determinaciones se realizaron por quintuplicado estimando la media y el coeficiente de variación. Los criterios de aceptación para cada uno de los analitos fueron: mentol: 40,0 ± 4,0 mg/100 mL; salicilato de metilo: 50,0 ± 5,0 mg/100 mL; timol: 60,0 ± 6,0 mg/100 mL y ácido benzoico: 30,0 ± 3,0 mg/100 mL.
RESULTADOS Y DISCUSIÓN
El diseño de un método capaz de cuantificar simultáneamente el mentol, salicilato de metilo, timol y ácido benzoico fue indispensable. Estos se encontraban presentes en la solución antiséptica y se optó por un método por CG sencillo y fácil de aplicar; con el uso de disolventes orgánicos disponibles y no agresivos con el material de relleno de las columnas cromatográficas de uso cotidiano. También se consideró la propiedad química que poseen los analitos de ser compuestos orgánicos hidrocarbonados fácilmente ionizados por un detector de ionización por llama.
El diseño experimental multifactorial facilitó determinar condiciones óptimas a partir de la realización de un número definido de observaciones. El establecimiento de las variables de respuestas permitió la determinación de modelos matemáticos adecuados. Los estadígrafos inferenciales, derivados de la evaluación del diseño experimental, permitieron caracterizar con un 95,0% de confianza si los modelos matemáticos eran adecuados para la predicción de los resultados. Los estadígrafos inferenciales del diseño experimental multifactorial se muestran en la tabla 1.
Tabla 1 Estadígrafos inferenciales del diseño factorial para la determinación de las condiciones cromatográficas.
| Variable respuesta | r2 | r2 ajustado | r2 predictivo | Precisión adecuada |
|---|---|---|---|---|
| Rs_MT | 0,999980 | 0,999961 | 0,999917 | 781,436954 |
| Rs_SM | 0,999640 | 0,999280 | 0,998476 | 199,288232 |
| Rs_TM | 0,999974 | 0,999948 | 0,999890 | 559,501130 |
| Rs_AB | 0,999777 | 0,999554 | 0,999056 | 177,302064 |
| As_MT | 0,995050 | 0,990099 | 0,979051 | 39,960180 |
| As_SM | 0,997401 | 0,994802 | 0,989002 | 64,435524 |
| As_TM | 0,994560 | 0,989119 | 0,976978 | 48,805209 |
| As_AB | 0,995137 | 0,990274 | 0,979420 | 43,768948 |
| N_MT | 0,999870 | 0,999740 | 0,999451 | 398,433020 |
| N_SM | 0,999697 | 0,999394 | 0,998718 | 211,246983 |
| N_TM | 0,998772 | 0,997545 | 0,994805 | 104,245498 |
| N_AB | 0,999498 | 0,998995 | 0,997874 | 155,370950 |
| Ttc | 1 | N/A | 1,001E-307 |
Rs: resolución, As: asimetría, N: platos teóricos, MT: mentol, SM: salicilato de metilo, TM: timol, AB: ácido benzoico.
Los r2 estuvieron en razonable acuerdo con los r2 ajustados, ambos con valores superiores a 0,98 justificando menos del 2,0% de las variabilidades debidas a los errores sistemáticos y aleatorios. Los resultados de las precisiones predictivas no arrojaron resultados que difieran a los ajustados con diferencias mayores a 0,02 unidades. La precisión adecuada midió la relación señal/ruido. Al obtenerse valores superiores a 4 (según criterio de DX8) se consideraron todos los modelos matemáticos adecuados, por lo que dichos modelos pudieron ser utilizados para el estudio estadístico de los resultados del diseño multifactorial propuesto. En el caso del tiempo total de corrida de los cromatogramas con equilibrio del coeficiente de determinación igual a uno (mayor grado de ajuste), el estadístico r predictivo no está definido por tener un ajuste perfecto, con variación despreciable o nula de los valores residuales en la ecuación de ajuste por mínimos cuadrados y la precisión adecuada deja de presentar valor de criterio por las mismas razones. La coincidencia, en cuanto a ajustes de las relaciones de residuales teóricos y reales, indicó la capacidad de los modelos matemáticos propuestos para explicar sus comportamientos con un grado de probabilidad superior al 0,05. Esto demuestra el alto nivel de confianza del método estadístico por ello fue empleado como predictivo del mejor comportamiento en la toma de decisiones respecto a las condiciones cromatográficas. En la figura 1 se muestran los gráficos de rampas de las condiciones de los tratamientos seleccionados como los más deseables; los valores de los parámetros cromatográficos más probables a obtener y el valor de deseabilidad.
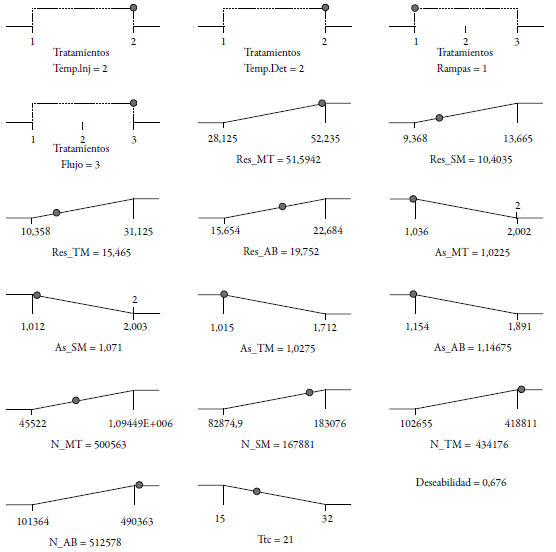
Figura 1 Gráficos de rampa del diseño multifactorial para la predicción de las condiciones cromatográficas. Rs: resolución, As: asimetría, N: platos teóricos, Tr: tiempo de retención, MT: mentol, SM: salicilato de metilo, TM: timol, AB: ácido benzoico.
Como resultado de todo lo anterior el programa sugirió 18 posibles soluciones, de las cuales la primera resultó ser la de mejor deseabilidad con un 67,6% de probabilidad de ejecutarse satisfactoriamente. La corrida propuesta coincidió con la número 10, estándar 53, del diseño experimental factorial propuesto. Los valores predichos difieren muy poco de los valores reales obtenidos. La comparación de los resultados se puede verificar en la tabla 2, que se incluye el porcentaje de coincidencia obtenido por la relación de los valores. Los valores más altos se obtuvieron en aquellas medidas en que el valor numérico fue más pequeño, por lo que se esperaban resultados superiores. Sin embargo, no superan el 3% de variabilidad, por lo que las predicciones se consideran acertadas.
Tabla 2 Comparación de resultados entre las condiciones reales y predictivas del sistema cromatográfico propuesto.
| Rs/MT | Rs/SM | Rs/TM | Rs/AB | As/MT | As/SM | As/TM | As/AB | N/MT | N/SM | N/TM | N/AB | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Valor real | 50,62 | 10,48 | 15,31 | 20,21 | 1,12 | 1,18 | 1,09 | 1,22 | 110008 | 167357 | 418811 | 490363 |
| Valor predicho | 50,62 | 10,47 | 15,35 | 20,24 | 1,15 | 1,18 | 1,07 | 1,26 | 110008 | 167357 | 418811 | 490363 |
| Porcentaje de coincidencia | 100,00 | 99,95 | 100,22 | 100,17 | 102,67 | 100,16 | 98,16 | 102,85 | 99,99 | 99,99 | 100,00 | 99,99 |
Rs: resolución, As: asimetría, N: platos teóricos, MT: mentol, SM: salicilato de metilo, TM: timol, AB: ácido benzoico.
Los parámetros cromatográficos como tiempo de retención (Tr), asimetría (As), resolución (Rs) y platos teóricos (N) se muestran en la tabla 3. La resolución se refiere a la medida de separación entre los picos de interés respecto a la línea base. Los platos teóricos es una función de la eficiencia de la columna y es específicamente para asegurar que los compuestos que eluyan estén resueltos uno del otro, para establecer el poder separativo del sistema. Un pico es considerado resuelto cuando el valor de R es mayor que 2,0 [5]; mientras que una columna es eficiente cuando N es mayor que 2000 (se entiende por eficiencia de una columna cuando más interactúan los componentes de una muestra en análisis con la fase estacionaria lográndose una mayor retención y resolución de los analitos). La asimetría indica la aproximación de la curva a la campana gaussiana, debido a efectos intra y extracolumnares en el proceso separativo; la unidad para picos simétricamente perfectos y su valor varía a medida que elfronting o el tailing del pico se hacen más pronunciadas. Un pico se considera simétrico cuando su valor está por debajo de 2,0 y cercano a 1,0 [5].
A partir del análisis de los resultados del diseño experimental se fijaron las siguientes condiciones de trabajo: columna DB-WAX de 30 m de longitud, 0,32 mm DI y 0,25 µm; flujo: 70 cm/s; gas transportador: hidrógeno; temperatura inyector: 250 °C; temperatura detector de ionización de llama: 250 °C; programa de temperatura: temperatura inicial de 60 °C por 5 min, incrementándose hasta 220 °C a razón de 12 °C/min y temperatura final de 220 °C mantenida por 3 min; tiempo de corrida: 25 min; modo de división de la muestra (Split): 1:5, flujo detector H2 y aire 50 m/L y 480 m/L, respectivamente, y volumen de inyección: 1 µL.
Tabla 3 Parámetros cromatográficos obtenidos con el sistema seleccionado.
| Parámetro cromatográfico | Mentol | Salicilato de metilo | Timol | Ácido benzoico |
|---|---|---|---|---|
| Tr (min) | 9,54 | 11,973 | 17,867 | 21,065 |
| As | 1,098 | 1,043 | 1,018 | 1,113 |
| Rs | 54,876 | 39,912 | 51,762 | 42,658 |
| N | 1 676 447,45 | 2 333 620,51 | 2 545 695,58 | 3 025 563,27 |
Rs: resolución, As: asimetría, N: platos teóricos, Tr: tiempo de retención.
Validación del método seleccionado
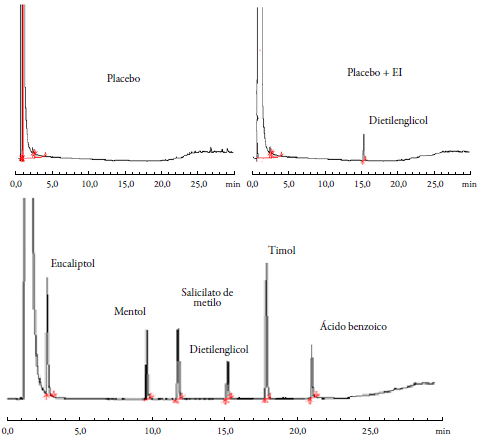
En la figura 2 se muestran los cromatogramas de la muestra, el placebo y el estándar interno con el placebo obtenidos durante la comprobación del parámetro de la especificidad del método. Al observar los cromatogramas se evidenció que no existen interferencias por parte de los analitos ni de los excipientes presentes en la formulación, por tanto, se considera que el método es específico y aplicable al control de calidad del producto terminado.
En los laboratorios de control de calidad que analizan grandes volúmenes de producción es necesario incluir varias muestras de lotes de un mismo producto para hacer los ensayos de cuantificación, lo que algunas veces prolonga el tiempo de análisis. Después de diluidas se evaluó la estabilidad para comprobar el periodo de tiempo durante el cual las muestras mantenían su concentración sin variación.
La tabla 4 muestra los resultados del estudio de estabilidad de las muestras en el cual se comprobó que las mismas fueron estables durante 3 días después de su preparación. El coeficiente de variación mayor, obtenido para el MT, no excedió del 0,26%. En todos los casos los resultados estuvieron por debajo del criterio de aceptación y cumplieron para los cuatro analitos con valores de CV < 2,0%. Se puede considerar que las muestras fueron estables durante ese periodo.
Tabla 4 Concentración de los cuatro analitos en el estudio de estabilidad de las muestras.
| Tiempo (h) | Concentración (mg/mL) | |||
|---|---|---|---|---|
| Mentol | Salicilato de metilo | Timol | Ácido benzoico | |
| 0 | 41,215 | 50,650 | 59,091 | 31,345 |
| 2 | 41,163 | 50,564 | 58,789 | 31,369 |
| 3 | 41,011 | 50,542 | 58,991 | 31,402 |
| 8 | 41,055 | 50,551 | 58,987 | 31,389 |
| 16 | 40,996 | 50,563 | 58,878 | 31,423 |
| 23 | 41,014 | 50,490 | 59,003 | 31,431 |
| 38 | 41,016 | 50,548 | 59,025 | 31,509 |
| 72 | 40,871 | 50,456 | 59,012 | 31,374 |
| Media (mg/mL) | 41,043 | 50,546 | 58,972 | 31,405 |
| DS | 0,1059 | 0,0570 | 0,0944 | 0,0506 |
| CV (%) | 0,2580 | 0,1127 | 0,1602 | 0,1612 |
En la tabla 5 se resumen los resultados del ensayo de robustez. Los resultados estadísticos mostraron que la variación de los parámetros cromatográficos fue muy pequeña, siendo menores que el valor asignado como criterio de aceptación. Esto confirma que los resultados obtenidos se mantuvieron dentro de los valores permisibles y que las variaciones en el método cromatográfico no influyeron en la calidad de los resultados, por lo que el método propuesto se consideró robusto.
Tabla 5 Robustez del método.
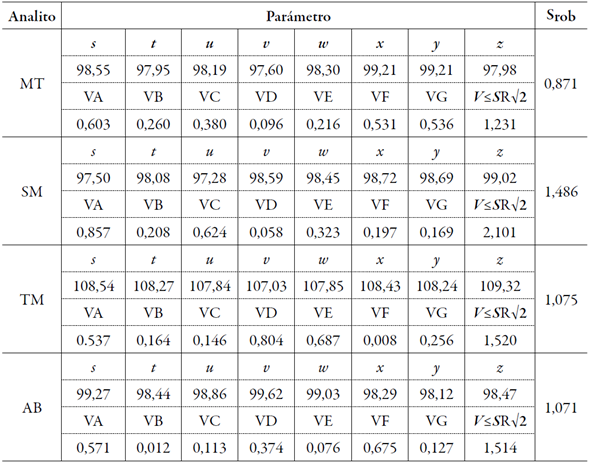
s, t, u, v, w, x, y, z: concentraciones ( %); VA, VB...VG: variabilidades calculadas, según procedimiento. MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico; S: desviación típica.
En la tabla 6 se observan los resultados estadísticos de la prueba de linealidad del método. Existieron fuertes relaciones seriadas entre las variables dependientes (Y, área bajo la curva) y las independientes (X, concentración) dado que los coeficientes de correlación presentaron valores superiores al 99,0% y los coeficientes de determinación mayores del 98,0%. El grado de ajuste o sensibilidad se demostró, además, por los valores de los coeficientes de los factores de respuestas (CVfr), que para todos los analitos fueron menores del 5,0% y la existencia de relaciones seriadas avaladas por el análisis de las varianzas de las regresiones con valores de probabilidades inferiores al 0,05. Los valores de probabilidades superiores al 0,05 de los estadígrafos de Durvin-Watson no mostraron indicios de una autocorrelación serial en los residuos, con un nivel de confianza del 95,0%. Al aplicar la prueba t de Student se demostró la existencia de una relación estadísticamente significativa, lo que indica que la probabilidad de que b≠0 fue muy elevada, superior al 99,9%. En el análisis estadístico de los interceptos, con las dócimas t de Student, se demostró que no existieron diferencias entre las medias de los residuales a cada nivel, para cada uno de los analitos estudiados. Además, los intervalos de confianza incluyen al cero, lo que indica que la probabilidad de que a=0 es muy elevada. En la figura 3 se observan las curvas de linealidad por el método de ajuste de los mínimos cuadrados. Todos los puntos a los distintos niveles se encuentran dentro de los límites de confianza y predicción, demostrando que en los cuatros casos el método de cuantificación se ajusta al modelo propuesto.
Tabla 6 Resultados estadísticos de la prueba de linealidad del método analítico.
Coeficientes de correlación (r); coeficientes de determinación (r2); coeficiente de variación del factor de respuesta (CVfr).
t (t n-2, p-valor=0,05)= 2,160.
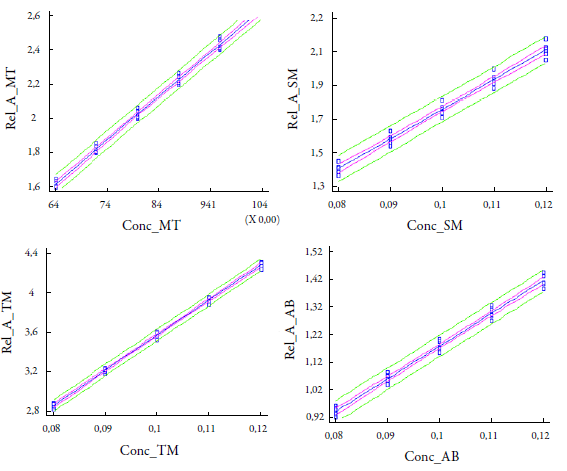
Figura 3 Curva de calibración de la linealidad. MT: mentol, SM: salicilato de metilo, TM: timol, AB: ácido benzoico.
Para el rango seleccionado en el estudio los porcentajes de recobro estuvieron dentro de los límites establecidos para los métodos cromatográficos (98,0-102,0%) y el valor del coeficiente de variación, fue menor que el 2,0% (tabla 7). En la influencia del factor concentración sobre la variabilidad de los resultados de la exactitud, al aplicar la prueba de Cochran, se obtuvieron valores de C calculada menores que la C tabulada para una probabilidad de 0,05, p=3 y n=5; por tanto, las varianzas de las concentraciones empleadas fueron equivalentes, indicando que la concentración no influyó en la variabilidad de los resultados, en el rango estudiado. Al realizar la prueba de significación entre la recuperación, las medias y el 100% de recuperación, se obtuvieron valores de t de Student menores que el valor tabulado, confirmando la elevada exactitud del método ya que el recobrado medio no difiere significativamente del 100%. Teniendo en cuenta estos resultados puede afirmarse que los errores sistemáticos tuvieron muy bajo impacto en la calidad de los resultados y que al cumplir con los indicadores establecidos para un método cromatográfico, el mismo puede ser utilizado para el fin propuesto. Estos resultados demuestran que el método permite determinar con exactitud los analitos, en el intervalo de 80 a 120% en las condiciones de trabajo estudiadas.
Tabla 7 Exactitud del método analítico.
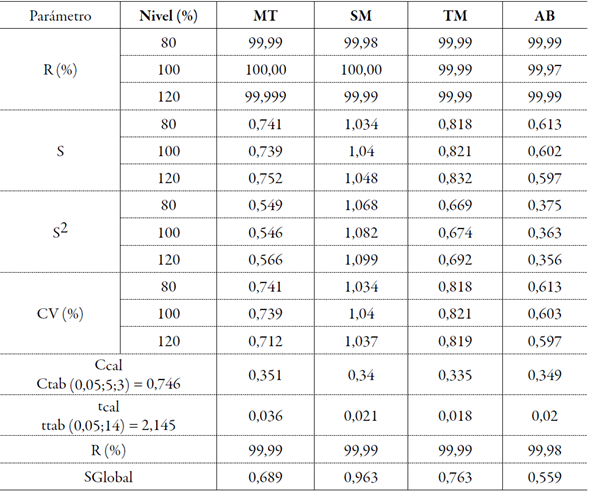
MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico; R: recobrado; CV: coeficiente de variación.
Se obtuvieron coeficientes de variación menores al 1,0% al evaluar la precisión en condiciones de repetitibidad (tabla 8), en los tres niveles de concentración, para los cuatros analitos. Este valor concuerda con lo expresado como criterio de aceptación (< 2,0%). El análisis de varianza mostró un valor del test de Levene's igual a 0,403 que corresponde a un valor de probabilidad igual a 0,755; indicando que no existen diferencias estadísticas significativas entre las varianzas para los tres niveles de concentración evaluados por lo que se puede considerar que existe homocedasticidad.
Tabla 8 Precisión del método.
| Analito | Nivel (%) | Concentración (µg/mL) | CV (%) | Valor de p |
|---|---|---|---|---|
| MT | 80 | 32,158 | 0,725 | Panalista = 0,9980 Pdía = 1,0000 |
| 100 | 40,204 | 0,733 | ||
| 120 | 48,259 | 0,745 | ||
| SM | 80 | 40,235 | 1,052 | Panalista = 0,9988 Pdía = 1,0000 |
| 100 | 50,294 | 1,041 | ||
| 120 | 60,373 | 1,055 | ||
| TM | 80 | 48,377 | 0,830 | Panalista = 0,9988 Pdía = 1,0000 |
| 100 | 60,469 | 0,825 | ||
| 120 | 72,581 | 0,831 | ||
| AB | 80 | 24,441 | 0,566 | Panalista = 0,9997 Pdía = 1,0000 |
| 100 | 30,554 | 0,596 | ||
| 120 | 36,666 | 0,597 | ||
| Levene's = 0,403 p = 0,7549 |
MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico; valor de p: valor de probabilidad.
La figura 4 muestra los gráficos de medias para la precisión intermedia del método. Los gráficos de bigote indican la homogeneidad de las varianzas entre las distintas mediciones comparadas en los factores analizados evidenciando, la similitud de los resultados entre los analistas y en diferentes días. En la tabla 8 se resumen los valores de probabilidades obtenidos por los dos analistas y los tres días estudiados, evidenciando que no existen diferencias estadísticas significativas para un 95,0% de probabilidad. Estos coeficientes indican baja variabilidad por lo que el proceso de cuantificación, los analistas involucrados en el estudio fueron lo suficientemente precisos y las condiciones de trabajos bien controladas. Por lo que se considera que el método fue preciso asegurando que los errores aleatorios no causaron impacto significativo sobre los resultados en las condiciones antes mencionadas.
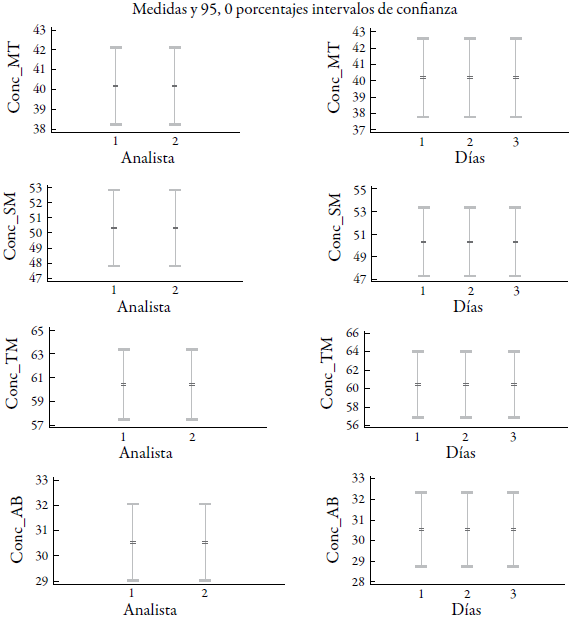
Figura 4 Gráficos de medias para la precisión intermedia del método, según la influencia de los analistas y días. MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico.
Los resultados de la determinación de los límites de detección y cuantificación para el MT, SM, TM y AB se observan en la tabla 9. Las curvas de calibración para la determinación de las respuestas y desviación estándar de los blancos mostraron ajustes adecuados con coeficientes de determinación que justificaron más del 98,0% de las variabilidades de los resultados. Con estos resultados se calcularon los valores de Ybl y Sbl para la determinación de los LD y LC. Estos valores fueron comprobados experimentalmente obteniendo buenos resultados.
Tabla 9 Límites de detección y cuantificación del método.
| Parámetro cromatográfico | MT | SM | TM | AB |
|---|---|---|---|---|
| Ecuación de la recta (Y blanco) | 26,12 X-0,00 | 18,18 X-0,00 | 30,02 X+0,00 | 59,84 X-0,00 |
| Ecuación de la recta (S blanco) | 0,53 X-0,00 | 0,04 X+0,00 | 0,53 X+0,00 | 0,03 X+0,00 |
| r2 (%) | 99,90 | 100,00 | 99,99 | 100,00 |
| Límite de detección (ng/mL) | 0,513 | 1,184 | 3,348 | 1,402 |
| Límite de cuantificación (ng/mL) | 1,459 | 3,438 | 9,734 | 4,363 |
MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico.
El conjunto de los resultados mostrados permite afirmar que el método por cromatografía gaseosa para la determinación de salicilato de metilo, timol, mentol y ácido benzoico es lineal, preciso, exacto, selectivo y robusto en el intervalo de 80 a 120% de concentración, por lo que podría ser empleado para el control de calidad de la solución antiséptica.
La tabla 10 resume los valores determinados de las incertidumbres específicas para cada uno de los analitos en cuestión. Los valores demuestran la poca influencia de los errores aleatorios y sistemáticos sobre los resultados en el proceso de cuantificación. Por tanto, hay aproximadamente un 95,0% de probabilidad de que las concentraciones verdaderas de MT, SM, TM y AB, en muestras de rutina, estén contenidas dentro del intervalo proporcionado por la concentración obtenida al analizar la muestra y su incertidumbre asociada.
Tabla 10 Incertidumbres del método cromatográfico desarrollado.
| Parámetro | MT | SM | TM | AB |
|---|---|---|---|---|
| Incertidumbre específica del ensayo de exactitud | ± 0,689 | ± 0,963 | ± 0,763 | ± 0,559 |
| Incertidumbre específica del ensayo de precisión intermedia | ± 0,101 | ± 0,180 | ± 0,167 | ± 0,064 |
| Incertidumbre combinada (gl= 43) | 0,034 | 0,041 | 0,037 | 0,031 |
| Incertidumbre expandida t(0,05, g.l.)= 2,017 | ± 0,069 | ± 0,082 | ± 0,074 | ± 0,062 |
MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico; gl: grados de libertad.
Los resultados de la cuantificación de las concentraciones de los analitos de interés en lotes pilotos, recién elaborados, de la solución antiséptica se resumen en la tabla 11. Estos pueden considerarse adecuados al obtenerse una repetibilidad dentro de los valores aceptados con coeficientes de variación inferiores al 2,0%.
Tabla 11 Cuantificación de los analitos de interés en la solución antiséptica con el método cromatográfico propuesto.
| Lote | Parámetro | MT | SM | TM | AB |
| 6001 | Media (mg/100 mL) | 40,20 | 50,29 | 60,47 | 30,55 |
| CV (%) | 0,74 | 1,04 | 0,82 | 0,60 | |
| 6002 | Media (mg/100 mL) | 40,21 | 50,52 | 60,15 | 30,16 |
| CV (%) | 0,75 | 1,27 | 1,08 | 1,29 | |
| 6003 | Media (mg/100 mL) | 40,42 | 50,03 | 60,19 | 30,45 |
| CV (%) | 1,27 | 1,44 | 1,12 | 0,75 |
MT: mentol; SM: salicilato de metilo; TM: timol; AB: ácido benzoico; CV: coeficiente de variación.
CONCLUSIONES
Un método de cromatografía gaseosa con detector de ionización de llama fue desarrollado y validado para la cuantificación simultánea de mentol, salicilato de metilo, timol y ácido benzoico. El método demostró ser confiable en cada criterio analítico evaluado, por lo que puede ser empleado para el control de calidad del producto terminado. El procedimiento y el sistema empleado en el estudio permitieron la determinación simultánea de los cuatro analitos en un tiempo de 25 min. Finalmente, la aplicación del método fue demostrada satisfactoriamente al analizar lotes pilotos de la solución antiséptica.