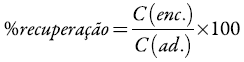INTRODUÇÃO
Os diferentes tipos de aguardentes produzidos no mundo (bebidas alcoólicas destiladas) são obtidos a partir de matérias-primas ricas em carboidratos. No Brasil, destaca-se a aguardente obtida do destilado alcoólico simples de cana-de-açúcar ou pela destilação de mosto fermentado de cana ou a obtida da mandioca (Manihot esculenta Crantz). A primeira é mais conhecida como cachaça, sendo a segunda, comum no Maranhão, conhecida como Tiquira. Independentemente da aguardente, todas deverão atingir graduação alcoólica entre 38° GL e 54° GL, estando, dessa forma, de acordo com a legislação brasileira [1, 2].
O processo de obtenção da Tiquira envolve quatro etapas. A primeira consiste na lavagem, descasco, ralação e prensamento da mandioca para eliminar parte da umidade (cerca de 50%). Na segunda, a massa é esfarelada e distribuída em chapas metálicas aquecidas a lenha para obtenção dos beijus que até então, são guardados à sombra em local quente e úmido em tanques de madeira (coxos) cobertos com água, forrado com folhas de bananeira e/ou palmeira, onde permanecem até o crescimento dos fungos originários da flora microbiana natural. Na terceira, os beijus são macerados e recolocados no coxo para fermentar em um período médio de quatro a seis dias [1]. Na quarta e última etapa, ocorre a destilação, que é puramente artesanal, onde o destilado é condicionado em alambique de cobre e este é submetido ao aquecimento direto que deve ser controlado para evitar a formação de produtos pirogenados e o sabor de "queimado".
Embora a Tiquira possua um cheiro característico, cujo aroma é formado pela mistura de vários álcoois, ácidos carboxílicos, ésteres, aldeídos e aminas, além de íon amônio [3, 4], esta bebida precisa atender a legislação para certificação de sua qualidade quanto ao risco de contaminação por cobre. A legislação brasileira e a Americana determinam que a concentração desse metal em bebidas destiladas sejam no máximo, respectivamente, 5 e 2 mg L-1 [2, 5]. Nesse caso, para manter o controle de qualidade, a AOAC (Association of Official Analytical Chemists) recomenda o método espectrométrico de absorção atômica em chamas [6]. No entanto, o uso desse método é limitado e com isso outros métodos foram desenvolvidos a fim de determinar esse metal nessas bebidas.
Assim, dentre os métodos que já foram utilizados para essa finalidade estão: espectrometría de absorção atômica sequencial rápida [7], espectrometria de absorção atômica de forno grafite [8], potenciometria [9] e absorção molecular UV vis, sendo este último utilizando o reagente biquinolina [10]. No entanto, na maioria dos métodos ou das reações utilizados possuem desvantagens, devido ao custo elevado dos equipamentos, o uso de grande quantidade de solvente, reagente e o tratamento prévio das amostras. Isso de alguma forma contraria os preceitos da química verde [11]. Portanto, diante dessas situações, esse estudo descreve as características da reação de complexação do cobre(II) com o reagente 1-(2-piridilazo)-2-naftol (PAN) e determina a concentração desse metal em aguardente de mandioca (Tiquira) por espectrofotometria de absorção molecular UV Vis.
METODOLOGIA
Espectrofotômetro e acessórios
As medidas espectrofotométricas foram conduzidas em um espectrofotômetro UV-Vis modelo HP8452A, equipado com monitor HP, modelo 386116 e impressora HP modelo 500.
Solução de 1-(2-piridilazo)-2-naftol (PAN)
Devido à baixa solubilidade do reagente PAN em água, ele foi dissolvido em uma solução alcoólica (50%) para obtenção de uma solução com concentração 1 X 10-3 mol L-1. Em seguida, a solução foi em estocada em frascos de polietileno e conservamos a temperatura de 15 °C.
Soluções tampão
A solução tampão acetato de sódio/ácido acético foi preparada a partir de uma solução estoque de CH3COONa de concentração 2 mol L-1 e outra solução de CH3COOH 2 mol L-1. Para o estudo do efeito da variação do pH no complexo Cu(II)-PAN, os valores de pH foram variados com misturas dessas duas soluções até pH= 6,0. Já no estudo da variação do pH na faixa alcalina usou-se solução tampão de NH4Cl/NH4OH (cloreto de amônio/hidróxido de amônio), preparada a partir de misturas previamente calculadas das suas soluções padrão de 2 mol L-1.
Soluções dos metais
Preparou-se as soluções estoque de Ni(II), Fe(III), Cd(II), Co(III), Pb(II) e Zn(II), com concentração de 1 X 10-2 mol L-1 e Cu(II) com concentração de 1 X 10-3 mol L-1. Efetuou-se diluições em tampão CH3COONa/CH3COOH (acetato de sódio/ácido acético), pH 6,0 com força iônica ajustada para 0,2 mol L-1. Para evitar a degradação, as soluções estoque foram acondicionadas e mantidas a temperatura de 15 °C para posterior preparo das soluções.
Coleta das amostras
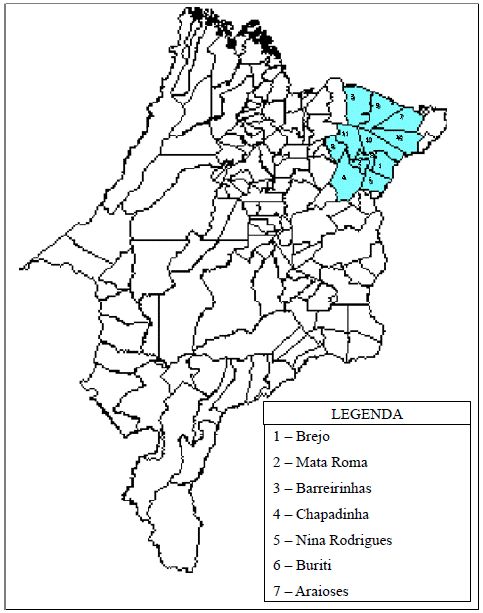
As diversas amostras de Tiquira foram selecionadas dos principais municípios maranhenses produtores dessa aguardente. Todas são originadas de fabricantes que obtém o seu produto de forma artesanal. Coletou-se cinco amostras oriundas do município de São Domingo, Cabeceira da Cruz, Anapurus, Brejo e Santa Quitéria, no período de maio a junho de 2002. Observamos a localização dos principais municípios produtores de Tiquira na figura 1.
Observa-se na tabela 1 as informações referentes à coleta das amostras e o respectivo teor alcoólico. As amostras foram coletadas de acordo com descrições da técnica de coleta para aguardentes [12]. Posteriormente foram estocadas a temperatura ambiente, após acidificação com ácido nítrico e de acordo com as recomendações para análise de traços metálicos [13].
Digestão das amostras
A digestão de cada amostra foi realizada em ácido nítrico e ácido perclórico na proporção de 2:1, respectivamente. Neste procedimento, retirou-se uma alíquota de 100 mL da amostra e transferiu-se para um balão de destilação com capacidade de 250 mL contendo esferas de vidro. Em seguida, adicionou-se 200 µL de ácido nítrico concentrado e colocamos para destilar durante 30 minutos em sistema fechado (refluxo). Transcorrido esse tempo, desconectou-se o balão do condensador e até a temperatura baixar, quando então adicionou-se mais 100 µL do ácido nítrico e 150 µL do ácido perclórico concentrado e colocando novamente para refluxo por mais 30 minutos. Após essa etapa, desconectou apenas o condensador deixando que o conteúdo do balão reduzisse a cerca de 5% do volume da amostra, quando então adicionou-se 30 mL de água deionizada e colocando novamente para evaporar. Seguido esse passo, o material foi resfriado e transferido, quantitativamente, para um balão volumétrico de 100 mL, aferindo-se logo em seguida. As amostras digeridas foram guardadas em frascos de polietileno (125 mL de capacidade), previamente rotulados, e conservadas em geladeira para posterior análise.
RESULTADOS E DISCUSSÃO
Caracterização espectrofotométrica do sistema Cu(II)-PAN
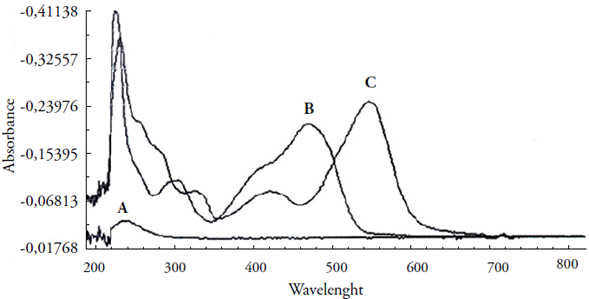
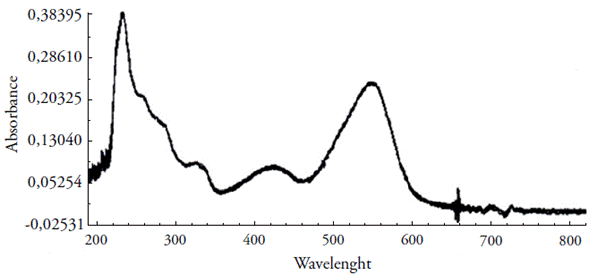
As bandas de absorção do íon Cobre (Cu+2), o ligante PAN e do complexo Cu(II) -PAN divergem. O íon cobre(II) absorve em 240 nm, a solução do ligante PAN, de cor vermelha, em 474 nm e o complexo Cu(II)-PAN, de cor rosa, em 548 nm (figura 2).
Efeito do pH
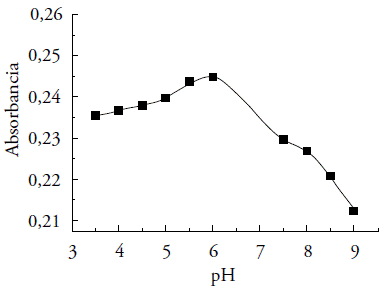
As absorbâncias da solução do complexo Cu(II)-PAN (metal e ligante, ambos 1,0 X 10-5 mol L-1) possuem variações na faixa de pH. Observa-se a maior absorção em pH 6, que foi no tampão NaAc/HAc (pH 3,5 a 6,0). No entanto, valores de pH acima (NH4C1/NH40H - 7,5 a 9,0) e abaixo desse valor, respectivamente, reduzem a absorbância desse complexo (figura 3).
Efeito da concentração do metal (Cu+2) e do ligante
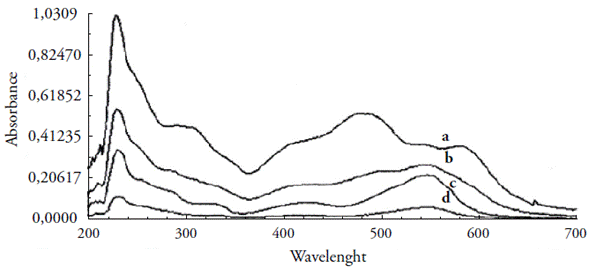
Pode-se observar o efeito da concentração do metal e do ligante a partir do método univariado. Variou-se a concentração do metal de 2,0 X 10-6 a 1,4 X 10-5 mol L-1 em tampão NaAc/HAc (pH 6,0), enquanto manteve-se constante a concentração do ligante em 1 X 10-5 mol L-1. À medida que aumenta a concentração do metal, verifica um aumento na absorbância do complexo formado (figura 4 (B)) até a proporção de 1:1. Quando as concentrações do ligante e metal se igualaram, houve uma sobreposição ponto a ponto da concentração de Cu+2 igual a 1,4 X 10-5 mol L-1, sobre a anterior (1,2 X 10-5 mol L-1). Além disso, observa-se a presença do ponto isosbéstico (@ 500 nm), caracterizando que o sistema é constituído por dois cromóforos interconvertíveis e que há um equilíbrio entre as duas formas, ligante e complexo [14].
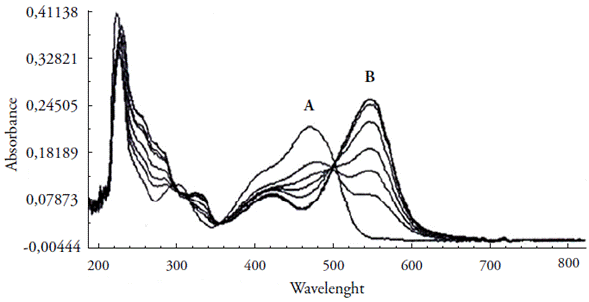
Figura 4 Espectros de absorção: Ligante PAN (A); complexo Cu(II)-PAN (B), mantendo-se constante a concentração do ligante em 1 X 10-5 mol L-1 e variando-se a concentração do metal (2 X 10-6 a 1,4 X 10-5 mol L-1), em tampão NaAc/HAc, pH 6,0.
Na figura 5, apresentamos os espectros obtidos em tampão NaAc/HAc, pH 6,0, quando manteve a concentração do metal constante em 1 X 10-5 mol L-1 e variou-se a concentração do ligante de 1 X 10-6 a 1,10-5 mol L-1, é visto um aumento na absorvência à medida que aumentávamos a concentração do ligante.
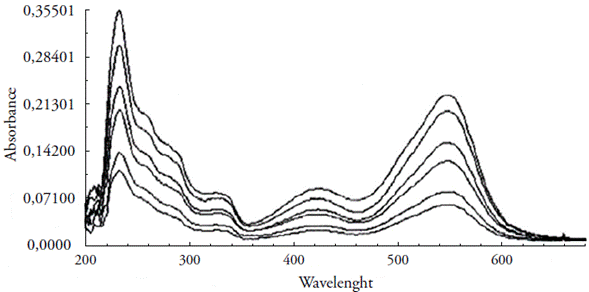
Figura 5 Espectros de absorção do complexo Cu(II)-PAN obtidos mantendo-se constante a concentração do metal em 1 X 10-5 mol L-1 e variando-se a concentração do ligante em 1 X 10-6 a 1 X 10-5 mol L-1, em tampão NaAc/HAc, pH 6,0.
Na figura 6, observamos a saturação de bandas do ligante a partir da concentração 2 X 10-5 mol L-1. Para a ocorrência é necessário manter fixo a concentração do metal em 1,10-5 mol L-1 e variar a concentração do ligante de 1 X 10-6 a 4 X 10-5 mol L-1. Portanto, a banda mais viável é aquela no qual a concentração do PAN é 1 X 10-5 mol L-1, uma vez que em concentrações superiores estão há saturação e consequentemente mascaramento.
Efeito do tempo
0 sucesso de um método analítico onde há formação de complexo está no tempo necessário para sua formação e na estabilidade em função do tempo. Para o sistema em estudo, observamos que a formação do complexo Cu(II)-PAN é instantânea, após a mistura das soluções de Cu(II) e PAN, ambos na concentração de 1,0 X 10-5 mol L-1 em tampão NaAc/HAc e pH 6,0. Contudo, ao realizarmos o estudo da estabilidade desse composto em um tempo de 420 minutos (7 horas), observa-se que este é estável (figura 7). Portanto, o composto não sofre degradação ao longo do tempo.
Proporção estequiométrica
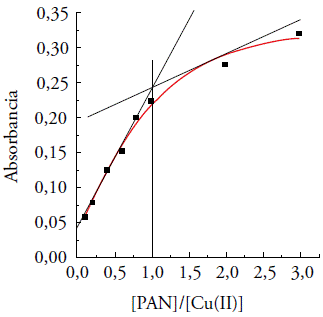
A quantidade estequiométrica do metal e do ligante na formação do complexo Cu(II)-PAN pelo método da Razão Molar foram avaliadas. O método consiste na relação entre a absorbância de uma série de soluções do complexo e a razão molar (R) entre a concentração do ligante (L) e a do metal (M) [15]. Tais medidas são obtidas mantendo-se a concentração do metal constante em 1 X 10-5 mol L-1 e variando-se a concentração do ligante.
Na figura 8, apresentamos os dados experimentais referentes à aplicação do método da Razão Molar ao sistema Cu(II)-PAN. Os resultados mostram que a razão estequiométrica para o sistema Cu(II)-PAN na formação do complexo é 1:1. Esse valor foi determinado após o rebatimento do ponto de extrapolação das tangentes, passando pelo ponto a partir do qual a curva muda de inclinação, até o eixo da razão molar. Tal proporção encontra-se dentro do esperado para metais de transição, embora o PAN seja um ligante tridentado [16, 17].
Estudo da interferência de cátions metálicos
O estudo da influência de íons no sinal analítico é de importância relevante em química analítica e é dirigido muito em função da matriz à qual o procedimento é aplicado. No presente trabalho o procedimento proposto e otimizado foi avaliado na determinação de cobre em solução padrão. A interferência foi avaliada para os íons metálicos possivelmente presentes na matriz estudada (Tiquira), podendo ser proveniente de fontes tais como: adubos químicos, processamento, armazenamento e água utilizada no processo [18]. A possível interferência pode ser devido à facilidade de formarem complexos com o PAN [17, 19], competindo desta forma com o íon Cu(II) no processo de complexação [20]. Os íons metálicos escolhidos no estudo da interferência foram: Cd(II), Co(III), Ni(II), Pb(II), Fe(III) e Zn(II) e os resultados são apresentados na tabela 2.
Tabela 2 Efeito da presença de outros cátions metálicos na resposta espectrofotométrica do Cu(II) em tampão acetato/ácido acético, pH 6,0 e concentração de Cu(II) 1 X 10-5 mol L-1.
| ÍON | CM / C CU(II) | SINAL |
|---|---|---|
| Co(III) | <10 ≥10 | n.i i |
| Zn(II) | ≤100 | n.i. |
| Ni(II) | ≤100 | n.i. |
| Fe(III) | <100 ≥100 | n.i. i. |
| Cd(II) | ≤100 | n.i. |
| Pb(II) | ≤100 | n.i. |
CM/Ccu(II)= concentração do metal/concentração do íon cobre; n.i.= não interfere; i.= interfere.
Avaliamos a interferência a partir da sobreposição dos espectros obtidos dos íons em diferentes concentrações com a do complexo Cu(II)-PAN (oriundo da mistura estequiométrica de metal e ligante, ambos 1 ' 10-5 mol L-1). Os estudos foram conduzidos adicionando-se soluções padrão dos íons metálicos escolhidos à solução de Cu(II). Em seguida, o ligante era adicionado [21]. Observamos que a presença dos íons Zn(II), Ni(II), Cd(II) e Pb(II) não interferiram significativamente no sinal analítico até uma concentração de 100 vezes maior que a concentração do íon Cu(II) em tampão NaAc/ HAc, pH 6,0. Já o íon Fe(III) interferiu em uma concentração 100 vezes maior que a de Cu(II) de modo a mascarar a banda do complexo Cu(II)-PAN, enquanto que o íon Co (III) interferiu em uma concentração de 10 vezes maior que a concentração do íon Cu(II), diminuindo a banda de absorção do complexo Cu(II)-PAN.
Curva analítica
A curva analítica foi obtida através da plotagem da absorbância lida em relação à concentração de Cu(II). Dessa forma, os resultados desse são: faixa de linearidade de 1 ' 10-6 a 1 ' 10-5 mol L-1, coeficiente de correlação (R)2= 0,9990 e desvio padrão= 0,0035.
Avaliação estatística do procedimento analítico proposto
A credibilidade e desempenho de um método ou procedimento analítico dependem, em grande parte, da avaliação estatística dos resultados obtidos nas análises, tendo-se como parâmetros a exatidão (recuperação), precisão (reprodutibilidade) e os limites de detecção [22].
A avaliação da exatidão foi baseada nas medidas de recuperação do cobre em amostras contendo concentrações variadas e conhecidas do analito [23]. Dessa forma, para o estudo da recuperação de Cu(II) utilizamos o método de adição padrão (tabela 3), onde a amostra utilizada teve o teor de Cu(II) previamente determinado por Espectro-fotometria de Absorção Atômica.
Tabela 3 Avaliação estatística de recuperação de Cu(II) (método de adição padrão) para 95 % de probabilidade em tampão NaAc/HAc pH 6,0.
 = média com desvio padrão; S= desvio padrão; S(%)= desvio padrão relativo.
= média com desvio padrão; S= desvio padrão; S(%)= desvio padrão relativo.
Determinamos as percentagens de recuperação através da seguinte equação [23]:
Onde C(enc.) significa concentração molar encontrada e C(ad.), concentração molar adicionada. Dessa forma, observamos que avaliação estatística mostrou recuperação na faixa de 98,00 a 107,50% e uma recuperação média de 104,54±7,01, adotando-se um limite de confiança de 95 %. Estes resultados validam o método proposto, uma vez que a recuperação ficou entre 80,00 a 110,00%, que é a razão considerada aceitável em estudo de confiança de um método [24], além de um baixo desvio padrão relativo 4,22%.
Avaliamos a precisão a partir do desvio padrão relativo (S(%)) das leituras feitas em 10 réplicas de cada amostra de Tiquira, realizadas no mesmo dia. Apresentamos na tabela 4 o resultado da repetibilidade e avaliação estatística. O desvio padrão relativo está entre 1,300 e 5,405, indicando que o método proposto possui boa precisão, já que valores próximos de até 15 % são considerados aceitáveis na validação de um método analítico [24].
Tabela 4 Avaliação da repetibilidade do sinal analítico para o complexo Cu(II)-PAN em amostras de Tiquira, tampão NaAc/HAc, pH 6,0 (n= 10).
 =
média com desvio padrão; S= desvio padrão; S(%)= desvio padrão relativo.
=
média com desvio padrão; S= desvio padrão; S(%)= desvio padrão relativo.
Calculamos a concentração mínima detectável a partir da equação 2, utilizando os resultados da curva analítica (curva padrão).
Onde K é uma constante e corresponde a três vezes o valor do ruído a partir do qual o valor lido pode ser considerado sinal analítico. No presente estudo o valor encontrado de SD (desvio padrão absoluto) e m (coeficiente angular) foram, respectivamente 0,0035 e 20251. Da Equação 2 calculamos o limite de detecção (LD) cujo resultado foi 3,3 X 10-2 mol L-1. Portanto, na tabela 5 mostramos um resumo das condições experimentais da reação de complexação.
Tabela 5 Condições experimentais recomendadas para a determinação de Cu(II) por espectrofo-tometria UV-Vis.
| Condições experimentais | Especificações |
|---|---|
| Comprimento de onda do complexo Cu(II)-PAN (nm) | 548 |
| pH | 6,0 |
| Tampão | Acetato de sódio/ácido acético |
| Faixa ideal de trabalho (mol L-1) | 1,0 X 10-6 a 1,0 X 10-5 |
| Catión metálico | Cu(II) |
| Limite de detecção (mol L-1) | 3,3 X 10-2 |
Aplicação do procedimento analítico proposto para a determinação de cobre em aguardente de mandioca (Tiquira)
O procedimento proposto foi aplicado para determinar a concentração de cobre em cinco amostras de Tiquira provenientes de municípios do Maranhão, cujas análises foram feitas em triplicatas. Na figura 9, apresentamos a curva analítica e os espectros de absorção referente à amostra 04 analisada pelo método da adição padrão. Como podemos observar, cada espectro apresentou bandas com boa resolução, indicando que outros íons metálicos, por venturas existentes na amostra, estão em quantidades inferiores ou iguais à concentração de interferência. Observamos ainda que a curva construída a partir dos espectros possui boa linearidade.
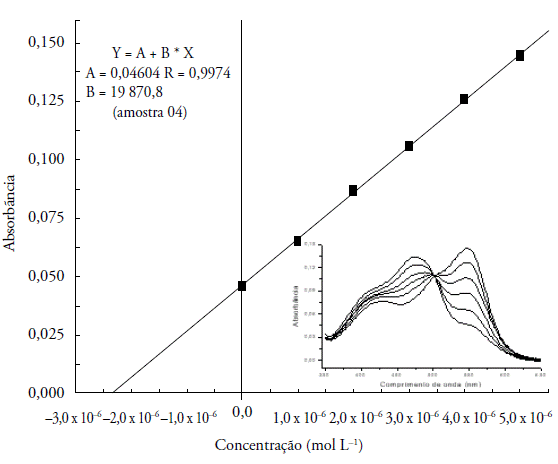
Figura 9 Curva de adição padrão de Cu(II) e espectros de absorção da amostra 04. [Cu(II)]= 10, 20, 30, 40 e 50 X 10-6 mol L-1 em tampão NaAc/HAc, pH 6,0, λ máx= 548 nm com [PAN]= 1 ' 10-5 mol L-1. Figura interna: espectros de absorção sobrepostos com adição padrão de Cu(II).
Na tabela 6, apresentamos a comparação entre os teores médios de Cu(II) em mg L-1 das cinco amostras analisadas com os valores encontrados por Espectrometria de Absorção Atômica (AAS) com o método proposto. Observamos que das cinco amostras de Tiquira analisadas, a de Nina Rodrigues (amostra 01) foi a que apresentou maior erro relativo, enquanto que as demais, com erro entre 5,76% a 11,11%, estão dentro da faixa aceitável [25], demonstrando que o método proposto pode ser considerado preciso. Assim, as concentrações de Cu(II) encontrada em todas as amostras estão acima da concentração máxima de 7,87 X 10-5 mol L-1 (5,0 mg L-1), recomendada pela legislação vigente [2].
Tabela 6 Dados da média da concentração de Cu(II) encontrado nas cinco amostras de Tiquira através do método proposto por adição padrão e a comparação como os resultados obtidos pela Espectrometria de Absorção Atômica (AAS).
| Amostra | Concentração média de cobre pelo método proposto (mg L-1) | Concentração de cobre por AAS (mg L-1) | Erro relativo (%) |
|---|---|---|---|
| 01 | 13,53 | 10,61 | 27,52 |
| 02 | 14,42 | 13,09 | 10,16 |
| 03 | 9,60 | 8,64 | 11,11 |
| 04 | 7,88 | 8,64 | 8,80 |
| 05 | 8,26 | 7,81 | 5,76 |
Descrevemos as características química da reação de complexação do Cu(II)-PAN a partir do método espectrofotométrico UV Vis. Como demonstrado, o complexo formado possui absorção máxima em 548nm, é estável em pH, levemente, ácido (pH= 6) e reage na proporção de 1:1 na relação do metal Cu(II) com o ligante PAN. Em relação ao método, este apresentou bons resultados na correlação, recuperação e desvio padrão. Apesar dos bons resultados no dimensionamento do método, constatamos que a concentração de cobre em Tiquira estava acima da máxima permitida pela legislação brasileira.
Existem vários métodos disponíveis para determinar cobre em cachaça ou aguardente, mas o método recomendado apresenta limitações. A AOAC (Association of Official Analytical Chemists) recomenda a espectrometria de absorção com chamas (do inglês FAAS). Nesse método, as soluções padrão são preparadas em meio alcoólico (50% v/v) e as leituras são feitas de modo direto sem ajuste da graduação alcoólica para construção da curva analítica de 0 a 0,96 mg L-1. No entanto, como há efeito da matriz, o método foi modificado, substituindo-se a curva de calibração por método de adição de padrões [26]. Apesar dessa modificação ajudar na determinação de cobre em aguardente, o método recomendado pela AOAC apresenta limitações, tais como: faixa linear de trabalho pequena e menor frequência analítica [27].
Apesar das limitações do método recomendado, observamos que os resultados do nosso estudo para as amostras de Tiquira apresentaram erros relativos aceitáveis (tabela 6) quando comparado com o método recomendado pela AOAC. Portanto, o método que propomos mostra-se uma alternativa ao método recomendado.
Embora o método proposto seja inovador, simples e prático para determinar cobre em Tiquira, este não é o único que foi realizado pelo método espectrofotométrico UV Vis e com o reagente PAN. No estudo realizado por [28], os autores utilizaram o sistema ternário homogêneo água, etanol e metilisobutilcetona (MIC) e dissolveram o reagente nesse solvente. No entanto, a diferença do nosso trabalho está na matriz, que nesse caso foi a aguardente de mandioca, enquanto o deles estão na aguardente de cana-açúcar. Portanto, os resultados do nosso estudo complementam aos que já se tem a respeito da determinação de cobre em aguardente.
CONCLUSÃO
A partir do método espectrofotométrico UV vis e da reação de complexação, descrevemos o comportamento do complexo PAN-Cu (II) e a determinação do teor de cobre em aguardente de mandioca. Do complexo PAN-Cu (II), conclui que absorção é maior em meio fracamente ácido, possui estabilidade em um tempo de 7 horas, proporções estequiométricas mínima de 1:1 do ligante e metal, os principais íons interferentes são o ferro (III) e o cobalto (II). Na aguardente, constatamos que o teor de cobre está acima do permitido pela legislação brasileira.