INTRODUÇÃO
A prospecção de novas moléculas com potencial efeito terapêutico, frente a diversas doenças na atualidade se faz necessária, em resposta à demanda por tratamentos mais inovadores, seguros e efetivos [1]. Assim, para que tais moléculas se viabilizem como fármacos, são necessárias etapas de avaliação de suas viabilidades de aplicação terapêutica, dentre as quais se destaca o delineamento farmacocinético, que aponta fatores associados à absorção, distribuição, metabolismo, excreção e toxicidade (ADMET) destes potenciais agentes terapêuticos [2]. Vale destacar que, grande parte das moléculas com atividade farmacológica promissora nos ensaios pré-clínicos falham em ensaios clínicos, muito em virtude de características farmacocinéticas inadequadas, como baixa estabilidade plasmática, rápida excreção e biodistribuição ineficaz [1-3]. Nesse contexto, com o intuito de superar as limitações farmacocinéticas de determinadas moléculas (como os peptídeos e proteínas), sistemas bioconjugados têm sido propostos. Esses sistemas empregam polímeros que, a exemplo do polietilenoglicol metil éter (mPEG-OH), resultam em aumento do tempo de meia-vida da molécula de interesse, redução do seu clearance renal, melhora da solubilidade e proteção contra inativação proteolítica [2, 3].
O polietilenoglicol (PEG) foi muito difundido na indústria como aditivo na produção de papel, agente de controle de viscosidade e precipitação de proteínas, e excipiente de formulações medicamentosas. Porém, foi somente na década de 70 que se explorou a conjugação deste polímero anfifílico com proteínas, com o pioneirismo do estudo de Abuchowski e Davis (1977) que resultou na conjugação da albumina bovina sérica com o mPEG-OH. A partir de então, a técnica da PEGuilação passou a ser mais explorada na bioconjugação de peptídeos, proteínas e oligonucleotídeos. De fato, o sucesso da PEGuilação levou ao lançamento de moléculas bioativas conjugadas na clínica, como o caso do Oncaspar® (Pegaspargase) e Cimzia® (Certolizumab pegol), que são atualmente empregados na terapia da leucemia e artrite reumatóide, respectivamente.
A polimerização de unidades de oxietileno (-CH2CH2O) pode resultar na formação dos polímeros de polietilenoglicol (PEG) ou polietilenoglicol metil éter (mPEG) de diversos tamanhos. Os índices de polidispersão variam de 1,01 para polímeros de PEG com massa molar entre 2-10 kDa e 1,2 para polímeros de alta massa molar. Por se tratar de polímeros com unidades monoméricas óxido de etileno, cada unidade monomérica é capaz de coordenar a 3-5 moléculas de água, o que aumenta o volume hidrodinámico do polímero de 10-15 vezes, retardando a excreção renal e prolongando a meia vida das moléculas conjugadas. A conjugação com tais polímeros também confere proteção frente à degradação química, redução da imunogenicidade, opsonização e agregação [2, 3].
Enquanto o PEG é um diol, i.e., tem dois sítios de reação; o mPEG contém um grupo metoxila e um grupo hidroxila que corresponde ao sítio de reação e que deve estar devidamente ativado para servir de agente de PEGuilação (figura 1). Assim, para conjugação do mPEG com o potencial alvo é necessário que o polímero esteja funcionalizado com um grupo reativo ao fármaco. O presente trabalho descreve a obtenção do polímero bromoacetil-mPEG-éster via bromoacetilação, com potencial aplicabilidade na conjugação com peptídeos e proteínas por reação de substituição nucleofílica bimolecular (SN2) [2-11].
MÉTODOS
A funcionalização do polímero mPEG-OH via reação de bromoacetilação foi realizada conforme metodologia de Benincasa et al. [8], com modificações. Foram empregados 151 µL (0,3 mmol) de mPEG-OH (Sigma Aldrich®) de 550 Da, os quais foram solubilizados em 2,5 mL de tolueno seco (Synth®). O solvente foi evaporado sob vácuo, a 80 °C até formação de um filme marrom. Posteriormente, o sistema foi mantido sob resfriamento a -10 °C, e em seguida foram adicionados 9 mL de diclorometano seco (DCM; Carlo Erba®) contendo 413 µL (2,5 mmol) de N,N-diisopropiletilamina (DIPEA; Sigma Aldrich®). A solução foi vigorosamente agitada por cerca de cinco minutos e, em seguida, foi adicionada sob gotejamento, solução contendo 413 µL (3 mmol) de brometo de bromoacetila (BrCH2COBr; Sigma Aldrich®) em 2 mL de diclorometano seco. A seguir, a solução foi agitada por 15 minutos a -5 °C e depois por 1 hora à temperatura ambiente (figura 2) [3].

Figura 2 Representação esquemática do procedimento de bromoacetilação do mPEG-OH proposto nesse estudo.
Após agitação à temperatura ambiente, 15 mL de isopropanol (Química Moderna®) foram adicionados e o diclorometano foi evaporado sob pressão. A solução em banho de gelo foi então submetida ao gotejamento de 10 mL de éter etílico (Dinámica®) e mantida sob agitação em resfriamento durante 1 hora. Em seguida, o produto foi filtrado sob vácuo e submetido a duas lavagens com cada um dos seguintes solventes, sequencialmente: 5 mL de isopropanol gelado, 5 mL de isopropanol:éter etílico (1:1) e 5 mL de éter etílico. O resíduo restante foi dissolvido em 7 mL de acetonitrila (Honeywell®), precipitado em éter etílico gelado sob centrifugação a 6600 rpm por cinco minutos e secado sob fluxo de nitrogênio (figura 2). Finalmente, o produto obtido foi caracterizado por espectrometría de massas por ionização/dessorção assistida por laser e análise por tempo de voo (MALDI-ToF; Bruker Daltonics Autoflex SmartBeam, MA) em matriz de ácido sinapínico [3].
RESULTADOS E DISCUSSÃO
Apesar de que atualmente se dispõem de diversos mPEG's funcionalizados comercialmente como o mPEG-succinato de succinimidila, mPEG-maleimidil, mPEG-carbonato de succinimidila, e mPEG-iodoacetamida, a ativação do mPEG in house ainda tem sido frequentemente empregada por indústrias químicas e farmacêuticas de todo o mundo. O procedimento adaptado de Benincasa et al. [8] e proposto nesse trabalho foi eficaz na obtenção do produto bromoacetil-mPEG-éster (mPEG-Br). Macroscopicamente, o mPEG-Br foi obtido como um sólido cristalizado amorfo (figura 3) e um rendimento bruto de 56,78 %. A verificação da formação do mPEG-Br se deu pelo espectro de massas MALDI ToF, demonstrando um sinal intenso correspondente ao íon molecular com razão massa carga igual a 671,644 [M+H+] (massa teórica 670 g.mol-1). Outro aspecto que corrobora este resultado é a diferença característica de 44 unidades entre os picos adjacentes, correspondendo à unidade monomérica (oxietileno) do mPEG-OH (figura 4).

Figura 4 Espectro de massas obtido por técnica MALDI-ToF, evidenciando o sinal intenso correspondente ao íon molecular de massa carga 671,664 [M+H+], confirmativo da obtenção do produto de interesse (bromoacetil-mPEG-éster).
Benincasa et al. [8] utilizaram mPEG-OH 20 kDa e nesse trabalho foi funcionalizado mPEG-OH com massa 36 vezes menor (550 Da). Nesse sentido, para se obter o produto precipitado foram utilizados dois ciclos utilizando éter etílico gelado e centrifugação a 6600 rpm (figura 2), adaptações feitas à técnica de Benincasa et al. [8]. Esses dois ciclos favoreceram a obtenção do polímero funcionalizado, pois o choque térmico induziu a precipitação e a centrifugação possibilitou a concentração do produto funcionalizado [12].
O brometo de bromoacetila tem dois sítios eletrofílicos susceptíveis ao ataque da hidroxila, a carbonila e o metileno, tal que as condições de reação empregadas favorecem a formação do produto esterificado [13, 14]. Considerando os mecanismos envolvidos nas duas possíveis reações, a etapa lenta da reação de adição à carbonila envolve um intermediário quaternário que mediante a saída do íon brometo leva à formação do produto esterificado [15]. Já na reação de substituição nucleofílica bimolecular, o mecanismo seria concertado com o ataque e simultánea saída do íon brometo, levando à formação do respectivo éter (figura 5).
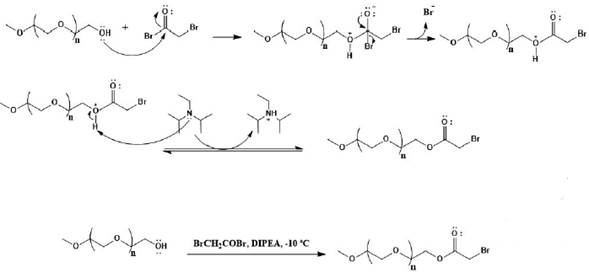
Figura 5 Mecanismo proposto da reação de bromoacetilação do mPEG-OH, evidenciando a formação do produto esterificado em etapa de precipitação com éter etílico gelado [14].
Nesse estudo mostramos, através da proposição do mecanismo de reação, que o controle de baixa temperatura favorece a reação de adição nucleofílica à carbonila em detrimento da reação de substituição nucleofílica bimolecular (figura 5) [13]. Isso resulta na disponibilidade do bromometil frente aos peptídeos e proteínas passíveis de reação, tendo em vista a susceptibilidade à reação com grupamentos nucleofílicos como sulfidrila (-SH) e amina (-NH2) levando à formação de ligação covalente estável com biomoléculas.
Uma vez que a reatividade do polímero mPEG-OH frente a peptídeos e proteínas depende da funcionalização da hidroxila com grupos eletrofílicos, o mPEG-Br destaca-se como um produto funcionalizado que pode ser empregado na conjugação com peptídeos e proteínas. A susceptibilidade dessas biomoléculas à conjugação com o mPEG-Br se dá pelo fato de que peptídeos e proteínas têm resíduos de aminoácidos contendo grupamentos nucleofílicos como -OH, -NH2, -SH, os quais são passíveis de reagirem com os grupos eletrofílicos presentes. Entretanto, vale destacar que para a reação de PEGuilação ocorrer normalmente, as reatividades dos grupamentos eletrofílico e nucleofílico devem ser compatíveis em termos reacionais com o pH, a temperatura, a concentração salina, e condições termodinamicamente favoráveis. Sendo assim, a ativação do PEG não deve ser considerada isoladamente durante a conjugação com as biomoléculas [2].
CONCLUSÃO
Com esse trabalho concluímos que, a exposição do mPEG ao brometo de bromoacetila (BrCH2COBr) em meio básico anidro, possibilita, mediante o controle de temperatura (-10 °C a 0 °C), a correta bromoacetilação do mPEG. Posteriormente, mostramos que o espectro de massas do MALDI-ToF foi capaz de caracterizar com eficiência o bromoacetil-mPEG-éster e que o controle da baixa temperatura reacional é essencial à obtenção do produto de interesse. Estudos adicionais deverão confirmar se o PEG esterificado nessas condições, poderá ser utilizado na conjugação com moléculas de natureza proteica ou peptídica por meio de substituição nucleofílica bimolecular. Assim, esse trabalho destaca as etapas e mecanismos envolvidos na ativação do mPEG por bromoacetilação, o que pode contribuir no desenvolvimento biofarmacêutico e melhora das propriedades terapêuticas de moléculas promissoras.
















