INTRODUCCIÓN
El desarrollo de nuevos productos es importante para la continua promoción de la salud humana y animal, sin embargo, es indispensable el estudio de metodologías alternativas que puedan evaluar la eficacia y la seguridad de estos productos. En este contexto, identificar y promover la implementación de métodos alternativos que puedan reducir, refinar y reemplazar (3R) el uso de animales de laboratorio en la investigación es urgente y desafiante [1]. Esta necesidad se hace más notoria con el continuo crecimiento de los productos naturales en el mercado, por ejemplo el uso de S. maxima y Kéfir como suplemento dietético [2-4]. Por otro lado en la biotecnología la manipulación de ovocitos, incluyendo los folículos preantrales, es usada para estudiar el fenómeno de la foliculogénesis y sus requerimientos metabólicos en cultivo in vitro [5-8] y con el propósito de tratar la infertilidad [9].
La técnica de estudio de manipulación de ovocitos incluidos en folículos preantrales (MFP) tiene diferentes ventajas además de los estudios fisiológicos [8, 10, 11], esta metodología puede usarse como un método alternativo que implementa la política de las 3R, que se refieren al uso de animales de laboratorio en investigaciones preliminares de varios fármacos y la evaluación de sustancias como los antioxidantes, las hormonas (FSH, LH, estradiol), los péptidos (péptido intestinal vasoactivo), y los factores de crecimiento (activin, GDF-9, KGF) [8, 12, 13]. Entre las sustancias que se pueden estudiar se encuentran los agentes tóxicos como el tabaco y las drogas utilizadas en la quimioterapia [10].
Un ejemplo de sensibilidad en los ovocitos a los compuestos naturales ha sido descrita en el Ginkgo biloba, porque durante su administración oral en ratones albinos suizos (Mus musculus) se encontró disminución de la fertilidad a la dosis de 14,8 mg/kg/ día [14].
El Centro Interagencial para la Evaluación de Métodos Toxicológicos Alternativos del Programa Nacional de Toxicología de los Estados Unidos (NICEATM, por sus siglas en inglés) afirma en su sitio web que las pruebas de toxicidad sistémica aguda se realizan tradicionalmente con ratas y que los enfoques como los ensayos de cultivos celulares reducen en gran medida el número de animales necesarios para estas pruebas.
En este artículo se estudiaron dos microorganismos: S. maxima y Kéfir. En el caso de Spirulina sp., esta microalga es una cyanobacteria usada como suplemento nutricional [15], también es conocida porque tiene ácidos fenólicos, tocoferol, betacaroteno y flavonoides con propiedades antioxidantes y antiapoptóticas [2, 16]. Estos antioxidantes han demostrado propiedades antiinflamatorias en ratas [15], así como genotoxicidad [17]. Estos eventos son reportados y monitoreados continuamente por el Comité Experto en Información de Suplementos Dietéticos de los Estados Unidos [18].
Kéfir es un consorcio de microorganismos que incluye bacterias acido lácticas y levaduras, que son usadas para fermentar productos lácteos [4, 19]. Se sabe que Kéfir estimula la respuesta inmune, es antiinflamatorio, antioxidante, hipoalergénico y con propiedades anti mutagénicas [20-24]. Kéfir contiene un exopolisacárido llamado Kéfiran que estimula el sistema inmune y evita la proliferación de células de cáncer [25]. Las funciones biológicas son explicadas porque los productos fermentados contienen fenoles y bioflavonoides clasificados como probióticos y bactericidas [26, 27]. Sin embargo, muchos de estos estudios resaltan la necesidad de estudiar la seguridad biológica antes de poder llamarse producto probiótico [23].
S. maxima and Kéfir son estudiados para diversas aplicaciones en salud, pero, se necesita de estudios complementarios para evaluar su toxicidad y su eficacia. Una de las directrices internacionales disponibles es la directriz ICH S6 [28], que facilita la realización oportuna de los ensayos clínicos y reduce el uso de animales de acuerdo con las 3R. Este apéndice justifica que varios métodos alternativos in vitro como: las células derivadas de mamíferos pueden predecir los efectos in vivo de un determinado biofármaco. Por otro lado, la FDA y la Unión Europea también alientan el uso de metodologías sin animales [29] y la guía de la Agencia Europea del Medicamento (EMA) en 2008 recomienda el uso de líneas celulares derivadas de mamíferos para predecir la actividad biofarmacéutica in vivo.
El presente estudio utilizó la técnica de MFP para evaluar la citotoxicidad de los extractos obtenidos a partir de S. maxima y Kéfir, con el fin de presentar la técnica de MFP como un posible método que puede contribuir con la política de las 3R por ser un método alternativo al uso de animales de laboratorio.
MATERIALES Y MÉTODOS
Extracto de Spirulina máxima
La cepa S. maxima fue proporcionada por la empresa Ouro-Fino de Ribeirão Preto en São Paulo, Brasil. Estas microalgas fueron cultivadas en tanques Raceway de 10 000 cm3 con medio de cultivo Zarrouk al 50 %, bajo agitación constante y con temperatura de 30 °C. Una vez que las microalgas fueron procesadas y secadas al sol, se utilizaron 10 g de estas y se mezclaron con 100 mL de agua estéril. Luego, la solución recibió 10 min de sonicación para causar lisis celular y la suspensión resultante se centrifugó a 12 000 g. El sobrenadante fue separado, liofilizado y esterilizado con óxido de etileno. Después de esto el extracto se mantuvo a temperatura ambiente en un recipiente al vacío. Un día antes de su uso, se prepararon suspensiones con cuatro concentraciones diferentes del extracto de S. maxima (10, 50, 100 y 200 µg.mL-1) y se almacenaron a -20 °C.
Extracto de Kéfir
Los granos de kéfir se fermentaron en 300 mL de suero de leche durante 48 h a 30 °C, el medio fue suplementado con 30% (p/v) de glucosa, 2% (p/v) de peptona, 4% (p/v) de fosfato y 4% (p/v) de citrato. Luego de la fermentación los granos de Kéfir fueron separados del medio líquido por centrifugación a 80 000 g para recuperar el sobrenadante. Posteriormente, se precipitó el sobrenadante con etanol absoluto durante 24 h a 4 °C y se recuperó el precipitado por centrifugación a 80 000 g, el cual fue lavado con agua destilada [27]. A continuación, se realizó una diálisis de 48 h, seguida de liofilización. El extracto obtenido se esterilizó con óxido de etileno y se almacenó al vacío. Un día antes de su uso, se prepararon suspensiones con cuatro concentraciones diferentes de extracto de Kéfir: 1,01 mg.mL-1; 5,05 mg.mL-1; 10,1 mg.mL-1 y 20,2 mg.mL-1 para obtener una concentración final dentro del ensayo experimental de: 10, 50, 100 y 200 µg.mL-1. Posteriormente todas las suspensiones se almacenaron a -20 °C hasta su uso en laboratorio.
Fuente de los ovarios
Los ovarios se colectaron en un frigorífico de Fortaleza-Ceará, Brasil. Se extrajeron 20 ovarios completos de diez cerdas jóvenes prepúberes de raza Yorkshire (Sus scrofa domestica). Los ovarios se lavaron una vez en etanol al 70% y dos veces en un medio mínimo esencial (MEM) que contenía 100 µg.mL-1 de penicilina, 100 µg.mL-1 de estreptomicina. Para transportar los ovarios hasta el laboratorio se usó medio de cultivo MEM a 37 °C [30]. En el laboratorio el córtex ovariano fue separado y cortado en pequeñas piezas cuadradas que fueron dejadas luego en medio de cultivo. Los grupos estudiados se organizaron en: grupo control (sin adición de extractos), grupo tratado con extracto de S. maxima y grupo tratado con extracto de Kéfir; El tiempo de cultivo fue de 1 y 7 días.
Protocolo experimental
El córtex de tejido ovariano fue cultivado de acuerdo la metodología de Mao et al. [30]. El medio de cultivo usado fue Alpha MEM, con pH entre 7,2 y 7,4, con 100 mg.mL-1 de ácido ascórbico, 1000 mg.mL-1 BSA, 200 µg/mL hipoxantina, 10 µg.mL-1 transferrina, 1 mM piruvato, 100 µg.mL-1 penicilina y 100 µg.mL-1 de estreptomicina. De acuerdo con varios protocolos en la literatura [12, 31] el córtex ovariano luego de disectado debe ser dividido en piezas de un tamaño aproximado de 5 mm x 5 mm x 1 mm usando un bisturí y bajo condiciones estériles. En esta metodología se debe tener en cuenta que una muestra debe ir para análisis histológico (control en fresco) y las otras muestras del mismo par de ovarios se colocan en un grupo cultivo de 1 día y otro grupo cultivo de 7 días (cada muestra en pozo individual). Por último, las muestras de tejido cortical fueron transferidas a platos de cultivo de 24 pozos, los cuales contenían 1 mL de medio de cultivo y 10 µL de extractos de S. maxima o Kéfir. Se evaluaron cuatro concentraciones (10, 50, 100 y 200 µg.mL-1) de cada extracto y posteriormente al término de los días de cultivo las muestras se analizaron por histología.
Análisis histológico
Las muestras se fijaron en una solución de paraformaldehído al 4% en PBS con pH 7,2 durante 12 h a 4 °C. Luego, se deshidrataron en concentraciones crecientes de etanol y se incluyeron en parafina. Las muestras histológicas se cortaron en secciones de 7 µm y se tiñeron con ácido periódico - Schiff (PAS) - hematoxilina. Cada sección fue evaluada con un microscopio óptico (Nikon, Tokio, Japón) en aumento de 400x.
Para realizar el análisis de las secciones histológicas, se evaluó en los tejidos ovarianos los folículos preantrales. Estos se clasificaron según su estado de desarrollo, el cual ya fue definido [6] como: 1. Folículos primordiales, los cuales tienen una capa de células de la granulosa de forma aplanada alrededor del ovocito. 2. Folículos en crecimiento, donde se incluyen los folículos primarios que poseen una capa de células de la granulosa de forma cuboidal y los secundarios que poseen dos o más capas de células de la granulosa.
Además de identificar el estado de desarrollo folicular, también los folículos preantrales se clasificaron en folículos sin alteraciones morfológicas y folículos con degeneraciones (no viables). Los folículos sin cambios en la morfología se evaluaron con base en la integridad de los ovocitos y las células de la granulosa, la presencia o ausencia de cuerpos picnóticos, la retracción ovoplásmica y la organización de las células de la granulosa (figura 1).
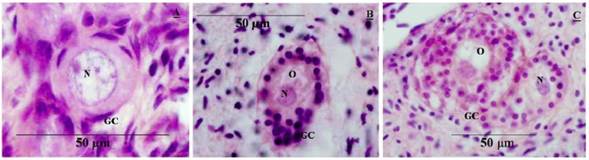
Figura 1 A) Folículos preantrales: folículo primordial sin cambios morfológicos. B) Folículo primario sin cambios morfológicos luego de 7 días de cultivo in vitro. C) Folículo preantral con cambios morfológicos que indican degeneración. (GC) células de la granulosa, (O) ovocito, (N) núcleo. Escala: 50 µm.
Los folículos con degeneraciones se identificaron como aquellos con un ovocito retraído, núcleo picnótico o células granulosas desorganizadas que se desprenden de la membrana basal. El porcentaje de folículos con cambios morfológicos, antes (día 0) y después del cultivo, indicó el porcentaje de supervivencia folicular (figura 1).
Análisis estadístico
Para cada uno de los extractos, los datos analizados contemplan una muestra control más cuatro grupos de concentraciones. De cada muestra se contaron 30 folículos (100%) y se dividió la población en tres grupos: folículos primordiales, folículos en desarrollo y folículos no viables. Luego de obtener un promedio para cada grupo, los valores fueron usados para el análisis estadístico. Las muestras control de los días de cultivo 0, 1 y 7 se analizaron sólo para establecer valores de referencia que pudieron ser comparados con los valores de los grupos tratados. Todos los datos fueron analizados en el programa R Commander y la normalidad de las muestras se evaluó mediante el teste de Shapiro-Wilk. Para evaluar la homogeneidad de los datos se utilizó el teste de Bartlett. El porcentaje de folículos primordiales y la supervivencia folicular, así como los diámetros de ovocitos y folículos fueron sometidos a análisis de varianza (Anova) realizando la prueba post hoc de Tukey para la comparación entre grupos [31].
RESULTADOS Y DISCUSIÓN
Los avances en salud en los últimos años han intentado disminuir el número de animales usados en experimentación. Para esto fueron creadas las 3R, reducir, refinar y reemplazar. En este contexto la técnica MFP puede reemplazar los animales de laboratorio y disminuir el número de repeticiones en un estudio, contribuyendo así con el bienestar animal y con el desarrollo de un posible algoritmo para tener en cuenta en el estudio de sustancias naturales (figura 2). Este algoritmo representa a MFP como una técnica para evaluar los extractos naturales y diferentes sustancias obtenidas por nuevos procesos biotecnológicos. En el caso de sustancias tóxicas ayudaría a ampliar la identificación de las moléculas citotóxicas y por el contrario si las sustancias son seguras, la técnica MFP puede ayudar a dirigir los estudios hacia la caracterización de moléculas para uso medicinal.
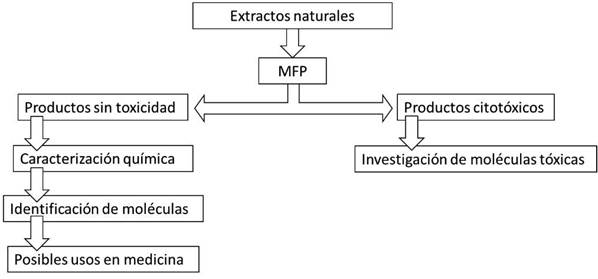
Figura 2 Algoritmo para la investigación de toxicidad y seguridad en sustancias naturales o las obtenidas por medio de biotecnología.
Análisis folicular
En el análisis realizado por la técnica MFP se encontró una disminución en el número de folículos preantrales durante la adición de los extractos de S. maxima y Kéfir. Esta baja en la población folicular se observó durante el día 1 y 7 de cultivo in vitro. A pesar de que la reducción en el número de folículos del grupo control es un parámetro esperado [32], en los extractos estudiados esta pérdida fue más marcada (tabla 1). Teniendo en cuenta las concentraciones ascendentes evaluadas de los extractos, 10, 50, 100 y 200 µg.mL-1, para el extracto de S. maxima los valores en la sobrevivencia folicular fueron entre: 63,33 ± 0,08 % a 48,66 ± 0,05 % en el día 1 de cultivo y para Kéfir estuvieron entre: 63,33 ± 0,08 a 50,00 ± 0,07 %. Los resultados para el día 7 de cultivo in vitro para el extracto de S. maxima fueron los más bajos variando entre: 47,33 ± 0,11% a 6,66 ± 0,07 % y para el extracto de Kéfir fueron entre: 43,33 ± 0,08 a 20,00 ± 0,03 %. Entre las dos sustancias naturales S. maxima fue el extracto con más toxicidad sobre la sobrevivencia folicular (p > 0,05), mientras que el extracto de Kéfir solo fue significativo en la concentración de 200 µg.mL-1 (tabla 1).
Tabla 1 Porcentaje de sobrevivencia del folículo preantral en las cerdas jóvenes en los días 0 y 7 con diferentes concentraciones de extractos de S. maxima, kéfir y grupos control.
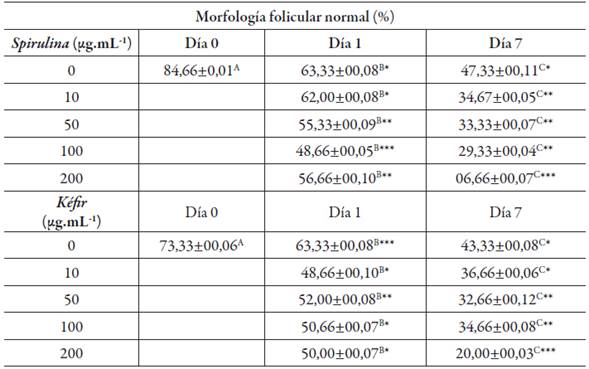
(*) El asterisco representa la igualdad entre las concentraciones de los extractos evaluados y las mayúsculas representan la similitud estadística entre los días de cultivo (p < 0,05).
Para analizar la activación y el desarrollo de los folículos preantrales se tuvo en cuenta la población de folículos en desarrollo a partir de su estado primario hasta antes de la formación del antro folicular (tabla 2). Para el extracto S. maxima se presentaron varios efectos adversos que indican toxicidad, el primer efecto negativo fue la baja activación folicular vista en las concentraciones de 50, 100 y 200 µg.mL-1 y el segundo efecto negativo fue la disminución del desarrollo folicular en la concentración de 200 µg.mL-1. Por otro lado, las concentraciones del extracto de Kéfir no influyeron de forma negativa sobre la activación y el desarrollo folicular porque no tuvieron diferencia con el grupo control (tabla 2).
Tabla 2 El porcentaje de activación de los folículos primordiales y el desarrollo de los folículos en los días cero, uno y siete con diferentes suspensiones de S. maxima y extracto de Kéfir.
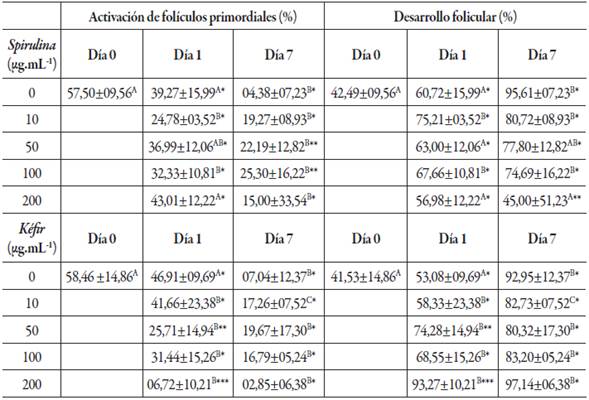
(*) El asterisco representa la igualdad entre las concentraciones de los extractos evaluados y las mayúsculas representan la similitud estadística entre los días de cultivo (p < 0,05).
El diámetro folicular y ovocitario fueron analizados porque permiten evaluar el crecimiento y la maduración de los folículos preantrales. El tamaño promedio para el grupo control fue un diámetro folicular de 40,5 ± 7,3 µm y para el diámetro ovocitario de 22,01 ± 2,8 µm luego de los 7 días de cultivo. Teniendo como referencia los anteriores diámetros, el extracto de S. maxima disminuyó significativamente el diámetro folicular (P<0,05) mientras que en el diámetro ovocitario no hubo diferencias estadísticas. Para el extracto de Kéfir no se encontraron diferencias para ninguna de las concentraciones evaluadas porque las concentraciones de 10, 50, 100 y 200 µg fueron estadísticamente igual a los grupos control (tabla 3).
Tabla 3 Diámetro de los folículos preantrales de las cerdas después del cultivo in vitro de 1 y 7 días con diferentes concentraciones (jig.mL-1) de S. máximas, Kéfir y grupo control.
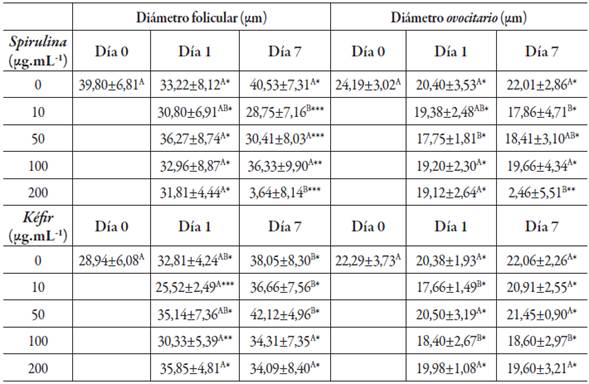
(*) El asterisco representa la igualdad entre las concentraciones de los extractos evaluados y las mayúsculas representan la similitud estadística entre los días de cultivo (p < 0,05).
El análisis estadístico muestra que a mayor concentración de extracto de S. maxima mayor toxicidad sobre la sobrevivencia y desarrollo folicular. Para el extracto de Kéfir solo se presenta toxicidad sobre la sobrevivencia folicular con la adición de 200 µg.mL-1.
Aunque no hay reportes de toxicidad para Spirulina spp., en varias investigaciones realizadas no se describe toxicidad sobre los tejidos como riñón, hígado, cerebro, bazo y eritrocitos [33]. En análisis practicados en peces zebrafish que fueron alimentados con S. platensis el número de huevos por desove disminuyó y la calidad de los huevos fue superior a los huevos del grupo control [34]. Sin embargo, en estos artículos no se evalúa la influencia de Spirulina spp. sobre la foliculogénesis. En este caso la técnica MFP muestra que hay toxicidad sobre sobrevivencia y el desarrollo folicular, evidenciando de esta manera la importancia de continuar ampliando los estudios de varios extractos naturales y sustancias obtenidas por bioprocesos. La toxicidad encontrada también se refuerza en los bajos diámetros ovocitarios encontrados (22,0 ± 2,8 µm y 2,46 ± 5,5 µm, tabla 3) y el pobre crecimiento de las células de la granulosa (entre 36,3 ± 9,9 µm y 3,6 ± 8,1 µm).
En relación al extracto de Kéfir, algunos estudios describen toxicidad subcrónica sin cambios histopatológicos [3, 35]. Esto puede confirmarse por la disminución de la sobrevivencia folicular con la concentración de 200 [zg.mL-1 y la ausencia de crecimiento del ovocito durante la evaluación de los diámetros. El óptimo desarrollo del ovocito y sus estructuras anexas son importantes para que una vez maduro el óvulo, este pueda ser fértil y también permita un desarrollo adecuado del embrión [36-38]. En este caso la falta de crecimiento ovocitario se evidencia en los diámetros descritos por Silva et al. [39], donde el valor de referencia fue de 26,0 ± 2,5 µm y 27,3 ± 2,8 µm. Estos diámetros ovocitarios fueron superiores a los presentados en esta investigación y a pesar de que el diámetro folicular muestra un mayor crecimiento en células de la granulosa, este comportamiento no justifica que los ovocitos puedan ser fértiles posteriormente, (crecimiento folicular fue de 42,1 ± 4.9 µm a 34,1 ± 8,4 µm y el ovocitário de 22,1 ± 2,2 µm a 18,6 ± 2,9 µm).
Los resultados del extracto de S. maxima muestran importantes efectos tóxicos sobre la foliculogénesis en todas las concentraciones evaluadas, mientras que para el extracto de Kéfir la concentración tóxica encontrada fue sobre los 200 µg.mL-1. Además de este resultado también se encontró alta variabilidad entre las repeticiones experimentales. Este fenómeno se puede explicar por las diferencias individuales relacionadas a la dieta y al estado fisiológico reproductivo [40, 41]. Este punto se debe tener en cuenta porque la mayoría de las muestras colectadas provienen de animales que son sacrificados en frigorífico y de diferentes sistemas de cría. También se debe resaltar que en tratamientos de superovulación, el estado fisiológico de cada hembra es altamente variable [42]. Por tanto, se debe tener en cuenta que es normal la alta variabilidad entre muestras durante los días de cultivo y que aun así la técnica MFP continúa siendo útil para la evaluación de la toxicidad.
Buenas prácticas de laboratorio
En la actualidad los modelos animales son usados en estudios de fármacos y diferentes sustancias porque su fisiología es similar a la de los humanos [1]. Debido a las nuevas políticas de protección animal, varias organizaciones en todo el mundo impulsan los estudios basados en metodologías diferentes al uso de animales, un ejemplo de esto son las técnicas in vitro [28, 29]. Por tanto, es necesario estudiar técnicas como el MFP, técnicas predictivas computarizadas [1] ,otras técnicas como el uso de bacterias y el cultivo de células de mamíferos in vitro [28] que podrían ofrecer alternativas.
A partir de este punto, se propone usar la técnica MFP en extractos de origen natural y durante los procesos de separación de moléculas para evaluar la seguridad y evitar el uso de animales. La técnica MFP puede ser auxiliada con otras técnicas como el test de Chopper, el cultivo de folículos aislados, la electroforesis para evaluar la fragmentación del ADN y la inmunohistoquímica (TUNEL). Este tipo de pruebas complementan los análisis de marcadores celulares apoptóticos y la integridad del folículo ovárico [31, 43-46].
Hoy en día los requisitos éticos en el uso de animales de laboratorio se han resumido en: reducir, refinar y reemplazar (3R) a través de la armonización de la declaración de Helsinki y las buenas prácticas de laboratorio. Todo esto en un intento de controlar el uso de animales en la investigación de acuerdo con las recomendaciones de varias organizaciones y leyes internacionales como: la directiva 2001/83/EC de la Agencia Europea de Medicamentos (EMA 2008), el Comité de Medicamentos para el Hombre (CHMP,) la regulación 1394/2007/EC, la Administración de Alimentos y Medicamentos (FDA), el Comité Coordinador Interinstitucional para la Validación de Métodos Alternativos (ICCVAM), el NTP Centro Interinstitucional de Evaluación de Métodos Toxicológicos Alternativos (NICEATM), la Organización Mundial de la Salud (WHO) y la Organización de Cooperación y Desarrollo Económicos (OECD). Sin embargo, a pesar de que varias de las anteriores organizaciones presentan nuevas alternativas y regulan el uso de animales, las metodologías alternativas al uso de animales aún son limitadas.
Se puede decir que la técnica MFP abraza la política de las 3R, porque reduce el número de animales sacrificados en los experimentos y aprovecha al máximo la unidad experimental [47], ya que con cada unidad se evaluaron todas las concentraciones de cada uno de los extractos. La técnica MFP también permitió refinar el uso de animales porque es una técnica menos invasiva, mejora las condiciones de bien estar animal y sustituye las microtécnicas de análisis de fluidos animales. La MFP es una técnica sensible en la experimentación, debido a que las células donadas con las que se trabajan no han son modificadas y porque este ensayo requiere siete días de cultivo, lo que es tiempo suficiente para analizar y autorizar su uso en los ensayos clínicos (Directiva 2001/83/ EC) [48]. Finalmente, reemplaza la tradicional prueba con animales, por una prueba basada en células donadas de los animales.














