INTRODUCCIÓN
La succinilcolina o suxametonio es un agente bloqueador neuromuscular despolarizante de acción ultracorta que se usa en anestesiología para facilitar la intubación traqueal y la ventilación mecánica [1, 2], que posibilita la reducción de la intensidad de las contracciones musculares producidas por medios farmacológicos o eléctricos [3-7]. Entre todos los bloqueadores neuromusculares, este muestra un inicio de acción de menor tiempo y un tiempo de recuperación rápido [8]. Se presenta como cloruro de succinilcolina o cloruro de suxametonio, en la bibliografía aparecen reportados los productos comerciales Anectine® y Mioflex® [9, 10].
En Cuba, la producción del medicamento succinilcolina (de concentración de dosis 50 mg/mL) en forma de inyección IM e IV se realiza en la unidad empresarial de base (UEB) de los Laboratorios Liorad; con presentación en bulbos de vidrio incoloro 20R, que en su formulación contiene alcohol bencílico como preservante [11]. Este medicamento tiene gran demanda por su uso en los procesos quirúrgicos [8, 11]. En visitas de poscomercialización realizadas a centros hospitalarios en distintas regiones del país (zona occidental, central y oriental), los especialistas en anestesiología plantearon que la presentación actual en bulbos 20R conlleva a desechar una porción del producto, lo que trae como consecuencia pérdidas económicas [12]. Actualmente, el Departamento de Investigación y Desarrollo (I+D) trabaja en un proyecto para el rediseño de la formulación de este inyectable como parte de la mejora continua de calidad del producto. Para el desarrollo del medicamento se tuvo en cuenta la formulación, Anectine®, (GlaxoSmithKline, S.A., España) y los resultados obtenidos en la solución inyectable succinilcolina 100 mg para uso infantil [13], que es un producto de nueva introducción en el cuadro de medicamentos nacional por la UEB de Laboratorios Liorad. El objetivo del presente trabajo fue desarrollar e introducir el inyectable succinilcolina 50 mg/mL en el cuadro básico de medicamentos.
MATERIAL Y MÉTODOS
Desarrollo de la formulación de succinilcolina 50 mg/mL
Se empleó para el desarrollo de la formulación el ingrediente farmacéutico activo (IFA) cloruro de succinilcolina del fabricante Micro Orgo Chem, India. Se estudiaron diferentes variantes de formulación con concentración de dosis 50 mg/mL, la primera y la segunda que contenían el IFA, los preservantes antimicrobianos (metilparabeno y propilprabeno, mezclados de 85 a 95 °C y posterior disminución de la temperatura de la mezcla de 25 a 35 °C antes de incorporar el IFA) y agua para inyección (API) como vehículo. Estas se envasaron en dos formatos diferentes de viales, 6R y 10R para evaluar dos presentaciones (1 y 2). Se elaboró una tercera variante que contenía el IFA, el API y sin preservantes antimicrobianos en su formulación, y se envasó en formato 6R, tomando como referencia la literatura consultada (Anectine®, GlaxoSmithKline, S.A. España) y los resultados obtenidos de forma previa en el desarrollo de la succinilcolina infantil 100 mg [13], registrado y comercializado por la UEB de Laboratorios Liorad e introducido en el cuadro básico de medicamentos nacional; también se estudió una formulación sin el uso del alcohol bencílico como preservante antimicrobiano.
Se analizó la influencia de los componentes y el envase sobre el contenido del fármaco durante 30 días, para lo cual se colocaron muestras a temperaturas entre 2 y 8 °C (estabilidad vida estante) y de 25 ± 2 °C, con humedad relativa de 60 ± 5% (estudio de estabilidad acelerado) [14].
Elaboración de lotes a escala de laboratorio de la formulación seleccionada
Se seleccionó la variante sin preservante para realizar tres lotes a escala de laboratorio (1,5 L cada uno), cumpliendo con las buenas prácticas de fabricación (BPF) de medicamentos [15, 16]. A los tres lotes recién elaborados se les realizaron los ensayos de control de calidad según se indica en la Farmacopea de los Estados Unidos (USP, por sus siglas en inglés), del año 2015 [17].
Evaluación del desempeño de las técnicas de análisis
Se definieron como técnicas de análisis los ensayos: características organolépticas, identificación (ensayo por cromatografía líquida de alta resolución (CLAR) y cromatografía en capa delgada), determinación de pH, partículas materiales, conteo de partículas en solución, determinación de endotoxinas bacterianas y el ensayo de esterilidad, según lo descrito en la USP [17]. Para analizar la valoración del IFA en el producto terminado se tuvo en cuenta lo que plantea el anexo N. °1 de las buenas prácticas para laboratorio de control de medicamentos del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed); con respecto a la validación de los métodos analíticos [18].
Esterilidad. Se realizó por el método de filtración por membrana, determinándose el volumen de lavado a emplear durante la ejecución del ensayo [17]. Se verificó que los lotes analizados no presentaron crecimiento microbiano en ninguno de los medios ensayados (cumpliendo la condición de estéril).
Determinación de endotoxinas bacterianas. El método empleado fue el del lisado de amebocitos del limulus (LAL) en su variante cromogénica cinética. El límite (no más que 2,0 UE/mg) aparece reportado en la farmacopea. Se definió la máxima dilución valida, se realizó la caracterización del producto para definir la dilución de trabajo y validar la dilución seleccionada [17].
Valoración del IFA (cloruro de succinilcolina) en el producto terminado. Se realizó la cuantificación directa del IFA contra una sustancia de referencia. Se consideraron valores adecuados en el rango de 90% a 110,0 % [17]. La evaluación del desempeño del método fue realizada por CLAR [18], con una columna de 4 mm x 25 cm, rellena con material L3, con una velocidad de flujo de aproximadamente 0,75 mL/min y detector a 214 nm.
Estudios de estabilidad a los lotes elaborados a escala de laboratorio
Se evaluó la estabilidad en vida estante y en condiciones aceleradas de succinilcolina 50 mg/mL (lotes de laboratorio). El estudio de estabilidad se realizó por hasta 150 días [14].
Elaboración de los lotes a escala piloto
Una vez culminado el estudio de estabilidad de los lotes a escala de laboratorio se procedió a realizar el escalado de tres lotes pilotos en la planta de producción con esta formulación. Estos se elaboraron cumpliendo con las BPF [15, 16].
Análisis del producto terminado
A los tres lotes pilotos recién elaborados se les realizaron los ensayos de control de calidad según la monografía de la farmacopea (USP 38).
Estudios de estabilidad
El estudio de estabilidad de los lotes pilotos se realizó en vida estante a temperaturas de 2 a 8 °C durante 12 meses y en condiciones aceleradas de 25 ± 2 °C y humedad relativa de 60 ± 5% hasta los 6 meses. Los parámetros evaluados en ambos estudios fueron los mencionados con anterioridad para los lotes a escala de laboratorio [14].
Lotes industriales
Al culminar los estudios de estabilidad de los lotes pilotos se presentó la solicitud de inscripción de la nueva formulación a la autoridad reguladora nacional (Cecmed), cumpliendo con los requisitos exigidos en la Regulación 61 del año 2012 [19].
RESULTADOS
En el desarrollo de la formulación, los resultados de valoración (contenido del IFA) y pH de las tres variantes ensayadas durante 30 días de estudio de estabilidad (vida estante y acelerada), se mantuvieron dentro de los límites establecidos [17]. La variante 3 en el tiempo de estudio mostró menos variabilidad en los resultados de pH y contenido de IFA tanto en el estudio realizado en vida estante, como en el estudio acelerado. Esto se tuvo en cuenta para la selección de la variante a emplear en la elaboración de los lotes a escala de laboratorio.
Al evaluar las características organolépticas, el pH inicial antes del ajuste y luego del enrase y la carga microbiana; en el control inicial de los lotes de laboratorio, cumplieron con los límites que se especificaron.
En esta etapa se definieron los puntos críticos del proceso tecnológico y se estableció el procesamiento aséptico para su elaboración y la filtración esterilizante [15].
En la evaluación del desempeño de las técnicas de análisis se determinó para realizar el ensayo de esterilidad del producto succinilcolina 50 mg/mL, un volumen de lavado de 400 mL de agua peptonada, a una concentración de 1 g/L [15, 17]. En la determinación de endotoxinas bacterianas, durante el ensayo de interferencia realizado a los tres lotes del producto a escala de laboratorio, se determinó la dilución a la cual el producto no mostraba interferencias con el método de ensayo (dilución 1/100) [17]. Los ensayos de validez, donde se retó la dilución de trabajo seleccionada con el reactivo LAL, mostraron que las muestras ensayadas cumplieron con el límite de endotoxinas bacterianas establecido (2,0 UE/mg). Se evaluó el desempeño del método cromatográfico para la cuantificación del IFA, de acuerdo con lo establecido en el anexo 1 del Cecmed: validación de métodos analíticos. Se fijaron las condiciones cromatográficas del ensayo [18].
El estudio de estabilidad (vida de estante y acelerado) realizado a los lotes elaborados a escala de laboratorio durante 150 días se muestran en las tablas 1 y 2. Todos los lotes cumplieron con los límites establecidos para cada ensayo realizado en las condiciones de temperatura de 2-8 °C. Los lotes almacenados a 25 ± 2 °C y 60 ± 5% de humedad relativa también cumplieron con las especificaciones de calidad durante el período evaluado, según se aprecia en la tabla 2. Los resultados obtenidos de los lotes piloto recién elaborados se muestran en la tabla 3.
Tabla 1 Estudio de estabilidad vida estante de los lotes de laboratorio.
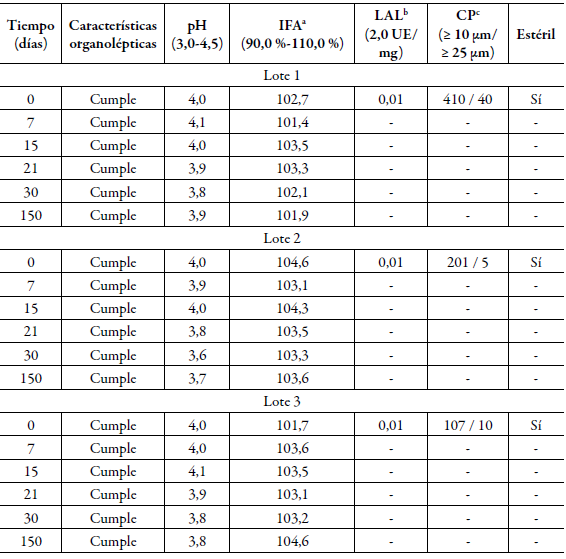
a Ingrediente farmacéutico activo, b Lisado de amebocitos del Limulus, c Conteo de partículas. Características organolépticas: líquido transparente e incoloro, libre de partículas visibles.
Tabla 2 Estudio de estabilidad acelerado de los lotes de laboratorio.
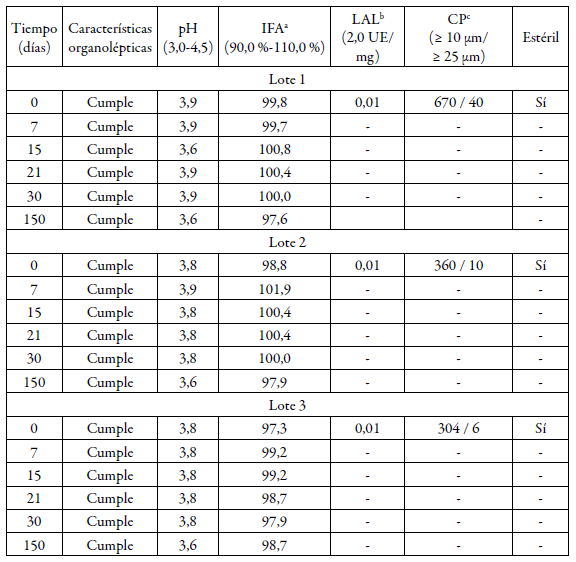
a Ingrediente farmacéutico activo, b Lisado de amebocitos del Limulus, c Conteo de partículas. Características organolépticas: líquido transparente e incoloro, libre de partículas visibles.
Tabla 3 Resultados del control de calidad (lotes pilotos).
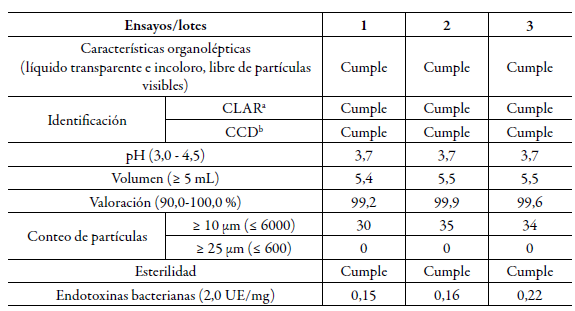
a Cromatografía líquida de alta resolución, b Cromatografía en capa delgada.
Una vez concedido el certificado de registro sanitario [20], por el CECMED, y realizadas las transferencias tecnológica y analítica fueron elaborados los tres primeros lotes a escala industrial, con sus correspondientes controles de calidad y se elaboró el protocolo para evaluar la estabilidad de estos.
DISCUSIÓN
El IFA cumplió con los requisitos de calidad requeridos para ser utilizado en el diseño de la formulación y el proceso tecnológico para la fabricación del producto terminado, succinilcolina 50 mg/mL.
En los estudios realizados en la etapa de formulación de las tres variantes se pudo constatar que en todos los casos cumplieron con los límites establecidos, lo que muestra que, ni el envase empleado ni los componentes de las formulaciones interfirieron con los resultados (no influyeron sobre el contenido del fármaco); por lo que se hubiese podido seleccionar cualquiera de las tres variantes ensayadas.
La formulación a escala de laboratorio compuesta por el cloruro de succinilcolina (50 mg/mL), sin preservante y con agua para inyección como vehículo resultó adecuada ya que se obtuvo un producto acorde con las especificaciones de calidad establecidas. Esto permite afirmar que es posible obtener el inyectable en solución acuosa de succinilcolina.
Los métodos de análisis oficiales utilizados resultaron adecuados para el control de calidad y los estudios de estabilidad del inyectable reformulado. La técnica de análisis diseñada para la valoración del contenido del IFA resultó apropiada para el control del proceso de producción al ser un método específico, preciso y exacto. La dilución de trabajo (ensayo de endotoxinas bacterianas) y el volumen de lavado de agua peptona (ensayo de esterilidad) fueron las condiciones establecidas para la realización de los ensayos de rutina; para la liberación de los lotes del producto terminado de succinilcolina 50 mg/mL [16-18].
Los resultados obtenidos de los lotes a escala piloto, recién elaborados, evidencian que se trabajó bajo condiciones que garantizaron un estricto cumplimiento de las BPF, establecidas para la producción de inyectables [15, 16]. Se logró una tecnología fácilmente escalable.
El estudio de estabilidad acelerada (seis meses) y la vida estante (veinticuatro meses) permitieron evaluar la estabilidad física, química y microbiológica de la succinilccolina 50 mg/mL [15]. Además, de establecer el periodo de validez y las condiciones adecuadas de almacenamiento del producto en el envase propuesto para su comercialización. Con ello, el Cecmed otorgó el registro sanitario de medicamentos [20], con un periodo de validez de veinticuatro meses. La tecnología propuesta resultó propicia para elaborar la formulación parenteral acuosa de succinilcolina, en la UEB de Laboratorios Liorad [17].
Los lotes a escala industrial cumplieron con las especificaciones de calidad, fueron comercializados y distribuidos por el país, así se logró la introducción de este producto en el cuadro básico de medicamentos nacional [21].
CONCLUSIONES
Se demostró la factibilidad de la tecnología propuesta para elaborar una formulación parenteral en solución acuosa de succinilcolina 50 mg/mL, en las condiciones actuales de la UEB de Laboratorios Liorad y se logró la introducción de este producto en el cuadro básico de medicamentos nacional.














