INTRODUCCIÓN
Los péptidos y las proteínas son moléculas que participan en la mayoría de los procesos biológicos que tienen lugar en los organismos vivos. Por esta razón, han sido el foco de numerosas investigaciones en las últimas décadas y se han constituido en una poderosa alternativa para el desarrollo de productos farmacéuticos de última generación. Como producto de estas investigaciones se han reportado moléculas peptídicas con diversas actividades biológicas: antioxidantes, antimicrobianos, anticancerígenos, antihipertensivos, citomoduladores e inmunomoduladores, entre otros. Lo anteriormente descrito refleja el creciente interés en la terapéutica basada en productos farmacéuticos que contienen péptidos sintéticos como ingrediente activo. Actualmente, en el campo farmacéutico, se estima que más de 60 fármacos peptídicos han sido aprobados, alrededor de 155 candidatos peptídicos se encuentran en estudios clínicos y se adelantan estudios preclínicos con más de 500 moléculas de esta naturaleza [1, 2].
De manera análoga, en el desarrollo de productos cosmecéuticos, los péptidos se han convertido en una nueva alternativa para el tratamiento del envejecimiento de la piel. Se ha reportado que algunos péptidos juegan un papel importante en la modulación de la proliferación celular, la migración celular, la inflamación, la angiogénesis y la melanogénesis [3]. En el campo cosmético, entre este tipo de moléculas se destaca el neuropéptido Ac-EEMQRR-NH2, también conocido como Argireline. Este péptido de naturaleza hidrofílica corresponde a una secuencia de seis aminoácidos, la cual presenta un grupo acetilo en el extremo N-terminal y la función amida en el extremo C-terminal. La secuencia es derivada de la región N-terminal de la proteína SNAP-25, esta se asocia con la proteína sinaptobrevina y la proteína sintaxina para formar el complejo SNARE, que es esencial para la liberación del neurotransmisor acetilcolina, este favorece la contracción muscular. El acetilhexapéptido-3 compite con la proteína SNAP-25, alterando la formación del complejo SNARE e inhibiendo la liberación de acetilcolina, lo que genera la parálisis muscular local de manera temporal; mecanismo mediante el cual se sugiere son atenuadas las líneas de expresión [4]. Adicionalmente, se ha reportado que este neuropéptido es totalmente inocuo, a diferencia de la toxina botulínica [5]. Es posible obtener las moléculas peptídicas como producto de hidrólisis de proteínas, mediante la tecnología de ADN recombinante o síntesis química. Es posible llevar a cabo la síntesis química en solución o SFS, esta es considerada una de las rutas más viables para la obtención de péptidos sintéticos de bajo peso molecular [6, 7].
Los péptidos sintéticos presentan una actividad biológica altamente específica y un perfil de seguridad bastante bueno, pero se ha reportado que son muy sensibles al ataque enzimático y pueden ser inestables a las variaciones de pH y temperatura, por lo que presentan una vida media relativamente corta y se requiere administrar dosis muy altas, preferiblemente, por vía parenteral [8-10]. Adicionalmente, estas moléculas, en casos particulares, presentan propiedades biofarmacéuticas como baja solubilidad acuosa y dificultad para permear membranas biológicas. Para superar estos inconvenientes, la investigación sobre tecnología farmacéutica ha aumentado, específicamente, en el diseño y desarrollo de sistemas no convencionales para su administración, con el propósito de obtener productos farmacéuticos más seguros, estables y eficaces. Entre los sistemas estudiados para la administración de péptidos sintéticos se destacan los liposomas, las microemulsiones y las micro y nanopartículas de diversa naturaleza [11-13]. Los liposomas se han utilizado como sistemas para la liberación no convencional de numerosos ingredientes farmacéuticos activos (IFA) anticancerígenos, antibióticos y antifúngicos, entre otros. Estos sistemas permiten minimizar efectos adversos asociados con IFA y posibilitan su administración por diferentes vías [14, 15]. Por otra parte, en el campo de los productos cosmecéuticos, los liposomas han sido ampliamente estudiados por su benéfico efecto sobre la piel y también como sistema para la administración de ingredientes activos [16].
En este contexto, el objetivo de este estudio fue sintetizar el neuropéptido Ac-EEMQRR-NH2 mediante SFS y, posteriormente, desarrollar un sistema liposomal para su microencapsulación. El acetilhexapéptido-3 se sintetizó empleando la estrategia Fmoc/tBu y se caracterizó mediante cromatografía líquida en fase reversa (RP-HPLC), espectrometría de masas (ES-MS) y dicroísmo circular (DC). Los sistemas liposomales con el péptido microencapsulado fueron obtenidos mediante la formación de una emulsión seguida de la evaporación del solvente orgánico e inversión de fase. Estos sistemas fueron caracterizados en su tamaño, potencial zeta, eficiencia de encapsulación del acetilhexapéptido-3 y se llevó a cabo un estudio preliminar de permeabilidad mediante un ensayo ex vivo. Los resultados demostraron que es posible obtener un neuropéptido con bajo número de residuos mediante SFS Fmoc/tBu con alto grado de pureza y buen rendimiento. Por otra parte, el sistema liposomal, conteniendo como ingrediente activo el acetilhexapéptido-3 sintetizado químicamente, tiene potencial para el desarrollo de un novedoso producto cosmecéutico.
MATERIALES Y MÉTODOS
Materiales
Resina Rink-amida (0,46 meq/g), Fmoc-Arg(Pbf)-OH, Fmoc-Gln(Trt)-OH, Fmoc-Met-OH, Fmoc-Glu(OtBu)OH, 1-hidroxibenzotriazol (HOBt) y N,N -diciclohexil carbodiimida (DCC) fueron adquiridos de Aapptec®. 4-metilpiperidina, anhídrido acético, A7, N,N-dimetil formamida (DMF), diclorometano (DCM) de Panreac®. Triiso-pripilsilano (TIS), 1,2-etanoditiol (EDT), ninhidrina, fenol, trifluoroetanol (TFE) de Merck®. Alcohol isopropílico (IPA), cianuro de potasio (KCN), metanol, éter etílico, acetonitrilo (AcN) y ácido trifluoroacético (TFA) de Honeywell Burdick and Jackson. L-α-fosfatidilcolina de soya (FoC), colato de sodio (CS), deoxicolato de sodio (DCS) y Tritón X-100 fueron adquiridos de Sigma® y búfer de fosfatos pH=7,4 (PBS) de Lonza®.
Síntesis de acetilhexapéptido-3
El acetilhexapéptido-3 Ac-EEMQRR-NH2 fue obtenido mediante la metodología SFS, empleando la estrategia Fmoc/tBu [6, 17]. (i) 1 g de resina Rink amida (0,66 meq/g), como soporte sólido, se sometió a un proceso de hinchamiento con DCM mediante agitación constante (AC) a temperatura ambiente (TA). (ii) Seguidamente la resina fue tratada con una solución de 4-metilpiperidina 20 % en DMF para remover el grupo protector Fmoc y dejar el grupo amino disponible para el acople del primer aminoácido de la secuencia. (iii) Para la reacción de acople, se preparó una solución del Fmoc-amino ácido/DCC/HOBt (1/1/1) en DMF y se adicionó a la resina desprotegida. (iv) Luego del acople del primer aminoácido, se llevaron a cabo reacciones sucesivas de remoción del grupo FMOC y de acople para cada uno de los aminoácidos, hasta completar la secuencia deseada. Estas reacciones fueron monitoreadas mediante la prueba de Kaiser [18]. v) Al finalizar el acople de todos los aminoácidos de la secuencia, la resina péptido se trató con solución de desanclaje (TFA/TIS/EDT/H2O 92,5/2,5/2,5/2,5) a TA y AC. Después de la reacción, la resina se separó mediante filtración y en el filtrado se precipitó el péptido mediante la adición de éter etílico frío. El acetilhexapéptido-3 seco se pesó y almacenó para su posterior caracterización.
Caracterización de acetilhexapéptido-3
El acetilhexapéptido-3 crudo se disolvió en solvente A (H2O:TFA 0,05%) y se analizó en el cromatógrafo HPLC Agilent series 1260. El sistema cromatográfico empleado fue elución por gradiente de 0 a 70 % de solvente B (ACN:TFA 0,05%) en 45 minutos, empleando una columna Agilent XDB-C18, flujo de 1 mL/minuto y detección a 210 nm. Basados en el resultado RP-HPLC analítica, se diseñó un método para la purificación del péptido mediante extracción en fase sólida (RP-SPE) empleando una columna Super Clean LC-18 de 5 g. El acetilhexapéptido-3 se disolvió en solvente A, filtró y aplicó a la columna para, posteriormente, realizar su elución por gravedad con fases móviles de diferente polaridad. Cada una de las fracciones colectadas fue analizada por cromatografía RP-HPLC analítica y las fracciones puras fueron sometidas al proceso de liofilización [17]. El producto liofilizado fue analizado mediante ES-MS, utilizando LCMS-IT-TOF (Shimadzu®) con inyección directa para determinar el peso molecular del péptido. ESI ionización positiva con la tensión de detector 1,35 kV y el ionizador tensión [+] =4,50 kV en un intervalo de 100 a 2000 m/z. El análisis por dicroísmo circular (DC) se realizó a TA utilizando un espectro polarímetro Jasco J-810. El acetilhexapéptido-3 fue disuelto en 30% TFE en PBS a una concentración 0,1 mM y el espectro se registró en un rango de longitud de onda de 190 a 260 nm.
Obtención de liposomas
Los sistemas liposomales se obtuvieron basados en el método de formación de una emulsión y posterior evaporación del solvente orgánico para seguidamente inducir la inversión de fases [19]. Brevemente, la FoC se disolvió en 12 mL de éter etílico (fase orgánica, FO), mientras que el agente tensioactivo (CS o DCS) y el acetilhexapép-tido-3 sintetizado se disolvieron en 4 mL de PBS (fase acuosa, FW). La FW se dispersó en la FO y se sometió a un proceso de homogenización con ultrasonido (Q-sónica 125) para obtener una emulsión W/O. Este sistema fue sometido a un proceso de evaporación del solvente orgánico empleando un evaporador rotatorio (Buchi® modelo R) hasta la formación de una fase gel. Esta fase fue agitada usando un mezclador de vórtice (IKA® Vortex 3) hasta obtener un sistema fluido, evidencia de la inversión de fases y el solvente orgánico residual se eliminó mediante evaporación rotatoria [20]. Posteriormente, la mitad de los sistemas obtenidos fueron sometidos a un proceso adicional de homogenización mediante ultrasonido y, finalmente, en todos los sistemas se llevó a cabo el aislamiento de los liposomas mediante ultrafiltración, para su caracterización.
Diseño experimental
Con el propósito de simplificar el número de ensayos en esta aproximación, se utilizó el diseño estadístico experimental. Se definieron tres variables independientes (X1 a X3) con el propósito de evaluar su influencia en la producción de liposomas con el acetilhexapéptido-3 encapsulado (tabla 1). El nivel de cada variable independiente fue definido con base en lo reportado en la literatura [21-23] y en resultados preliminares obtenidos en el marco del desarrollo de esta investigación. Por otra parte, se definieron tres variables dependientes o respuesta: tamaño promedio de partícula (nm), índice de polidispersidad (IPD) y eficiencia de encapsulación (EE) del neuropéptido. Teniendo en cuenta esto, se realizó un diseño experimental factorial reducido de la forma 2P-K donde P=3 y K=1 [24, 25], lo que permitió trabajar con cuatro unidades experimentales (UE) y tres variables independientes en dos niveles. Además de las cuatro UE derivadas del diseño experimental reducido, se incluyó una UE como referencia, en la cual se utilizó el nivel bajo de FoC y no se utilizó agente tensioactivo, como se describe en la tabla 2. De cada una de las cinco UE se realizaron seis réplicas, de las cuales tres de ellas fueron sometidas a un proceso de homogenización final mediante ultrasonido durante 45 segundos.
Tabla 1 Diseño experimental factorial reducido para la obtención de un sistema liposomal con acetilhexapéptido-3 encapsulado.
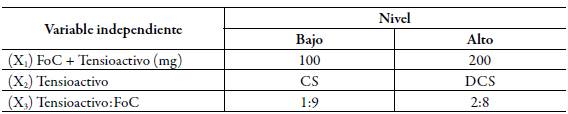
FoC: L-α-fosfatidilcolina de soya, CS: colato de sodio y DCS: deoxicolato de sodio. En todos los ensayos se mantuvo constante un volumen de 12 mL para FO, 4 mL para FW y 5 mg de péptido sintético disuelto en la FW.
Tabla 2 Unidades experimentales desarrolladas para la encapsulación de acetilhexapéptido-3 en sistemas liposomales obtenidos mediante inversión de fases por evaporación del solvente.
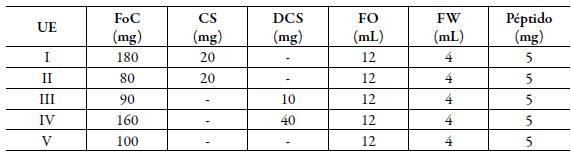
FoC: L-α-fosfatidilcolina de soya, CS:colato de sodio, DCS: deoxicolato de sodio, FO: éter etílico, FW: búfer de fosfatos pH=7,4 (PBS) y péptido: acetilhexapéptido-3. UE I-IV: derivadas del diseño estadístico factorial reducido y UE V: incluida como referencia.
Caracterización de liposomas
El tamaño medio y el potencial zeta de los sistemas liposomales conteniendo el acetilhexapéptido-3 encapsulado fueron determinados por el método de dispersión de luz dinámica utilizando un Zeta Sizer® Nano ZS (Malvern Instruments).
Para determinar la eficiencia de encapsulación (EE), una alícuota de la dispersión liposomal fue dispensada en un sistema Amicon Ultra® 0,5 (MilliporeUltracel-10 kDa). El sistema se centrifugó durante 30 minutos a 14 000 g, el sedimento se lavó con PBS y centrifugó nuevamente (en las mismas condiciones), el filtrado se reservó para determinar el acetihexapéptido-3 no encapsulado. Con el propósito de cuantificar el neuro-péptido encapsulado, el sedimento fue tratado con una solución de Tritón X-100 2 % bajo agitación a 65 °C durante 10 minutos. Tanto el acetilhexapéptido-3 no encapsulado como el encapsulado fueron determinados mediante RP-HPLC. La EE (%) fue calculada a partir de la relación entre el péptido encapsulado y la cantidad de péptido inicial en el proceso de encapsulación.
Evaluación preliminar ex vivo de permeabilidad
Para este estudio se emplearon celdas de Franz, con un área de difusión promedio de 1,62 ± 0,07 cm2 y un compartimento receptor 15,5 ± 0,8 mL. Se utilizó una membrana de 4 cm2 de superficie proveniente de la parte interna de oreja de cerdo y para la obtención de una membrana integra se siguieron la reglas de la guía OECD [26]. Al compartimento receptor de la celda se adicionó solución PBS y en el compartimento donador se colocó una dispersión del sistema liposomal a evaluar o una solución de acetilhexapéptido-3 en PBS. El sistema se colocó en agitación constante a 400 rpm y a una temperatura de 32 °C durante todo el periodo del ensayo. A intervalos de tiempo establecidos se realizó el muestreo del compartimento receptor, con la correspondiente reposición con PBS fresco. Los ensayos se realizaron por triplicado y la cuantificación de acetilhexapéptido-3 permeado se realizó mediante RP-HPLC.
RESULTADOS Y DISCUSIÓN
Los productos o ingredientes cosmecéuticos tienen la capacidad de proporcionar no solamente beneficios para el cuidado de la piel, sino que pueden presentar potenciales indicaciones farmacéuticas, las cuales dependen de la presencia de un activo natural y de su accesibilidad al blanco terapéutico [27]. En ese contexto, la presente investigación se encaminó, en primera instancia, a la obtención mediante SFS del neuropéptido antiedad acetilhexapéptido-3, cuya secuencia corresponde a Ac-EEMQRR-NH2. Simultáneamente, se enfocó al diseño y desarrollo de un sistema liposomal con características que permitiera la encapsulación del neuropéptido y de esta forma favorecer su permeación en una membrana modelo para obtener un sistema con potencial uso en el desarrollo de un novedoso producto cosmecéutico. El acetilhexapéptido-3 fue seleccionado para este estudio por su demostrada actividad para minimizar las líneas de expresión y porque ha surgido como una alternativa segura a la toxina botulínica, cuyas limitaciones de uso son conocidas [4, 5].
La síntesis del acetilhexapéptido-3 se llevó a cabo de mediante SFS utilizando la estrategia FMOC/tBu, esta metodología se constituye en la mejor alternativa para obtener péptidos sintéticos de bajo peso molecular, con buen rendimiento y un alto grado de pureza. En este proceso, las reacciones de acople y de desprotección de cada uno de los residuos de aminoácidos de la secuencia del neuropéptido fueron asistidas por radiación microondas, aprovechando que el suministro de energía cinética al seno de la reacción es considerado como uno de los mayores avances en la síntesis de péptidos, con el propósito de alcanzar reacciones completas en un menor tiempo. De otra parte, esta condición contribuye a minimizar la agregación de cadenas peptídicas, mejorando considerablemente la calidad del producto de síntesis.
El rendimiento del proceso de síntesis para el péptido crudo fue del 92 %, mientras que para el péptido puro fue cercano al 40 %, se obtuvo un producto con una pureza superior al 90 %, estos resultados se consideran bastante buenos, teniendo en cuenta la cantidad y complejidad de las reacciones que se deben realizar para obtener este tipo de moléculas. En lo que se refiere a la caracterización del acetilhexapéptido-3 mediante RP-HPLC; en el panel a de la figura 1 se observa un perfil cromatográfico con una señal principal (tR: 8,3 m y 64 % de pureza) para el péptido crudo y algunas señales de menor intensidad y mayor tiempo de retención, probablemente, atribuidas a especies peptídicas en las cuales no fue totalmente retirados los grupos protectores de las cadenas laterales de los aminoácidos presentes en la secuencia. En el panel b se observa un perfil cromatográfico con una especie mayoritaria (tR: 8,2 m y 90 % de pureza), que hizo evidente el eficiente proceso de purificación al que fue sometido el acetilhexapéptido-3 mediante RP-SPE. Esta especie pura fue caracterizada por ES-MS y DC cuyos espectros se reportan en el panel c y d, respectivamente. La señal registrada en el espectro de masas corresponde a (m+2)/2, así de esta forma la masa molecular del péptido sintetizado fue de 888,44 daltons, esto es equivalente a la masa calculada teóricamente e indica que el producto de síntesis corresponde a la molécula que se deseaba obtener.

Figura 1 Caracterización de acetilhexapéptido-3. Perfil cromatográfico RP-HPLC a: péptido crudo y b: péptido puro. Espectro de masas ES-MS c: péptido puro y dicroísmo circular DC y d: péptido puro.
Respecto al análisis por DC del acetilhexapéptido-3, como se observa en el panel d, de acuerdo con los mínimos registrados aproximadamente en 203 nm, 230 nm y un máximo en 197 nm, se sugiere que la secuencia de aminoácidos del neuropéptido sintetizado, a pesar de ser corta, presenta elementos de estructura secundaria característicos de a-hélice, la cual podría estar relacionado con su capacidad para inhibir la formación del complejo SNARE e inhibir la liberación del neurotransmisor acetilcolina y, de esta forma, causar la parálisis temporal en músculo facial minimizando la generación de líneas de expresión. Todos los resultados de la caracterización fisicoquímica indican que el neuropéptido fue sintetizado de manera eficiente y con alta pureza, para posteriormente ser utilizado en el estudio de su encapsulación en un sistema liposomal.
Los sistemas liposomales se han empleado como una de las estrategias para superar las limitaciones atribuidas a las propiedades fisicoquímicas de algunos IFA. Los péptidos sintéticos no han sido ajenos a este desarrollo y han sido objeto de numerosos estudios con estos sistemas [28]. Luego de una revisión exhaustiva, para el diseño y desarrollo de los liposomas para la encapsulación del acetilhexapéptido-3, se planteó trabajar con FoC como principal precursor de estos sistemas, ya que es el glicerofosfolípido más estudiado y, probablemente, el más utilizado para ello, además, es considerado el más abundante en la naturaleza. En cuanto a las cantidades de FoC como agente formador del sistema liposomal, está reportado que se debe trabajar con la cantidad necesaria para mantener la emulsión primaria estable durante al menos media hora luego del proceso de homogenización por ultrasonido [19]. En estudios preliminares de nuestro grupo (datos no reportados) se determinó que la cantidad de FoC apropiada para que la primera emulsión (W/O) fuera estable, se encontraba entre 80 y 180 mg en un volumen de 12 mL de éter etílico (FO). Por otra parte, se determinó que el volumen óptimo de FW fue de 4 mL de PBS, en el cual se disolvió completamente el acetilhexapéptido-3 y el agente tensioactivo, de acuerdo con las UE derivadas del diseño experimental. En lo que se refiere CS y DCS, estas son sales biliares denominadas como tensioactivos fisiológicos o "biotensioactivos" [21] y constituyen uno de los más importantes grupos de adyuvantes estabilizantes en las preparaciones farmacéuticas heterodispersas; por esta razón fueron incluidos en nuestro estudio para la obtención de los sistemas liposomales. Adicionalmente, se ha reportado que la utilización de estos tensioactivos de carácter aniónico asociados con un fosfolípido facilita la permeación o penetración el sistema a través de la piel, ya que se generan los denominados liposomas flexibles [22, 29].
En la tabla 3 se reportan los resultados de la caracterización de los sistemas liposomales obtenidos, se observó que el efecto de las variables independientes sobre cada variable respuesta definida para este estudio dependen de cada una de las formulaciones desarrolladas. En este ensayo se reporta cuatro UE que corresponden a las formulaciones FP1 a FP4, las cuales fueron derivadas del diseño experimental y una UE que corresponde FP5, formulación incluida como de referencia. Las cinco formulaciones denominadas como -0, no fueron sometidas al proceso de homogenización final con ultrasonido, mientras que las formulaciones denominadas -45 fueron sometidas al proceso de homogenización final con ultrasonido durante 45 segundos para evaluar su efecto en el tamaño de los liposomas. Teniendo en cuenta las diez formulaciones desarrolladas, se presentó un rango de tamaño entre 130 ± 10 nm y 670 ± 65 nm, tamaño que permitiría a estos sistemas desplazarse a través de folículos y glándulas, pero con limitación para hacerlo a través de canales intercelulares en el estrato corneo. Al tratarse de liposomas flexibles (UE I-IV), estos podrían deformarse sin alteración de su integridad y pasar a través de un poro con un tamaño cinco veces menor a su tamaño, es decir, si tenemos en cuenta el tamaño inferior de los liposomas obtenidos (130 ± 10 nm), al deformarse podrían pasar a través de un poro de aproximadamente 20 a 30 nm, tamaño que alcanzan los canales intercorneocitos en su máxima capacidad para ensancharse [30, 31].
Tabla 3 Caracterización de los sistemas liposomales obtenidos mediante inversión de fases por evaporación del solvente. Los resultados se reportan como el promedio ± SD (n=3).
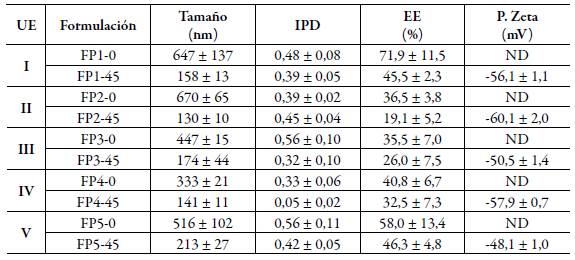
UE: unidad experimental, PDI: índice de polidispersidad, EE: eficiencia de encapsulación y ND: no determinado.
De otra parte, se observó que IPD en todos los casos fue inferior a 0,56 ± 0,11, lo que indica que con la metodología empleada es posible obtener sistemas liposomales con una distribución de tamaño uniforme. De acuerdo con los resultados reportados, se observa que para las formulaciones en las cuales no se realizó el proceso de homogenización final, se presentaron los mayores tamaños de partícula (333 ± 21 nm - 670 ± 65 nm) y los mayores IPD (0,33 ± 0,06 - 0,56 ± 0,11), mientras que para las formulaciones con proceso de homogenización final durante 45 segundos se encontraron valores menores tanto para el tamaño (130 ± 10 nm - 213 ± 27 nm) como para el IPD (0,05 ± 0,02 -0,45 ± 0,04). En cuanto a la EE se encontró que estaba en el rango entre 19,1 ± 5,2 % y 71,9 ± 11,5 % después de evaluar todas las formulaciones desarrolladas y, al igual que las demás variables dependientes, fue afectada por el proceso de homogenización final. En las formulaciones en las que no se realizó el proceso de homogenización final la EE fue mayor (35,5 ± 7,0 % - 71,9 ± 11,5 %), esto fue atribuido a que los liposomas obtenidos fueron de mayor tamaño y como consecuencia de esto presentarían un reservorio con mayor capacidad para encapsular el acetilhexapéptido-3.
En las formulaciones en las cuales se llevó a cabo proceso de homogenización final se presentó un efecto negativo en todos los casos en la EE (19,1 ± 5,2 % - 46,3 ± 4,8 %), probablemente, como consecuencia de la reducción del tamaño y que por efecto del ultrasonido se haya generado una alteración en la integridad de la bicapa liposomal que haya permitido la salida del acetilhexpéptido-3. Ahora analizando específicamente el efecto de FoC como el agente formador en los sistemas obtenidos sin homogenización final, se observó que en la formulación FP1-0 se presentó la mayor EE (71,9 ± 11,5 %), atribuida no solamente al mayor tamaño de los liposomas, sino a la utilización de la mayor cantidad de FoC (180 mg). Por otra parte, se observó una EE intermedia (58 ± 13,4 %) en la formulación de FP5-0 en donde se utilizó FoC (100 mg) y una baja EE (36,5 ± 3,8 %) en la formulación FP2-0 en la cual se utilizó la menor cantidad de FoC (80 mg).
De acuerdo con lo anteriormente descrito, es posible sugerir que la cantidad de FoC como agente formador de los liposomas es directa menta proporcional a la EE del ace-tilhexapéptido-3. Ahora, según los resultados obtenidos de EE para las formulaciones sometidas al proceso de homogenización final y teniendo como referencia FP5-45 (EE 46,3 ± 4,8 %) se evidenció que la inclusión de moléculas de naturaleza anfifílica y carácter aniónico, como CS o DCS para la formación de liposomas (FP1-45,FP4-45), esto generó una reducción en la EE probablemente debido al efecto del ultrasonido y a las interacciones hidrofílicas e hidrofóbicas de estas moléculas con la FoC, ocasionando un desorden en el autoensamblaje del fosfolípido haciendo que el liposoma formado sea más flexible y probablemente más permeable al péptido encapsulado [21]. Este efecto fue más pronunciado cuando la proporción de agente tensioactivo fue mayor con respecto a la FoC, independiente que se haya utilizado CS o DCS y también se observó en las formulaciones que no fueron sometidas al proceso de homogenización final. Según lo anterior, es importante tener presente que, aunque el propósito de incluir CS o DCS fue generar sistemas liposomales flexibles, que permearan a través de una membrana modelo sin que se viera alterada su integridad, esto ocasionó una reducción en la EE del acetilhexapéptido-3.
Como una prueba adicional, para la caracterización de los sistemas sometidos al proceso de homogenización final, se determinó que todas las formulaciones presentaron un potencial zeta bastante similar de carácter negativo y se encontró en un rango entre -48,1 ± 2,4 mV y -60,1 ± 4,1 mV, atribuido principalmente al fosfolípido formador de los liposomas y al agente tensioactivo aniónico (CS o DCS). La formulación que presentó menor potencial zeta (-48,1 ± 1,0 mV) fue FP5-45, en la cual no fue incluido ningún agente tensioactivo. Este potencial zeta contribuiría a la estabilidad física de la dispersión de los sistemas liposomales, minimizando fenómenos de floculación y la probabilidad de coalescencia de las vesículas [28, 32] y, en el momento de su administración, facilitaría su paso a través de canales hidrofílicos de la piel, pero lo dificultaría a través de los canales lipofílicos.
De acuerdo con los resultados obtenidos no se evidenció un efecto diferenciador entre utilizar CS o DCS como agente tensioactivo sobre las variables como el tamaño de los liposomas, el IPD y la EE del acetilhexpéptido-3, una formulación utilizando el nivel alto de FoC + tensioactivo (200 mg) y el nivel bajo en la proporción tensioactivo: FoC, es decir ,1:9 permitiría obtener un sistema liposomal flexible con el acetilhexapéptido-3 microencapsulado apropiado para una administración tópica. En el marco de este estudio se encontró que la composición de la formulación FP1-45 (UE I) se ajustó a estos requerimientos, presentando la siguiente caracterización: tamaño promedio de 158 ± 13 nm, IPD de 0,39 ± 0,05 y una EE: 45,5 ± 2,3%.
Finalmente, mediante la realización de un ensayo preliminar ex vivo, se buscó evaluar la capacidad que tendría uno de los sistemas liposomales flexibles desarrollados en esta aproximación, para permear o penetrar a través de una membrada modelo de acuerdo con lo descrito previamente en el apartado de metodología. El sistema liposomal seleccionado para este ensayo correspondió a la formulación FP1-0 (tamaño: 647 ± 137 nm, IPD: 0,48 ± 0,08 y EE: 71,9 ± 11,5 %). La razón para seleccionar este sistema fue que presentó la mayor EE del acetilhexapéptido-3 y uno de los mayores tamaños de partícula obtenido en el estudio con una distribución relativamente uniforme. Para el ensayo se utilizó como referencia una solución de acetilhexapéptido-3 en PBS.
En el momento de realizar la cuantificación de acetilhexapéptido-3 en las alícuotas de 1 mL tomadas del sistema liposomal FP1-0 la respuesta fue totalmente nula, es decir, que los resultados sugerían que el sistema FP1-0 no había facilitado la permeación del acetilhexapéptido-3 a través de la membrana modelo al compartimento receptor. Con el propósito de verifcar este resultado y contemplando la posibilidad que al tratarse de sistemas liposomales flexibles, estos se hubieran deformado y penetrado a través de la membrana modelo de manera íntegra y manteniendo encapsulado el acetilhexapéptido-3, se realizó un tratamiento a cada una de las alícuotas tomadas con 20 μL de solución acuosa de tritón X-100 al 6%. El objetivo de este tratamiento, en caso de que se encontraran los liposomas íntegros, fue inducir su disrupción mediante la solubilización del fosfolípido (FoC) con Tritón X-100, permitiendo la liberación del acetilhexapéptido-3 y su posterior cuantifcación mediante RP-HPLC. Para mantener condiciones similares en todas las muestras analizadas, este tratamiento se llevó a cabo también a las alícuotas tomadas en el sistema acetilhexapéptido-3 en solución. El análisis cromatográfco se realizó empleando una curva de calibración realizada con el acetilhexapéptido-3 en las mismas condiciones. En la figura 2 se reporta el porcentaje acumulado de acetilhexpéptido-3 que permeó a través de la membrana modelo a partir del sistema liposomal FP1-0 y a partir de una solución acuosa del acetihexapéptido-3.

Figura 2 Perfil de permeación de acetilhexapéptido-3 a través de la membrana modelo a partir del sistema liposomal FP1-0, teniendo como referencia una solución acuosa del neuropéptido. Los resultados se reportan como el promedio ± SD (n=3).
En ambos casos se observó un perfil bifásico, en la primera hora del estudio se presentó una rápida permeación seguida de una fase latente hasta concluir el estudio, la permeación se vio favorecida durante todo el periodo del estudio cuando se utilizó el sistema liposomal FP1-0. Para el sistema FP1-0 la permeación del acetilhexapéptido-3 fue en promedio del 78 % en la primera hora y se alcanzó aproximadamente el 100 % al final concluir el estudio. Para el sistema acetilhexapéptido-3 en solución, su permeación fue prácticamente la mitad, en la primera hora del estudio fue en promedio del 35% y alcanzó el 50% al final del estudio.
De acuerdo con los resultados obtenidos en este ensayo preliminar se puede sugerir que el sistema liposomal FP1-0, a pesar de presentar un tamaño relativamente grande, probablemente por sus características de flexibilidad presentó la capacidad de deformarse y penetrar la membrana modelo sin que se viera alterada su integridad estructural. Esto nos permite sugerir que el sistema FP1-0 alcanzaría de manera íntegra la dermis y allí se produciría la liberación del acetilhexapéptido-3, para inhibir la liberación del neurotransmisor acetilcolina y de esta forma reducir o minimizar las líneas de expresión.
CONCLUSIÓN
En el presente trabajo se sintetizó el neuropéptido Ac-EEMQRR-NH2 mediante SPPS, empleando la estrategia Fmoc/tBu y se obtuvo un producto con buen rendimiento y un alto grado de pureza. El sistema liposomal FP1-45 (UE I) presentó el tamaño de partícula e IPD adecuado y una aceptable EE del Acetilhexapéptido-3, como una contribución para el desarrollo de un novedoso producto cosmecéutico de aplicación tópica.














