INTRODUÇÃO
A leishmaniose é uma doença causada pelo protozoário Leishmania e tem duas formas principais, a cutânea (mais comum) e a visceral (mais grave). Por ano, esta doença mata 70 000 pessoas ao redor do mundo e infecta 1,5-2 milhões de pessoas [1]. Em 2018, 200 países relataram casos de leishmaniose, destes, 44% são considerados endêmicos para a forma cutânea e 39% endêmicos para a forma visceral [2].
Para o controle da leishmaniose são utilizados alguns medicamentos que, embora eficientes, apresentam uma série de limitações com efeitos colaterais severos que podem provocar o surgimento de espécies de Leishmania resistentes à medicação e até mesmo levar a morte [3]. Além disso, a quantidade de medicamentos disponíveis para tratamento da leishmaniose é pequena, tornando o tratamento mais complicado [4]. Neste contexto, a procura por novos medicamentos é crucial para o controle da doença. Para isso, os óleos essenciais (OE) são apresentados como uma das alternativas mais promissoras [5].
Alguns trabalhos revisaram a utilização de extratos de plantas no combate a leishmaniose [6, 7], porém, sem dar foco aos OE. Neste trabalho, foi revisado a atividade antileishmanial dos OE focando em seu potencial inibitório, seletividade e mecanismo de ação. Utilizou-se como bancos de dados, plataformas e repositórios digitais como: PMC, PubMed e ScienceDirect. Nestes bancos foram selecionados os artigos mais relevantes publicados entre 2000 e 2020. As principais palavras-chaves empregadas na pesquisa foram Leishmania e essential oil. As referências dos trabalhos selecionados também foram consultadas.
Tratamentos atuais e limitações
O principal mecanismo de defesa do corpo humano contra parasitas celulares, como a Leishmania, é a produção de oxido nítrico (NO) [8]. O mecanismo de ação do NO sobre a Leishmania ainda está em estudo, no entanto, evidências apontam para um processo de apoptose [9]. De forma a tornar possível seu crescimento, a Leishmania desenvolveu mecanismos capazes de inibir a produção de NO [10]. Visto que as defesas do organismo são em alguns casos insuficientes para inibir sua ação, a utilização de medicamento se faz necessária. Os medicamentos disponíveis para combate a Leishmania incluem anfotericina B, antimoniais, pentamidina, paromomicina e miltefosina (figura 1).
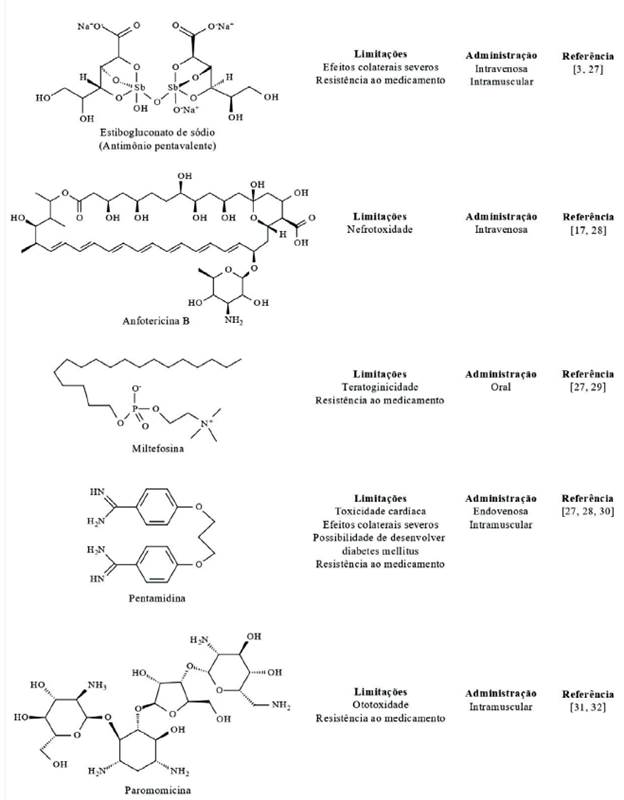
Figura 1 Limitacoes dos principais medicamentos disponiveis no combate a leishmaniose [3, 17, 27-32].
Os mecanismos de ação pelo qual os medicamentos atuam contra a Leishmania não estão totalmente esclarecidos. Os antimônios, mais especificamente, a administrada como antimônio pentavalente, aparentemente apresentam dois mecanismos de ações que atuam em sinergia [4]. No primeiro mecanismo o antimônio reduz a capacidade do tiol de tamponamento pelo efluxo rápido do tripanotione (T[SH]2) e glutationa (GSH). O segundo mecanismo envolve a inibição da T[SH]2 redutase, causando acúmulo das formas dissulfeto do T[SH]2 e GSH [11]. Embora os antimônios sejam importantes para o controle da leishmaniose, o surgimento de cepas resistente a este medicamento torna sua utilização ineficaz em algumas regiões endêmicas, sendo este o caso de Bihar, na Índia, onde poucas pessoas tiveram resposta ao tratamento com o antimônio [12]. No este Africano a combinação de antimônio com paromomicina demonstrou que pacientes tratados com ambos os medicamentos apresentaram recuperação mais rápida do que os tratados somente com um medicamento [13]. Diferente do antimônio, os mecanismos de atuação da paromomicina estão relacionados à redução do potencial da membrana mitocondrial, além de também inibição da síntese de proteínas citoplasmáticas e mitocondriais [14].
O uso da anfotericina B é outra alternativa medicamentosa para regiões em que não há resposta positiva ao tratamento por antimoniais [15]. O mecanismo de ação proposto para este medicamento está relacionado à sua capacidade de se ligar ao colesterol da membrana do hospedeiro. Visto que o colesterol é de grande importância para entrada do parasita na célula, a interação anfotericina B com o colesterol é capaz de impedir a infecção. Além disso, a anfotericina B também se liga ao ergosterol da Leishmania.
Supõe-se que o mecanismo mais provável da anfotericina B seja a combinação de sua interação tanto com o colesterol da célula hospedeira quanto com o ergosterol do parasita [16, 17].
A pentamidina também surgiu como alternativa aos antimoniais pentavalentes, que embora eficiente no início de sua utilização, o surgimento de variantes resistentes associado aos seus efeitos colaterais fez com que sua utilização fosse reduzida [18]. Seu mecanismo foi pouco explorado, mas evidências apontam para ação direta na mitocôn-dria da Leishmania [19]. A miltefosina é outro medicamento ativo contra a Leishmania. Seu modo de ação ainda não é totalmente conhecido, todavia, supõe-se que esteja relacionado à perturbação da remodelação éter-lipídico [20].
Estes medicamentos e outros poucos medicamentos disponíveis no combate a leishmaniose apresentam certas limitações em sua aplicação como observado na figura 1, a principal é o surgimento de variedades de Leishmania resistentes à medicação [4, 21]. As limitações dos atuais medicamentos são discutidas com mais profundidade por Tiwari etal. [22]. Para contornar esta situação da resistência à medicação o emprego da terapia combinada é uma alternativa eficiente. Esta metodologia, como o nome sugere, utiliza a combinação de dois ou mais medicamentos disponíveis para o tratamento da leishmaniose. Esta estratégia é abordada com mais profundidade no trabalho de Olliaro [23]. Outras estratégias disponíveis para melhorar a eficiência do tratamento são o monitoramento da terapia, distribuição livre do medicamento e monitoramento da resistência à droga [4]. Vacinas também foram estudadas para controle da leishmaniose. A literatura dispõe de candidatas excelentes, sendo as vacinas de poliproteína e DNA plasmídico as abordagens consideradas mais promissoras [24]. No entanto, ainda falta interesse industrial para produção [25], além de que, infelizmente, nenhuma vacina estudada induziu proteção a longo prazo ou garantiu imunidade [26]. Vistos as limitações dos tratamentos atuais, principalmente as poucas drogas disponíveis para o combate da Leishmania [4], medicamentos alternativos têm sido pesquisados, sendo um deles os OE.
Potencial inibitório dos OE
A IC50 é definida como a concentração inibitória máxima capaz de inibir 50% do crescimento de microrganismos e é utilizada para avaliar o desempenho de medicamentos [33]. O principal fator associado ao desempenho de medicamento contra a Leishmania é o estágio do ciclo de vida, sendo os dois estágios principais: a promastigota, quando presente no vetor de transmissão, e a amastigota, quando parasitando uma célula [34]. As diferenças de IC50 dos OE para ambos os ciclos de vida podem ser visualizados na tabela 1.
Tabela 1 Concentração inibitória (IC50) dos óleos essenciais para as formas amastigotas e promastigota da Leishmania.
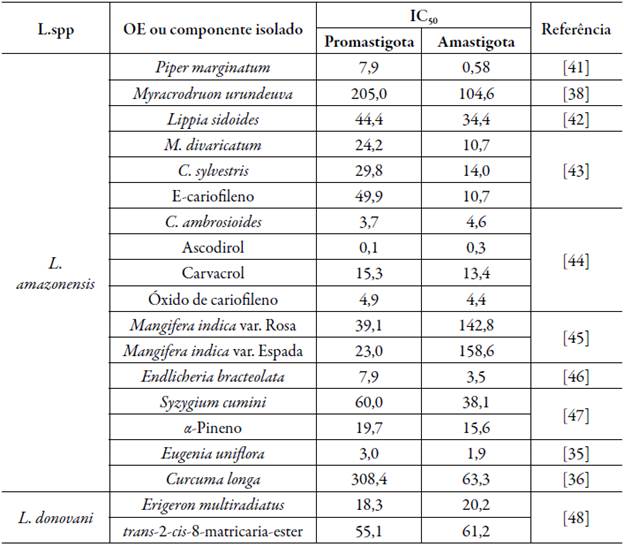
Nota: para compor a tabela 1 foram selecionados apenas artigos que estudaram os ciclos de vida da Leishmania.
A forma amastigota intracelular da Leishmania (L.) é mais sensível à inibição por OE do que a formas promastigota. O OE de Eugenia uniflora tem IC50 de 1,9 fxg/mL para forma amastigota da L. amazonensis, enquanto a forma promastigota teve IC50 de 3 fxg/mL [35]. O OE de Curcuma longa apresenta IC50 de 63,4 µg/mL para a forma amastigota da L. amazonensis, enquanto a forma promastigota apresentou IC50 de 308,4 µg/mL [36]. A maior efetividade dos OE na forma amastigota está relacionada ao seu modo de ação. Os OE agem diretamente sobre a Leishmania [37], no entanto, também é reportado que eles podem promover aumento da atividade microbicida do macrófago parasitado, ou seja, além de atuar diretamente sobre a Leishmania ele também pode induzir a produção de NO, o que auxilia na eliminação do parasita [38].
Em condições equivalentes, o mesmo OE apresenta diferentes IC50 sobre diferentes espécies de Leishmania. Como exemplo tem-se o OE de Nectandra hihua, cujo IC50 sobre as formas promastigotas da L. infantum e L. amazonensis é de 0,2 µg/mL e 24,2 µg/mL, nesta ordem [39]. Da mesma forma, o OE de Lavandula stoechas apresentou diferentes potenciais inibitórios as formas promastigotas de L. major (IC50 = 0,9 fxg/mL), L. infantum (IC50 = 7,0 µg/mL) e L. tropica (IC50 > 10,0 µg/mL) [39]. O OE de Cymbopogon citratus também teve diferentes IC50 as formas promastigotas da L. infantum (IC50 = 25,0 µg/mL), L. tropica (IC50 = 2,0 µg/mL) e L. major (IC50 = 38 µg/mL) [40]. A composição química dos componentes isolados dos OE também é um fator a ser levado em consideração.
Para que o OE apresente um bom IC50, a presença de anéis aromáticos e grupo hidroxila é fundamental. Silva et al. [5] estudaram o potencial inibitório de dez componentes isolados de OE sobre a L. amazonensis e determinou que os compostos de maior atividade antileishmanial foram timol (IC50 = 26,8 µg/mL) e carvacrol (IC50 = 25,4 µg/mL). O autor atribuiu esta maior atividade inibitória a presença da hidroxila aromática. Outros compostos estudados, ausentes de hidroxila ou anel aromático, tiveram menor atividade antileishmanial, sendo este o caso do mentol (IC50 = 198,9 fxg/mL), um composto com grupo hidroxila e sem anel aromático, e do p-cimeno (IC50 > 1000 µg/mL), um composto com anel aromático e sem grupo hidroxila. Estudos posteriores comprovaram a importância da hidroxila na atividade antileishmanial. Tasdemir et al. [49] substituíram o grupo hidroxila do carvacrol e timol por um grupo metil e observou que a substituição resultou na diminuição do IC50 de, respectivamente, 25,1% e 79,9% para a forma amastigota da L. donovani.
Além da composição química, a quiralidade aparenta ser um fator importante na atividade antileishmanial dos componentes isolados dos OE. Moléculas de composição idêntica, porém quirais, têm diferentes IC50. É o caso do R-(+)-limoneno e S-(+)-limo-neno, que apresentaram IC50 de, respectivamente, 16,6 µg/mL e >100 µg/mL contra a L. mexicana [50].
Seletividade dos OE sobre a Leishmania
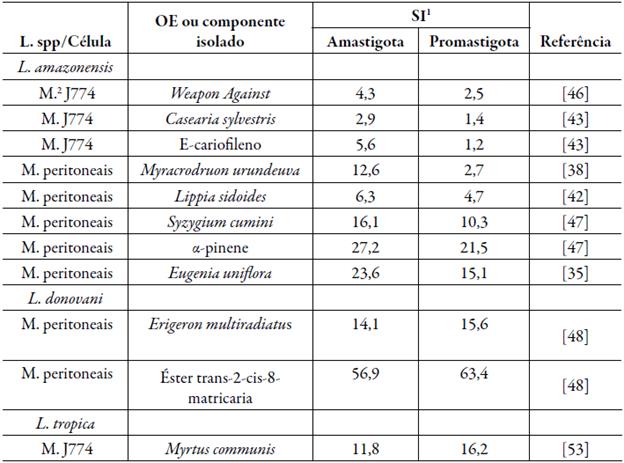
O índice de seletividade (SI) é definido como a razão entre a citotoxicidade e atividade antileishmanial [51]. Em tese, quanto maior o SI, maior será a segurança do medicamento [52]. Para a Leishmania a seletividade varia de acordo com seu ciclo de vida. Para a maioria dos casos a seletividade é maior para a forma amastigota, como demonstrado na tabela 2. Todavia, alguns OE apresentaram maior seletividade a forma promastigota, como é o caso do OE de Myrtus communis [53] e o OE de Erigeron multiradiatus e seu componente isolado, o éster trans-2-cis-8-matricaria [48].
Para compor a tabela 2 foram selecionados apenas artigos que estudaram os ciclos de vida da Leishmania. Não foram considerados artigos cujo limite para o CC50 é desconhecido. 1Os valores foram arredondados para apenas uma escala decimal. 2Macrófagos.
Outro fator que influencia a seletividade do OE é sua composição química, no entanto, sua relação com a seletividade à Leishmania ainda é alvo de debate. É dito que os compostos isolados que apresentam em sua composição hidroxilas aromáticas possuem maior potencial inibitório (IC50) [5], no entanto, necessariamente não significa que estes compostos apresentam maior seletividade à Leishmania. Como exemplo há o carvacrol, 6,7-dehydroroyleanone e o timol, todos contendo hidroxila aromático, todavia, contendo baixa seletividade. O carvacrol apresenta seletividade de 2,4 para a forma amastigota da L. amazonensis do que em comparação a macrófagos peritoneais [44]. O 6,7-dehydroroyleanone possui SI de 0,22 para a forma promastigota da L. amazonensis com relação aos macrófagos murinos [54]. A seletividade do timol a forma promastigota L. amazonensis é de 1.1 em comparação a macrófagos peritoneais [42]. Em contraste, o 7-hidroxicalameneno, também composto por hidroxila aromática, apresentou SI > 365,0 entre a forma promastigota do L. chagasi e macrófagos peritoneais, indicando ausência de citotoxicidade [55].
Alguns compostos isolados, cuja composição química apresenta ausência de hidroxilos aromáticos, também divergem entre si, é o caso do cariofileno e do trans-2-cis-8-matricaria. O cariofileno possui seletividade de 0,9 para entre a forma promastigota L. amazonensis e macrófagos peritoneais [44]. Já o éster trans-2-cis-8-matricaria apresenta SI de 63,3 entre a forma promastigota da L. donovani e macrófagos peritoneais [48]. Logo, ainda há muito a ser debatido a respeito da relação entre estrutura química e seletividade.
Mecanismo de ação dos OE sobre a Leishmania
A Leishmania sofre diferentes danos celulares quando expostos aos OE ou seus componentes isolados. Algumas alterações estruturais observadas na Leishmania quando em contato com os OE foram: formação de estruturas densas de elétrons, vacúolos similares ao autofogosoma, aumento do número de gotículas lipídicas próximas a membrana plasmática, inchaço nos cinetoplastos e vácuos na bolsa flagelar, aumento do volume do cinetoplastos, fragmentação do kDNA e condensação da cromatina nuclear [46]. Estas alterações sofridas pela Leishmania indicam que o mecanismo mais provável é a indução da morte celular programa, de forma mais específica, uma apoptose [56].
A apoptose pode ocorrer por duas vias possíveis: a via extrínseca e a via intrínseca ou mitocondrial [57], sendo a via mitocondrial apontada como a principal via de ação dos OE sobre a Leishmania. Uma das evidências que apoia o processo de apoptose por via mitocondrial é a externalização da fosfatidilserina observado por Islamuddin etal. [58] ao estudar o efeito do OE de Artemisia annua sobre L. donovani. Durante o processo de apoptose a fosfatidilserina localizado predominantemente no "folheto interno" da membrana plasmática migra para o "folheto externo", tendo este processo grande participação da mitocôndria [59]. Além da externalização da fosfatidilserina, outra evidência de apoio a apoptose por via mitocondrial é a fragmentação do DNA nuclear da Leishmania. Quando a célula sofre um estímulo apoptótico por via mitocondrial, há a liberação de uma DNAse específica, fragmentando o DNA em unidades nucleossômicas [60]. Outra característica da alteração apoptótica por via mitocondrial apontada pela literatura está na parada do ciclo celular na fase G0/G1 [61, 62].
Além de induzir a apoptose, os OE também podem se ligar a coenzimas importantes para o metabolismo energético. Monzote et al. [37], o equipe isolou frações mitocondriais da L. tolentolae e avaliou a interação dos componentes isolados carvacrol, arcaradol e óxido de cariofileno com as coenzimas NADH: ubiquinona oxidoredutase (complexo I), succinato:ubiquinona oxidoredutase (complexo II) e ubiquinol:cit c3+ oxidoredutase (complexo III). Os compostos não apresentaram atividade relevante sobre o complexo I e II, enquanto o complexo III foi inibido por todos os compostos, principalmente pelo óxido de cariofileno. O complexo III é uma coenzima importante para criar um gradiente de prótons na membrana mitocondrial interna, onde é utilizada para a produção de ATP [63].
Para as formas amastigotas, os mecanismos de ação também envolvem o sistema autoimune do macrófago infectado. Estima-se que os OE estimulam a produção de NO [64]. A contribuição do NO produzido se dá pela sua combinação com o ânion superóxido dentro do fagolisossomo, produzindo peroxinitrito, que por sua vez agirá como microbicida [47]. Islamuddin et al. [58] observaram que a presença do OE de Artemisia annua em macrófagos infectados com a forma amastigota da L. amazonensis gerou aumento significativo na produção de NO pela célula infectada, resultando em fragmentação do DNA nuclear do parasita. Islamuddin et al. [65] estudaram o potencial terapêutico de nanoemulsões de eugenol, também notou aumento significativo de NO induzido pelo eugenol, sugerindo um efeito de imonomodulação no próprio macrófago. Em contraste, Rodrigues et al. [35] não observaram aumento significativo na produção de NO induzido pela adição do OE de Eugenia uniflora no macrófago infectado pela L. amazonensis, todavia, o autor observou aumento significativo na capacidade fagocitária e atividade lisossomal, ambas com atividades imunomoduladoras.
Limitações do uso de OE
Logicamente, a aplicação dos OE está atrelada a algumas limitações que devem ser superadas para que seu emprego como um novo fármaco contra a Leishmania seja eficiente. Algumas destas limitações são alta volatilidade, baixa estabilidade oxidativa, hidrofobicidade e, dependendo do tipo e concentração do OE, citotoxicidade ao macrófago [66, 67].
Para uso terapêutico, a hidrofobicidade da maioria dos OE é uma das limitações que mais se destaca, visto que afeta diretamente a taxa de absorção e distribuição do fármaco [68, 69]. Para os OE, essa limitação pode ser superada pela formulação em nano-cocleatos. Machín et al. [70] demostraram por meio da administração intralesional que os OE de Bixa orellana e Dysphania ambrosioides formulados em nanococleatos apresentam uma entrega sistémica in vivo. Este resultado também foi observado para o OE de Artemisia absinthium [71].
Outra limitação que se destaca é a sua citotoxicidade que, logicamente, depende do tipo de OE e a concentração utilizada [72]. A citotoxicidade dos OE também pode ser reduzida pela nanoencapsulação, como discutido por Galvão et al. [73] ao investigar a citotoxicidade do carvacrol. Os autores também observaram aumento da seletividade do carvacrol encapsulado à forma amastigota da L. amazonensis em comparação ao carvacrol não encapsulado, além de melhoria no tempo de meia vida e tempo médio de residência.
CONCLUSÕES
A concentração do OE ou composto isolado, a espécie de Leishmania, o ciclo de vida e a composição química dos componentes individuais dos OE são fatores cruciais ao estudar a atividade antileishmanial dos OE. Com relação à composição química, compostos cuja composição química apresenta um grupo hidroxila e anel aromático aparentam ter maior potencial inibitório. A quiralidade também aparenta ter um papel fundamental na atividade antileishmanial. Com relação à seletividade, os OE são mais seletivas as formas amastigotas do que para as promastigotas. Quanto ao mecanismo de ação, os OE são responsáveis por causar apoptose mitocondrial, mas também podem inibir a ação de coenzimas importantes para o metabolismo energético da Leishmania. Além disso, os OE podem induzir a produção de óxido nítrico, aumentando sua ação sobre a forma amastigota. As principais limitações a serem superadas para o uso efetivo dos OE são sua baixa solubilidade em água, baixa estabilidade a oxidação e alta volatilidade. Estas limitações podem ser minimizadas pelo uso da nanoformulação.