INTRODUCCIÓN
Un pilar fundamental en la farmacoterapia de la leucemia linfoblástica aguda (LLA) en pediatría es L-asparaginasa, la cual ha sido probada como tratamiento de pacientes con cáncer desde 1960 [1]. L-asparaginasa es una enzima que cataliza la hidrólisis de asparagina extracelular en ácido aspártico y amoníaco restringiendo el suministro de asparagina a las células leucémicas, con lo cual se interrumpe la síntesis vital de proteínas, el ciclo celular no se completa y la célula entra en apoptosis [2, 3].
Existen tres formulaciones de L-asparaginasa que involucran a la enzima nativa derivada de Escherichia coli, su variedad conjugada con monometoxipolietilenglicol o pegaspargasa, y una variedad derivada de Erwinia chrysanthemi. Todas tienen perfiles farmacocinéticos distintos y se administran por vía intramuscular o intravenosa [2, 4]. Sin embargo, el principal obstáculo para la utilización de cualquier formulación de L-asparaginasa es la aparición de toxicidad. Una de sus manifestaciones más relevantes es la pancreatitis asociada a L-asparaginasa (PAA) [5]. Su frecuencia abarca un rango de 1 % a 18% [6, 7], pero su importancia radica en que constituye una causa de descontinuación del tratamiento con L-asparaginasa en pacientes con LLA, además que existe un alto riesgo de recurrencia al reanudar la terapia [5, 6, 8, 9].
La PAA es un diagnóstico clínico que se basa en la combinación de al menos dos de los siguientes criterios: dolor abdominal, elevación de los niveles séricos de amilasa o lipasa mayor al triple del límite superior de referencia, y evidencia en imagen compatible con PAA [10, 11]. Aunque el mecanismo directo de la PAA es incierto, se ha propuesto que la privación corporal de asparaginasa interfiere con la síntesis de proteínas pancreáticas altamente activas. La PAA es resultado de la activación prematura de tripsina dentro de células acinares pancreáticas, la destrucción de las células acinares origina inflamación local y, finalmente, la autodigestión pancreática [10].
Ciertas características clínicas como la edad (que el paciente sea mayor de 10 años) [12, 13], pacientes con leucemia de riesgo alto [6] y ciertos marcadores genéticos [14] parecen estar asociados con el desarrollo de pancreatitis aguda. Por otro lado, factores como tipo de formulación y la dosis aún son controversiales [6].
Algunos estudios sugieren una relación entre la intensidad del tratamiento con L-asparaginasa y el desarrollo de PAA, pues se presentan reducciones desde 2,5% hasta 8,3% en su incidencia en los grupos que reciben dosis menos intensas de L-asparaginasa [5, 14-17]. Sin embargo, entre 68% a 79% de los episodios de PAA se originan entre las primeras semanas de tratamiento, predominantemente en inducción a la remisión [7, 8, 18], por lo cual se ha propuesto que existe una predisposición al desarrollo de PAA sin relación con la dosis acumulada [8, 19-21]. Esto difiere de otras manifestaciones de toxicidad de L-aspararaginasa como hepatotoxicidad [7], no obstante, la intensidad de la quimioterapia y el uso concomitante de corticosteroides podrían ser relevantes [17, 22].
Ningún estudio ha explorado la posible asociación de los errores de medicación, como indicadores de la seguridad del proceso de medicación y el desarrollo de PAA. Un estudio mostró que los errores de dosificación pueden presentarse en 47,5% de los pacientes pediátricos con LLA en fase de inducción, y hasta 25,5% de los errores de dosificación involucran a L-asparaginasa [23]. Los errores de dosificación son un tipo de incidente prevenible que puede causar daño al paciente cuando se administra una dosis inapropiada por un profesional de la salud o paciente [24]. Tales errores de dosificación modifican la intensidad del tratamiento con L-asparaginasa y podrían afectar la seguridad de la quimioterapia. Por ello, el propósito de este estudio exploratorio fue evaluar si existe alguna asociación entre la exposición a errores de dosificación con L-asparaginasa y el desarrollo de PAA en pacientes pediátricos con LLA en fase de inducción a la remisión.
METODOLOGÍA
Este estudio es un análisis secundario de datos de una cohorte retrolectiva que abarcó registros clínicos de pacientes pediátricos con LLA de novo, entre enero de 2015 y diciembre de 2017 [23]. El protocolo de origen fue aprobado por los comités de ética e investigación del Hospital Infantil de México Federico Gómez con el número HIM-2018-018.
Ámbito y población de estudio
El Hospital Infantil de México Federico Gómez es un Instituto Nacional de Salud pediátrico que presta servicios de atención en el tercer nivel de atención, así como actividades de investigación y enseñanza, donde una cuarta parte de sus egresos anuales son pacientes con neoplasias. La población blanco en este estudio fueron pacientes menores de 18 años diagnosticados con LLA que recibieron tratamiento de inducción a la remisión dentro del hospital hasta el inicio de la siguiente fase o hasta el fallecimiento y que recibieron al menos una dosis de L-asparaginasa en el periodo de seguimiento.
Tamaño de muestra
Para la estimación de asociación se estableció un tamaño de muestra a priori, con un error tipo I (a) de 0,05 bilateral y una potencia de estudio (1-ß) de 0,80. Se asumió la mitad de la incidencia máxima reportada para PAA [6,7] como la proporción en el grupo no expuesto a errores de dosificación con L-asparaginasa, es decir: 9,0%. Además, se planteó un riesgo relativo (RR) de cinco, con una razón hipotética de seis entre el número de pacientes expuestos en ambos grupos. El cálculo se realizó con el programa en línea Granmo versión 7.12; 17 sujetos estuvieron en el grupo de expuestos y 102 en el de no expuestos.
Extracción de información
La extracción de datos de los registros clínicos se llevó a cabo por un farmacéutico clínico, quien capturó variables demográficas y clínicas relevantes para el diagnóstico (leucocitosis, inmunofenotipo, marcadores genéticos y comorbilidades) y clasificación del tipo de leucemia (riesgo habitual/alto), así como toda la información documentada sobre eventos adversos (incluyendo PAA), evolución clínica y el manejo farmacológico durante la inducción a la remisión, capturando nombre de los medicamentos, dosis, vía y fechas de administración.
Variables en estudio
Un error de dosificación se definió operativamente como una desviación absoluta >10% entre la dosis administrada y la dosis indicada en el protocolo institucional estándar. Dicho protocolo incluye cuatro fármacos: dexametasona (6 mg/m2/día) o prednisona (60 mg/m2/día), vincristina (2 mg/m2/dosis), daunorrubicina (25 mg/m2/ dosis) y L-asparaginasa nativa de Escherichia coli (10 000 UI/m2/dosis) [25]. Las desviaciones absolutas sobre la dosificación pueden ser relativas a sobredosis o subdosis. Para mantener la coherencia temporal, los errores de dosificación con L-asparaginasa solo se contaron cuando ocurrieron con prioridad al inicio de la PAA. Para validar la información relativa a dosis erróneas administradas al paciente, se verificó la dosis preparada en la farmacia del hospital o por el centro de mezclas externo; este proceso ha sido descrito previamente [23].
El diagnóstico clínico de PAA fue tomado desde los registros clínicos y la asignación de severidad de los episodios se realizó atendiendo los Common Terminology Criteria for Adverse Events (CTCAE) versión 5 del National Cancer Institute [26], tal como en otros estudios [12, 15]. Donde grado 2 involucra elevación de amilasa o lipasa con hallazgos radiológicos, grado 3 agrega dolor y vómito que requiere intervención médica (analgésica y nutrimental), grado 4 cuando pone en riesgo la vida y grado 5 cuando se relaciona a la muerte.
Análisis estadístico
El análisis estadístico se realizó con el software SPSS 25. Las variables categóricas se expresaron como frecuencias y porcentajes por la presencia de errores de dosificación con L-asparaginasa y en general. El error de dosificación es una variable de conteo. Sin embargo, la hipótesis a explorar concibe el error de dosificación como una intensificación mayor en la dosis de L-asparaginasa, por lo cual la variable error de medicación fue dicotomizada (presente/ausente) por paciente, distinguiendo dos subcategorías: subdosis y sobredosis. Otra variable continua como la edad en años también fue dicotomizada para su descripción (<10 vs. ≥10 años). Diferencias en la distribución del error de dosis con L-asparaginasa fueron evaluadas con la prueba ji-cuadrada (X2) o exacta de Fisher, ambas con un α=0,05 a dos colas, tal como fuera adecuado. Se utilizó el coeficiente phi (ф) para explorar la fuerza de asociación entre el error de dosificación de los fármacos utilizados en inducción a la remisión con la presencia de PAA. También se calculó el RR con intervalo de confianza al 95% para el error de dosificación, la sobredosis y la subdosis de L-asparaginasa. Así mismo se calculó la fracción de riesgo atribuible poblacional (RAp) y en el grupo expuesto (RAex), ambas expresadas como porcentaje [27].
RESULTADOS
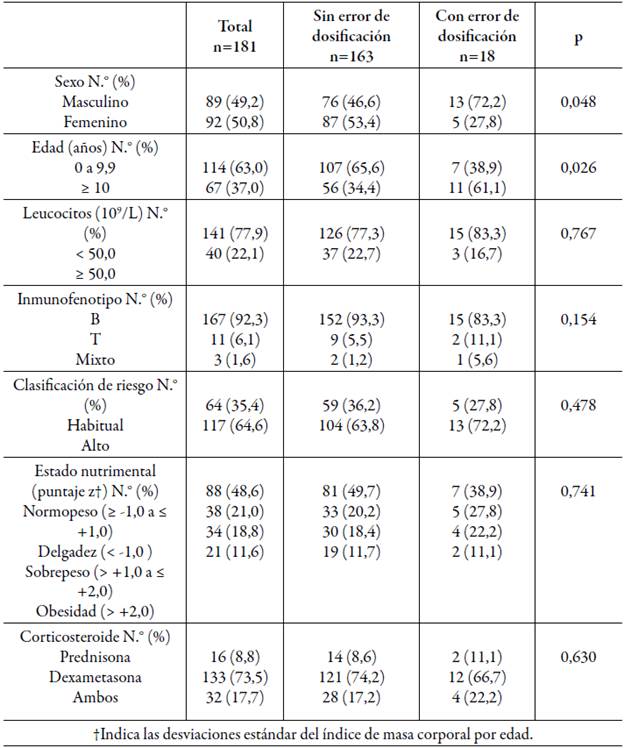
Se incluyeron 181 pacientes recién diagnosticados con LLA y se excluyeron 11 porque no contaban con la adecuada documentación de la terapia de inducción y 15 no recibieron tratamiento de inducción en el hospital. En la tabla 1 se observan las características basales de los pacientes. Hubo diferencias estadísticamente significativas entre la frecuencia de errores de dosis con L-asparaginasa por sexo y grupo de edad.
Se identificaron 18 (9,9%) pacientes con uno o más errores de dosificación con L-asparaginasa. La magnitud promedio de los errores de dosificación fue 17,3% (±9,8%), en la sobredosis 16,5% (±3,2%) y la subdosis 17,5% (±10,6%). En la tabla 2 se puede observar que la fuerza de asociación entre la presencia de errores de dosificación y la aparición de PAA es muy baja con otros fármacos utilizados en la terapia de inducción a la remisión.
Tabla 2 Asociación la pancreatitis con errores de dosificación por fármaco usado en inducción a la remisión.
| Fármacos con error de dosificación | Pancreatitis | Sin pancreatitis | Coeficiente phi | p‡ |
|---|---|---|---|---|
| Corticosteroidet | 2/5 | 52/176 | 0,037 | 0,636 |
| Daunorrubicina | 0/5 | 28/176 | -0,072 | 1,000 |
| Vincristina | 0/5 | 24/176 | -0,066 | 1,000 |
†Incluye datos de dexametasona y prednisona.
‡Significancia estadística con prueba exacta de Fisher.
Por otro lado, se observaron 5 episodios de PAA (1,1%), ninguno por reexposición a L-asparaginasa. Todos los casos se presentaron en pacientes mayores de 10 años (mínimo 10,5, máximo 14,9) y 4 de las pacientes eran mujeres. Los 5 pacientes tuvieron LLA de riesgo alto. cuatro recibieron dexametasona como ventana esteroidea y 1 recibió prednisona y después dexametasona. Respecto a la severidad de la PAA, 2 fueron consideradas severas (grado 3) y requirieron hospitalización entre 6 y 14 días, otros 3 casos condujeron a la muerte del paciente (grado 5) y fueron confirmadas en el certificado de autopsia. El tiempo promedio entre la primera dosis de L-asparaginasa y la PAA fueron 11,8 días (mínimo 36 h y máximo 25 días).
En la tabla 3 se observa que los pacientes con errores de dosificación involucrando a L-asparaginasa tuvieron 5,04 veces mayor riesgo de PAA, que aquellos sin errores. Así mismo, la sobredosis representó 9,67 veces mayor riesgo de PAA, que los pacientes sin errores durante la fase de inducción. Ambos RR mostraron relevancia clínica y significancia estadística (el intervalo inferior no es menor que la unidad), pero no así la subdosis.
Tabla 3 Asociación entre L-asparaginasa con error de dosificación y pancreatitis.
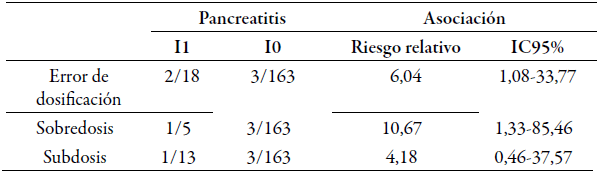
Abreviaturas. Incidencia en expuestos: I1, incidencia en no expuestos: I0, intervalo de confianza al 95%: IC95%.
El cálculo del RAp mostró una reducción hipotética de 33,4% de los casos de PAA, si se elimina el error de dosificación de los procesos de atención hacia la población, 22,7% menos si se eliminara la sobredosificación, y 19,0% en ausencia de subdosificación. Por su parte, el RAex sugirió una reducción de 83,4% en los casos de PAA en ausencia de errores de dosificación sólo en el grupo expuesto; 90,6% en ausencia de sobredosificación y 76,1% en ausencia de subdosificación.
DISCUSIÓN
Este fue un estudio exploratorio sobre la asociación entre los errores de dosificación con L-asparaginasa y la presencia de PAA en pacientes pediátricos con LLA durante la inducción a la remisión. Los errores de medicación son indicadores de la calidad y la seguridad de los procesos de medicación, por lo cual es necesario conocer su influencia sobre manifestaciones clínicas relevantes, ya que su naturaleza prevenible permitiría reducir el impacto sobre la morbilidad asociada a las intervenciones del cuidado de la salud.
Las estimaciones de RR en este estudio son importantes porque relevan la posible asociación de riesgo entre la ocurrencia de PAA y la presencia de errores de dosificación con L-asparaginasa durante la terapia de inducción a la remisión de LLA en pacientes pediátricos. Especialmente, sobresale la estimación de riesgo de PAA entre pacientes con sobredosificación respecto a aquellos sin sobredosificación, ya que significó un riesgo clínicamente relevante y con significancia estadística. No obstante, la tendencia (sin significancia estadística) hacia una asociación de riesgo entre pacientes con subdosificación de L-asparaginasa, puede sugerir la presencia de interacciones estadísticas o sesgo de confusión en la asociación.
Una variable confusora potencial es la edad, pues los resultados observados en este estudio son consistentes respecto al predominio de PAA en pacientes mayores de 10 años [12, 13] y en la corta relación temporal entre el inicio de la terapia de inducción a la remisión y la aparición de PAA. Además, los oncólogos pueden preferir redondear la dosis calculada en pacientes pediátricos de mayor edad o adolescentes y también en dichas edades se producen cambios fisiológicos que pueden afectar la farmacocinética de L-asparaginasa [4]. Otras variables importantes pueden ser la clasificación de riesgo de la LLA y ciertos marcadores genéticos [6, 14], pero se necesita mayor investigación.
A pesar de lo anterior, se debe considerar que las asociaciones observadas son estimaciones crudas no ajustadas y que una vez ajustados en modelos multivariados por edad y sexo, así como otras variables confusoras relevantes para la dosificación de L-asparaginasa y la aparición de PAA, los intervalos de confianza y estimadores puntuales podrían reducirse o desplazarse hacia la ausencia de riesgo. Lamentablemente, el número de casos de PAA en este análisis secundario no permitió obtener estimadores más precisos ni tampoco ajustar los RR, lo cual constituye una fuerte limitación a este trabajo. Por consiguiente, aún se requieren estudios con modelos multivariados para confirmar la estimación del riesgo.
A partir de los resultados, parece razonable suponer que la sobredosis de L-asparaginasa se asocie con el desarrollo de PAA durante la inducción a la remisión, porque las sobredosis equivalen a una intensificación involuntaria de la quimioterapia, tal como sugieren estudios previos [14-16]. Dicha sobredosificación podría tener un efecto intensificado de disrupción sobre la síntesis de proteínas, afectando la adaptación inicial a los efectos tóxicos de la quimioterapia en su conjunto. Tal capacidad adaptativa podría estar condicionada por aspectos intrínsecos del paciente [19]. Sin embargo, no debe olvidarse que la inducción a la remisión es una fase crítica, donde coexisten los efectos clínicos de la actividad de la leucemia y la exposición por primera vez en la vida a los efectos tóxicos de la quimioterapia [28]. Por lo tanto, una hipótesis alternativa es que la aparición de PAA no necesariamente debe ser consistente con la dosis acumulada de L-asparaginasa, sino con la intensidad de la disrupción aguda que puede mediar otros mecanismos de adaptación temprana al tratamiento.
Aunque se ha mencionado que la mitigación de la toxicidad de la terapia con L-asparaginasa durante la inducción a la remisión, podría ayudar a mejorar la tolerabilidad y el éxito del tratamiento de LLA [5, 8, 9], ni el RAp o el RAex implican la posibilidad real de eliminar factores de riesgo completamente o eliminar toda morbilidad asociada y no asociada [27]. Estos sólo señalan la importancia que debe tener la prevención de fallas en los procesos de atención a la salud, particularmente los relativos al uso de medicamentos; en este caso, de los errores de dosificación como potenciales determinantes de la seguridad de L-asparaginasa en niños con cáncer [23, 24].
Además de la potencia estadística, otra limitación es la influencia no explorada de fármacos asociables a pancreatitis como los corticosteroides. Se observaron dos casos de sobredosis concurrentes de corticosteroides y L-asparaginasa previos a la presencia de PAA, pero debido a la ubiquidad de los errores de dosificación con los corticosteroides, se observó un coeficiente phi de correlación insignificante entre estos y el desarrollo de PAA, aunque su efecto sinérgico si ha sido discutido [17, 19, 22].
Finalmente, estos resultados preliminares deben ser interpretados con cautela, pues no establecen causalidad ni la asociación observada es definitiva.
En conclusión, se observó una asociación entre la presencia de errores de dosificación, especialmente sobredosis, con L-asparaginasa y la presencia de PAA durante la fase de inducción a la remisión en pacientes pediátricos con LLA. No obstante, dada la naturaleza exploratoria de este trabajo, tales resultados deben ser replicados en un estudio con enfoque estadístico y, además, es pertinente ajustar los estimadores en modelos multivariados para minimizar el efecto de las variables confusas y los sesgos de selección.