INTRODUÇÃO
Dados da Organização Mundial da Saúde apontam que aproximadamente 80% da população mundial são consumidores ativos de plantas ou medicamentos derivados de produtos naturais, sejam eles de origem vegetal, animal ou de microorganismos [1]. Nesse contexto, as plantas medicinais vêm sendo empregadas na medicina popular desde os tempos pré-históricos para o tratamento e prevenção de diversas patologias, podendo serem incorporadas em diversas formulações para fins nutricionais, cosméticos e principalmente medicinais [2].
Espécies vegetais podem produzir substâncias através do seu metabolismo secundário que apresentam capacidade de interagir com receptores e moléculas de organismos vivos. Tal interação pode levar a uma resposta biológica específica e eventualmente à modulação de uma ação farmacológica [1, 2]. A partir da ciência de plantas que apresentam propriedades medicinais, torna-se importante o investimento no estudo da composição química desses vegetais, visando o descobrimento de substância uteis para o desenvolvimento de novos medicamentos [3].
Nessa perspectiva, espécies do gênero Erythroxylum merecem destaque pela sua utilização na medicina popular frente a diferentes acometimentos. Há relatos da sua utilização para o tratamento de febre, asma, sinusite, gripe, sangramento, amenorreia, problemas no estômago e rim, além como tônico estimulante, diurético e antiparasitário [4]. Erythroxylum é considerado o maior gênero da família Erythroxylaceae, composta por árvores floridas de distribuição tropical e subtropical, apresentando aproximadamente 240 espécies catalogadas [5].
Plantas do gênero Erythroxylum são responsáveis por biossintetizar alcaloides tropâ-nicos, que vêm apresentando atividades biológicas como anticolinérgica, antiemética, antidepressiva, anestésica e antitumoral [6]. Além disso, alcaloides, flavonoides, tani-nos, esteroides e triterpenos oriundos de espécies desse gênero vêm sendo isolados e avaliados quanto a ações farmacológicas, o que vêm justificando as propriedades medicinais e o conhecimento etnobotânico descrito para essas plantas [2].
A E. coca é a espécie mais conhecida desse gênero, visto que é responsável pela síntese da cocaína, alcaloide tropânico utilizado para fins recreativos [7]. Contudo, dentre as espécies utilizadas medicinalmente, pode-se citar o exemplo da E. minutifolium, empregada popularmente no tratamento de infecções virais e bacterianas na pele, afecções respiratórias e renais [8]. Há descrição do uso de extratos de E. laurifolium para o tratamento de diarreia e eliminação de cálculos nos rins [9, 10]. E. cuneatum vem sendo relatada quanto a sua propriedade abortiva [11, 12]. Já E. sideroxyloides é utilizada na medicina tradicional para o tratamento de infecções de garganta, febre e pedra nos rins [13].
Dadas as diversas aplicações medicinais relatadas pelas culturas tradicionais, espécies do gênero Erythroxylum se mostram promissoras como fontes de moléculas úteis no desenvolvimento de novos medicamentos frente a diversos acometimentos em saúde [4].
Entretanto, observa-se a necessidade da realização de uma sistematização dos trabalhos já publicados sobre as propriedades bioativas já descritas para o gênero, de forma a contribuir tanto para divulgação de estudos que validem o seu uso na medicina popular quanto para auxiliar no levantamento de informações para pesquisas de planejamento de novos fármacos a partir de espécies do gênero [2].
Diante disso, o presente trabalho teve como objetivo realizar uma revisão sistemática da literatura sobre as atividades biológicas de espécies do gênero Erythroxylum descritas a partir de ensaios in vitro, bem como traçar uma a comparação entre os resultados das propriedades encontradas em diferentes espécies estudadas.
METODOLOGIA
O presente estudo é uma revisão sistemática de literatura [13]. As buscas foram realizadas em dezembro de 2020 nas seguintes bases eletrônicas: LILACS, PubMed, SciELO, ScienceDirect e BIREME. Os descritores consultados foram Erythroxylum AND in vitro. Não houve limite de período. O objetivo do trabalho foi responder a pergunta: Quais propriedades biológicas do gênero Erythroxylum estão descritas através de testes in vitro?
O critério de seleção dos artigos seguiu a ferramenta PRISMA. Inicialmente, foram incluídos apenas os artigos que se enquadraram no tema proposto após análise de títulos e resumos. Além disso, apenas trabalhos contendo dados quantitativos dos resulta dos das análises in vitro das atividades biológicas de espécies do gênero Erythroxylum foram considerados, redigidos nas línguas inglesa, espanhola ou portuguesa.
Como critérios de exclusão: trabalhos que abordavam estudos exclusivamente qualitativos, estudos de revisão/etnobotânicos estritamente descritivos e que não apresentavam resultados quantitativos in vitro de atividades biológicas no seu conteúdo, que não traziam dados sobre espécies do gênero Erythroxylum, que analisaram fórmulas fitote-rápicas que continham Erythroxylum ssp. acrescidas de outras espécies, que apresentavam dados exclusivamente da atividade citotóxica e genotóxica, ou que apresentavam resultados de experimentos com a substância cocaína que não foi isolada diretamente de extratos ou frações da espécie Erythroxylum abordada.
RESULTADOS E DISCUSSÃO
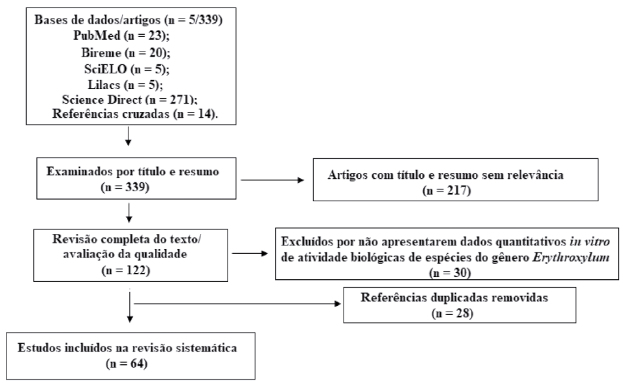
A figura 1 expõe os resultados encontrados em cada uma das bases de dados pesquisadas, bem como o fluxograma ilustrando a seleção dos artigos. Dessa forma, foram encontradas 339 publicações através dos descritores empregados, contudo, após a revisão completa dos textos, remoção de publicações repetidas em diferentes bases de dados e acréscimo das referências cruzadas, um total de 64 artigos foram selecionados para a construção da revisão, visto que se enquadraram dentro dos critérios de inclusão.
Através do levantamento bibliográfico realizado, observou-se que os estudos incluídos nesta revisão validaram interessantes propriedades biológicas para as espécies Erythroxylum. A partir dos resultados encontrados, o gênero se mostrou rico na síntese de moléculas bioativas promissoras para o desenvolvimento de medicamentos com propriedades antimicrobiana, anti-hipertensiva, anticâncer, antiviral, antidiabética, antioxidante, dentre outras.
Atividade anti-hipertensiva
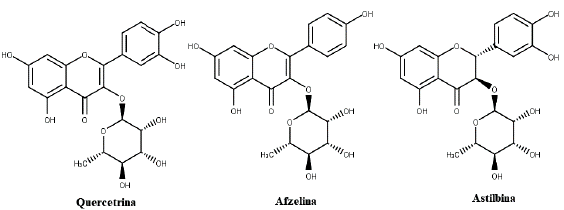
Duas espécies do gênero Erythroxylum foram testadas quanto à sua propriedade anti-hiper-tensiva por meio da capacidade de inibição da enzima conversora de angiotensina (ECA). O extrato de 99% em etanol das folhas de E. laurifolium apresentou potencial atividade de reduzir a pressão arterial, o extrato na concentração de 0,33 mg/mL inibiu 64% da atividade da ECA. Este resultado foi atribuído à presença de quercetina-3-O-raminosídeo (querci-trina) (IC50 = 0,67 mM) e kaempferol-3-O-raminosídeo (afzelina) (IC50 = 2,8 mM) (figura 2), que demonstraram atuar de forma sinérgica [14, 15].
O extrato etanólico das partes aéreas de E. gonocladum também foi avaliado quanto a inibição da ECA, este apresentou capacidade de inibição concentração-dependente com IC50 de 4,53 a 0,33 mg/mL. Astilbina (figura 2), um flavonoide isolado de E. gono-cladum, também promoveu inibição significante in vitro da ECA (IC50 5,87) na concentração de 10 mM [16].
Picot, Subraty e Mahomoodally realizaram um estudo de cinética enzimática quanto a capacidade de inibição das enzimas α-amilase e α-glicosidase de extratos de cinco espécies medicinais utilizadas tradicionalmente para o tratamento da diabetes pela população das Ilhas Maurício [17]. O extrato metanólico da folha de E. laurifolium apresentou significante inibição da a-amilase (IC50 7472,92 μg/mL) e α-glicosidase (IC50 1,02 μg/mL) ao se comparar com a acarbose. Demonstrou-se então que E. laurifolium apresenta uma potente atividade antidiabética, com forte inibição sobretudo da α-glicosidase [18].
O extrato das folhas de E. macrocarpum e suas frações em diclorometano, acetato de etila, n-butanol e água foram avaliados quanto a capacidade de antiglicação. Em concentrações entre 250 a 2000 μg/mL, os extratos e frações de E. macrocarpum apresentaram baixa propriedade de antiglicação, com IC50 de 0.11 a 9.36 μg/mL ao se comparar com o padrão aminoguanidina [19]. Já os esteroides 4-metil ergosta-7, 23-dien-3ß-ol e 4-metil ergosta-7, 24 (28)-dien-3β-ol, isolados das folhas de E. monogynum, demonstraram alta capacidade de antiglicação, com mais de 90% de inibição dos produtos finais da glicação avançada (AGE) na concentração de 100 mg/mL e com IC50 de 35,12 e 39,28 mg/mL da, respectivamente [20].
Atividade anticâncer
No estudo de Elias et al. [21], o extrato hexânico das folhas de E. daphnites apresentou atividade antiproliferativa em células escamosas de carcinoma oral SCC-9 (IC50 de 448.9 mg/mL), mediante redução dos níveis intracelulares de ciclinas. D e E, juntamente com o aumento da expressão de caspase-3, demonstrando então propriedade pró-apoptótica. Outra espécie vem apresentando atividade anticâncer, extratos e frações da casca em diferentes solventes de E. caatingae foram avaliadas in vitro contra linhas celulares cancerígenas, sendo estas: células de carcinoma mucoepidermóide de pulmão humano (NCI-H292), leucemia mielocítica crônica (K562) e células de carcinoma epidermóide de laringe humana (HEp-2). Neste estudo, as maiores atividades se deram contra HEp-2, com IC50 de 8,25 μg/mL para a fração em clorofórmio, e para a linha celular K562, com valores de IC50 9,86 μg/mL e 11,21 μg/mL para as frações em acetato de etila e clorofórmio, respectivamente [22].
Já no estudo de Pereira et al., as frações enriquecidas com alcaloides derivadas das folhas, cascas e raízes de E. pugens apresentaram atividade citotóxica para linhagens tumorais de carcinoma cervical causadas pelos vírus HPV18 (HeLa) e HPV16 (SiHa), além de células de câncer de próstata (PC-3) e renal (786-0) [6]. O mesmo efeito não foi observado para o extrato das folhas de E. macrocarpum em células epiteliais do câncer de mama, uma vez que não foi obtido um resultado estatisticamente significante [23]. Em contrapartida, o extrato aquoso das folhas de E. cuneatum apresentou atividade cito-tóxica frente células de carcinoma de fígado (HepG2), com IC50 de 125 μg/mL. Além disso, na concentração de 1 mg/mL o extrato não causou danos significativos em DNA no estudo de genotoxicidade, tanto para células normais do fígado (WRL68), quanto para HepG2 [11].
Em combinação com radioterapia, o extrato aquoso das folhas de E. suberosum a 500 μg/mL apresentou elevada toxicidade frente as células de carcinoma oral e da hipofaringe. O tratamento padrão com cisplatina (associada a 4 Gy de radiação) resultou em 36% de células de câncer oral viáveis, já o pré-tratamento com E. suberosum derivou em 27% de viabilidade celular, demonstrando aumento da eficácia [24].
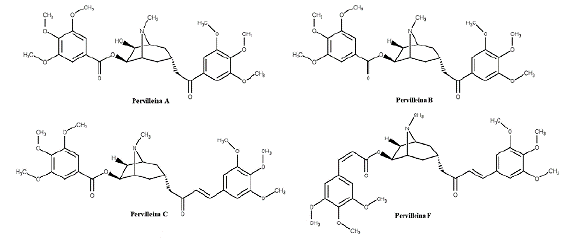
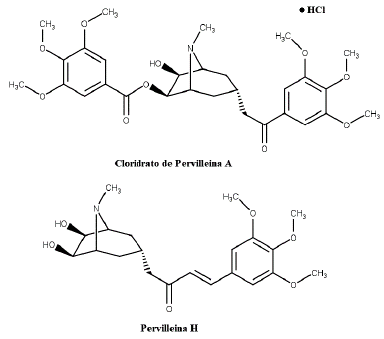
O alcaloide tropânico Pervilleina A, isolado do extrato das raízes de E. pervillei, ressensibiliza as células de carcinoma epidermóide humano (KB-V1) multirresistente e CEM/VLB100 à vimblastina (VBT) com valores de IC50 de 0,36 e 0,02 μM, respectivamente. Da forma semelhante, restaura a quimiossensibilidade das células KB-8-5 à colchicina com valor de IC50 de 0,61 μM [25, 26, 27]. Já Pervilleinas B e C, também isolados de extratos da raiz de E. pervillei, demonstraram capacidade de restaurar a sensibilidade à VBT de células KB-V1 resistentes a múltiplas drogas com IC50 de 0,17 mM [28, 29], resultado este também encontrado para Pervilleina F com IC50 de 0,40 mM, através da parada na fase G2/M do ciclo celular (figura 3) [30].
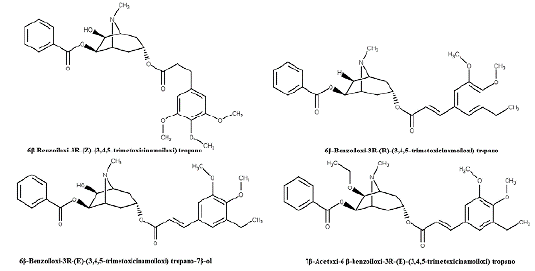
Compostos isolados de E. rotundifolium também foram avaliados contra células cancerígenas humanas. Os alcaloides 6β-Benzoiloxi-3R-(Z)-(3,4,5-trimetoxicinamoiloxi) tropano, 6β-Benzoiloxi-3R-(R)-(3,4,5-trimetoxicinamoiloxi) tropano, 6β-Benzoilo-xi-3R-(E)-(3,4,5-trimetoxicinamoiloxi) tropano-7β-ol e 7β-Acetoxi-6 ß-benzoiloxi 3R-(E)-(3,4,5-trimetoxicinamoiloxi) tropano (figura 4) apresentaram importante atividade frente células KB-V1 multirresistente incubadas com VBT [25]. Observou-se que os alcaloides isolados de E. pervillei e E. rotundifolium têm a capacidade de reverter a multirresistência ao interagir possivelmente com a glicoproteína-P [30, 31, 32].
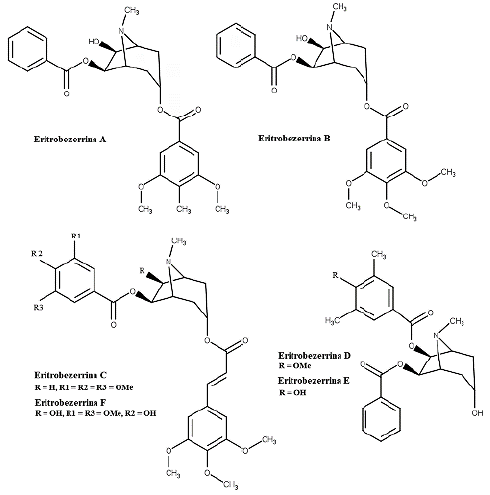
Para mais, do extrato da casca do caule de E. bezerrae foram isolados os alcaloides tropânicos Eritrobezerrinas A, B, C, D, E e F (figura 5), que foram avaliados frente células do câncer de próstata metastático (PC-3), adenocarcinoma de cólon (HCT-116), glioblastoma (SNB-19) e câncer de pulmão (NCI-H460). Contudo, apenas Eritrobezerrina C apresentou atividade moderada com valores de IC50 de 3,38 e 5,43 μM para HCT-116 e NCI-H460, respectivamente [33].
Atividade antioxidante
Diversas publicações avaliaram a atividade antioxidante de espécies do gênero Exrythroxylum através de diferentes metodologias. As técnicas in vitro analisaram a capacidade de sequestrar o radical 2,2-difenil-1-picril-hidrazil (DPPH), o radical ácido 2,2>-azinobis-3-etilbenzotiazolina-6-sulfónico (ABTS), o radical peroxil (ORAC), óxido nítrico (ON), superóxido (SO), peróxido de hidrogênio (H2O2), além da inibição da xantina oxidase (XO) e do poder de redução do íon ferro (FRAP).
O extrato aquoso e metanólico das folhas de E. macrocarpum e suas frações (em diclo-rometano, acetato de etila, n-butanol e água) apresentaram baixa atividade antioxidante ao se comparar com as outras espécies avaliadas no mesmo estudo. Obtiveram-se na concentração de 100 μg/mL o valor de IC50 entre 8,63 e 14,59 μg/mL frente ao radical DPPH, 2,23 a 19,36 μg/mL para o radical SO e 1,23 a 10,67 μg/mL para ON [19]. Ramhit et al. também estudaram o extrato das folhas de E. macrocarpum, no entanto, estas apresentaram elevada atividade antioxidante se comparadas com outras espécies da flora Maurícia estudadas no mesmo material, com IC50 de 0,30 mg/mL para sequestro de ON, 4,08 mg/mL para SO e 0,34 mg/mL para inibição da XO [23]. De forma adicional, o estudo de Neergheen et al. [34] apontou para o extrato da folha de E. macrocarpum os valores de 441μM/g em peso fresco em equivalente de trolox para ABTS e 517 μM/g em peso fresco em equivalente de Fe (II) da capacidade de redução para FRAP. A divergência de resultados entre os estudos pode ser justificada pelos diferentes locais de coleta da espécie, diferentes métodos extrativos empregados, resultando na variação da composição dos extratos, além das diferentes técnicas utilizadas para a avaliação desta propriedade.
Ledoux et al. buscaram avaliar a atividade antioxidante por ABTS, FRAP e ORAC de 64 plantas endêmicas das Ilhas Mascarenhas, dentre elas E. laurifolium e E. sideroxyloides, que demonstraram alta capacidade antioxidante. Para os extratos das folhas e da casca de E. laurifolium, encontrou-se como resultados de IC50, respectivamente, ABTS 134,5; FRAP 18,1; ORAC 72,2 μM/mg/mL e ABTS 1927,0, FRAP 391,9, ORAC 6310,3 μM/mg/mL, já para E. sideroxyloides ABTS 157,4; FRAP 63,9; ORAC 229,1 μM de Trolox equivalente por mg/mL de extrato e ABTS 1493,7; FRAP 88,8; ORAC 4441,1 μM de Trolox equivalente por mg/mL de extrato [35]. E. sideroxyloides também foi estudada por Soobrate et al., o extrato das folhas apresentou promissor efeito protetor na peroxidação lipídica, com IC50 de 0,0435 mg de peso fresco por mL no sistema Fe3+/ascorbato e 0,05 mg de peso seco por mL no sistema induzido de peroxidação lipídica microssomal [12].
Já os extratos em n-hexano, clorofórmio e acetato de etila das folhas de E. alaternifolium apresentaram propriedade antioxidante quase indetectável quando empregadas as técnicas de DPPH e ABTS. Apenas para fração em n-butanol foi encontrada propriedade antioxidante detectável (11,2 e 35,1 mg por Trolox/g de peso seco), demonstrando uma correlação entre o aumento desta propriedade com a utilização de solventes polares empregados na extração [36].
Outras duas espécies foram avaliadas quanto às suas atividades antioxidantes através do método de captação de DPPH, os extratos alcoólicos das folhas de E. novogranatense e E. coca apresentaram IC50 de 271,20 μg/mL e 172,59 μg/mL, respectivamente [7]. A infusão aquosa de sachês de chá de E. coca adquiridos em comércio local do Chile apresentou como capacidade antioxidante o valor de 7,61 mM em equivalente de Trolox pelo método de ORAC [37].
Porém, destaca-se a capacidade de esteroides isolados das folhas de E. monogynum, em que 4-metil ergosta-7, 23-dien-3β-ol apresentou 100% de atividade antioxidante a 100 mg/mL para os ensaios de sequestro de DPPH e H2O2 e 4-metil ergosta-7, 24 (28)-dien-3β-ol demonstrou IC50 de 38.74 mg/mL para sequestro de NO [20].
Atividade antimicrobiana
0 extrato alcoólico das folhas de E. novogranatense em concentrações de 25 e 50 μg/mL apresentaram atividade antibacteriana in vitro por difusão radial sobre as seguintes cepas orais: Streptococcus mutans (8,8 mm e 10,4 mm), Lactobacillus acidophilus (9,8 mm e 10,0 mm), Actinomyces viscosus (8,8 mm e 9,4 mm), Prevotella melaninogenica (12,6 mm e 13,4 mm) e Fusobacterium nucleatum (9,6 mm e 11,0 mm) [38, 39]. O extrato a 1 g/mL das folhas de E. novogranatense também apresentou atividade antimicrobiana frente Streptococcus epidermidis (28 mm), Escherichia coli (24 mm) e Pseudomonas aeruginosa (19 mm) pelo método de difusão radial [7].
Outra espécie também apresentou propriedade contra tais microorganismos, o extrato das folhas de E. coca (1 g/mL) demonstraram halo de inibição de 33 mm frente S. epidermidis, 18 mm para E. coli, 23 mm para P. aeruginosa e 23 mm para Staphylococcus aureus, [7]. Já no que se refere à atividade antifúngica, os extratos aquosos e etanólicos das folhas de E. coca não apresentaram efeito sobre o crescimento de Candida albicans e Trichophyton mentagrophytes, mas sim para Trichophyton rubrum e Microsporum canis [39].
O extrato e as frações em diferentes concentrações de acetato de etila e metanol da casca de E. caatingae também foram avaliados através do método de difusão radial. No qual, obteve-se interessante atividade frente às cepas de Micrococcus luteus, Bacillus subitilis, S. aureus e C. albicans, mas com um maior destaque para os halos de inibição de 13,5 a 29,5 mm contra Mycobacterium smegmatis [22]. Já o estudo de Correia et al. [40] buscou avaliar a atividade antifúngica dos extratos aquoso, alcoólico e hexânico das folhas de E. subrotundum e E. daphnites contra diferentes espécies de Candida. E. subrotundum e demonstrou atividade contra as cepas de C. glabrata, C. parapsilosis e C. guilliermondii com valor de concentração inibitória mínima (CIM) de 1000 μg/mL.
Extratos brutos de E. suberosum também foram avaliados quanto a suas propriedades antibacterianas e antifúngicas. Os extratos da casca do caule (frações etanólica, hexâ-nica, diclocrometano, acetato de etila e hidrometanólica) apresentaram atividade frente diferentes cepas, com os valores de CIM para C. albicans (500 μg/mL), C. glabrata (125 μg/mL) C. krusei (62,5 μg/mL), C. parapsilosis (250 μg/mL), S. aureus (250 μg/mL) e Cryptococcus neoformans (250 μg/mL) [41].
Pilna et al. [42] buscaram avaliar a atividade antimicrobiana in vitro de espécies medicinais contraculturas planctónicas de microrganismos cariogênicos, periodontais e candidais. Neste estudo, E. catuaba apresentou propriedade moderada, com concentração inibitória mínima de IC50 > 256 μg/mL para bactérias gram-positivas, gram-negativas e fermentadoras.
Os extratos das folhas de E. macrocarpum demonstraram possuir atividade antibacteriana alta (78,1 μg/mL) frente P. fluorescens, Bacilus cereus e Klebsiella oxytoca, moderada (156 μg/mL) frente E. coli e Serratia marcescens e fraca (625 μg/mL) para P. aeruginosa e Salmonella entérica [23]. Este estudo foi convergente ao realizado por Mahomoodally, Gurib-Fakim e Subratty, em que o extrato metanólico das folhas de E. macrocarpum também foram ativos contra B. cereus, B. subtillis, S. aureus, E. coli, P. aeruginosa e Enterococcus faecalis [43].
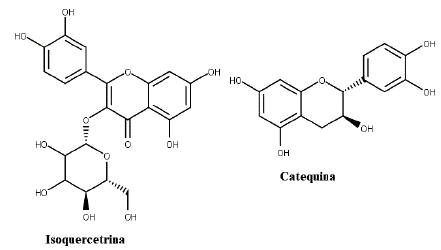
Para mais, Gurib-Fakim et al. avaliaram a atividade dos extratos metanólicos e aquosos das folhas e do caule de E. macrocarpum, E. hypericifolium, E. laurifolium e E. sideroxyloides frente a S. aureus, E. coli, P. aeruginosa e S. typhi. Todas as espécies demonstraram propriedade antimicrobiana para pelo menos uma das cepas utilizadas, atividade é atrelada à presença de quercitrina (figura 2), isoquercitrina e catequina (figura 6), substâncias isoladas das folhas das quatro espécies [44]. Contudo, houve destaque para E. macrocarpum, que se mostrou ativo frente a todas as bactérias testadas, e para E. hipericifolium, que apresentou atividade antifúngica para Aspergillus niger. Estes resultados se mostram semelhantes ao encontrado por outro estudo realizado com os extratos metanólicos da casca do caule de E. macrocarpum, E. sideroxyloides e E. laurifolium, em que o CIM variou de 2 a 8 mg/mL para estas mesmas bactérias [45].
Além disso, extratos das folhas e E. laurifolium foram reportados por apresentar atividade inibitória do crescimento microbiano frente Salmonella enteritidis, P. aeruginosa, Enterobacter cloacae, B. subtilis e C. albicans [46]. Outrossim, extratos de E. ovalifolium apresentaram atividade antifúngica para Stryphnodendron adstringens, Styrax spp., Synadenium sp. e Symphytum officinale [47].
Atividade antiprotozoária
Espécies do gênero Erytroxylum foram analisadas quanto a sua propriedade antiplas-módica. Extratos das folhas de E. monogynum apresentaram uma interessante atividade antimalária, sendo o metanólico o mais promissor, com IC50 de 12,23 μg/mL frente Plasmodium falciparum [48]. Em contrapartida, os extratos das folhas e da casca de E. laurifolium e E. sideroxyloides só possuíram capacidade em reduzir a população de P. falciparum em concentrações maiores que 50 μg/mL [35].
No que se refere à avaliação das atividades tripanocida e leishmanicida de espécies Erythroxylum, os dados são praticamente inexistentes, demonstrando uma lacuna imensa de estudos a serem realizados, com resultados inéditos a serem publicados. A única publicação encontrada investigou a atividade antiparasitária de 174 compostos e extratos de plantas do semiárido baiano, dentre eles, uma substância pura isolada de E. passerinum, que na concentração de 0,1 mg/mL apresentou 21,39% de inibição para epimastigotas de Trypanosoma cruzi e 5,88% de inibição para promastigotas de Leishmania amazonensis [49].
Atividade antiviral
Ledoux et al. [35] avaliaram a atividade antiviral de extratos em acetato de etila das cascas e das folhas de E. laurifolium e E. sideroxyloides contra o vírus da chikunguya, no entanto, apenas o extrato da casca de E. sideroxyloides apresentou propriedade anti-chikunguya, com IC50 de 22 jjg/mL e índice de seletividade > 5,4.
Outro estudo analisou a propriedade antiviral dos extratos metanólicos das folhas e casca de E. laurifolium frente os vírus Herpes simples tipo 1 (HSV-1) e Poliovírus tipo 2 (PV-2). Observou-se que os extratos não apresentaram capacidade de inibir o crescimento de PV-2, no entanto, se mostraram ativos para HSV-1 com IC50 de 125 jg/mL e 16 de índice de seletividade [9]. Além disso, o extrato enriquecido de taninos a partir das folhas e casca e E. laurifolium na concentração de 2 mg/mL apresentou atividade virucida tempo-dependente para HSV-1, tal propriedade é justificada pelos taninos terem capacidade de afetar a replicação do vírus devido à sua habilidade de se complexar com proteínas do envelope celular [50].
Um complexo lignina-carboidrato da casca de E. catuaba foi estudada quanto a sua atividade anti-HIV e apresentou como índice de seletividade 43 [51, 52]. Já o extrato aquoso do tronco de E. citrifolium foi avaliado quanto a capacidade inibitória de proteases do HIV (HIV-1 PR) e se encontrou um valor de IC50 de 43 μg/mL [53, 54].
Atividade imunomudoladora
Um estudo avaliou a capacidade dos extratos metanólicos e aquosos das folhas de E. macrocarpum em desencadear atividades da mieloperoxidase de fagócitos. Contudo, nas concentrações de 25, 50 e 100 μg/mL, os extratos apresentaram baixa atividade imunomoduladora ao se comparar com o controle [55].
Atividade colinérgica e adrenérgica
Pervilleina A e seus análogos (±)- pervilleina H e (±)- cloridrato de pervilleina A (figura 8), isolados de E. pervillei, foram estudados quanto ao seu efeito colinérgico e adrenérgico, visto que apresentam similaridade estrutural à cocaína e hiosciamina. O análogo (±)- cloridrato de pervilleina A apresentou atividade colinérgica fraca e não específica, além de bloqueio adrenérgico vascular. Já, (±)- pervilleina H foi inativo em todas as concentrações [56, 57].
O alcaloide tropânico 7β-acetoxi-3β, 6β-dibenzoiloxitropano (figura 8), isolado das folhas de E. rimosum, foi avaliado quanto a inibição da acetilcolinesterase (AChE) e butirilcolinesterase (BuChE), apresentando como valores de IC50 4,67 x 103 mmol/L e 2,71 x 104 mmol/L, respectivamente, efeito este significante ao se comparar com obtido pelo controle com fisostigmina [4]. Além disso, também foi descrito na literatura que o extrato das folhas de E. macrocarpum apresenta uma potente atividade inibitória da AChE com IC50 de 0,04 mg de peso fresco por mL [23].
Atividade moduladora da CYP
Um estudo reportou a capacidade de extratos das folhas de E. minutifolium e E. confusum em modular o sistema citocromo P450 de hepatócitos de rato. Ambos os extratos produziram diminuição nas atividades de CYP1A2, CYP2E1 e SM4OH, ao passo que, não foram observadas a influência nos valores de CYP3A1, 2D2, e 2C6 [8].
Luck et al. avaliaram misturas voláteis induzidas por ácido jasmónico de duas espécies Erythroxylum. O estudo concluiu que CYP79D60, CYP79D61 e CYP79D62 aceitam L-fenilalanina, L-leucina, L-isoleucina e L-triptofano como substratos, e que estes in vivo contribuem para a produção de compostos nitrogenados voláteis e semivoláteis de defesa nitrogenada em E. coca e E. fischeri [58].
Atividade antiparkinsoniana
Astilbina (AST) (figura 2), flavonoide isolado de espécies vegetais, em especial E. gonocladum, vem sendo relatado quanto a sua propriedade antiinflamatória, antioxidante e neuroprotetora. Nesse sentido, AST foi avaliado quanto seu potencial em tratar a doença de Parkinson (DP) induzido com 1-metill-4-fenil-1,2,3,6-tetrahidropiridina (MPTP) em ratos. O AST apresentou capacidade de exercer efeitos neuroprotetores em camundongos DP induzidos por MPTP, suprimindo a gliose, a superexpressão de α-sinucleína e o estresse oxidativo, sugerindo que o AST poderá ser empregado para o desenvolvimento de medicamentos para o tratamento da DP [59].
Atividade hepatoprotetora
O efeito protetor no dano oxidativo induzido por modelos tóxicos em culturas de hepatócitos de ratos foram estudados para os extratos de E. minutifolium e E. confusum. Ambos os extratos apresentaram atividade hepatoprotetora, reduzindo dano aos hepatócitos causados por hidroperóxido de terc-butila (EC50 72 a 83 μg/mL) e tetracloreto de carbono (EC50 86 a 33 μg/mL), além de etanol e lipopolisacarídeo com EC50 >100 μg/mL [60].
Outras atividades
Suliman et al. [61] buscaram determinar o efeito do extrato alcaloide das folhas de E. cuneatum contra dependência crónica à morfina e as influências nos processos de neurotransmissão in vitro. Sugeriu-se que E. cuneatum possui atividade antidependente contra a morfina, com propriedade similar à metadona, aumentando o tráfego de vesículas e liberação de neurotransmissores.
Quanto à atividade larvicida, os extratos metanólicos e em acetato de etila das folhas e frutas de E. passerimum e E. numularia se mostraram inativos frente às larvas de Aedes aegypti (L.), contudo, o composto 14-O-metil-rianodanol, diterpeno isolado de E. nummularia, apresentou leve atividade no teste larvicida com CL50 82 ppm [62].
Também há relatos que E. ovalifolium e E. subsessile apresentam capacidade de neutralizar os efeitos tóxicos do veneno da serpente Lachesis muta. As frações e extratos em hexano, diclorometano, acetato de etila, etanol e butanol do caule de Erythroxylum sp. possuíram capacidade de inibir os efeitos de proteólise, coagulação, hemólise, hemorragia e edema do veneno de L. muta. O efeito antiveneno pode estar correlacionado à presença de friedelina, lupeol e ß-sitosterol na composição dos extratos, além dos flavonoides quercitrina e rutina [5].
Foram realizados estudos farmacológicos in vitro e in vivo de extratos brutos das folhas e raízes de E. argentinum. A espécie apresentou capacidade de reduzir a pressão arterial de rato e potenciaram o sono barbiturico em camundongos, reduzir o edema induzido na pata de rato, relaxamento inespecífico no útero de rata e contração do íleo de cobaia. Além disso, os testes demonstraram que o extrato bruto ou frações semi-purificadas das folhas produziram uma ação semelhante à cocaína no canal deferente de rato. Observou-se que os constituintes de E. argentinum vêm a possuir distintas propriedades farmacológicas, dentre estas, destaca-se a antiinflamatória [62-64].
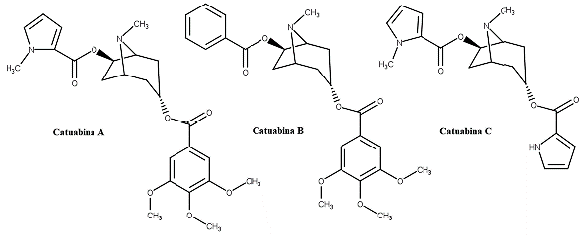
O efeito afrodisíaco e estimulante de uma amostra comercial da casca do caule de E. vacciniifolium foi avaliado in vitro, contudo não houve evidências de tais propriedades, pelo menos não no teste do corpo cavernoso de coelho, no qual não foi observado efeito na ereção e na libido [65]. No entanto, este resultado póde ter sido encontrado pela amostra comercial ter uma menor concentração de catuabinas A, B e C (figura 11), substâncias relatadas como responsáveis pelo efeito afrodisíaco de E. vacciniifolium [66].
E. caatingae foi investigada quanto ao seu efeito miorelaxante do tecido muscular através da análise capacidade em reduzir a contratilidade do cérvix ovino. O extrato etanólico das folhas de E. caatingae em concentrações cumulativas (1-729 g/mL) diminuiu a amplitude da contratilidade in vitro, com EC50 de 17,9 g/mL. O efeito miorelaxante pode envolver sinalização de óxido nítrico mediado por transdução celular de cGMP, relacionado com sequestro intracelular de cálcio [64].
Outras espécies também demonstraram interessantes efeitos no sistema muscular, os extratos aquosos e metanólicos das folhas e cascas de E. sideroxyloides, E. hypericifolium, E. laurifolium e E. macrocarpum apresentaram respostas de contração e relaxamento in vivo dos músculos lisos, músculos aortais e traqueais em animais de sangue frio [44].
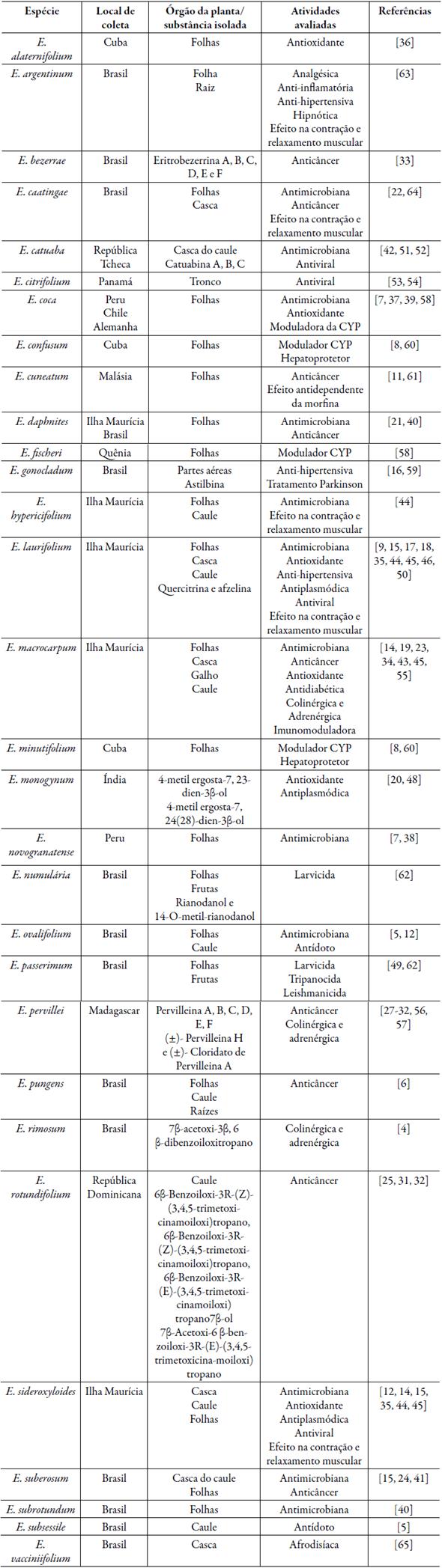
A tabela 1 relaciona os trabalhos encontradas através da busca sistemática e respectivas informações sobre espécies estudadas, local da coleta, partes utilizadas e atividades biológicas avaliadas.
Potencialidades das espécies Erythroxylum
O gênero Erythroxylum se apresenta com ampla diversidade na produção de metabó-litos secundários. A partir dos extratos das folhas, cascas, caules, partes aéreas, tronco e raízes, observou-se o isolamento de flavonoides, alcaloides, esteroides, terpenos, ácidos carboxílicos, dentre outros [16, 20, 23, 30, 62]. É importante destacar que as cascas do caule e as folhas foram os órgãos mais estudados, visto que tais partes são as empregadas na medicina popular para o tratamento de diversas patologias. Partindo desse princípio, a partir da confirmação das atividades biológicas e das substâncias isoladas a partir de estudo in vitro, observa-se que a população tradicional vem selecionando corretamente o modo de uso de tais espécies [43, 44, 46].
Estudos etnobotânicos e fitoquímicos reportam uma ampla distribuição de Erythroxylum pelo globo, com um maior relato nos seguintes países: Cuba, Panamá, Índia, Ilha Maurícia, Brasil, Quênia, Madagascar, Malásia, Alemanha, República Dominicana, Peru e Chile. Apesar da maioria das espécies terem sido coletadas no Brasil, as duas espécies mais avaliadas quanto ao seu potencial farmacológico in vitro foram E. laurifolium e E. macrocarpum, cuja distribuição não é relatada no território brasileiro, demostrando a necessidade da realização de mais estudos que avaliem o potencial farmacológico das espécies endêmicas do país.
Extensas são as atividades biológicas avaliadas através de estudos in vitro para o gênero, com um maior destaque para as propriedades anticâncer, antimicrobiana, antioxidante, anti-hipertensiva e antidiabética [7, 20, 37, 41]. Tais atividades vêm sendo justificadas pela presença de compostos ativos produzidos a partir do metabolismo secundário, em especial os flavonoides e alcaloides, isolados de espécies Erythroxylum [14, 16, 23, 25, 30, 33] . De forma semelhante, os extratos que apresentaram maior potencial biológico foram os que empregaram solventes polares e ácidos, uma vez que a utilização da influência do pH no momento da extração é responsável pela obtenção de frações ricas em alcaloides, e o emprego de solventes como etanol, metanol, n-butanol e água facilitam a extração de flavonoides, taninos e demais compostos fenólicos. Já os extratos que obtidos a partir de solventes de baixa a média polaridade, a exemplo de clorofórmio, acetato de etila, hexano e diclorometano, mostraram-se com menor potencial biológico ao se comparar com as demais frações [23, 34, 36, 40].
Os flavonoides são um grupo de moléculas com capacidade de desempenhar variadas propriedades farmacológicas e de inibir uma gama diversificada de enzimas. Essa classe de compostos, juntamente com os alcaloides e demais compostos fenólicos, justificam diferentes propriedades dos extratos de espécies Erythroxylum, a exemplo da anti-hipertensiva, antibiótica e antioxidante [5, 23, 34]. A atividade anti-hipertensiva de E. laurifolium e E. gonocladum foi atribuída à flavonoides isolados de suas folhas e partes aéreas, visto que quando as proantocianidinas foram removidas do extrato de etanol de E. laurifolium por precipitação com gelatina, a atividade inibitória da ECA foi reduzida significativamente. Astilbina, quercitrina e afzelina promovem inibição in vitro da ECA, sendo seus valores dependentes no padrão de substituição dos grupos hidroxila [14-16].
A inibição do crescimento de bactérias gram positivas e gram negativas de E. sideroxyloides, E. laurifolium, E. macrocarpum e E. hypericifolium se correlacionam à presença de quercitrina, isoquercitrina e (+) - catequina em seus extratos [55]. Os compostos fenólicos, em especial taninos e flavonoides, também estão relacionados a atividade antimicrobiana e antifúngica de E. novogranatense [38], E. coca [39], E. suberosum [41], E. subrotundum, E. daphnites [40], E. sideroxyloides, E. laurifolium, E. macrocarpum, E. hypericifolium [44], E. catuaba [42] E. ovalifolium [47] e E. caatingae [22]. Tais compostos possuem diferentes mecanismos de ação antibiótica, podendo agir através da inibição da produção de ácido e da enzima glucosiltransferase [38]. Contudo, estudos demonstram que os alcaloides também podem ser responsáveis pela propriedade antimicrobiana de espécies Erythroxylum [39, 40].
A atividade antioxidante do gênero é atribuída aos compostos fenólicos dos vegetais, cujos mecanismos de ação estão atrelados a eliminação de radicais livres, propriedades quelantes de metais, capacidade de regular a expressão gênica e ação como co-antioxidantes [12, 34]. Os flavonoides e compostos fenólicos se mostram como importantes doadores de hidrogênio e promissores para reduzir o stress oxidativo, estes podem exercer capacidade em influenciar processos patológicos, a exemplo dos inflamatórios [63], diabetes, aterogênese [34], doença de Alzheimer [59] e na modulação da CYP [8]. O efeito hepatoprotetor de E. minutifolium e E. confusum também têm sido associados à sua atividade antioxidante, visto que podem fornecer proteção para doenças do fígado ao inibir e eliminar radicais livres [60].
Os alcaloides são outra classe de metabólitos secundários amplamente encontrados em espécies Erythroxylum, substâncias estas reconhecidas pela sua potencial atividade anticâncer. Dos extratos de E. pervillei e E. rotundifolium foram isolados alcaloides tropânicos com capacidade de restaurar a sensibilidade VLB de células KB-V1 multirresistentes. O grupamento dos ésteres aromáticos do grupamento tropano reverte o fenótipo de multirresistências a quimioterápicos através da inibição da glicoproteína P. Para as pervilleinas, postula-se que a unidade trans-3,4,5-trimetoxicinamoil na posição C-6 pode ser o requisito estrutural fundamental para a atividade anticancer, já substituintes em C-3 e C- 7 podem desempenhar papéis menos importantes [25, 26, 28-30].
Os alcaloides tropânicos isolados de E. bezerrae também foram avaliados quanto a sua propriedade anticâncer, contudo apenas eritrobezerrina C apresentou propriedade significativa [33]. Mas não somente substâncias isoladas foram estudadas quanto ao seu potencial antineoplásico, o extrato clorofórmico das cascas de E. caatingae demostrou aumento de morte por apoptose para as linhas celulares HEp-2 e K562, em que possivelmente os ácidos graxos saturados (ácidos oleico, palmitoléico, palmítico e esteárico) levam a ativação de proteínas BCL-2, além dos mediadores de morte celular Bim e Bax, desencadeando na apoptose por via mitocondrial [22]. Outro extrato apresentou atividade citotóxica através da ativação da apoptose, o extrato hexânico de E. daphnites reduziu a expressão intracelular de ciclinas D e E e da caspase-3 de células SCC-9 [21]. Já o extrato aquoso das folhas de E. cuneatum demostrou atividade anticancer por outra via de morte celular, em que promoveu a necrose através da disruptura da membrana celular de células HepG2 [11].
A citotoxidade de extrato de espécies Erythroxylum não se aplicam exclusivamente quanto a sua propriedade anticâncer, mas também no que se refere ao seu potencial como antiviral. As atividades anti-herpética e anti-HIV de extratos de folhas e caule de E. laurifolium vêm sendo atribuídas a presença de taninos em sua composição, que apresentam capacidade de afetar um ou vários estágios do ciclo de replicação dos vírus, após a penetração e descapsidação, além de se associarem a proteínas do envelope [9, 35, 50]. As espécies E. catuaba e E. citrifolium também apresentam interessante atividade anti-HIV [51, 53, 54, 66].
É importante destacar também as propriedades dos esteroides 4-metil ergosta-7, 23-dien-3β-ol e 4-metil ergosta-7, 24(28)-dien-3β-ol isolados de E. monogynum, que vêm demostrando atividades antioxidantes, antiglicação e inibidoras da xantina oxidase [2]. Além do alcaloide tropânico 7ß-acetoxi-3β, 6β-dibenzoiloxitropano, isolado das folhas de E. rimosum, com importante capacidade na inibição de AChE e BuChE [4]. E para mais, o flavonoide astibilina com efeito neuroprotetor, suprimindo a gliose, a superexpressão de α-sinucleína e do estresse oxidativo [59].
Por fim, é necessário ressaltar que a apresentação de uma maior ou menor atividade biológica in vitro, além da divergência de resultados entre estudos podem ser justificados por diferentes fatores inerentes à produção de metabolitos secundários de espécies vegetais. Sabe-se que o estado de maturação do órgão recolhido, diferentes locais, estação do ano e horário de coleta, atrelados aos fatores bióticos e abióticos aos quais as plantas foram expostas, podem influenciar na produção e diferentes compostos para uma mesma espécie, ou no quantitativo de substância produzida, influenciando diretamente na atividade biológica avaliada [3].
Finalmente, diversas espécies do gênero Erythroxylum apresentaram suas propriedades biológicas validadas através de estudos in vitro, corroborando para a ratificação do seu uso popular para diferentes patologias, com destaque para as atividades antioxidante, antibiótica, anticâncer, anti-hipertensiva, antidiabética, neuroprotetora, dentre outras. O gênero Erythroxylum é composto por 230 espécies distribuídas em todo o globo, no entanto, apesar de muitos artigos terem sido publicados empregando tais vegetais, foram encontrados estudos validando as propriedades biológicas de apenas 30 espécies, constatando a lacuna de vegetais do gênero a serem avaliados. Destaca-se a atividade anticâncer dos alcaloides de E. pervillei, E. rotundifolium e E. pugens, a propriedade antimicrobiana de extratos de E. novogranatense, E. macrocarpum, E. caatingae, E. hipericifolium, e E. sideroxyloide, o efeito antiparkinson a partir do composto isolado de E. gonocladum, além de E. laurifolium por suas atividades antidiabética, anti-hiper-tensiva, antiviral e antioxidante. Portanto, observa-se a necessidade da realização de mais estudos a fim de elucidar as atividades biológicas de Erythroxylum sp., visto que o gênero se mostrou promissor para o desenvolvimento de medicamentos para as mais diversas indicações, além de contribuir com a validação do seu extenso uso popular.