INTRODUCCIÓN
La administración oral es la ruta de preferencia para la administración de medicamentos [1], debido a que esta es más cómoda, segura y económica en comparación con las otras vías de administración [2]. La importancia de la vía de administración oral de medicamentos se evidencia por el hecho de que más del 60% de las nuevas entidades moleculares que recibieron la aprobación de la FDA en el 2014 son formulaciones orales [3]. Sin embargo, la respuesta terapéutica de los fármacos que son administrados por esta vía se ve influenciada negativamente debido a la escasa solubilidad de fármacos en los fluidos gastrointestinales (GI), la permeación insuficiente a través de la membrana GI y el extenso efecto del primer paso hepático [4]. Muchas de las fallas que se presentan en el desarrollo de fármacos se deben a sus propiedades biofarmacéuticas, principalmente su errática disolución, ya que más del 40% de las nuevas entidades químicas descubiertas son lipófilas y, por lo tanto, son insolubles o poco solubles en agua, debido a su elevada complejidad molecular [5], este es el principal problema para lograr una buena biodisponibilidad, ya que estos necesitan estar disueltos en los fluidos gastrointestinales para poder ser absorbidos [6]. Alrededor del 70% de estas nuevas entidades químicas pertenecen al sistema de clasificación de biofarmacéutico (BCS) de clase II, las cuales presentan baja solubilidad y alta permeabilidad, en estos fármacos la velocidad de absorción es mayor que la de disolución, razón por la cual la disolución del fármaco in vivo es entonces un paso limitante de la velocidad de absorción [7].
Entre esta clase de fármacos que presentan baja solubilidad acuosa se encuentra el estradiol, una hormona esteroide sexual femenina usada ampliamente como terapia hormonal sustitutiva (THS) para el tratamiento de los síntomas de la menopausia y en la prevención de la osteoporosis en mujeres postmenopáusicas con alto riesgo de fracturas a las que se les ha contraindicado el uso de otros medicamentos autorizados para la prevención de la osteoporosis [8]. El desarrollo de nuevos productos farmacéuticos en los últimos años ha sido considerado un gran desafío como consecuencia de la baja solubilidad y, por ende, a la baja biodisponibilidad oral de los fármacos, en este sentido mejorar la solubilización constituye el método más importante para la mejora de la absorción [9]. Una de las estrategias más populares que nos permite lograr un incremento significativo de la solubilidad de fármacos lipofílicos es la utilización de sistemas de administración de fármacos basados en lípidos [10]. Dentro de esta estrategia de formulación podemos encontrar diversos sistemas tales como emulsiones, microemulsiones, soluciones micelares, emulsiones secas, soluciones lipídicas y sistemas de entrega de fármacos autoemulsificables o SEDDS (del inglés Self-Emulsifying Drug Delivery System) [11]. Los SEDDS han sido diseñados para darle solución a estos problemas de solubilidad ya que logran tener al fármaco solubilizado y capaz de ser liberado sin presentar precipitación [12], además de ofrecer estabilidad termodinámica y aumentar la biodisponibilidad oral.
En este sentido, tienen un gran potencial como alternativa para la formulación de principios activos con una baja o variable biodisponibilidad oral. Sin embargo, su potencial se ve restringido por la falta de correlaciones in vivo-in vitro, buenas pruebas in vitro predictivas y el hecho que solo muy pocas combinaciones específicas de excipientes resultan en sistemas efectivos. A pesar que en el mercado farmacéutico existe gran diversidad de lípidos, tensioactivos y co tensioactivos que pueden emplearse para este sistema, para su elección es necesario tener en cuenta las propiedades autoemulsificables que le otorgaran al mismo, por lo cual, su adecuada elección, combinación y proporción resultan críticos para lograr un sistema de entrega eficaz, asimismo, constituye un problema de investigación, ya que si la selección de excipientes no se realiza de forma correcta podría derivar en inconvenientes como toxicidad, inestabilidad química del activo y problemas en cuanto a la biodisponibilidad del medicamento [12]. Para desarrollar este tipo de sistemas se emplean diferentes herramientas, entre ellas, los diagramas de fases pseudoternario, los cuales nos permiten reconocer las diferentes regiones de formación de SEDDS en relación con las proporciones de los componentes de la formulación, lo cual es muy útil al momento formular estos sistemas.
No obstante, dada la complejidad que presentan los SEDDS, los resultados obtenidos a partir del diagrama de fases necesitan ser complementados con otro tipo de pruebas para caracterizar de un modo inequívoco este sistema. Para ello se hace necesario el empleo de pruebas fisicoquímicas tales como determinación del tamaño de la gota, tiempo de autoemulsificación, robustez de la dilución y punto de nube [13]. Esta estrategia de investigación permite la evaluación o caracterización de estos sistemas, brindando al investigador las herramientas necesarias para realizar un análisis exhaustivo que le permitirán desarrollar formulaciones tipo SEDDS más eficaces, estables y robustas. En esta investigación se desarrolló y caracterizó un SEDDS de estradiol como fármaco modelo con el fin de aportar a un conocimiento más amplio en cuanto al diseño de estos sistemas y potenciar el uso de estas metodologías en el desarrollo de SEDDS y promover la investigación en esta área del conocimiento farmacéutico, poco explorada en el país.
MATERIALES Y MÉTODOS
Estudio de solubilidad de Estradiol en diferentes aceites
Se preparó una solución saturada de estradiol USP en un vial de vidrio sellado, para lo cual se agregó 5 g de la muestra de aceites reportados en sistemas SEDDS [14]: aceite 1 (A1): Capmul® MCM (caprilato de glicerilo/caprate); aceite 2 (A2): Maisine® CC (glicerol/glicerol monolinoleado); aceite 3 (A3): Miglyol® 812 (triglicérido caprílico/ cáprico); aceite 4 (A4): aceite de sésamo y una cantidad suficiente de fármaco, inicial-mente, 50 mg, la cual se fijó experimentalmente hasta saturación), y se sometió a agitación a 100 rpm por 72 h de las cuales se realizaron 3 muestreos por aceite cada 24 h a una temperatura constante de 37 °C. Posteriormente, las muestras se centrifugaron a 2800 rpm, se tomó el sobrenadante y se llevó a una volumétrica donde se aforó con metanol y se cuantificó la cantidad disuelta en el aceite a través de la técnica de cromatografía liquida de ultra alta eficacia o UHPLC (del ingles Ultra High Performance Liquid Chromatography) en un equipo UHPLC Agilent technologies 1290 equipado con un detector de fluorescencia (FLD)[15]. La separación se realizó en una columna de fase inversa Agilent Zorbax C18 (250 x 4 mm, 5 μm); la fase móvil estaba compuesta de acetonitrilo: agua en una proporción (55:45) a una velocidad de flujo de 1,0 mL/min. El volumen de inyección fue de 25 μL, y las longitudes de onda de excitación y emisión del detector de fluorescencia fueron 280 y 312 nm, respectivamente [16, 17].
Estudio de compatibilidad con excipientes
Se evaluaron las características físicas de los excipientes por separado y en combinación con el activo, para esto, se prepararon mezclas binarias del principio activo con los respectivos excipientes en una proporción (1:5; w/w) en viales transparentes. Las muestras se expusieron a condiciones de estrés (40°C/60% HR) y condiciones de control (25°C/60% HR) durante 30 días en cabinas de estabilidad. Este estudio se realizó a través de UHPLC bajo las mismas condiciones cromatográficas señaladas en el estudio de solubilidad. Con el fin de identificar la existencia de interacción fisicoquímica entre los componentes de la mezcla que pudieran modificar las condiciones del preparado final cualquier cromatograma cambiante con respecto a un estándar de referencia, como picos adicionales correspondientes a productos de degradación, se tomaron como indicativo de una incompatibilidad [18].
Selección de tensioactivo y cotensioactivo
Los tensioactivos fueron seleccionados a través de una revisión bibliográfica teniendo en cuenta su uso en formulaciones de SEDDS, su valor de HLB (>10) y su seguridad clínica (se prefirieron tensioactivos no iónicos). Los tensioactivos seleccionados fueron el Kolliphor® RH40 (HLB entre 14 y 16) y el Gelucire® 44/14 (HLB 14) dado que sus valores del HLB les confieren características hidrosolubles y facilitan la disminución de la energía interfacial, lo que conduce a la formación de dispersiones más estables y de menor tamaño [19]. El cotensioactivo se escogió teniendo en cuenta las sustancias que han mostrado mejores resultados en la formación de SEDDS de acuerdo con los reportes bibliográficos [20]. El cotensioactivo seleccionado fue el Transcutol® HP, un potente solubilizante, ampliamente usado como cotensioactivo en formulaciones orales de LFCS Tipo III (SMEDDS), presentando varias ventajas sobre los tradicionales, incluyendo mejor estabilidad y menor volatilidad. También fue escogido por su seguridad de uso y baja irritación inferida por numerosos estudios toxicológicos, precedencia de uso en productos farmacéuticos aprobados [21], incluyendo terapia hormonal sustitutiva con estradiol [22]. El tensioactivo y el cotensioactivo en cada grupo de excipientes se mezclaron en diferentes proporciones de peso 2:1 y 9:1. Estas proporciones se eligieron para aumentar la concentración de tensioactivo con respecto al cotensio-activo para conocer el comportamiento de dichos materiales en una alta y baja concentración y así realizar un estudio exhaustivo de los diagramas de fases pseudoternarios.
Construcción del diagrama de fases pseudoternario
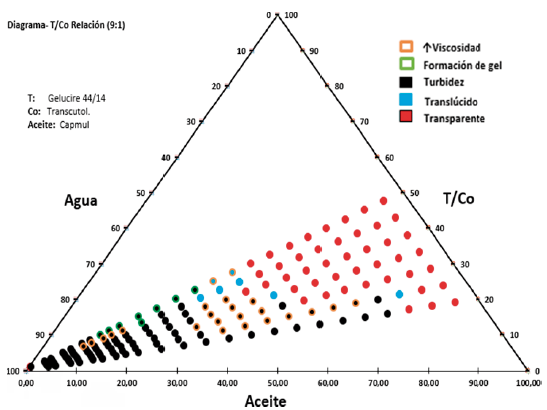
Para desarrollar los diagramas de fases se empleó el método de titulación con agua mencionado en otras investigaciones [23]: se titularon las mezclas de tensioactivo/cotensioactivo y el aceite (seleccionado en el estudio de solubilidad) (T/Co-A) con una cantidad conocida de agua destilada que representó un incremento del 5%. El rango propuesto de las mezclas preparadas fue de T/Co-A (50:50) a T/Co-A (20:80) [24], de las cuales se prepararon 5 g. Las proporciones de T/Co se prepararon en las relaciones 2:1 a 9:1. Los cambios físicos que se observaron y a partir de los cuales se caracterizaron las mezclas fueron: transparencia, translucidez, turbidez; determinadas de forma cualititativa realizando una descripción visual de las muestras en los diferentes ensayos con la adición de agua, detectando la posible formación de microemulsiones teniendo en cuenta cambios de apariencia(blanco, azul, grisáceo, aparición de gotitas de aceite en la superficie) [15] y cambios de estados físicos: aparición de gel y aumento de viscosidad apreciables al aplicar fuerza de agitación utilizando una plancha de laboratorio con barras magnéticas. Estas propiedades se identifican en los diagramas con el color rojo, azul, negro, verde y naranja, respectivamente.
Formulaciones propuestas con estradiol
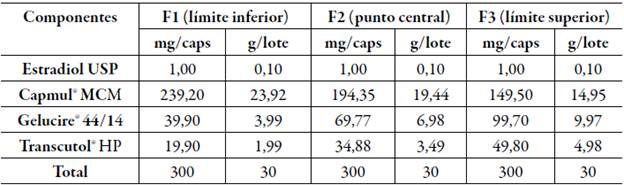
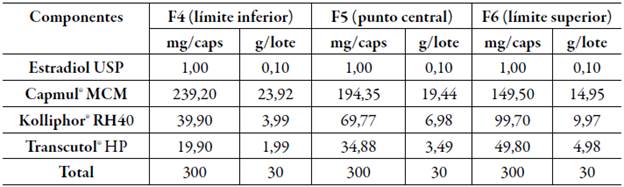
Para la preparación de las formulaciones se escogieron proporciones de acuerdo con las concentraciones máximas y mínimas de lípidos y tensioactivos necesarias para el desarrollo de un sistema clase III (autoemulsificable) basado en el sistema de clasificación de formulación lipídica (LFCS) introducido por Pouton [25]. Así, el límite superior con la máxima concentración de tensioactivo/co- tensioactivo fue de 50% y para aceite de 80%, y el límite inferior con la mínima concentración a utilizar fue de 20% para tensioactivo/cotensioactivo y de 50% para aceite, a su vez se escogió un punto central (35%) entre el límite superior e inferior para un total de 3 formulaciones por cada mezcla resultante de T/Co-A. Estas formulaciones contenían una concentración de estradiol USP de 1 mg [26] y un peso de dosificación de 300 mg para ser incluidas en capsulas duras. El aceite se añadió en cada sistema T/Co con agitación continua. Una vez preparado el sistema se adicionó el estradiol USP gradualmente con agitación continua y se mantuvo en agitación a 100 rpm durante 1 h aproximadamente hasta solubilización completa. Finalmente, la mezcla se mantuvo a 25 °C. Estas formulaciones fueron caracterizadas a través de las siguientes pruebas descritas a continuación.
Tiempo de autoemulsificación
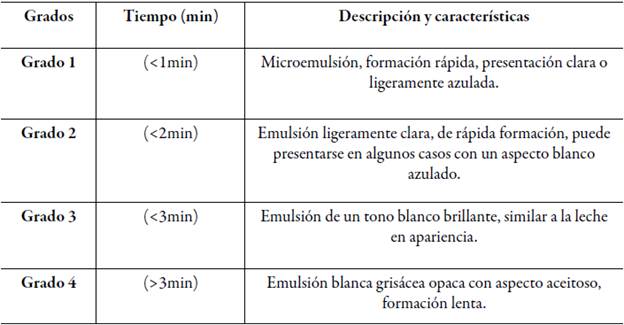
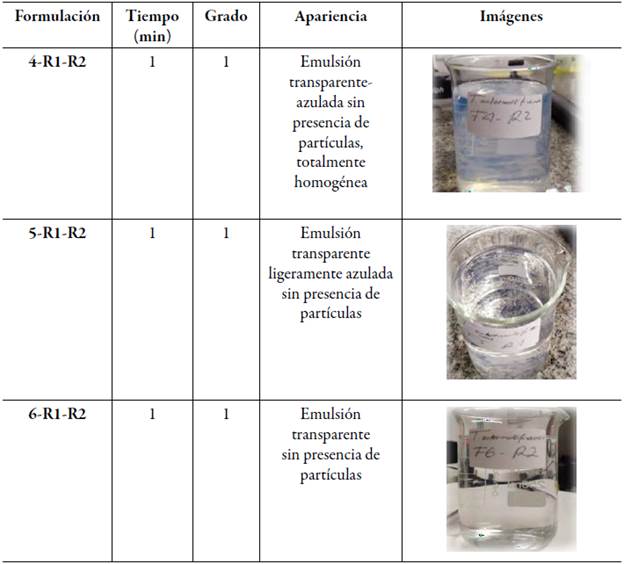
El tiempo de autoemulsificación es el tiempo requerido para formar una mezcla homogénea tras la dilución, este parámetro se evaluó empleando un equipo de disolución modificado utilizando el aparato 2 USP (paletas) con una velocidad de 100 rpm, en un beaker con 250 mL de agua destilada, en el cual se adicionó la formulación gota a gota manteniendo una temperatura constante de 37 °C. La formación de la emulsión se determinó de manera visual. Los parámetros observados para cada formulación fueron: la capacidad de mantenerse estable, completamente homogeneizado, sin separación y sedimentación de aceite y de acuerdo con el tiempo en que tardó en autoemulsificarse se estableció un grado para cada formulación tal como se clasifica en la tabla 1 de "grados de autoemulsificación" según lo señalado por Khoo [27].
Robustez a la dilución
La robustez a la dilución se evaluó como un indicador de estabilidad que determina si las mezclas sufren cambios a medida que el medio varía. Esta prueba se realizó en 3 medios de disolución, HCl 0,1 N (pH 1,2), buffer acetato (pH 4,5) y buffer fosfato (pH 7,2). Se tomaron 300 mg de cada formulación y se diluyeron en volúmenes de 10, 100 y 250 ml por cada medio, así se evaluó el comportamiento de las muestras a medida que se incrementaba el volumen del medio, cada muestra diluida se almacenó durante 1 día a 37 °C [28].
Determinación del punto de nube (cloud point)
Las soluciones acuosas que incluyen tensioactivos no iónicos exhiben un comportamiento de turbidez al ser calentadas o enfriadas que depende de la naturaleza y de la concentración del tensioactivo. La temperatura a la cual ocurre este fenómeno se denomina punto de nube y es importante en la formulación de SEDDS, ya que esta separación de fases puede provocar inestabilidad física de la emulsión, afectando la entrega del fármaco [29]. Para determinar esta temperatura en las distintas formulaciones ensayadas por triplicado se diluyeron 300 mg de cada formulación en 30 ml de agua destilada, en recipientes herméticamente cerrados y se introdujeron en un baño de agua con una temperatura inicial de 25 °C con aumentos graduales de 5 °C, cada uno seguido de 3 a 5 min de período de equilibrio, al final de cada período las muestras se sacaron del baño momentáneamente y se inspeccionaron visualmente, de acuerdo con otras investigaciones. La temperatura a la primera señal de turbidez se tomó como el punto de nube y fue medido con un termómetro Silber Brand (-10/±250 °C). Para confirmar esto, las soluciones se enfriaron nuevamente hasta limpidez y se sometieron nuevamente a la temperatura de calentamiento [30].
Pruebas de disolución del SEDDS incorporado en capsula dura
Para estudiar y caracterizar las formulaciones seleccionadas se realizó un perfil comparativo tomando como referencia un producto existente en el mercado (sistema autoemulsificable) que, al igual que las formulaciones desarrolladas, también se encuentra en cápsulas duras, evaluando la velocidad de disolución del estradiol USP en la matriz desarrollada en esta investigación. En base a los resultados obtenidos en la caracterización de los sistemas autoemulsificables, se seleccionaron las formulaciones con mejor desempeño para introducirlos en una cápsula de gelatina dura. Para esto se añadieron 300 mg exactamente pesados de cada formulación a una cápsula de gelatina dura Coni-Snap® Empty gelatin capsules natural Size 2 que posteriormente fueron analizadas a través de un perfil de disolución [10].
Los perfiles de disolución se realizaron utilizando el aparato N°3 USP Modelo BIO DIS Agilent Technologies. Se empleó como medio de disolución lauril sulfato de sodio al 0,3% en agua similar a lo establecido en la USP 41-NF 36, se tomaron las alícuotas respectivas y se cuantificaron a los tiempos de muestreo que correspondían a 5, 10, 15, 20, 30, 45 y 60 min. Las muestras fueron cuantificadas a través del equipo UHPLC Agilent technologies 1290 con detección de fluorescencia (FLD). La separación se realizó en una columna de fase inversa Agilent Zorbax C18 (250 x 4 mm, 5 μm); la fase móvil estaba compuesta de Acetonitrilo: Agua en una proporción (55:45) a una velocidad de flujo de 1,0 mL/min. El volumen de inyección fue de 25 μL y las longitudes de onda de excitación y emisión del detector de fluorescencia fueron 280 y 312 nm, respectivamente (USP 41-NF 36, 2018) [16, 17]. Las comparaciones de los perfiles de disolución se realizaron utilizando el modelo independiente, en el cual se incluyeron los cálculos de tiempo medio de disolución (TMD), eficiencia de disolución (ED), factor de diferencia (F1) y factor de similitud (F2) [31].
RESULTADOS Y DISCUSIÓN
Estudio de solubilidad
La tabla 2 presenta los resultados hallados en el estudio de solubilidad de estradiol, donde se puede evidenciar que el aceite que exhibió el mayor potencial de solubilización fue el Capmul® MCM, este aceite es un monodiglicérido de ácidos grasos de cadena media que se recomienda particularmente para la disolución de compuestos complejos incluyendo los esteroides [32]. Este resultado de solubilidad obtenido estuvo influenciado por el contenido de ácido caprílico (C8) de este aceite que se encuentra 80-90%; la polaridad de este ácido graso hace más favorable la solubilización de fármacos poco solubles en agua, tal como lo reportaron Bandivadeka et al., en un estudio comparativo de aceites de bajo peso molecular que incluía el Capmul® MCM, en dicho estudio se demostró que el contenido de ácido caprílico (C8) en los aceites incidía positivamente en la solubilidad del fármaco evaluado [33]. Cabe resaltar que se necesitó más tiempo para conseguir el equilibrio termodinámico en este aceite, sin embargo, este resultado es similar con un estudio realizado por Bernick et al. en 2014, en los cuales la solubilidad de estradiol USP en Capmul MCM fue de 31,2 mg/g [34].
Tabla 2 Cantidad (mg) de estradiol USP disuelta en 1g de cada aceite empleado.
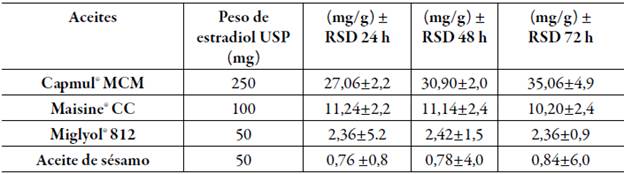
RSD= desviación relativa estándar; n=2.
Es importante destacar que el valor arrojado con Maisine® CC puede considerarse aceptable en comparación con aceite de sésamo y el Miglyol® 812; Maisine® CC es una mezcla de mono, di y triglicéridos de ácido oleico y linoleico (C18: 1/C18: 2) de origen vegetal y es ampliamente usado en formulaciones lipídicas para mejorar la solubilidad y biodisponibilidad de fármacos hidrófobos, además tiene la capacidad de mantener e incluso aumentar la solubilidad del fármaco en fases post-digestivas [35]. Por otra parte, es útil reconocer que, algunos fármacos, en especial aquellos con Log P >3, como es el caso del estradiol USP (Log P = 4.7) pueden solubilizarse tanto por triglicéridos de cadena larga (TCL) que tienden a ser más lipófilos como por triglicéridos de cadena media ( TCM), más hidrófilos [36]; en este sentido es razonable que el estradiol USP se solubilizara en Capmul® MCM y a su vez en Maisine® CC, a pesar de que ambos poseen distinta composición de triglicéridos, TCM y TCL, respectivamente. En cuanto al aceite de sésamo y el Miglyol® 812, ambos fueron descartados para las pruebas posteriores de caracterización debido a sus bajos valores de solubilidad.
Estudio de compatibilidad de excipientes
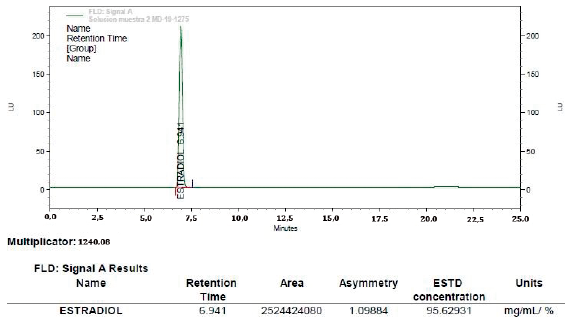
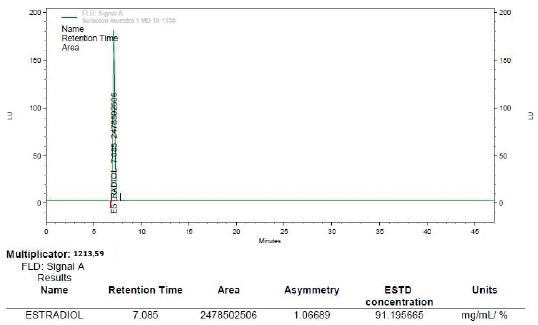
Concluido el tiempo del estudio de estabilidad en condiciones de estrés (30 dias a 40 °C y 60% HR) y condiciones de control (30 días a 25 °C y 60% HR) se pudo evidenciar que las mezclas binarias pueden considerarse compatibles y estables, dado que no presentaron cambios en su color o apariencia fisica. Se puede afirmar que el estradiol USP era estable en forma pura o en presencia de los excipientes analizados después que fueron almacenados bajo condiciones de estrés (40 °C y 25 °C/60% HR) y condición de control (25 °C/60% HR) arrojando un valor promedio de conecentración 97,1% para ambas condiciones teniendo que se obtuvó un valor de concentración inicial a tiempo cero de un 98,66% de estradiol USP. En los cromatogramas de todas las mezclas binarias analizadas se obtuvieron áreas del pico similares al estándar de estradiol USP. No se evidenció formación de picos adicionales importantes debido a productos de degradación (impurezas), lo que indica que las características del principio activo evaluado no fueron modificadas por la presencia de cada uno de los excipientes empleados, esto significa que no existe incompatibilidad química entre las sustancias estudiadas y se recomienda el uso de las mismas para el desarrollo de las formulaciones de esta investigación. A manera de ilustración las figuras 1 y 2 muestran los cromatogramas de las mezclas binarias Capmul® MCM + estradiol USP a 40 °C 60%HR y mezcla binaria (Kolliphor® RH40 + estradiol USP) a 40 °C 60%HR.
Construcción del diagrama de fases pseudoternario
Las cantidades experimentales de excipientes que se utilizaron para preparar las mezclas que se titularon se detallan en la tabla 3, en las cuales se reconocerán a los excipientes con la siguiente codificación: A1: Capmul® MCM, A2: Maisine® CC, T1: Gelucire® 44/14, T2: Kolliphor® RH 40 y Co: Transcutol® HP.
Tabla 3 Cantidades experimentales de excipientes que se utilizaron para preparar las mezclas que se titularon en la relación 9:1.
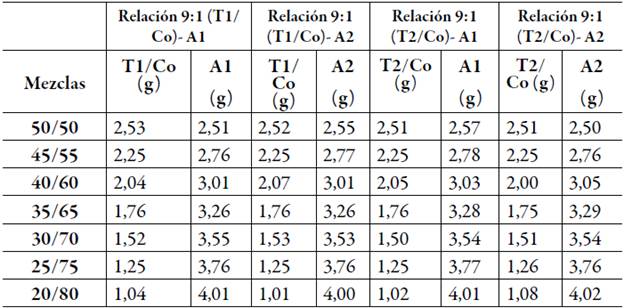
Tabla 4 Cantidades experimentales de excipientes que se utilizaron para preparar las mezclas que se titularon en la relación 2:1.
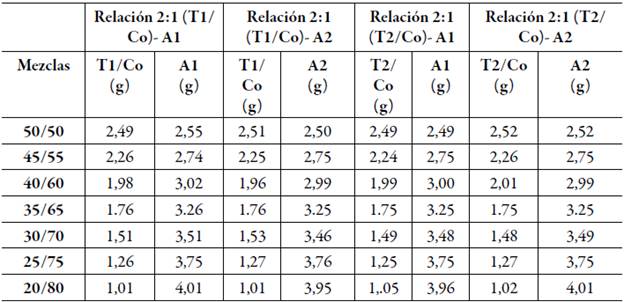
Los cambios físicos obtenidos en cada una de las formulaciones se presentan en la figura 3, donde se destaca que la mezcla 9:1(T2/Co)-A1 45/55 con un 75% de adición de agua (3A), presenta una apariencia trasnslucida-azulada característica de micro y nanoemulsiones [37].
En las muestras ensayadas para la relación 2:1 (T1/Co)- A1 se puede observar en la figura 4 que prevalecen las mezclas transparentes en los niveles 50/50 y 45/55 (hasta el 50% de adición de agua), este comportamiento disminuye en los niveles 40/60 y 35/65 hasta el 40% de agua y sigue disminuyendo a medida que disminuye la proporción de T-Co hasta llegar a un 15% de agua en los tres últimos niveles (30/70, 25/75, 20/80). En general, el comportamiento turbio prevalece a lo largo del diagrama, sin presencia de gel ni aumentos de viscosidad.
Para la relación relación 2:1 (T1/Co)-A2 prevalecen las mezclas turbias y se presenta una amplia zona de formación de gel y de aumento de viscosidad (comprendida entre el 45 y 65% de adición de agua), las mezclas transparentes se presentan en los niveles 50/50 y 45/55 hasta el 30% de adición de agua y disminuyen hasta el punto de solo presentar una en los dos últimos niveles (25/75 y 20/80), poca presencia de mezclas translúcidas. Este comportamiento podría atribuirse al aceite empleado (Maisine® CC), dado que el tensioactivo es el mismo en el diagrama anterior.
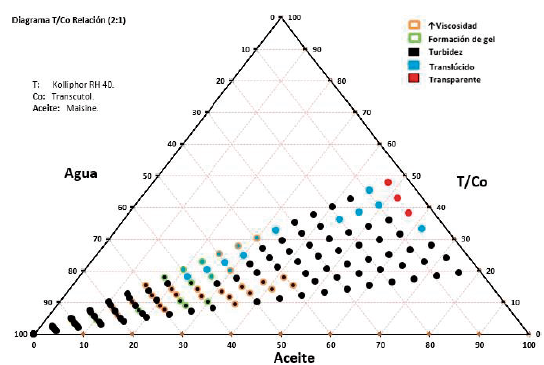
En el diagrama de fases pseudoternario relación 2:1 (T2/Co)-A1 se presentaron mezclas transparentes en todos los niveles hasta el nivel de 15% de adición de agua, luego se presentan unas pocas mezclas translúcidas, y, en el resto del diagrama predomina el comportamiento de turbidez. La viscosidad cambia en los niveles intermedios (40/60 y 35/75) a partir del 65% de adición de agua y se presenta poca formación de gel. La figura 5 corresponde al diagrama de fases pseudoternario relación 2:1 (T2/Co)-A2, donde solo hay tres mezclas transparentes (correspondientes a las tres primeras mezclas en el 5% de adición de agua), hay pocas mezclas translúcidas, predominan las mezclas turbias y, en general, hay una amplia zona de mezclas viscosas y formación de gel (comprendidas entre 40 y 75% de adición de agua).
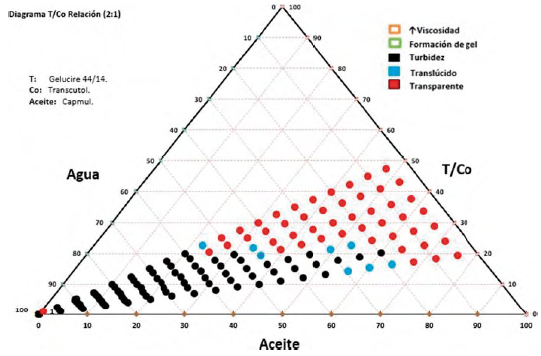
Para la relación 9:1(T1/Co)-A1 podemos observar en la figura 6 que en las primeras proporciones (50/50 a 30/70) se presenta más transparencia (hasta el 40% de agua) respecto a las dos últimas proporciones 25/75 y 20/80 (hasta el 10 y 15% de agua respectivamente), en los cuales predomina el comportamiento de turbidez y de alta viscosidad, hay poca formación de mezclas translúcidas. Se observa poca formación de gel (únicamente se presentó a partir del 55% hasta el 80% de adición de agua de la proporción 50/50), lo cual podría atribuirse a la proporción en que se encuentra la mezcla tensioactiva/ cotensioactivo.
Análisis del comportamiento de los aceites en los resultados obtenidos en los diagramas de fase
El comportamiento de las mezclas descritas en los diagramas varió en función al aceite empleado en cada uno, se pudo apreciar que con Capmul® MCM (A1), se obtuvieron mezclas más transparentes relacionadas con microemulsiones mientras que con Maisine® CC (A2) prevalecieron las mezclas turbias (emulsiones). Esta diferencia encontrada entre los aceites se debe a la longitud de la cadena lipidica presente en los mismos; Maisine® CC está compuesto de mono, di y triglicéridos de cadena larga (TCL), estos aceites son más hidrófobos que los de cadena media por lo tanto repelen más el agua y son más difíciles de emulsionar, dando como resultado la formación de emulsiones de aspecto turbio. Capmul® MCM, por su parte, es un mono-diglicérido de ácidos grasos de cadena media (TCM), los cuales se relacionan con una mayor hidrofilia y poseen mayor capacidad de autoemulsificación, por lo tanto, presentaran una mayor zona de microemulsión en comparación con Maisine® CC [38]. Estos resultados son consistentes con los obtenidos por Grove et al, en un estudio en el que se compararon directamente dos SMEDDS cargados con Seocalcitol II que contenían TCM y TCL, se encontró un área de microemulsión más grande en el diagrama de fase cuando se usó TCM en lugar de TCL y se hacía necesaria una mayor concentración de Kolliphor® RH 40 para formar microemulsiones cuando se usaba TCL en comparación con TCM [39].
Comparación de tensioactivos
Durante la elaboración de los diagramas de fases pseudoternarios el Gelucire® 44/14 tuvo la tendencia a formar más zonas de microemulsión y mezclas homogéneas mientras que el Kolliphor® RH40 se caracterizó por presentar menos zonas de microe-mulsión y mezclas con presencia de grumos y partículas. Esto nos hace suponer que el Gelucire® 44/14 tiene una mayor capacidad autoemulsionante que el Kolliphor® RH40, sin embargo, según la bibliografía, el Kolliphor® RH 40 (aceite de ricino hidrogenado PEG-40) puede reducir el tamaño de las micelas a microemulsión mejor que el Gelucire® 44/14 (lauroil polioxil PEG-32 glicéridos) [40], posiblemente debido a su estructura química, la cual cuenta con mayor grupo de polietilenglicol (PEG-40) que el Gelucire® 44/14 (PEG-32). La presencia de grupos PEG en estos sistemas implica una notable mejora en la eficiencia de la autoemulsificación, tal como lo reporta Bandiva-deka et al. [41]. Por otra parte, el Kolliphor® RH 40 presenta un mayor valor de equilibrio hidrofílico-lipofílico (HLB) (14-16) [40], que el Gelucire® 44/14 (HLB = 11-14) [21], y, a medida que este valor aumenta, la solubilidad en agua incrementa, por tanto, teóricamente, el Kolliphor® RH 40 será más hidrosoluble que el Gelucire® 44/14, lo cual le otorgaría mayor capacidad emulsionante y, en consecuencia, mayor formación de microemulsiones [40]. Ah bien, en estos ensayos, el Gelucire® 44/14 tuvo la tendencia a formar más microemulsioes que el Kolliphor® RH40 en combinación con el Capmul® MCM; este evento se debe a que en estos diagramas de fases no está presente aún el principio activo, pues, según la literatura, este tiene la capacidad de interactuar con el tensioactivo a través de la formación de enlaces de hidrógeno entre los grupos hidroxilo presentes en su estructura, por lo cual se esperaba una mayor capacidad autoemulsionante en las pruebas posteriores de caracterización en las que se incluiría el estradiol USP en las formulaciones [41].
Relación tensioactivo/cotensioactivo
Tal como se evidenció en los diagramas, la relación tensioactivo/cotensioactivo incide en la capacidad autoemulsionante del primero, en este sentido, comparando ambas relaciones, podemos notar que en la relación 2:1 se obtuvo un mayor número de mezclas transparentes (mayor formación de microemulsiones), mientras que en 9:1 se obtuvieron mezclas más turbias (mayor formación de emulsiones) [42]. Estos resultados se pueden explicar con base al mecanismo de autoemulsificación, el cual implica la formación de una interfaz entre las fases oleosa y acuosa que permite una rápida autoemulsificación, esta interfaz rara vez se consigue mediante el uso de un solo tensioactivo, sino que generalmente requiere la adición de un cotensioactivo para reducir aún más la tensión interfacial, facilitando así, la penetración de la fase acuosa en la oleosa y por tanto, favoreciendo la formación de microemulsiones [43], en este sentido, la mayor cantidad de Transcutol presente en la relación 2:1 consiguió que se obtuvieran mayor número de microemulsiones que en la relación 9:1, en la cual la proporción era menor.
Cambios de viscosidad de las mezclas
Durante el desarrollo de los diagramas se notó un comportamiento particular en la viscosidad de las mezclas trabajadas en función de la concentración de agua en las mezclas, estas se mostraban liquidas en las primeras adiciones de agua, luego se presentaba un incremento en su viscosidad alrededor de 40-50% de agua, presencia de gel entre 55-65% y, finalmente, por encima de 70% volvía a su estado inicial. Esta transición estructural continua (solución-solución viscosa-gel-solución), se debe a la inversión estructural de la microemulsión de agua en aceite (w/o) al tipo de aceite en agua(o/w) como consecuencia de la adición gradual de agua [44].
En base a los resultados obtenidos en los diagramas de fases pseudoternarios realizados las mezclas que tuvieron una mayor zona de automicroemulsificación (SMEDDS) fueron (Gelucire® 44-14/Transcutol® HP)- Capmul® MCM y (Kolliphor® RH40/Transcutol® HP)- Capmul® MCM en la relación 2:1.
Formulación y caracterización del SEDDS con estradiol USP
Las formulaciones resultantes tanto para la mezcla de (Gelucire® 44-14/Transcutol® HP)- Capmul® MCM como para (Kolliphor® RH40/Transcutol® HP)- Capmul® MCM, de acuerdo con lo señalado se muestran en las tablas 5 y 6.
Tiempo de autoemulsificación
Los parámetros observados para cada formulación fueron la capacidad de mantenerse estable, completamente homogeneizado, sin separación y sedimentación de aceite, y de acuerdo con el tiempo en que tardó en autoemulsificarse se estableció un grado para cada formulación tal como se clasifica en la tabla 1 de "grados de autoemulsificación". Los resultados de las formulaciones que contienen (Gelucire® 44-14/Transcutol® HP)- Capmul® MCM (F1-F3) que se detallan en la tabla 7 corresponden al grado de autoemulsificación 2 según los de "grados de autoemulsificación" [27] , pues el tiempo que tardaron en emulsionar fue menor a 2 min y la apariencia final de estas formulaciones fueron mezclas translúcidas con pequeñas partículas lipidicas dispersas, este comportamiento se debe a que esta prueba se realizó a una temperatura de 37 °C, bajo esta condición el Gelucire® 44/14 presentó una inestabilidad en sus componentes los cuales pueden precipitar por separado afectando negativamente los resultados [21, 35]. Según un estudio realizado por Janin, el Gelucire® 44/14 presenta un amplio rango endotérmico que varía de 10 a 45 °C, con una temperatura de fusión inicial de aproximadamente 38 °C y una temperatura de fusión máxima de aproximadamente 43 °C, este comportamiento térmico está relacionado con la composición: la fracción de mono-, diy triglicéridos se funde primero seguida de la fracción de PEG-éster [45].
Tabla 7 Tiempos de autoemulsificación de formulaciones que contienen Gelucire® 44-14/Transcutol® HP- Capmul® MCM.
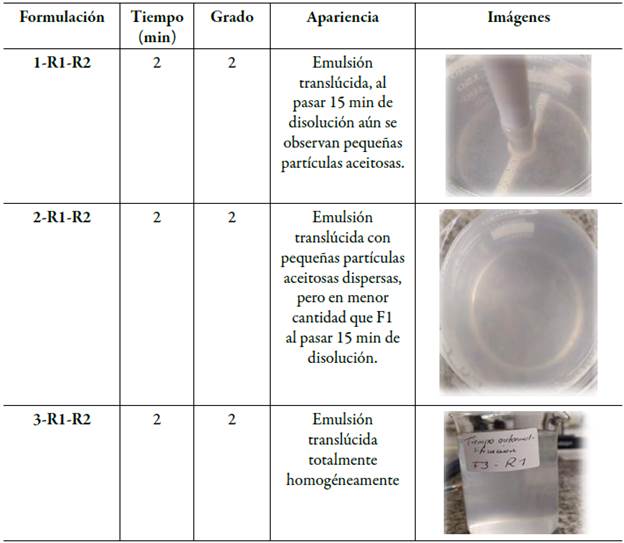
En la tabla 8 se describen las formulaciones 4, 5 y 6 que corresponden a Kolliphor® RH40/Transcutol® HP)- Capmul® MCM (F4-F6) , que según los grados de autoemulsificación corresponden al grado 1, ya que su formación fue rápida en un tiempo de aproximadamente 1 min, y su apariencia fue transparente ligeramente azulada sin presencia de partículas y totalmente homogénea [27], de acuerdo con estos resultados, las pruebas visuales confirman lo mencionado previamente en la bibliografía de formación de microemulsiones en formulaciones de tipo III [46]. Estas formulaciones fueron clasificadas como las mejores entre las formulaciones probadas ya que todas son grado 1, demostraron buenas características de microemulsión, ya que se forman rápidamente como una solución clara y transparente con solo una ligera opalescencia (apariencia azulada), sin espuma, sin separación de aceite y sedimentación de partículas.
Robustez a la dilución
La formulación 1 fue inestable en los tres pH, presentando en los tres casos una ligera capa opaca en la superficie de la solución. Las formulaciones 2 y 3, por su parte, fueron estables en pH ácido, sin embargo, presentaban partículas oleosas blanquecinas en el medio acetato y fosfato. Se puede decir que estas partículas corresponden a compuestos del tensioactivo, pues el Gelucire® 44/14 es una mezcla de 72% de ésteres de PEG, 20% de glicéridos, 8% de PEG puro y 2% de glicerol, debido a su composición este tensioactivo debe fundirse y homogenizarse antes de su uso, por lo tanto, es posible que esas partículas observadas correspondan a alguno de sus componentes. Este comportamiento podría reducir la solubilidad total de la formulación para el fármaco [28]. Las formulaciones que contenían Kolliphor® RH 40 se mantuvieron estables en los 3 medios, en todos los volúmenes de dilución, exhibiendo una apariencia transparente y ligeramente azulada en el caso de las formulaciones 4 y 5, lo cual indica una alta solubilidad del activo en los tres medios trabajados y nos permite asumir que no se presentaría precipitación del fármaco en el intestino antes de la respectiva absorción [28]. La importancia de evaluar la estabilidad en estos medios es imitar a las condiciones que se pueden dar en el estómago posteriormente de la administración oral de SMEDDS. Ante estas condiciones, las formulaciones con Kolliphor® RH 40 no presentaron separación de fases, por tanto, podemos concluir que las formulaciones con Kolliphor® RH 40 (F4, F5, F6) son de mayor utilidad y rendimiento en el desarrollo de esta investigación.
Determinación del punto de nube
En todos los casos se observó que la solución se volvía ligeramente azul y translúcida y luego la aparición de una capa de gotas oleosas en la superficie de la solución acompañada de una ligera turbidez en la matriz. Para efectos de confirmación, las soluciones se enfriaron nuevamente hasta limpidez y se sometieron nuevamente a la temperatura de calentamiento [47]. Estos resultados se pueden detallar en la tabla 9.
Los resultados obtenidos en esta prueba muestran puntos de nube bajos para las formulaciones que contenían Gelucire® 44/14 y altos para aquellas con Kolliphor® RH40. Esto se podría explicar en primer lugar por los valores de HLB, de 11 a 14 para Gelucire® 44/14 y de 14 a 16 para Kolliphor® RH40. El valor de HLB y el punto de nube se encuentran directamente relacionados, pues el punto de nube es causado por la deshidratación de las cadenas de polioxietileno en los tensioactivos no iónicos [48], la cual produce una disminución en el HLB del tensioactivo lo que se relaciona con una menor capacidad emulsionante y la consecuente separación de fases, en este sentido, valores de HLB más altos proporcionaran mayores puntos de nube. Asimismo, se ha demostrado que al aumentar el número de unidades de óxido de etileno se obtiene un incremento en el punto de nube de tensioactivos no iónicos de acuerdo con lo reportado por Barrios et al., en este caso, el 18% de la composición del Kolliphor® RH 40 es de óxido de etileno mientras que el Gelucire® 44/14 solo contiene un 8%, por lo cual el punto de nube de Kolliphor® RH40 fue mayor.
En ese mismo estudio se demostró que a concentraciones de tensioactivo más altas se aumenta el punto de nube [49] lo cual se evidencia en la formulación 3, la cual contiene 33% de tensioactivo y presenta un punto de nube ligeramente mayor que las formulaciones 1 y 2 las cuales contienen 13 y 23 % respectivamente, así mismo en la formulación 4 que contiene un 13% y presenta un valor menor que el de las formulaciones 5 y 6 cuya concentración es mayor. Por otra parte, si bien las temperaturas obtenidas con el Kolliphor® RH40 superan la temperatura corporal, en general todos los valores obtenidos, tanto para Gelucire® 44/14 como para Kolliphor® RH40 fueron significativamente bajas en comparación con otros tensioactivos, esto se debe a la presencia de grupos (-OH) provenientes de los grupos glicerol presentes en ambos tensioactivos, ya que los aniones que promueven la estructura del agua o se unen ampliamente a las moléculas de agua como (OH-) suprimen el punto de nube [50].
Perfil de disolución del SEDDS en la capsula dura
De acuerdo con los resultados obtenidos en la caracterización de los sistemas autoemulsificables, se seleccionaron las formulaciones 3, 4, 5 y 6 para introducirlos en una cápsula de gelatina dura y evaluar su desempeño de disolución desde una forma farmacéutica. Se puede afirmar que todas las formulaciones fueron compatibles con la cápsula dura puesto que no se presentaron cambios notables en su apariencia, tales como colapsamiento o perdida de dureza que indique incompatibilidad con el material polimérico de la gelatina principal constituyente de la capsula. Para evaluar en detalle el comportamiento de los perfiles de disolución reportados, en la tabla 10 se pueden observar los promedios obtenidos de los porcentajes de estradiol USP disuelto de cada uno de los vasos en los diferentes tiempos de muestreo para cada formulación y el producto de referencia.
Tabla 10 Promedios obtenidos de los porcentajes de estradiol USP disuelto de cada uno de los vasos en los diferentes tiempos de muestreo.
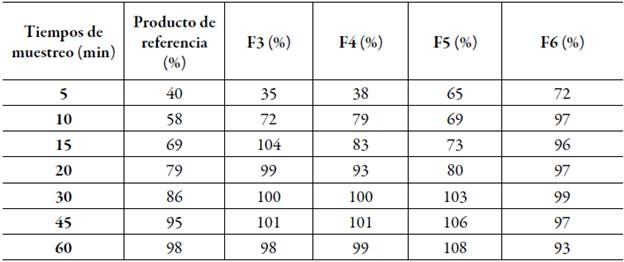
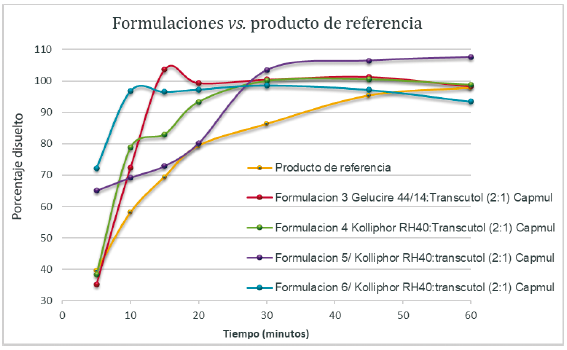
Teniendo en cuenta los resultados reportados en la tabla 10 se puede observar que al transcurrir 10 min de disolución la formulación 6 ya estaba disuelta en un 97%, y a los 15 min la formulación 3 tenía un porcentaje de disolución de un 104%, lo cual quiere decir que las formulaciones 3 y 6 disolvieron más del 95% de estradiol USP en menos de 15 min, a diferencia de la formulación 4 y 5 donde solamente el 83% y 73% de estradiol USP se encuentra disuelto en dicho tiempo. Según estos resultados se puede afirmar que todas formulaciones evaluadas alcanzaron una concentración en solución de más del 95% a los 30 min, a excepción del producto de referencia el cual se disolvió por completo a los 60 min de disolución.
Aplicación del modelo independiente para evaluar los perfiles de disolución
Las comparaciones de los perfiles de disolución se realizaron utilizando el modelo independiente, en el cual se incluyeron los cálculos de tiempo medio de disolución (TMD), eficiencia de disolución (ED) (tabla 11) y factor de diferencia (F1) y factor de similitud (F2) (tabla 12).
Tabla 11 Resultados de % de eficiencia (ED) y tiempo medio de disolución (TMD).
| Formulaciones | % de eficiencia (ED) | Tiempo medio (TMD) |
|---|---|---|
| F3 | 90,09 | 8,37 |
| F4 | 87,63 | 10,05 |
| F5 | 82,14 | 13,98 |
| F6 | 97,54 | 3,71 |
| RLD | 79,29 | 15,71 |
Valores bajos de TMD indican que, en los primeros tiempos del proceso de disolución, se produce una liberación y disolución rápida del principio activo [51]. En este sentido, la formulación que tuvo mayor velocidad de disolución fue la 6, con un valor de TMD de 3,71, a su vez, la formulación 5 y el RLD presentaron una velocidad de disolución más lenta con valores de TMD de 13,98 y 15,71.
En lo referente a la ED las formulaciones que presentaron una mayor eficiencia fueron la 3 y 6 con un porcentaje de 90,09% y 97,54% respectivamente, en comparación a las formulaciones 4 y 5 donde se obtuvieron porcentajes de 87,63% y 82,14% respectivamente, lo que indica que, en las formulaciones 3 y 6 en los primeros tiempos (15 min) del proceso de disolución, se produjo una liberación y disolución rápida del principio activo. En cuanto al RLD, presentó un porcentaje de eficiencia menor de 79,29% en comparación de todas las formulaciones. En general, las formulaciones 3 y 6 fueron las que mostraron una mayor velocidad de disolución, presentando valores bajos de TMD y altos para ED, este comportamiento se debe a las altas concentraciones de tensioactivos empleados en estas formulaciones, las cuales corresponden al nivel superior (50% de T/Co), en comparación con las formulaciones 4 y 5 las cuales contienen menor cantidad de T/Co (20% y 35% respectivamente). Como lo señala Fernandez et al. [52], una alta concentración de tensioactivo favorece la disminución del tamaño de las micelas, cuanto menor sea el tamaño de la micela, mayor será el área superficial para la disolución del fármaco, por tanto, su velocidad de disolución será mayor; es decir, que la concentración de tensioactivo utilizado es directamente proporcional a la velocidad de disolución del SEDDS [52]. La formulación 6 que contenía Kolliphor® RH40 presentó una velocidad de disolución mayor, lo cual puede explicarse por el hecho de que el aceite empleado (Capmul® MCM) y el Kolliphor® RH 40 tienden a formar rápidamente una microemulsión, por su fácil dispersabilidad y su alta hidrofilicidad, en comparación con la formulación 3, la cual contiene Gelucire® 44/14 (lauroil polioxil PEG-32 glicéridos).
En general, los resultados mostrados en la tabla 11 el producto de referencia utilizado presenta una menor velocidad de disolución en comparación a todas las formulaciones preparadas en esta investigación. Cabe resaltar que este producto esta formulado como un sistema autoemulsificable por lo cual se utilizó para comparar y caracterizar las formulaciones propuestas en esta investigación, a través de la evaluación de la velocidad de disolución del estradiol USP. Consideramos que el tipo de liberación para RLD es de tipo inmediata (t90% en 60 min), ya que no tiene componentes o auxiliares declarados en las bases de datos consultadas que permitan una liberación modificada: retardada o prolongada. Su aparente baja velocidad de disolución (comparada con las formulaciones evaluadas) se puede atribuir a que contiene un tensioactivo (estearato de PEG-6 y palmitostearato de etilenglicol y estearato de PEG-32) el cual tiene un comportamiento muy parecido al Gelucire® 44/14, ya que su punto de fusión esta entre 46-53 °C y a bajas temperaturas empieza a solidificar, por lo tanto, se comporta de forma similar a la formulación 3 en los primeros 10 min como se puede evidenciar en la figura 7 [35]. Como resultado de esta prueba, se puede decir que los sistemas autoemulsificables lograron mejorar la velocidad de disolución del estradiol USP, principalmente la formulación que contenía niveles superiores de Kolliphor® RH40.
Comparación de los factores de diferencia (F1) y factor de similitud (F2)
A partir de los resultados obtenidos de los perfiles de disolución y dada la variabilidad de los resultados se dividieron los tiempos de muestreo en 3 rangos específicos como se muestra en la tabla 12, de 5 a 20 min, de 30 a 60 min y el tiempo completo de la disolución, para comparar los factores de diferencia F1 y similitud F2.
Tabla 12 Resultados obtenidos del factor de diferencia (F1) y factor de similitud (F2).
| Formulación | Rango(min) | F1 | F2 |
|---|---|---|---|
| 5 a 20 | 30 | 34 | |
| F3 | 30 a 60 | 7 | 52 |
| 5 a 60 | 18 | 38 | |
| 5 a 20 | 20 | 42 | |
| F4 | 30 a 60 | 7 | 53 |
| 5 a 60 | 13 | 46 | |
| 5 a 20 | 17 | 43 | |
| F5 | 30 a 60 | 14 | 44 |
| 5 a 60 | 15 | 43 | |
| 5 a 20 | 47 | 26 | |
| F6 | 30 a 60 | 7 | 56 |
| 5 a 60 | 26 | 32 | |
| Criterio de aceptación | 0-15 | 50-100 | |
Se puede observar que en los primeros tiempos de disolución de 5 a 20 min se presentan grandes diferencias en los criterios de los factores F1 y F2; sin embargo, en el rango de 30 a 60 min de disolución se encuentran similitudes entre el producto de referencia y las formulaciones 3,4 y 6, por tanto, se podría decir que estas serían las formulaciones con mayor potencial para ser comparadas con un producto de referencia. Sin embargo, como es de notar, estos resultados no son homogéneos en todos los tiempos, esto puede atribuirse al hecho de que son formulaciones trabajadas a escala de laboratorio comparadas con un producto fabricado a nivel industrial, aun así, esta prueba es de gran valor para generar datos que nos indiquen como mejorar el proceso.
Ah bien, el objetivo de este desarrollo no fue encontrar un producto equivalente al producto de referencia, sin embargo, los resultados obtenidos durante toda la caracterización de las formulaciones nos muestran que estas se ajustan a una forma de liberación inmediata, la cual puede llegar a ser considerada viable para un posterior proceso de manufactura como objetivo de un desarrollo comercial. Las posibles mejoras a estas formulaciones consistirían principalmente en el desarrollo de matrices que le otorguen diferentes formas de liberación a la matriz propuesta en este desarrollo.
CONCLUSIONES
Un adecuado diseño y caracterización de formulaciones de sistemas SEDDS para estradiol fue logrado, siendo la de mejor desempeño la constituida por Capmul® MCM (50%), Kolliphor® RH40 (33%) y Transcutol® HP (16%) , con la cual se consiguió mejores tiempos de autoemulsificación con emulsiones transparente azulada; estable en tres diferentes pH, mayor valor de punto de nube y mayor velocidad de disolución, presentando valores bajos de TMD y altos para ED. Nuestra investigación demostró que una caracterización detallada de estos sistemas permiten lograr mejorar la velocidad de disolución de fármacos de baja solubilidad como el estradiol en formulaciones estables y robustas.