Introducción
El zoledronato, un aminobisfosfonato, es un potente inhibidor de la resorción ósea [1-5]. Se utiliza para el tratamiento de la enfermedad ósea de Paget, prevención de la osteoporosis inducida por glucocorticoides y para tratar la osteoporosis en mujeres posmenopáusicas y en hombres [2, 6]. El ácido zoledrónico se administra en forma de infusión intravenosa única de 5 mg para tratar la enfermedad ósea de Paget [2, 7]. Para la osteoporosis posmenopáusica, la osteoporosis masculina y la osteoporosis inducida por glucocorticoides [8], la dosis recomendada es una infusión intravenosa única de 5 mg de ácido zoledrónico administrada una vez al año [2, 9, 10].
Las preparaciones de ácido zoledrónico se han estudiado por cromatografía líquida de alta resolución (CLAR) con detección ultravioleta (215-220 nm), usando tampón fosfato y pareamiento iónico con sales de tetrabutilamonio [1, 6, 11-13], ambos en mezclas con metanol en columnas de fase reversa (C8 y C18) y temperaturas que rondan los 50 °C. Estas metodologías se resumen en la tabla 1.
Tabla 1 Metodologías descritas para la cuantificación del ácido zoledrónico.
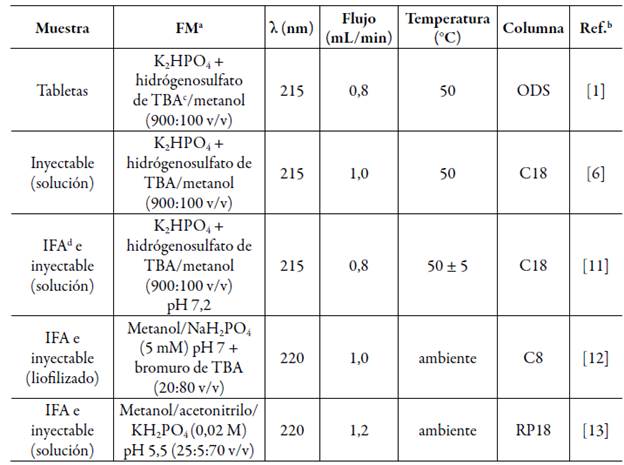
aFM: fase móvil, bRef.: referencia, cTBA: tetrabutilamonio, dIFA: ingrediente farmacéutico activo (ácido zoledrónico).
Los métodos de análisis se deben validar previos a su uso [14, 15]. Uno de los parámetros, la especificidad, asegura la no interferencia del analito con impurezas, productos de degradación y excipientes, entre otros [14]. Con respecto al ácido zoledrónico se refieren como sustancias relacionadas probables en el producto terminado, compuesto relacionado A de ácido zoledrónico [ácido (imidazol-1-YL) acético] e imidazol [11, 12].
El presente estudio tiene como objetivo evaluar la estabilidad acelerada y de vida de estante de una nueva formulación inyectable y liofilizada de ácido zoledrónico 5 mg.
METODOLOGÍA
Reactivos y materias primas
Fueron utilizados el hidrógenosulfato de tetrabutilamonio (C16H37NO4S, IPC), dihidrógenofosfato de potasio (KH2PO4), hidróxido de sodio (lentejas), ácido clorhídrico (HCl) y peróxido de hidrógeno (H2O2, 30%); de calidad PA y procedentes de Alemania. El estándar de referencia secundario de ácido zoledrónico fue suministrado por el Centro de Investigación y Desarrollo de Medicamentos (CIDEM, Cuba). El ácido zoledrónico monohidratado como ingrediente farmacéutico activo (IFA) fue suministrado por Shan Dong Boyuan Chemical Co. LTD, mientras el manitol se obtuvo de Qingdao Bright Moon, ambos de China. El trisodio citrato dihidratado se adquirió de Panreac (España) y las sustancias relacionadas: imidazol y compuesto relacionado A de ácido zoledrónico fueron estándares de referencia USP (EE.UU.).
Elaboración del inyectable liofilizado
El inyectable de ácido zoledrónico (5 mg) estaba compuesto por manitol (sustancia de soporte), trisodio citrato (regulador de pH) y agua para inyección (vehículo). Como material de envase fueron empleados viales transparentes 6 R, calidad hidrolítica I, de 10 mL de capacidad con tapón de bromobutilo de 20 mm de diámetro y sello de aluminio anodizado.
La liofilizadora industrial utilizada fue LYOMEGA 80ST TELSTAR (España), con capacidad de evacuación de 75 kg de hielo. Los lotes pilotos fueron identificados como ZO13001, ZO13002 y ZO13003 para un total de 7484 viales.
Durante los procesos de liofilización se midió y registró de forma continua la temperatura del producto, las platinas, el condensador y la presión de la cámara. Los ciclos se consideraron concluidos cuando las temperaturas del producto y las platinas se mantuvieron igualadas al menos 4 h. Se realizó también la prueba de presión de la cámara aislada considerándose satisfactoria una variación menor de 0,05 mbar [16].
Evaluación de la formulación Características organolépticas
Se comprobó a través de la inspección visual que 10 viales/lote de inyectable, se correspondieran a un bulbo transparente con un polvo liofilizado de color blanco, libre de cuerpos extraños.
pH
Para la medición se utilizó un pH-metro Orion 420 Aplus (EE.UU.). Se tomaron 10 viales liofilizados y se les inyectaron 5,0 mL de agua destilada a cada uno, agitando hasta disolver todo el contenido. La solución se vertió en un vaso de precipitado de 100 mL. La determinación se realizó por triplicado aceptando valores entre 5,9 y 7,0 [3,10].
Determinación de agua
Se realizó con el empleo del equipo Karl Fischer (Mettler Toledo V20, Suiza), según el procedimiento descrito en la USP 40 [15]. Los viales con las muestras se pesaron de forma individual. En la determinación se adicionaron 3,0 mL de metanol (Merck, Alemania) en cada bulbo independiente para dispersar la muestra y fue empleado como blanco la misma cantidad de metanol (n=3). Por otra parte, los bulbos se lavaron con agua destilada, hasta quedar limpios y fueron secados a 120 °C por 2 h en estufa lo cual permitió establecer la masa de producto extraída en cada análisis. Estos últimos se colocaron en desecadora hasta que alcanzaron la temperatura ambiente. Valores de humedad residual inferiores a 5% [16] fueron considerados adecuados.
Ensayos de esterilidad y endotoxinas bacterianas
Los procedimientos se realizaron según la USP 40 [15]. Para la determinación de endotoxinas bacterianas se aplicó el ensayo del lisado de amebocitos del Limulus (LAL), con el empleo de la técnica cromogénicocinética. Al no estar reportada la monografía para este producto en la USP 40, el valor límite fue calculado a partir del cociente K/M, K fue la dosis pirogénica umbral por kg de peso corporal y M, la dosis máxima recomendada del producto (en bolo, 5 mg) por kg de peso corporal (adulto promedio, 70 kg). El valor obtenido del límite máximo, para este caso fue de 70,4 UE/mL.
Totalidad y transparencia de soluciones [15]
A cinco viales de producto liofilizado de cada lote (n=3) se les inyectaron 5 mL de agua destilada y fueron agitados hasta disolución total. Se verificó que la solución reconstituida no fuera significativamente menos transparente que un volumen igual de agua purificada exenta de partículas en un recipiente similar y que se pudieran observar durante la inspección visual.
Partículas en inyectables [15]
Se empleó el método de obstrucción de luz, en el que se utilizaron 10 bulbos/lote, reconstituidos con agua exenta de partículas, para obtener una solución con un volumen mayor de 25 mL. Las muestras se colocaron en el contador de partículas subvisibles (Ryon, EE.UU.) y se comprobó que el número de partículas ≥ 10 μm fuera ≤ 6000; y para partículas ≥ 25 μm ≤ 600.
Productos de degradación
El desarrollo del estudio correspondiente se llevó a cabo por CLAR (Shimadzu Prominence, Japón) con una bomba (LC-20AT), detector UV de arreglo de diodos (SPD-M20A), un inyector automático (SIL-20A), además de desgasificador y horno. El software LCSolution 1.24 (Shimadzu, Japón) permitió analizar los resultados cromatográficos. También fueron utilizados una estufa (Boxum BGZ series III, China) y un baño termostatado (Ultrasoniccleaner SB-3200DT, China). Como fase móvil fue empleada una mezcla de 5 mM de dihidrógenofosfato de potasio y 10 mM de hidrógenosulfato de tetrabutilamonio disueltos en agua destilada. El volumen de inyección fue de 20 μL, con 1,0 mL/min de flujo, midiendo a 215 nm en una columna C8 (Grace, Apollo, 250 L x 4,6 mm DI, 5 μm, EE.UU.) [17].
Valoración de IFA e impurezas en producto terminado
Se empleó un cromatógrafo (Knauer, Alemania), con bomba de gradiente de baja presión 1000, inyector manual Rheodyne 7725i, detector UV-visible S2600, controlado mediante el software ClarityChrom versión 6.1.0.130, con las condiciones y columna establecidas en el estudio de productos de degradación. Durante la estabilidad se consideraron los límites especificados a continuación para el IFA y sus sustancias relacionadas. Tomando en consideración que el rango de uso de ácido zoledrónico es de 2 a 10 mg/dosis y que las más empleadas son las de 4 y 5 mg [18], se estableció un intervalo de ± 10% de la dosis para la valoración. Los criterios seleccionados en cada caso fueron:
Validación del método cromatográfico para cuantificar el IFA en el producto terminado
Para validar este método se tuvo en cuenta que el contenido de un bulbo de ácido zoledrónico debe estar entre 4,5-5,5 mg, equivalente a 90,0-110,0% de la dosis establecida (5 mg). Los parámetros evaluados fueron: especificidad, linealidad, exactitud y precisión, según la categoría de análisis [14,15]. Los datos se analizaron con el programa Statgraphics Plus 5.0 (EE.UU.). En los ensayos descritos se empleó un volumen de inyección de 20 μL.
Especificidad
Se analizó el producto terminado, la mezcla de patrón de analito con imidazol, compuesto relacionado A de ácido zoledrónico y citrato trisódico; y el producto terminado degradado bajo diferentes condiciones de estrés [14, 15]. La degradación artificial de las muestras (un bulbo equivalente a 5 mg de IFA) se efectuó durante 4 h (80 °C) con adición de 2 mL/bulbo de agua, NaOH 1 N, HCl 1 N y 10 gotas de H2O2 (30%) por separado. La fotodegradación se realizó por exposición a la luz solar directa durante siete días, mientras la termólisis se llevó acabo a 80 °C durante 4 h en estufa, ambos ensayos realizados con bulbos de producto terminado liofilizado. Antes de analizar las soluciones resultantes de las hidrólisis básica y ácida, estas fueron neutralizadas. Todas las soluciones fueron llevadas a un volumen final de 50 mL completando con fase móvil y luego inyectadas en el equipo (20 μL). Todos los ensayos, con excepción de la fotodegradación, fueron realizados en la oscuridad para evitar combinación de efectos.
Linealidad
La linealidad del método se analizó entre 50 y 150% a 5 niveles de concentración por triplicado. Las soluciones de cada nivel de concentración fueron preparadas disolviendo la cantidad adecuada del patrón ácido zoledrónico en 4 mL de NaOH 0,1 N y enrasando a 50 mL con la fase móvil para obtener concentraciones entre 0,20 mg/ mL (50%)-0,60 mg/mL (150%). En la evaluación de la linealidad fueron estimados el factor de correlación (r), el intercepto y su significación, la pendiente de la recta y el coeficiente de variación de los factores respuesta.
Exactitud
Al placebo se le adicionaron cantidades conocidas de ácido zoledrónico monohidratado, por triplicado, equivalentes a las concentraciones de 0,3; 0,4 y 0,5 mg/mL (equivalentes a 75-125%). Se determinó el porcentaje de recuperación, el coeficiente de variación total (CV), realizándose la comparación con los valores añadidos (t-Student) y de dispersión entre los respectivos niveles de recobrados (C-Cochran).
Repetibilidad
Las determinaciones fueron hechas por el mismo analista en las mismas condiciones de trabajo. Se estudió la concentración del 100% en 10 determinaciones de una muestra homogénea y se calcularon los valores de la media y CV.
Precisión intermedia
El estudio se realizó en dos días, por dos analistas diferentes, en el mismo laboratorio. Se prepararon por triplicado las muestras de producto terminado liofilizado correspondientes a las concentraciones 75% (3 bulbos), 100% (4 bulbos) y 125% (5 bulbos) de la concentración teórica (5 mg) disolviendo con 2 mL de NaOH 0,1 N y diluyendo en 50 mL de fase móvil. Se determinaron la media y CVtotal, comparando además los resultados entre analistas y entre días, para un nivel de confianza del 95% para las medias (t-Student) y para las varianzas entre ellos (F-Fisher).
Estudios de estabilidad del producto terminado
Para el estudio de estabilidad en vida estante durante 24 meses se almacenaron las muestras de 3 lotes a una temperatura de 30 ± 2 °C y 70 ± 5% de humedad relativa, mientras que para la estabilidad acelerada se colocaron en la cámara Lunaire Enviro-mental (CEO910-4, EE.UU.) durante 6 meses a una temperatura de 40 ± 2 °C y 75 ± 5% de humedad relativa [19].
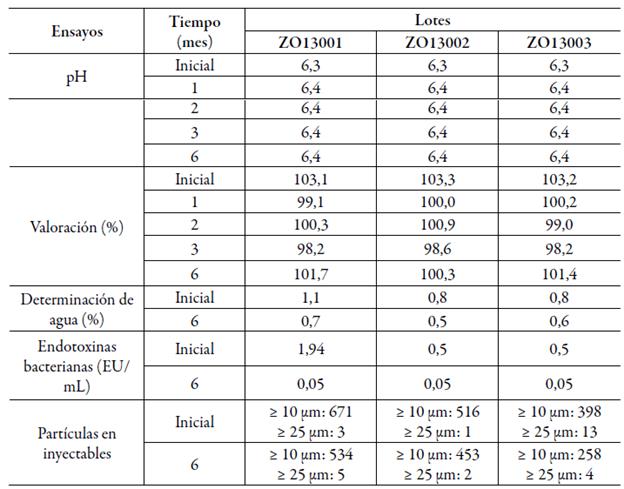
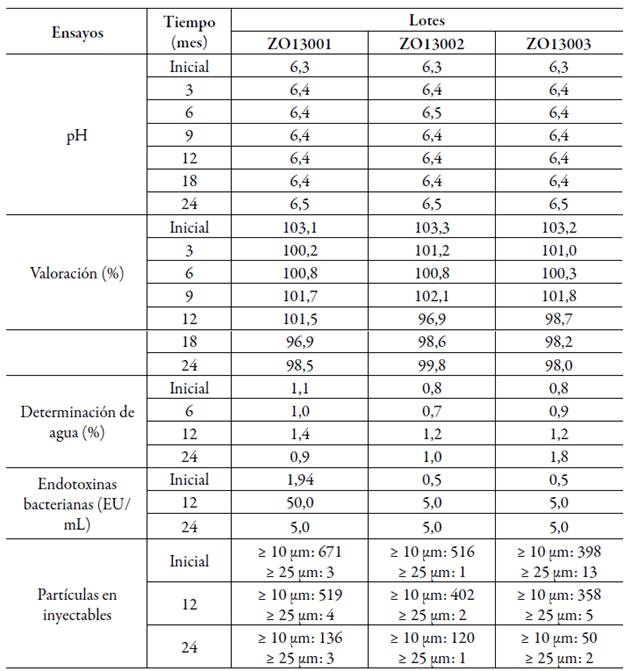
La frecuencia de análisis (estudio acelerado: 0, 1, 2, 3 y 6 meses; vida de estante: 0, 3, 6, 9, 12, 18 y 24 meses) y los parámetros a evaluar correspondieron a lo descrito en la regulación de estabilidad del Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos de Cuba [19], a saber, las características organolépticas, valoración, pH, totalidad y transparencia de soluciones para todos los tiempos de ensayo. La determinación de agua se realizó al inicio, a los 6 meses (acelerado y vida estante), 12 y 24 meses. La esterilidad, las endotoxinas bacterianas y las partículas en inyectables fueron evaluadas al inicio, 6 meses (estudio acelerado), además de 12 y 24 meses en vida estante.
Con el método CLAR se cuantificaron los productos de degradación, en los intervalos de tiempos correspondientes para los estudios de estabilidad acelerada y de vida de estante. En el ensayo se empleó una mezcla de imidazol y del compuesto relacionado A de ácido zoledrónico (mezcla 1), ambos a una concentración de 0,6 ¿g/mL (0,15% de la concentración de ácido zoledrónico de 0,4 mg/mL).
RESULTADOS Y DISCUSIÓN
La figura 1 muestra los cromatogramas característicos del producto terminado y de la separación del ácido zoledrónico con respecto a sus productos de degradación: imidazol, compuesto relacionado A y de la señal del excipiente ácido cítrico.
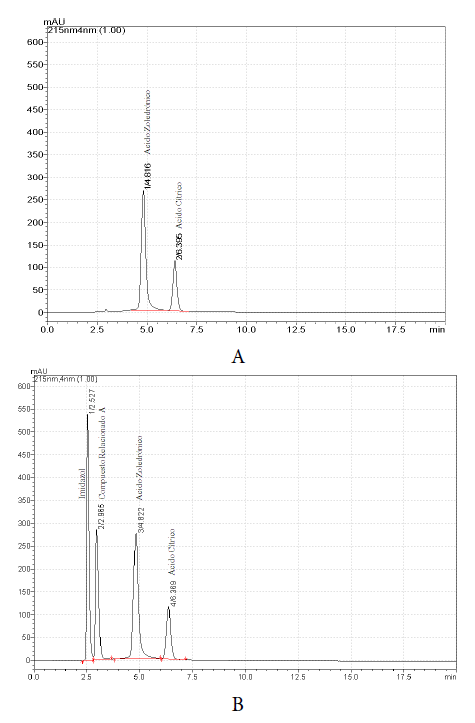
Figura 1 A: cromatograma correspondiente a producto terminado. B: mezcla de producto terminado con los productos de degradación del IFA. Las concentraciones empleadas en la obtención del cromatograma fueron: imidazol (0,08 mg/mL), compuesto relacionado A (0,08 mg/mL) ácido zoledrónico (0,4 mg/mL) y citrato de sodio (1,68 mg/mL). El volumen de inyección utilizado en la obtención de ambos cromatogramas fue 20 μL.
La figura 2 muestra los cromatogramas de los diferentes tratamientos de degradación forzada sobre el producto terminado en el estudio de especificidad.
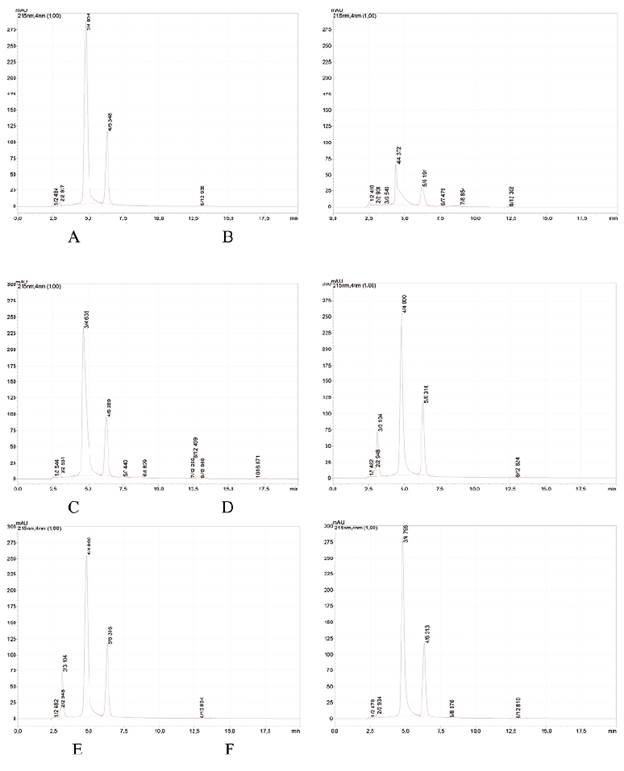
Figura 2 Cromatogramas correspondientes a los tratamientos. A: hidrólisis acuosa, B: hidrólisis básica, C: hidrólisis ácida, D: termodegradación, E: oxidación, y F: fotodegradación.
En la tabla 2 se resumen los resultados de la exactitud y precisión intermedia.
Tabla 2 Resultados de los ensayos de exactitud y precisión intermedia.
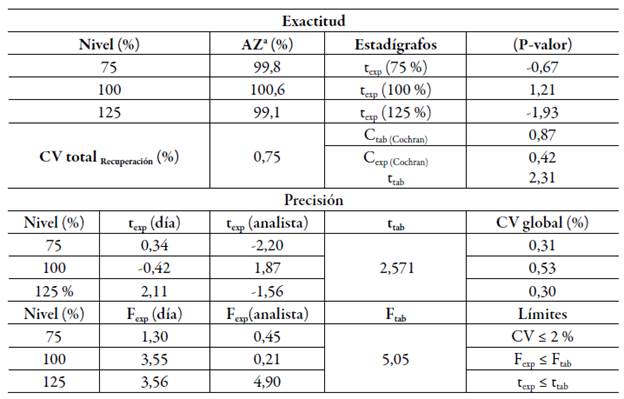
aAZ: concentración de ácido zoledrónico
Los resultados satisfactorios en los lotes pilotos liofilizados de la formulación recién elaborada sugieren la consistencia del proceso tecnológico desarrollado. Los resultados del estudio de estabilidad se resumen en las tablas 3 y 4 (acelerado y vida estante, respectivamente). Todos los parámetros cumplieron con los criterios de aceptación establecidos, manteniéndose la apariencia del producto liofilizado, pH, contenido de fármaco, contenido de humedad y calidad microbiológica reflejada en los resultados de endotoxinas bacterianas y la esterilidad.
La especificidad a los productos de degradación se logró mediante un mecanismo de distribución. El uso de un reactivo de pareamiento iónico (tetrabutilamonio en forma de hidrógeno sulfato) fue completamente necesario, al anular las cargas negativas del ácido zoledrónico (valores de pKa = 0,66 [20] - {2,89-6,63-10,99} [21]) ionizado al pH de trabajo (2,3). Este par iónico permitió obtener temporalmente una especie más hidrófoba que el analito, haciendo posible su retención bajo estas condiciones. El uso de modificadores orgánicos (solventes) durante la cromatografía no fue necesario pues la elución ocurrió en un tiempo inferior a 20 min sin distorsión de los picos, ni retención excesiva de productos de degradación. La columna seleccionada (C8) permitió mantener la resolución adecuada (1,748-5,505) entre el ácido zoledrónico, sus productos de degradación (imidazol y compuesto relacionado A) y tri-sodio citrato. La retención de este último, en forma de ácido cítrico, también observable, fue posible a partir de la supresión iónica que sufre al encontrarse el pH de la fase móvil por debajo de su menor valor de pKa (pKa1=3,14; pKa2=4,77; pKa3=6,39) [22]. En las condiciones del método se obtuvieron valores de asimetría entre 1,020-1,614 para los cuatro picos observables (figura 1). Estos valores fueron adecuados para la cuantificación del ácido zoledrónico y de sus productos de degradación en el producto terminado.
En los cromatogramas obtenidos (figura 2) se distinguen los productos de degradación que aparecen después de los tratamientos aplicados y la no interferencia en la determinación del IFA, manteniéndose una pureza de pico para el ácido zoledrónico ≥ 99,0% en todos los casos. No se observó ninguna señal, como resultado de las degradaciones, por encima de los 20 min de corrida.
La hidrólisis básica provocó una disminución en 73,3% y una distorsión del pico perteneciente al ácido zoledrónico, por lo que no se descartó la presencia de productos de degradación no absorbentes a esta longitud de onda y, por tanto, no detectables en este sistema cromatográfico. De los tratamientos realizados, este resultó ser el de mayor impacto en la muestra.
Una degradación menos importante se produjo con la oxidación mediante H2O2 (7,4%), observable en el incremento de una señal asignable al compuesto relacionado A. La variación de la señal del IFA para el resto de los tratamientos fue la siguiente: hidrólisis acuosa (1,6%), hidrólisis ácida (2,7%), degradación térmica (2,5%) y degradación por exposición a la luz (0,8%). Con esto se concluyó que el método resultó específico para evaluar el ácido zoledrónico en presencia de sus productos de degradación principales y de otras sustancias provenientes de la exposición de la formulación a condiciones adversas.
En la linealidad se obtuvo r= 0,9999.La pendiente de este análisis fue significativa (texp=249,1; >ttab=2,145), con lo cual el procedimiento es adecuado para medir pequeños cambios en la concentración del IFA mientras que el intercepto resultó no significativo (texp=1,667 <ttab=2,145). El CV (factores respuesta) fue de 0,48% (≤ 5 %) indicando una baja dispersión de los datos.
En el ensayo de exactitud (tabla 2), la recuperación (75-125%) estuvo entre 99,1% y 100,6% (CVglobal ≤0,75%), sin presentar diferencias significativas entre lo añadido y lo recobrado para cada nivel de concentración y entre todos ellos (Cexp=0,42).
Los resultados de la repetibilidad mostraron un CV de 0,37% (< 2%) y en la precisión intermedia (tabla 2) los CVtotales se encontraron entre 0,30-0,53%. Para esta última, al comparar los resultados entre días, analistas y niveles de concentración fueron obtenidos valores de texp<ttab; por tanto, el método resultó preciso.
Durante el estudio acelerado (tabla 3), los atributos de calidad correspondientes como las características organolépticas del producto, totalidad y transparencia de soluciones y esterilidad cumplieron con los límites establecidos. Respecto a la estabilidad en condiciones de estante (tabla 4), hasta los 24 meses el producto mantuvo todos los índices de calidad.
La mezcla 1 se empleó para confirmar el tiempo de retención de las señales de imidazol y compuesto relacionado A y el cumplimiento de los valores límites de estos compuestos. En ningún tiempo de estudio, las concentraciones de los productos de degradación, en las muestras evaluadas, sobrepasaron los de las sustancias de referencia.
CONCLUSIONES
La especificidad del método cromatográfico permite identificar los productos de degradación conocidos y aquellos que pudieran aparecer como consecuencia de condiciones inapropiadas de almacenamiento y ninguno de ellos afecta la cuantificación del ácido zoledrónico. El método analítico resultó lineal, exacto y preciso; lo cual permite emplear la técnica validada en el control de calidad y en los estudios de estabilidad del inyectable liofilizado de ácido zoledrónico 5 mg. El inyectable liofilizado, a partir de las mediciones de todos los parámetros de calidad, se mantuvo estable durante los 24 meses de estudio lo cual asegura su inocuidad y efectividad terapéutica.