INTRODUÇÃO
Acinetobacter baumanni é uma bactéria Gram negativa, coco-bacilar, não fermentadora de glicose, e oxidase negativa, que é frequentemente responsável por Infecções Relacionadas à Assistência à Saúde (IRAS), sobretudo naqueles pacientes internados em unidades de terapia intensiva (UTI) [1]. Tem sido relatado que 2 a 10 % das infecções causadas por bactérias Gram-negativas têm como agente este patógeno e que em pacientes internados o risco de mortalidade pode chegar a 40 % [2].
Esta espécie se agrupa filogeneticamente no complexo Acinetobacter calcoaceticus-bau-mannii [3] no qual estão incluídas mais cinco espécies: Acinetobacternosocomialis, Acinetobacter pittii, Acinetobacter seifertii [4], Acinetobacter dijkshoorniae e Acinetobacter calcoaceticus [5], sendo que esta última é considerada não patogênica.
A.baumannii é caracterizada por alto nível de resistência intrínseca a várias classes de antimicrobianos tais como glicopeptídeos, macrolídeos, lincosamidas e estreptograminas [6]. Além disso, esta bactéria é capaz de adquirir resistência a todas as classes de agentes antimicrobianos usados na terapêutica de infecções bacterianas. De acordo com Giammanco et al. [7], entre os anos de 2004 e 2014, mais de 50 % dos isolados de A. baumannii identificados na África, Oriente Médio e América Latina eram multi-drogaressitente (MDR). Deve ser ressaltado que bactérias são consideradas MDR quando não são sensíveis a pelo menos um agente antimicrobiano em três ou mais classes utilizadas na farmacoterapia afim de eliminar o patógeno [8]. Em 2016, o A. baumanni resistente aos carbapenêmicos foi considerado de prioridade crítica em uma lista publicada pela Organização Mundial da Saúde (OMS) com o objetivo de apoiar a pesquisa e o desenvolviemento de antimicrobianos efetivos tendo em vista o perigo eminente de disseminação dessa espécie no ambiente hospitalar [9].
Pneumonia, em sua maioria associada à ventilação mecânica, infecções de feridas em queimados e bacteremia são as infecções clínicas mais incidentes relacionadas à A. baumannii. Tornando esses eventos ainda mais adversos, com a pandemia da doença do coronavírus de 2019 (Covid-19) a partir de 2020, um aumento de internações em UTIs e do número de pacientes sob ventilação mecânica foi observado, considerando o comprometimento pulmonar grave causado pelo vírus SARS-CoV-2. Como consequência, a frequência de infecções secundárias, sobretudo por A. baumannii MDR aumentou consideravelmente, com surtos em várias unidades de saúde em todo o mundo [10, 11]. Este patógeno pode causar também infecções da pele e tecidos moles, bem como infecções do trato urinário em pacientes sob uso de sondas uretrais [12, 13].
Especificamente em queimaduras, A. baumannii é um dos patógenos mais notórios, sendo essa uma das maiores causas de mortalidade em todo o mundo entre esses pacientes, especialmente nos países em desenvolvimento [14, 15]. As infecções se tornam persistentes em feridas de vítimas de queimaduras, levando à perda de enxertos de pele e retardo na cicatrização de feridas [16]. Além disso, tem sido relatado um aumento da frequência de surtos de infecções por A. baumannii em militares feridos do Iraque e Afeganistão [17], sendo também registrado aumento na incidência de A. baumannii com fenótipo MDR em infecções de feridas relacionadas com o combate nos últimos 10-15 anos nos EUA [18, 19]. Esse fato fez com que esse patógeno fosse conhecido como "Iraqbacter" em virtude da alta frequência de isolamento de A. baumannii em feridas de combatentes americanos que lutaram na Guerra do Iraque (2003-2011) [18, 19].
Deve ser ressaltada ainda a habilidade de A. baumannii em formar biofilme em substratos abióticos e bióticos, o que é de grande impacto clínico considerando que o manejo terapêutico dessas infecções é extremamente complexo [20, 21]. Biofilmes são comunidades microbianas, em sua maioria compostos por bactérias, envoltas em uma matriz exopolimérica com estrutura tridimensional que conhecidamente contribuem para o aumento da resistência antimicrobiana [22-24]. Especificamente, biofilmes de A. bau-mannii ocorrem em feridas e curativos oclusivos, além de cateteres e tubos endotra-queais. De acordo com Gil-Perotin et al. [25] em pacientes de UTI mecanicamente ventilados por mais de 24 horas, a possibilidade de formação de biofilme, sobretudo por bastonetes Gram-negativos não-fermentadores de glicose (i.e., A. baumannii e Pseudomonas aeruginosa) é muita alta, uma vez que essas bactérias se aderem facilmente na superfície interna dos tubos.
Tem sido relatado na literatura a relação da produção de biofilme por A. baumannii e resistência a antimicrobianos como tetraciclinas, inibidores da via do folato (i.e., sulfas), aminoglicosídeos, carbapenêmicos e penicilinas [20]. Possivelmente esta associação está relacionada com o aumento global de A. baumannii MDR, tornando o cenário ainda mais crítico, sendo necessário maior conhecimento para estabelecimento de estratégias de prevenção, controle e manejo terapêutico mais eficaz [7]. Dessa forma, essa revisão tem como objetivo resumir o conhecimento atual realacionadoa possível associação entre a produção de biofilme e perfil de susceptibilidade aos antimicrobianos em isolados clínicos de A. baumannii que circulam nas UTIs de hospitais ao redor do mundo.
METODOLOGIA
Estratégias de busca
Uma revisão sistemática da literatura foi conduzida, no período de novembro a março de 2021, de acordo com as orientações do Cochrane Handbook (Cochrane Collaboration, 2011) [26]. As etapas de pesquisa, seleção, extração dos dados de interesse e análise dos resultados observados nos artigos incluídos seguiram as normas do Preferred ReportingItems for Systematic Reviews andMeta-Analyses (Prisma).
A busca sistemática foi feita nos bancos de dados Pubmed/Medline, Scopus E Lilacs, SciELO, e Web of Science. Para a determinação dos descritores empregados nas estratégias de busca foi utilizado o Medical Subheading Terms (MesH) para a definição das palavras-chaves em inglês, e os Descritores Virtual em Saúde (DeCS) para a definição das palavras-chaves em português e espanhol. Os seguintes descritores: "Acinetobacter" OR "Acinetobacter baumannii" OR "Acinetobacter Infection" AND "Biofilm" foram pesquisados. A busca foi filtrada para artigos escritos em português, espanhol e inglês, e publicados a partir do ano de 2015 (últimos 5 anos).
Critérios de inclusão e exclusão
Para a inclusão dos estudos foram considerados artigos originais que se tratavam de infecções por A. baumannii produtora de biofilme no contexto das UTIs. A seleção dos estudos foi realizada segundo a estratégia PVOS, como segue: "Population", Isolados clínicos de Acinetobacter baumannii recuperados de pacientes internados em UTIs; "Variável", Perfil de susceptibilidade aos antimicrobianos das classes das polimixinas, carbapenêmicos, aminoglicosídeos e tigeciclina; "Outcomes (Desfechos)", Capacidade de produção de biofilmes; "Study design", Estudos observacionais (i.e., Transversais, Coorte, Caso-controle, e Relatos de caso) e Estudos de Vigilância epidemiológica, microbiológica, e molecular. Foram incluídos os estudos que apresentaram: (i) espécies clínicas de A. baumannii corretamente identificadas e caracterizadas; (ii) estudos que determinaram o perfil de susceptibilidade a pelo menos um agente antimicrobiano da classe das polimixinas, aminoglicosídeos, carbapenêmicos e tigeciclina, usando métodos de microdiluição em caldo ou disco-difusão de acordo com o Clinical Laboratory Standard Institute guidelines (CLSI) ou European Committee on Antimicrobial Susceptibility Testing (EUCAST); e (iii) determinação da habilidade do isolado em produzir biofilmes por métodos fenotípicos ou genotípicos.
Artigos de revisão, e-mails, editoriais, cartas ao editor, e resumos apresentados em eventos foram excluídos, assim como: (i) artigos repetidos entre as diferentes bases de dados; (ii) conteúdosnão originais ou inéditos; (iii) estudos que não identificaram corretamente as espécies de A. baumannii ou não determinaram o perfil de susceptibilidade aos antimicrobianos de interesse; (iv) estudos que não avaliaram a presença ou desenvolvimento de infecção causada por A.baumanni formador de biofilme; e (v) estudos que não avaliaram infecções oriundas de pacientes internados em UTIs.
Seleção dos estudos
Os títulos, resumos e palavras-chaves, foram inicialmente analisados por dois autores de maneira independente (T.T.A.C. e A.P.C.), a fim de verificar se os estudos estavam em acordância com os critérios de inclusão estabelecidos. Logo após a pré-seleção dos artigos, foi feita a leitura do artigo completo e aplicação dos critérios de inclusão e exclusão. Em caso de alguma descordância entre os autores, um terceiro autor (M.C.P.) foi solicitado para o encontro de um consenso.
Análise dos dados
Os artigos que apresentaram todos os critérios de inclusão foram submetidos a uma leitura do texto analítica para a extração dos seguintes dados: (i) Referência (autores e ano de publicação); (ii) País e tipo de estudo; (iii) Unidade hospitalar (UTI, clínica médica, cirurgia, pediatria, entre outros); (iv) Sítio de infecção/Tipo de amostra clínica; (v) Método de identificação dos isolados de A. baumannii; (vi) Perfil de susceptibilidade aos antimicrobianos: carbapenêmicos (CRAB), aminoglicosídeos (ARAB), polimixinas (PRAB), tigeciclina (TRAB); e (vii) Produção de biofilme. Todos os dados de interesse foram resumidos em uma tabela para análise e interpretação pelos autores.
RESULTADOS E DISCUSSÃO
Pesquisa da literatura
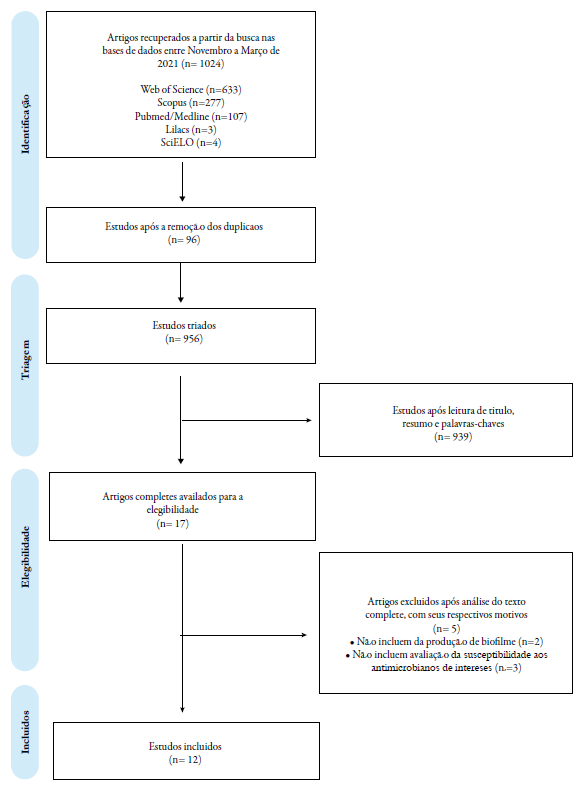
O processo de busca nas bases de dados resultou em 1.024 artigos, sendo 107 no Pub-Med, 277 na Scopus, 4 no SciELO, 3 no LILACS e 633 no Web of Science (figura 1). Após a seleção, 17 estudos foram obtidos. Desses artigos, 5 foram excluídos e as principais razões de exclusão foram estudos que não identificaram a presença de biofilme (n=3) ou não incluíram o perfil de resistência aos antimicrobianos de interesse (n=2). Por fim, foram selecionados 12 estudos que atenderam aos critérios de elegibilidade para extração das variáveis de interesse (figura 1).
Principais características dos estudos incluídos
Foram analisados 1006 isolados clínicos de A. baumannii associados à formação de biofilmes em infecções ativas de pacientes internados em UTIs, os quais apresentaram alta incidência de resistência aos antimicrobianos carbapenêmicos, considerados primeira escolha para o tratamento de infecções por A. baumannii MDR (tabela 1).
Tabela 1 Principais caracteristicas dos artigos incluidos na revisao sistematica.
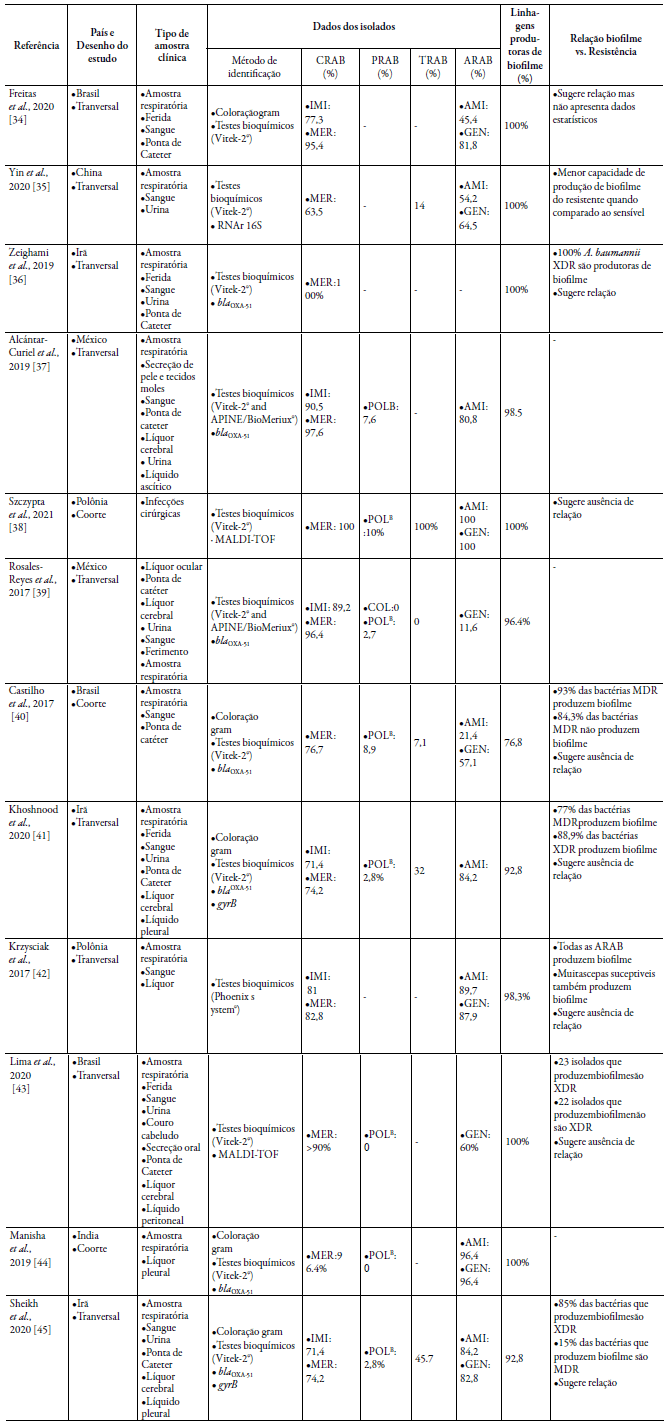
ARAB, Acinetobacter baumanni resistente aos aminoglicosideos (amicacina, gentamicina); CRAB: Acinetobacter baumannii resistente a carbapenemicos (meropenem, imipenem);
PRAB: Acinetobacter baumannii resistente a polimixina (polimixina B) ou colistina (polimixina E); TRAB Acinetobacter baumannii resistente a tigeciclina.
A maioria dos estudos (5/12; 41,6 %) foi publicada no ano de 2020. Possivelmente, isso se deve ao fato de que A. baumannii tem sido apontado como um dos principais agentes etiológicos associados a infecções em pacientes internados em UTIs, sobretudo relacionados com a infecção por SARS-CoV-2. Deve ser destacado que esse patógeno apresenta grande plasticidade e capacidade de adaptação a diversos estresses ambientais. Aliado a isso, sua habilidade de produção de biofilme em equipamentos médico--hospitalares e superfícies de policarbonato e aço inoxidável favorecem sua persistência e envolvimento em IRAS [27-31]. Dentre os 12 artigos incluídos, os países que mais apresentaram estudos foram o Irã (3/12; 25 %) e Brasil (3/12; 25 %). Sugere-se que a grande quantidade de estudos originados do Irã, como também de outros países da região do Oriente Médio, deve-se ao fato de A. baumannii ser uma causa frequente de infecções nosocomiais principalmente em feridas de pacientes com queimaduras, evento frequente nestas regiões devido à situação constante de guerra [17]. Além disso, é preocupante a resistência aos antimicrobianos entre esses isolados, limitando o manejo terapêutico por várias vias, inlcuindo o uso tópico [14, 32, 33].
No Brasil, têm sido demonstrados diversos isolados de A. baumannii resistentes aos carbapenêmicos, limitando o tratamento aos antimicrobianos de última linha, como as polimixinas, que levam a efeitos nefrotóxicos importantes em 36 % dos pacientes [34, 35]. Dessa forma, compreender os mecanismos associados à resistência pode ajudar na implementação de medidas para controlar e prevenir a aquisição de infecções nosocomiais, especialmente em UTIs, além de desempenhar um papel essencial no desenvolvimento de estratégias terapêuticas [33, 34].
Dentre o conjunto de dados analisados (tabela 1), pode ser observado também que o sítio de infecção mais frequente nos estudos incluídos foi o trato respiratório (11/12; 91,6 %), sendo coletadas para diagnóstico microbiológico amostras de escarro, aspirado traqueal, líquido pleural e lavagem broncoalveolar. Além disso, a maioria dos estudos incluídos detectou a presença de A. baumannii em infecções primárias da corrente sanguínea (83,3 %) e de infecções relacionadas a cateteres (58,3 %).
De fato, A. baumannii e outras bactérias Gram-negativas têm sido responsáveis pelo alto índice de pneumonias em ambientes clínicos, sobretudo durante a pandemia pelo SARS-CoV-2 [46]. Pacientes com Covid-19 grave são comumente submetidos à intubação endotraqueal e ventilação mecânica devido à insuficiência das vias aéreas, o que são considerados fatores de risco para co-infecções bacterianas [21, 36]. Shari-fipour et al. [37] relataram que todos os pacientes internados na UTI por Covid-19 da cidade de Qom (Irãs em 2020 adquiriram co-infecção bacteriana sendo que em 90 % das infecções, A. baumannii foi identificado como o agente etiológico.
Para identificação laboratorial de A. baumannii, métodos fenotípicos e genotípicos são utilizados, não constituindo tarefa simples e muitas vezes envolvendo a associação de métodos para a identificação em nível de espécie [38]. Neste sentido, ressalta-se a detecção do gene bla OXA-51 , intrínseco em A. baumannii e por isso, considerado padrão--ouro para identificação e diferenciação das espécies do complexo Acinetobacter baumannii- calcoaceticus [39]. Aqui foi observado que a maioria dos estudos (8/12; 66,6 %) utilizaram para a identificação da espécie a reação em cadeia da polimerase (PCR) para identificação do gene bla OXA-sl , associado com o método de coloração de Gram e testes bioquímicos-fisiológicos automatizados. O segundo método mais utilizado foi a técnica espectrométrica MALDI-TOF (do inglês, Matrix Associated Laser mannii ao nível de espécie.
Resistência aos antimicrobianos carbapenêmicos, polimixinas, tigeciclina, e aminoglicosídeos em Acinetobacter baumannii
Resistência aos antimicrobianos em A. baumannii, frequentemente com determinantes de resistência a múltiplas classes de antimicrobianos tem sido amplamente descrito [40]. Nesta revisão, os isolados de A. baumannii com maior taxa de resistência aos antimicrobianos carbapenêmicos (CRA") foram encontrados na Polônia, México e Índia enquanto aqueles resistentes às polimixinas (PRA) e tigeciclina (TRA) foram mais detectados na Polônia e no Irã. Contudo vale ressaltar a presença de CRA" em todos os estudos, com incidência de 70 % a 100 %, sendo assim a classe de antimicrobianos para a qual essa bactéria apresenta mais cepas resistentes.
Notoriamente, os antimicrobianos com maior número de isolados sensíveis foram observados para as polimixinas e tigeciclinas. Menores taxas de CRA" foram relatadas nos estudos do Irã e China, contudo um dos estudos apresentou 100 % de amostras resistentes aos carbapenêmicos [41]. A presença de ARA" foi menor nos estudos do "rasil, México e China. Apesar da baixa resistência a esses antimicrobianos entre os isolados do "rasil, mais pesquisas devem ser conduzidas para avaliar a resistência em todo o país uma vez que apenas três estudos foram encontrados no período do estudo.
A. baumannii resistentes a amicacina e gentamicina foram descritos respectivamente em nove (9/12; 75 %) e oito (8/12; 67 %) estudos incluídos, com taxas de resistência superiores a 80 % em países orientais como Polônia, Irã e Índia. Nos estudos conduzidos no "rasil, foram observadas taxas de resistência mais baixa a amicacina (inferior a 50 %) quando comparadas a gentamicina (81,8 %), o que pode ser justificada pelo uso preferencial da gentamicina no país em relação aos outros aminoglicosídeos. Apesar dos aminoglicosídeos serem amplamente utilizados na prática clínica em tratamento com monoterapia em infecções por Gram-negativos, os dados aqui obtidos apontam que para o tratamento de infecções por A. baumanni iesse uso é limitado.
Devido a sua boa atividade e baixa toxicidade, os carbapenêmicos, antimicrobianos betalactâmicos, são considerados boa opção terapêutica nas infecções por A. baumannii MDR [40]. Entretanto, a emergente resistência destes patógenos a esses compostos tem criado uma crise global. Nos estudos incluídos nesta revisão, todos os isolados (1106) foram resistentes aos carbapenêmicos imipenem e/ou meropenem, refletindo a disseminação mundial de determinantes de resistência aos carbapenêmicos entre A. baumannii circulante em UTIs. Este dado vai de encontro às orientações da OMS, que desde 2017 coloca a comunidade científica em alerta para conter a disseminação de CRA^ cujo tratamento das infecções fica limitado a poliximinas e tigeciclina [9].
Com relação às poliximinas (polimixina " e polimixina E - colistina), apesar de terem seu uso abandonado entre 1970 e 1980 devido aos efeitos tóxicos ao organismo humano, atualmente elas figuram como uma das poucas opções para tratar infecções por bactérias Gram-negativas extensivamente resistentes aos antimicrobianos (XDR) [42]. Apesar das reformulações farmacêuticas destes compostos visando reduzir os efeitos adversos, ainda assim a nefrotoxicicidade e a neurotoxicidade causada por esses fármacos tem sido um desafio para o tratamento, tendo em vista que os pacientes acometidos por essas infecções podem apresentar outras comorbidades que limitam o seu uso [43].
Aqui foi observado que oito estudos (66,6 %) avaliaram o perfil de susceptibilidade dos isolados de A. baumannii às polimixinas e apenas um avaliou o perfil à colistina. O maior número de isolados resistentes às polimixinas foi descrito no México [44], no entanto, ressalta-se que dos antimicrobianos estudados, esta é classe para a qual maior sensibilidade foi observada entre os isolados de A. baumanii (tabela 1). Resistência às polimixinas nesta espécie envolve na maioria das vezes mecanismo de resistência cro-mossômico com alteração no lipídeo A que forma o LPS bacteriano, um dos principais componentes da membrana externa [45]. Apesar da baixa resistência associada à essa classe, outros estudos vêm alertando para o aumento da resistência às polimixinas, tendo em vista o aumento do seu uso, principalmente em infecções causadas por A. baumannii resistente aos carbapenêmicos [46]. Foram demonstradas taxas de resistência de 40,7 % e 30,6 % na Espanha e Coréia, respectivamente. Esse panorama é bastante preocupante, visto que as polimixinas são consideradas últimas opções de tratamento das infecções por A. baumannii XDR [47-49].
No contexto da resistência as polimixinas, um gene de resistência à colistina mediado por plasmídeo (mcr-l) relatado pela primeira vez na China em 2015 em um isolado de Escherichia coli, tem sido descrito em várias regiões do mundo [50]. Em 2019, um estudo no Paquistão descreveu pela primeira vez A. baumannii-mcr positivo dentre os isolados resistentes a colistina [51]. No "rasil, também no ano de 2019 foi descrita pela primeira vez A. baumannii com resistência a polimixina mediada por plasmídeo, ressaltando o alto potencial de disseminação e enfatizando a necessidade de conhecer e monitorar o status da resistência global à colistina neste patógeno [52, 53].
Considerando as opções antimicrobianas para o tratamento das infecções por A. bau-mannii, foi avaliada a susceptibilidade a tigeciclina, um antimicrobiano da classe das glicilciclinas, nos estudos incluídos nesta revisão. Perfis de susceptibilidade variáveis a esse fármaco foram observados nos isolados descritos em seis estudos (6/12; 50 %). Na Polônia, todos os isolados foram resistentes a tigeciclina [54], ao contrário do México que apresentou 100 % de susceptibilidade a esta classe [55] (tabela 1). No "rasil, apenas um estudo avaliou o perfil de suceptibilidade de A. baumanniia tigeciclina [56] e apontou uma taxa de 7,1 %, similar a do México, sugerindo baixa resistência a este composto entre isolados do continente Americano. Já no Irã, similar à Polônia, alto índice de resistência (45,7 %, 32/70) foi observado. Esses achados sugerem que a resistência a esse antimicrobiano, bem como a sua disseminação depende de fatores locais, tais como exposição prévia à antimicrobianos e perfil da unidade de assistência à saúde [57].
Formação de biofilmes em Acinetobacter baumannii
O sucesso de A. baumannii nas infecções está associado aos diversos fatores de virulência que essa bactéria é capaz de produzir, incluindo lipopolissacarídeo (LPS), cápsulas de polis-sacarídeos, proteína de membrana externa A (AbOmpA), vesículas de membrana externa, fosfolipase D e biofilme [58, 59]. Tem se tornado cada vez mais evidente que a capacidade de formação de biofilme de A. baumanii pode ser considerada um dos principais fatores de virulência, amplamente encontrado em isolados clínicos [22, 60, 61].
Biofilmes bacterianos desempenham um papel essencial na patogênese bacteriana e, além disso, comprometem a susceptibilidade aos antimicrobianos [22, 24, 62]. A alta resistência aos antimicrobianos em bactérias envolvidas em biofilmes é favorecida pela matrixexopolissacarídica, responsável pela ancoragem e suporte da comunidade microbiana. De fato, a habilidade das bactérias em se manterem na fase estacionária de crescimento dentro do biofilme aliado a fatores bioquímicos, tais como bomba de efluxo, quorum sensing, e eventos moleculares de mutação e transferência gênica contribuem para o desenvolvimento da resistência. Além disso, condições externas ao biofilme, incluindo exposição a concentrações subclínicas de antimicrobianos, nutrientes, pH, temperatura também interferem na resistência antimicrobiana [28, 31].
Dentre os estudos avaliados, seis (6/12; 50%) demonstraram que 100 % dos isolados de A. baumannii (n=301) eram produtores de biofilme e em outros cinco estudos, mais de 90 % dos isolados também apresentavam a capacidade de produzir biofilme. Como citado anteriormente, biofilmes bacterianos são de difícil manejo terapêutico com implicações no aumento da morbimortalidade e dos custos de tratamento [63]. Infecções com biofilmes de A. baumannii são frequentes em pacientes utilizando dispositivos médicos tais como cateteres, tubos endotraqueais e/ou implantes de próteses ortopédicas [63]. De acordo com Gil-Perotin et al. [25], a formação de biofilme por A. baumannii e Pseudomonas aeruginosa em tubos endotraqueias de pacientes em UTI mecanicamente ventilados foi observada a partir de 24 horas, o que é de grande preocupação em função das condições do paciente e possibilidade de instalação da pneumonia e complicações.
Relação entre produção de biofilmes e resistência aos antimicrobianos em Acinetobacter baumannii
De acordo com alguns estudos, a resistência aos antimicrobianos em A. baumannii pode estar associado com a habilidade de produção de biofilme [64, 65]. Assim, para uma melhor compreensão desta possível associação, foi avaliado o perfil de suceptibilidade versus habilidade de formar biofilmes nos isolados incluídos nos estudos selecionados para esta revisão. Dentre os estudos, sete (7/12; 58 %) relataram A. baumanii MDR ou XDR com capacidade de produzir biofilme, incluindo os estudos brasileiros de Castilho et al. [56] e Lima et al. [43]. Bactérias XDR são epidemiologicamente significativas devido não apenas à sua resistência a vários agentes antimicrobianos, mas também à sua ameaçadora probabilidade de serem resistente a todos ou quase todos os agentes antimicrobianos disponíveis [8]. Além disso, muitos estudos mostram que a tolerância antimicrobiana após a formação do biofilme pode aumentar de 10 a 1000 vezes, desempenhando um papel importante na resistência bacteriana [66-69].
No entanto, dois estudos [38, 43] não sugeriram relação entre essas características, mostrando que linhagens que são fortes produtoras de biofilme apresentam maior susceptibilidade aos antimicrobianos. Apesar disso, para concluir a relação entre a resistência microbiana e a produção de biofilme em isolados de A. baumannii ainda são necessárias mais pesquisas. Isso porque, isolados não produtores de biofilme também apresentaram o mesmo fenótipo de resistência dos produtores [56]. Da mesma forma, Krzysciak et al. [42] também não conseguiram estabelecer associação entre a resistência aos aminoglicosídeos e produção de biofime, enquanto Yin et al. [38] e Lima et al. [43] não encontraram relação entre A. baumannii MDR e XDR com a capacidade de produção de biofilme. Certamente vários fatores são envolvidos no desenvolvimento desses fenó-tipos de A. baumannii [69-71] e pesquisas futuras poderão elucidar os mecanismos contribuindo para a prevenção e controle das infecções por este patógeno.
CONCLUSÃO
Resistência aos antimicrobianos em A. baumannii tem aumentado em todo mundo, sendo crítica para os carbapenêmicos e parece ser dependente de fatores locais para a tigeciclina. Polimixinas, sobretudo polimixina ", continua sendo uma opção para o tratamento de infecções por A. baumannii XDR, como sugerido pela baixa taxa de resistência a essa classe.
Em adição, concluímos que não foi possível observar uma associação entre capacidade da produção de biofilme e resistência aos antimicrobianos carbapenêmicos, aminogli-cosídeos, polimixinas e tigeciclinas entre A. baumannii recuperados nas UTIs. Apesar de algumas evidências mostrarem que essa associação pode existir, muitas outras não encontram nenhum favorecimento para resistência aos antimicrobianos em linhagens produtoras de biofilmes. Assim sendo, novos estudos devem ser conduzidos a fim de elucidar melhor a real importância dessa associação em um contexto clínico.