INTRODUCCIÓN
El trastorno bipolar es una enfermedad crónica y recurrente que afecta al 1% de la población mundial, es una de las principales causas de discapacidad en personas jóvenes, puede llevar a limitación funcional y cognitiva e incrementar la mortalidad, principalmente por aumento en el riesgo suicida y del riesgo de enfermedad cardiovascular [1].
En el DSM-5, los trastornos bipolares están subclasificados como trastorno bipolar I, trastorno bipolar II, ciclotimia y categorías residuales de formas atípicas que no encajan en los subtipos antes mencionados. Esta subclasificación depende de la gravedad y duración de los episodios maníaco (o hipomaníaco) y depresivos [1].
La prevalencia del trastorno bipolar I es similar para hombres y mujeres, mientras que el trastorno bipolar II ocurre con mayor frecuencia entre las mujeres. El trastorno bipolar prevalece en las prácticas de atención primaria. Por ejemplo, un estudio mostró que hasta el 9,8% de pacientes de atención primaria en la ciudad de Nueva York tuvo una prueba de detección positiva para el trastorno bipolar, que parecía haber sido poco detectado y tratado, y otro estudio mostró que el 15% de los pacientes que reciben atención por depresión unipolar en las prácticas de atención primaria pueden tener un trastorno bipolar no reconocido [2].
Según la Encuesta Nacional De Salud Mental la prevalencia estimada del trastorno bipolar tipo I en Colombia es del 1,9% en los hombres y del 0,6% en las mujeres, para un porcentaje total de 1,3% con un intervalo de confianza del 95%. Para el trastorno bipolar tipo II, la prevalencia estimada es del 0,3% para los hombres y del 0,1% para las mujeres, con una prevalencia total del 0,2% con un intervalo de confianza del 95%. En la población adolescente los registros para trastorno bipolar I y II, para hombres y mujeres es de un 0,9%, no se encuentran registro de datos epidemiológicos sobre TAB en niños(as) [8].
Los estudios de mortalidad indican que los trastornos bipolares, de forma similar a la esquizofrenia, se asocian con una pérdida de aproximadamente 10 a 20 años potenciales de vida. La brecha de morbimortalidad en comparación con la población general es enorme y está aumentando, especialmente en las poblaciones más jóvenes (de 15 a 29 años). La alta prevalencia de comorbilidad médica en los trastornos bipolares (sobre todo enfermedades de tipo cardiovasculares) subraya la necesidad de un enfoque integrado de la evaluación y manejo de individuos con este grupo de trastornos [1].
La etiopatogenia incluye: factores genéticos: los estudios epidemiológicos familiares, de concordancia de gemelos y los de adopción permiten señalar que los factores genéticos juegan un papel esencial. En los familiares de primer grado de las personas con TB tipo I se incrementa el riesgo de esta enfermedad de 8 a 10 veces, y el de depresión mayor de 2 a 10 veces [2].
Estimaciones de heredabilidad para el trastorno bipolar oscilan entre el 70 y el 90%. Hallazgos provisionales con respecto a la genética subyacente y el potencial de las vías neurobiológicas de los trastornos bipolares han derivado de la asociación del estudio del genoma. Muchos genes se considera que contribuyen a este grupo de trastornos. Por ejemplo, un estudio de asociación del genoma del 2019 identificó 30 loci significativos, de los cuales 20 no habían sido reconocidos previamente. Un análisis mostró conjuntos de genes enriquecidos en poblaciones bipolares, incluidos los conjuntos involucrados en la regulación de la secreción de insulina y la señalización endocannabinoide [7].
Las variantes de riesgo en conjunto representan sólo aproximadamente el 25% de la heredabilidad general del trastorno. Además, se cree que las variantes genéticas comunes interactúan con factores de riesgo, pero estos últimos tampoco están bien establecidos.
Dentro de los factores neuro bioquímicos se han encontrado niveles elevados de dopa-mina y noradrenalina durante los episodios de manía y bajos en los estados depresivos. Se ha hipotetizado además un desequilibrio del balance adrenérgico-colinérgico en la génesis del TB. Finalmente, dentro de los factores neuroanatómicos como posible sustrato neurobiológico se ha propuesto la desregulación de la modulación del circuito prefrontal y del sistema límbico [4]
Además de los factores genéticos, neuroquímicos y neuroanatómicos, se ha descrito la influencia de otro tipo de factores de riesgo como los de tipo médico y ambiental que pueden modificar el inicio y el curso del TB, por ejemplo, factores de riesgo perinatal como el parto por cesárea, la infección materna por influenza, tabaquismo durante el embarazo, la alta edad paterna y otros como los eventos adversos de la vida, particularmente durante la niñez han sido implicados en el aumento del riesgo de trastorno bipolar, este último además se considera un predictor de un curso más tórpido [9]
Durante los episodios maníacos, se presenta hiperactividad, aumento de autoestima, grandiosidad, disminución en la necesidad de dormir, estado de ánimo y conductas expansivas, además de síntomas psicóticos, mientras que, durante los episodios depresivos, se presentará una disminución en el nivel de energía, tristeza, aislamiento social, hipersomnia y baja autoestima. La psicosis puede también ocurrir durante episodios depresivos, pero aparece con mayor frecuencia durante la manía. La hipomanía es una forma más leve y más corta de manía, quienes pueden tener un juicio relativamente intacto. A menudo, episodios agudos de las alteraciones del estado de ánimo pueden incluir síntomas en ambos polos, es decir, síntomas mixtos [2].
El objetivo del tratamiento es reducir la frecuencia, duración y gravedad de los episodios activos y aumentar el tiempo empleado en remisión. [6]. El tratamiento del trastorno bipolar se puede dividir en dos fases distintas: Manejo de un episodio inicial y tratamiento a largo plazo para prevenir recaídas. Estas dos fases requieren diferentes estrategias de tratamiento y coordinación entre atención primaria y secundaria [5].
Varios factores influyen en la selección del tratamiento inicial, incluyendo la preferencia de los pacientes, las condiciones médicas y psiquiátricas coexistentes y respuestas previas al tratamiento, incluidos los efectos secundarios asociados. Durante los episodios afectivos agudos, debe garantizarse la seguridad de los pacientes, particularmente determinando si están en riesgo de suicidio, auto ó heteroagresión, de ser así, introducir medidas para reducir el riesgo. Es aconsejable discutir con los pacientes las intervenciones farmacológicas y no farmacológicas basadas en la evidencia y monitorear la adherencia en la medida de lo posible [6].
El tratamiento farmacológico en manía aguda se da con antipsicóticos o estabilizadores del estado de ánimo. Las estrategias no farmacológicas también se pueden utilizar para pacientes con manía severa o resistente al tratamiento. Hay evidencia mínima con respecto a la elección de la medicación para la hipomanía, y los tratamientos para la manía se utilizan a menudo para hipomanía. Los estabilizadores del estado de ánimo aceptados por la FDA son: litio, carbamazepina y divalproato.
La más antigua y posiblemente, la más eficaz de estas terapias fue la terapia con litio. Se ha utilizado durante 70 años en trastorno bipolar. Inicialmente se observó que tenían un efecto antimaníaco, y solo se estableció como una terapia de mantenimiento veinte años después.
Los antipsicóticos han pasado a primer plano en los últimos años después del descubrimiento de los antipsicóticos atípicos como la clozapina. Este medicamento fue muy valioso, ya que tuvo una incidencia mucho menor de efectos secundarios de tipo extra-piramidales que sus predecesores.
Los antiepilépticos son la tercera clase de fármacos comúnmente utilizados en el tratamiento del trastorno bipolar. Actúan inhibiendo la señalización de sodio en las neuronas del SNC y, por lo tanto, disminuyen la neurotransmisión global. Los dos antiepilépticos claves que se utilizan ampliamente como estabilizadores del estado ánimo son valproato y lamotrigina, siendo capaces de mantener la remisión en una variedad de grupos de pacientes. Valproato ha demostrado importantes propiedades antimaníacas, mientras que lamotrigina por su parte es útil en estados depresivos bipolares [5].
Se define como reacción adversa a medicamentos (RAM) cualquier respuesta nociva y no intencionada a un medicamento. Las RAM constituyen una importante causa de morbimortalidad y de aumento de los costes sanitarios. Los sistemas de farmaco-vigilancia permiten la identificación y prevención de los riesgos asociados al uso de medicamentos.
Según Rawlins y Thompson, las RAM se clasifican principalmente en: reacciones de tipo A (augmented), son el resultado de un aumento de la acción farmacológica del fármaco administrado; por tanto, dependen de su mecanismo de acción, y en general son predecibles, frecuentes, dependientes de la dosis y tienen una baja mortalidad, pueden estar relacionadas con su efecto farmacológico principal o terapéutico (efecto secundario) o relacionarse con otros efectos farmacológicos no principales (efecto colateral).
Las reacciones de tipo B (bizarre) son reacciones que no se relacionan con el mecanismo de acción del fármaco y, por tanto, en general, son impredecibles, infrecuentes y tienen una alta mortalidad. Forman este grupo B las reacciones idiosincrásicas (que se relacionan con polimorfismos genéticos) y las reacciones de hipersensibilidad alérgica (desencadenadas por un mecanismo inmunológico, que incluyen los 4 tipos, I-IV, de la clasificación de Gell y Coombs).
Posteriormente, Grahame-Smith y Aronson añadieron 2 categorías más a la clasificación de las RAM: las reacciones de tipo C (chronic) que están relacionadas con la duración del tiempo de tratamiento o con la acumulación de dosis. Las reacciones de tipo D (delayed) ocurren o se observan tiempo después de haber tomado el fármaco, como serían la carcinogénesis y la teratogénesis. Otro tipo de reacciones son las de tipo E (end of treatment), que aparecen tras la retirada brusca del fármaco y se podrían evitar con una disminución progresiva de las dosis hasta la supresión del tratamiento [8].
METODOLOGÍA
Se realizó una búsqueda bibliográfica mediante la base de datos PubMed, utilizando términos MeSH: ("Carbamazepine/adverse effects") AND ("Lamotrigine/adverse effects" OR "Lamotrigine/pharmacokinetics") AND "Bipolar Disorder/diagnosis" AND ("Bipolar Disorder/etiology") AND "Bipolar Disorder/physiopathology" AND "Bipolar Disorder/statistics and numerical data" AND ("Bipolar Disorder/ therapeutic use") AND ("Bipolar Disorder/drug effects" OR "Bipolar Disorder/ drug therapy") (bipolar disorder and covid-19) AND LitCTREATMENT[filter], (psychopharmaceuticals and covid) AND LitCTREATMENT[filter], "valproic acid and covid" que arrojaron como resultado 58, 227 y 17 artículos, respectivamente.
Los criterios de inclusión utilizados fueron: a) Artículos publicados entre el año 2016 y 2021, b) Idioma inglés ó español, c) Población a estudio: Pacientes con diagnóstico de Trastorno Bipolar según criterios del DSM 5.
REVISIÓN DE LA LITERATURA
Carbamazepina
Es el primer anticonvulsivante que se utilizó como tratamiento de la manía en el trastorno bipolar desde los años 70 [10, 11]. El cual se consideró como alternativa al tratamiento con Litio, con adecuado resultado y una eficacia similar en la prevención de la manía aguda [11]. También posee usos off-label para esquizofrenia refractaria, en pacientes con esquizofrenia con alteraciones en el EEG, en esquizofrenia con episodios violentos y el trastorno esquizoafectivo [12]. Se ha demostrado que mejora los síntomas positivos y negativos. Entre otros usos para el tratamiento del síndrome de piernas inquietas y la disminución de la agitación y agresividad en pacientes con demencia [13]. Adicionalmente, se utiliza para el tratamiento de epilepsia focal, generalizada y neuralgia del trigémino. Inicialmente se hablará de las generalidades farmacocinéticas, farmacodinámicas y luego de las reacciones adversas severas reportadas en la literatura.
La carbamazepina presenta una estructura similar a los antidepresivos tricíclicos como la Imipramina [12]. Es absorbida después de su administración con una biodisponibilidad del 75-85%; La unión a proteínas en plasma alcanza el 70-80% y es metabolizado completamente en el hígado por epoxidación e hidroxilación. La vida media de eliminación es aproximadamente de 35 horas, pero se ha reportado ser menor en niños con un aproximado de 10 horas y es mayor en los ancianos de 30 a 50 horas. Sin embargo, se ha reportado que la vida media de eliminación es inicialmente de 25-65 horas con las formulaciones de liberación extendidas de 35 a 40 horas [14-17]. Adicionalmente la carbamazepina induce su propio metabolismo, aumentando así su eliminación y por consecuencia disminuyendo su vida media; por lo tanto, se necesita realizar ajustes de la dosis administrada después de las semanas 2 o 3 del tratamiento, aunque se reporta desde la semana 3 a 5 igualmente. Los niveles estables de la concentración en plasma se alcanzan después de los 5 a 7 días [17].
Es metabolizada principalmente a carbamazepina-10,11-epóxido por las isoenzimas hepáticas CYP3A4, CYP3A5 Y CYP2C8. El metabolito reactivo tiene una gran importancia, ya que es activo farmacológicamente y tiene un potencial tóxico debido a su capacidad de formar aductos covalentes de proteínas. Los niveles que presenta en el plasma contiene una variabilidad interindividual y esto corresponde al 15-55% y 5-81% de la concentración total de la Carbamazepina en adultos y niños, respectivamente [18].
El mecanismo de acción no está bien dilucidado se ha sugerido la unión a los canales de sodio y tiene interacciones con los canales de calcio y potasio. Igualmente, aumenta el efecto inhibitorio de GABA y disminuye el efecto excitatorio del glutamato [19].
Antes de entrar a hablar sobre los efectos adversos, se tiene que mencionar la farmacogenética de la carbamazepina dada la importancia y relación con la respuesta interindividual a la medicación y así mismo con los efectos adversos. La farmacogenética tiene como objetivo explicar el rol de las variaciones genéticas en las respuestas a la farmacoterapia y así mismo que efectos adversos tienen una mayor probabilidad de manifestarse. Los estudios que evalúan la farmacogenética de los efectos adversos incluyen una variación en genes que codifican enzimas transportadoras y genes relacionados con la inmunidad (i.e. alelos HLA) para los efectos adversos idiosincrásicos [20-22].
Para los efectos adversos inducidos por la Carbamazepina la mayoría de los estudios han evaluado la asociación de los alelos HLA con reacciones de hipersensibilidad, Síndrome de Stevens-Jhonson y necrólisis epidérmica tóxica [22].
Siendo así, la literatura ha reportado tres principales efectos adversos graves o severos, según la clasificación de la OMS de tipo B son: dermatológicos, hepáticos y hematológicos.
Efectos adversos cutáneos
Se han reportado que el 16% de los pacientes tratados con drogas antiepilépticas presentan reacciones cutáneas y 1/10 000 pueden sufrir efectos adversos cutáneos severos. Están relacionadas principalmente con los medicamentos antiepilépticos aromáticos. El riesgo varió entre los antiepilépticos usados y se ha estimado que el 11% está relacionado con la carbamazepina con un mayor riesgo que la fenitoína, fenobarbital y ácido valproico [23, 24].
Adicionalmente, los efectos adversos cutáneos aumentan con la edad. En un estudio en pacientes con epilepsia de novo, el 19% de los expuestos a la carbamazepina fueron retirados por rash cutáneo a pesar de utilizar dosis bajas en las primeras 2 semanas (100 mg/día) [25].
Hay varios tipos de reacciones de hipersensibilidad que puede producir efectos adversos cutáneos. Algunos pueden ser severos como el síndrome de Stevens-Johnson (SJS), el síndrome de DRESS (Reacción a las drogas con eosinofilia y síntomas sistémicos) y la necrólisis epidérmica tóxica (NET). Con respecto al síndrome de DRESS en relación al uso de carbamazepina, se presenta entre la segunda y sexta semana de administración y es uno de las antiepilépticos más comunes que induce los efectos adversos dermatológicos, en un estudio retrospectivo se ha reportado que el 5-20% de los casos de DRESS son causado por la carbamazepina y con una ocurrencia del 44% de pacientes, incluidos los reportes de casos [26].
Existen unos factores de riesgo relacionados a los efectos adversos-cutáneos. El alelo HLA-B*15:02 está estrechamente asociado al SJS/NET en pacientes con ascendencia asiática. Adicionalmente, la edad cumple un papel importante como se había mencionado anteriormente. Se ha reportado diferencias en el metabolismo del fármaco, en especial la reducción de la conjugación glucurónica en niños a diferencia de los adultos y adultos mayores en quienes las reacciones por las isoenzimas CYP son más lentas. Otros riesgos como el sexo, las hormonas, la titulación del fármaco, el uso de medicamentos concomitantes son factores de riesgo para presentar los efectos adversos cutáneos [27].
Se ha reportado que el uso de la titulación gradual ayuda a prevenir los efectos adversos cutáneos y adicionalmente previene las reacciones de hipersensibilsidad. Se debe evitar el uso de carbamazepina en pacientes que presentaron reacciones cutáneas previas o a otros antiepilépticos aromáticos como la lamotrigina. Asimismo, se debe ser cuidadoso en la formulación en pacientes cuyos familiares han presentado efectos adversos cutáneos a los antiepilépticos aromáticos, ya que se reporta una probabilidad del 25% de presentar una reacción similar [27].
Efectos adversos hepáticos
La enfermedad hepática inducida por fármacos (DILI) por sus siglas en inglés, es causada por una exposición a un medicamento y se clasifica en tres formas: hepatocelular, colestásica o mixta, correlacionada a las enzimas hepáticas. La duración de estas manifestaciones y lesiones hepáticas son variables, las cuales pueden durar de 30-90 días y se pueden presentar en las 3 clasificaciones anteriormente mencionadas. Existen varios criterios para clasificar la hepatotoxicidad, sin embargo, según la fórmula definida por el Council for International Organizations of Medical Sciences y modificadas por la FDA, estos patrones de injuria se pueden distinguir por un R (ratio) (tabla 1), el cual se representa por la fórmula [28]
Tabla 1 Fórmulas para clasificar los tipos de lesión hepática inducida por drogas acorde al patrón de lesión.
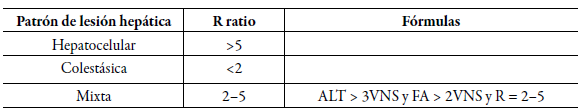
FA, fosfatasa alcalina; ALT alanino aminotransferasa; VNS, valores normales superiores.
Es importante tener en mente que el uso de rutina de carbamazepina puede llevar a una elevación de la gamma glutamil transferasa (GGT) y en menor medida la fosfatasa alcalina (FA), esto está relacionado por la propiedad inductora enzimática del fármaco, más que una lesión celular per se. Igualmente, las lesiones hepáticas pueden ser parte de los síndromes de hipersensibilidad ya descritos como el síndrome de DRESS.
La lesión hepática inducida por carbamazepina es rara pero sus consecuencias pueden ser muy serias incluso fatales o requerir de trasplante hepático causado por falla hepática aguda [19]. Las lesiones hepáticas son usualmente autolimitadas, con resolución de los síntomas (fiebre, náuseas, dolor en hipocondrio derecho) posterior a unos días de suspender el fármaco. Igualmente, con la normalización de los niveles de enzimas hepáticas, el cual ocurre alrededor de las 4 semanas [30, 31].
Efectos adversos hematológicos
Los trastornos hematológicos severos asociado al uso de carbamazepina incluyen la anemia aplásica, agranulocitosis y pancitopenia. Con una incidencia de 1:38 000 a 1:10 800 [32]. La anemia aplásica es un trastorno de las células hematopoyéticas caracterizado por pancitopenia de la sangre periférica y de la médula ósea. Su aparición es idiosincrática, no obstante, es uno de los efectos adversos más temidos dado a una mortalidad cercana al 10% [33].
Un estudio retrospectivo de casos y controles, reportó que la exposición a carbama-zepina y a ácido valproico fue asociado con un aumento del riesgo de nueve veces de presentar anemia aplásica [34]. No se conoce con claridad los mecanismos por los que se induce la anemia aplásica por estos medicamentos. Sin embargo, se ha propuesto una respuesta inmunológica causada probablemente por los metabolitos tóxicos [35].
Los síntomas que se manifiestan están relacionados con la anemia y la trombocitopenia, y en menor medida relacionados con las infecciones secundarias a la neutropenia. Aun así, la reducción de las células en sangre periférica puede ser un hallazgo sólo cuando se monitoriza con laboratorios. Por lo tanto, los exámenes hematológicos de rutina son importantes para realizar un diagnóstico precoz y descontinuar el fármaco para mejorar el pronóstico de la enfermedad [36].
El tratamiento para la anemia aplásica es el trasplante hematopoyético de células madre, pero solo está indicado en paciente menores de 50 años que tengan familiares compatibles como donantes. Para los pacientes entre la edad de 50 a 60 años que no tiene un donante idéntico en la familia, se encuentra la inmunosupresión como terapia principal.
Otros de los efectos adversos hematológicos son la agranulocitosis y la aplasia pura de células rojas, es poco común e igualmente grave. La agranulocitosis es definida como una disminución de los granulocitos en sangre (conteo de neutrófilos <0.5 x 109/L). La agranulocitosis inducida por carbamazepina puede iniciar a los 7 días de inicio del tratamiento. Con respecto a la aplasia pura de células rojas es una condición extremadamente rara y se desarrolla en su mayoría varios meses posteriores al inicio de tratamiento con carbamazepina (2-7 meses). Mejora dentro de los 10 días posteriores a la suspensión de la medicación [39].
Ácido valproico (VPA)
Fue sintetizado hace más de un siglo, usado inicialmente como disolvente para compuestos orgánicos, hasta 1963 cuando Pierre Eymard descubrió sus propiedades anti-convulsivantes, fue utilizado con este fin en Francia (finales de la década de 1960), así como en el Reino Unido (1972) y los Estados Unidos (1978). Su utilidad como estabilizador del estado del ánimo fue demostrada por primera vez por Lambert y colegas en 1966; actualmente como monoterapia se considera un fármaco con una eficacia equivalente al litio y los antipsicóticos atípicos para el tratamiento de la manía aguda, con una mejor tolerabilidad; por lo cual las guías internacionales recomiendan su uso para el tratamiento agudo y a largo plazo del trastorno bipolar [40].
Se han encontrado últimamente, otras propiedades farmacocinéticas de este medicamento, demostradas mediante algunas investigaciones, entre las cuales destaca el efecto directo sobre los canales de sodio dependientes de voltaje o la alteración del entorno de la membrana de los mismos. Además, se ha demostrado que el VPA al parecer regula la actividad excitatoria de los receptores de glutamato NMDA y su acción inhibitoria sobre la desacetilasa, modula la regulación epigenética de la expresión de genes neuronales [40].
El ácido valproico se puede administrar por vía intravenosa, oral y rectal. La administración intravenosa es puramente experimental y, de hecho, sólo se ha utilizado en voluntarios sanos en el contexto de estudios de biodisponibilidad en formulaciones de ácido valproico oral. La vía oral es, por mucho, la más utilizada, y en la mayoría de los países se dispone ahora de una variedad de formulaciones diferentes de ácido valproico (jarabe, solución oral, tabletas simples, tabletas con recubrimiento entérico, formulaciones de liberación lenta) [2]. Este medicamento se absorbe rápidamente después de la administración oral cuando se administra en forma de tableta convencional; Se alcanzan las concentraciones plasmáticas máximas en 4 horas después de la administración del fármaco, en la mayoría de los casos entre 1 y 2 horas. La absorción de ácido valproico se retrasa un poco si el fármaco se toma después de una comida. Después de un desayuno estándar el tiempo de retraso de la absorción del comprimido con recubrimiento entérico se prolonga de 2 a 4,5 horas y la concentración máxima se retrasa de 3 a 7,5 horas, sin embargo, la biodisponibilidad no se altera cuando la tableta con cubierta entérica se toma después de la comida [42].
Dado que la administración de ácido valproico con el estómago vacío puede causar irritación gástrica local debido a la transformación del fármaco en ácido libre, se han desarrollado preparaciones con recubrimiento entérico que dan como resultado la liberación de ácido valproico en el intestino delgado. Con estas preparaciones se observa un tiempo de retraso de absorción de 1 a 2 horas, después de lo cual la absorción parece producirse sin inhibición. En consecuencia, la tableta con recubrimiento entérico no es una forma de liberación sostenida de ácido valproico [43].
Con respecto al volumen aparente de distribución del ácido valproico, este es determinado a partir de la concentración plasmática total que está entre 0,1 y 0,4 L/kg. Este pequeño volumen de distribución de 8 a 10 L indica que la distribución está restringida a la circulación y al agua extracelular rápidamente intercambiable. Los estudios autorradiográficos en ratas han demostrado que el ácido valproico se distribuye rápidamente alcanzando algunas estructuras cerebrales pocos minutos después de la administración. Las concentraciones máximas en el cerebro se produjeron después de 30 minutos en las ratas, mientras que en los ratones las concentraciones máximas en el cerebro estuvieron presentes después de 15 minutos. Los estudios de distribución regional en ratones mostraron que el ácido valproico se distribuyó de manera homogénea en el cerebro, excepto por el cerebelo donde la sustancia blanca mostró más actividad que la corteza. El fármaco pareció localizarse preferentemente en aquellas estructuras con los mayores niveles de actividad de la enzima degradante del ácido aminobutírico (GABA) [43].
El ácido valproico se une extensamente (90% en promedio) a las proteínas plasmáticas, principalmente albúmina, dado que es la concentración de fármaco libre la que se supone que está en equilibrio con la concentración de fármaco en el sitio del receptor. La información sobre el grado de unión del ácido valproico en el paciente individual es esencial para la interpretación de la concentración plasmática del fármaco. En sujetos sin enfermedad asociada (p. ej., hígado, riñón) y en aquellos que reciben ácido valproico como terapia con un solo fármaco, la variación interindividual en la unión a proteínas es relativamente pequeña a concentraciones plasmáticas terapéuticas bajas, la unión a proteínas del ácido valproico es, sin embargo, reducido a concentraciones de alrededor de 100 mg/ml y superiores con un aumento de más del 50% en la fracción de fármaco libre a altas concentraciones terapéuticas. La reducción de la unión a proteínas se asocia con concentraciones de fármaco totales más bajas en estado estacionario, hecho que puede explicar por qué la relación dosis-concentración plasmática del ácido valproico no es lineal a dosis más altas [43].
El aclaramiento plasmático del ácido valproico está en el intervalo de 5 a 10 ml/min. El aclaramiento plasmático total es el producto del flujo sanguíneo hepático y el índice de extracción hepática. El ácido valproico es un fármaco de eliminación restrictiva, lo que significa que solo se puede eliminar el fármaco no unido. Cuando se calcula el aclara-miento plasmático del ácido valproico para el fármaco libre, se obtiene un aclaramiento medio de 77 ± 33 ml/min [43].
Se ha informado que la vida media de eliminación plasmática del ácido valproico es de entre 8 y 15 horas o entre 12,2 (±3,7) horas y 14 horas, cuando el fármaco se administró a sujetos sanos o, a pacientes epilépticos que estaban recibiendo ácido valproico solo. La disminución de la concentración plasmática de ácido valproico fue obviamente bifásica, indicando que debe aplicarse un modelo abierto de 2 compartimentos en lugar de uno para describir adecuadamente su farmacocinética. Dado que en muchos pacientes la parte aparentemente logarítmica lineal de la curva del nivel plasmático no comienza antes de las 12 horas posteriores a la administración oral, el cálculo correcto de la vida media de eliminación sólo puede realizarse utilizando concentraciones plasmáticas obtenidas después de 12 horas.
La semivida plasmática fue idéntica cuando se determinó en el mismo sujeto después de una dosis única y después de dosis múltiples, lo que sugiere que no se produce ni autoinducción ni saturación del metabolismo del ácido valproico [43].
La vía renal es de menor importancia para la eliminación del ácido valproico, ya que sólo el 1,8% de una dosis oral única y el 3,2% de una dosis en la situación de dosis múltiples se excretan en la orina como fármaco inalterado. A partir de estos datos, se podría concluir que la insuficiencia renal no debería afectar en gran medida la disposición del ácido valproico. Sin embargo, si se forman metabolitos activos durante el metabolismo del ácido valproico, estos bien podrían acumularse en la insuficiencia renal y contribuir a su efecto farmacológico [43]
Se ha encontrado que el ácido valproico provoca una mayor disponibilidad de ácido gamma-aminobutírico (GABA), un neurotransmisor inhibidor, para las neuronas cerebrales o puede mejorar la acción de GABA o imitar su acción en los sitios receptores postsinápticos. También bloquea los canales de sodio dependientes del voltaje, lo que da como resultado la supresión de la descarga neuronal repetitiva de alta frecuencia [44].
Más recientemente, algunas investigaciones han demostrado otras propiedades farmacodinámicas del compuesto, incluido un efecto directo sobre los canales de sodio dependientes de voltaje o la alteración del entorno de la membrana de los canales de sodio. El VPA también parece regular la actividad excitatoria de los receptores de glu-tamato NMDA y modula la regulación epigenética de la expresión de genes neuronales mediante la inhibición no selectiva de la histona desacetilasa [40].
Este medicamento es comúnmente utilizado para el tratamiento de la epilepsia. Los mejores resultados se observan en las epilepsias sintomáticas generalizadas, parciales y según la localización. Además, el VPA es útil en el trastorno bipolar, la migraña y el dolor por neuropatía diabética. El valproato ofrece la ventaja de tener menos efectos adversos molestos que los anticonvulsivantes más antiguos [45].
A continuación, se referencian los resultados de algunos estudios de relevancia e interés clínico con respecto a los eventos adversos graves.
Efectos adversos hematológicos
Trombocitopenia
Se desconoce el mecanismo exacto a través del cual el ácido valproico puede causar trombocitopenia; puede ser causado por una mayor alteración de las plaquetas, así como por la formación de anticuerpos que destruyen las mismas o por una disminución de la producción debido a un efecto tóxico directo sobre la médula ósea [40].
Un estudio con una muestra de 126 pacientes psiquiátricos adultos informó una pre-valencia de trombocitopenia del 5% (<150 000 /µL) con un aumento significativo del riesgo en mujeres en caso de concentraciones séricas> 80 µg/mL; además, cada aumento de 10 µg/ml en los niveles séricos del fármaco se asoció con una disminución de 17 unidades /µl en el recuento de plaquetas. Otra encuesta con 264 pacientes psiquiátricos informó una prevalencia de trombocitopenia del 12%, siendo los ancianos los que tenían el mayor riesgo, especialmente con una dosis de VPA> 1 g/día Trannel et al. confirmaron en una pequeña muestra de 39 pacientes psiquiátricos que los pacientes ancianos experimentaron trombocitopenia con más frecuencia que los más jóvenes durante el tratamiento con VPA (54%) frente al (13%) [40].
Es importante tener en cuenta ciertas precauciones a la hora de prescribir este compuesto debido a que la trombocitopenia asociada a VPA parece estar relacionada con dosis altas de la medicación, la edad avanzada, y sexo femenino, por lo que es pertinente la vigilancia de este aspecto en pacientes femeninas de edad avanzada con dosis > 1 g/día, además se debe recordar que los pacientes de edad avanzada con frecuencia se encuentran recibiendo múltiples terapias que puedan elevar el riesgo de trombocitopenia [40].
Efectos adversos cutáneos
El síndrome de Stiven Johnson y necrólisis epidérmica tóxica son las reacciones adversas cutáneas raras pero fatales del VPA. La incidencia del síndrome de Stiven Johnson y necrolisis epidérmica tóxica pareció ser de 1 a 6 casos por millón de personas por año y de 0,4 a 1,2 casos por millón de personas por año, y se encontró que la tasa de mortalidad era de 10 y 45%, respectivamente [46].
El alelo del factor de predisposición genética HLA-B * 15:02 aumenta el riesgo de síndrome de Stevens-Johnson y necrólisis epidérmica tóxica en pacientes con tratamiento con ácido valproico. Este alelo se encuentra solo en el 10-15% de las poblaciones que pertenecen a China, el sur de Asia y el sudeste de Asia. Un error innato del metabolismo es otro factor de riesgo de reacciones idiosincrásicas graves causadas por ácido valproico. La aparición de SSJ se observa cada vez más en pacientes a los que se les ha añadido recientemente lamotrigina a su tratamiento [46].
Metabólicos y endocrino
Hiperamonémia
La encefalopatía hiperamonémica secundaria al uso de valproato es rara sin evidencia de hepatotoxicidad y generalmente se presenta con confusión, agitación, irritabilidad, alteraciones cognitivas, letargo, coma y muerte [47].
Una encuesta transversal retrospectiva de pacientes de hospitales generales, encontrados en las bases de datos de laboratorios y farmacias del hospital se combinaron para identificar una cohorte de todos los pacientes tratados con ácido valproico que desarrollaron hiperamonemia durante un período de 5 años [48]. 20 de 793 (2,52%) pacientes tratados con ácido valproico tenían signos y síntomas compatibles con hiperamonemia. La mayoría eran hombres blancos con múltiples agentes psicotrópicos. El valproato se suspendió adecuadamente en 8 (40%) pacientes [48].
Los resultados del estudio indican que la hiperamonemia puede ser más común en pacientes psiquiátricos de lo que se suponía anteriormente, pero no se reconoce ni se trata adecuadamente. El diagnóstico de hiperamonemia requiere un alto índice de sospecha. El resultado es favorable una vez que se reconoce y se trata adecuadamente [48].
Pancreatitis.
Los fármacos son responsables del 0,1 al 2% de los incidentes de pancreatitis aguda. El ácido valproico es uno de los medicamentos que más comúnmente puede provocar pancreatitis aguda, con una incidencia significativa en niños y jóvenes que conduce en algunos casos a la muerte del paciente [45].
Litio
Es un catión monovalente que pertenece al grupo de los metales alcalinos, no se encuentra libre en la naturaleza debido a la disposición especial de sus electrones, y la alta densidad de la carga positiva de su núcleo; sin embargo, se puede encontrar en aguas minerales, en tejidos animales, y en pequeñas cantidades en plantas de agua de mar [49]. Dentro de las sales de litio, se destaca carbonato de litio, siendo la forma más utilizada, debido a su ventaja práctica por sobre las demás sales (cloruro, citrato y sulfato); puesto que su anión pesa aproximadamente la mitad, además de su mayor conveniencia en costo, obtención y administración [50].
Esto significa que se pueden contener cantidades relativamente grandes de litio en una tableta o cápsula de carbonato de litio de tamaño adecuado. La sal de carbonato es una sal blanca, inodora, amorfa o microcristalina. Se presenta en forma de comprimidos o cápsulas, cada una de las cuales contiene 300 mg de sal de carbonato, equivalente a 8,1 mEq de litio. Recientemente se han planteado algunas objeciones contra el carbonato de litio debido a su relación química con el carbonato de sodio, por lo que se teme que pueda producir corrosiones de las mucosas [50].
El carbonato de litio se absorbe rápidamente en el tracto gastrointestinal y menos del uno por ciento se elimina con las heces [51]. El nivel máximo en suero se alcanza en dos a cuatro horas; el nivel sérico aumenta de 0,2 a 0,4 mEq por litro después de la administración de 300 mg. de carbonato de litio y 0,3 - 0,6 mEq por litro después de 600 mg [50].
Pueden producirse algunos efectos secundarios luego de la absorción de esta medicación que son de corta duración y que coinciden con el nivel sérico máximo: Náuseas, vértigo, sensación de aturdimiento y debilidad muscular [50]. El litio no se une a las proteínas plasmáticas. Su distribución se aproxima a la del agua corporal total, pero difiere de la del sodio y el potasio. Schou cree que tiene una influencia única sobre los mecanismos de transporte de sodio [49], puede reemplazar el ion sodio en la producción de un potencial de acción. Una vez intracelular, su eliminación es lenta y se acumula en la membrana celular. Los mecanismos de transporte de sodio se ralentizan e incluso pueden detenerse [51]. El patrón de retención y distribución de iones de litio se estudió en pacientes deprimidos y se encontró que se aproxima más al de los normotímicos que al de los pacientes maníacos. Los pacientes con manía aguda retienen más iones de litio y lo distribuyen de manera diferente en el agua corporal total que los pacientes normotímicos [52, 53].
El litio se elimina del cuerpo principalmente en la orina, aunque se pueden detectar trazas en el esputo, las lágrimas, el líquido seminal, el sudor y las heces. Un estudio reciente de McDonald, Dransfield et al. [51] en un grupo de catorce pacientes maníacos informó que durante los primeros nueve días del tratamiento con litio y los primeros tres días después de la interrupción del tratamiento, el 78-79 % de la dosis total de litio se puede recuperar en la orina. Una investigación similar de diez sujetos normales muestra que la recuperación del litio fue del 86-91%, siendo significativamente más alta que la del grupo de los pacientes con TB en fase maníaca. El aclaramiento renal de litio permanece constante en circunstancias normales, pero disminuye con la edad y con una menor ingesta de sodio. Tiene un tiempo de eliminación medio de aproximadamente 24 horas y el nivel de litio en suero cae en un 50 % en ese tiempo.
El litio se filtra por los glomérulos, el 80% del litio filtrado se reabsorbe en los túbulos contorneados proximales [14], probablemente por el mismo mecanismo responsable de la reabsorción de sodio; una ingesta baja de sal que da como resultado una concentración tubular baja de sodio aumentará la reabsorción de litio y podría resultar en su acumulación y aparición de niveles de toxicidad. Se ha descubierto que la clorpromazina aumenta la excreción del fármaco [50].
Se desconoce el mecanismo de acción preciso en los trastornos del estado de ánimo. Tradicionalmente se pensaba que alteraba el transporte de cationes a través de las membranas celulares en las células nerviosas y musculares, influía en la recaptación de serotonina o norepinefrina e inhibe los sistemas de segundos mensajeros que implican el ciclo del fosfatidilinositol [54]. También puede proporcionar efectos neuroprotectores al aumentar la depuración de glutamato, inhibir la actividad apoptótica de la glucógeno sintasa quinasa, aumentan los niveles de proteína antiapoptótica Bcl-2 y mejorar la expresión de factores neurotrópicos, incluido el factor neurotrófico derivado del cerebro [55].
La eficacia del litio para tratar la manía se descubrió en 1949, lo que lo convirtió en el primer medicamento desarrollado específicamente para tratar el trastorno bipolar [56]. El litio sigue siendo un pilar del tratamiento del trastorno bipolar, especialmente para la manía aguda y el tratamiento de mantenimiento. Además, el litio parece reducir el riesgo de suicidio en pacientes con trastorno bipolar [57].
Reacciones adversas graves
Aunque no se han aclarado los mecanismos terapéuticos específicos del litio en la regulación del estado de ánimo, recientemente se ha sugerido que el litio ejerce sus efectos estabilizadores del estado de ánimo ejerciendo efectos neuroprotectores. La vía de señalización GSK-3 modula la apoptosis y la plasticidad sináptica, con una mayor actividad que apoya la apoptosis y una actividad atenuada que mejora la neuroplasticidad y la resiliencia celular. Se ha demostrado que la manipulación de la vía GSK-3 produce efectos tanto antimaníacos como antidepresivos, y los genes que regulan la GSK-3 se han implicado en la etiología del BD. Se considera que el litio influye en numerosas vías neuroprotectoras aumentando la GSK3ß fosforilada e inhibiendo su acción, mejorando los efectos de la excitotoxicidad. Estudios previos han informado que la respuesta al tratamiento con litio puede ser predicha por la expresión y fosforilación del gen GSK3β y los aumentos inducidos por el litio en GSK3 β fosforilada se correlacionan con la mejoría de los síntomas [58].
El litio tiene efectos adversos renales, a nivel de la glándula tiroides y de las glándulas paratiroides, por lo que es necesario controlar las funciones de estos órganos mediante análisis de sangre periódicos [58].
Efectos adversos renales
Diabetes insípida nefrogénica
Días o semanas después de la administración de litio en dosis psiquiátricas, casi el 50% de los pacientes presentan algún grado de poliuria. Entre el 15% y el 20% de los pacientes desarrollan diabetes insípida nefrogénica (NDI), caracterizada por la pérdida de la capacidad del riñón para concentrar la orina debido a la resistencia a la vasopresina. La NDI incontrolada puede producir alteraciones de líquidos y electrolitos, como hipo-volemia, hiponatremia, acidosis metabólica hiperclorémica y acidosis tubular renal distal. Se han propuesto múltiples mecanismos para explicar la NDI inducida por litio. La entrada de litio mediada por el canal de sodio epitelial (ENAC) en las células principales del conducto colector parece contribuir [59].
Se considera que el litio es una de las causas más comunes de NDI adquirida, con tasas de NDI manifiesta que son aproximadamente del 12% observadas en aquellos tratados con litio durante 15 años y tasas de deterioro menor, como poliuria o capacidad de concentración renal deteriorada que se observa en 19% y 54% respectivamente. El desarrollo de NDI manifiesta se caracteriza por polidipsia, la producción de cantidades excesivas de orina, 3000 ml en 24 horas, y una osmolalidad de la orina diluida <300 mOsm/kg. El defecto en la capacidad de concentración urinaria puede verse tan pronto como 2 a 4 meses después del inicio de la terapia con litio, pero generalmente se vuelve más evidente con duraciones más largas de la terapia. Suele ser reversible con el cese de la terapia con litio, pero puede volverse irreversible con una terapia prolongada [59].
Enfermedad renal crónica.
La aparición de insuficiencia renal es especialmente problemática a largo plazo. La insuficiencia renal no solo es un factor de riesgo para la aparición de enfermedades cardiovasculares, sino que también puede hacer necesario sopesar el equilibrio entre los pros y los contras de continuar la terapia con litio.
Aunque varios informes sugieren poco efecto del litio sobre la función renal, otros estudios estiman la prevalencia de la enfermedad renal crónica (ERC) entre los usuarios de litio entre 10 y 35% [51].
Los primeros informes de que el litio tiene un efecto deletéreo sobre la función renal aparecieron por primera vez en la década de 1970 con una serie de casos de pacientes con nefropatía tubulointersticial crónica en la biopsia renal atribuida al litio. La nefropatía inducida por litio parece ser una enfermedad de progresión lenta. El período de latencia promedio desde el inicio del litio hasta la presencia de ERC es de al menos 20 años, y más del 80% de los pacientes con litio como la causa principal de su ERC han estado con litio durante más de 20 años. Otros estudios han demostrado que después de una duración media del tratamiento de 6,5 años, solo el 4% de los pacientes presentarán una elevación de la creatinina sérica, mientras que después de 19 años de tratamiento, esta proporción aumentará al 12% de los pacientes. La incidencia de ERC que se cree que se debe al litio es muy baja, estimada entre 0,2 y 0,7% según ANZDATA 2000, sin embargo, esto todavía representa un riesgo casi ocho veces mayor de ERC en comparación con la población general. Se ha sugerido que la tasa de disminución de la TFG es de alrededor de 0,92 ml/min/1,73m 2 por año de tratamiento con litio y parece ser mayor en las mujeres que en los hombres. También es mayor en los ancianos, aquellos con una mayor duración de exposición al litio y una dosis acumulada de litio más alta. Existe una mayor incidencia de ERC en estadio 3 en aquellos pacientes que toman litio a largo plazo en comparación con la población general, con estimaciones que sugieren que entre el 21 al 55% de los usuarios de litio a largo plazo tienen TFG que se encuentran en esta categoría [60].
Deterioro cognitivo.
Los efectos negativos sobre la cognición de un medicamento son sumamente angustiantes para los pacientes. Los primeros estudios describieron el embotamiento cognitivo (y afectivo) del litio, que mostró un patrón claro de respuesta a la dosis. Además, se concluyó que el litio causa amnesia anterógrada, movimiento motor levemente lento y creatividad disminuida. La disminución de la creatividad, mejor demostrada por un estudio intermitente de asociaciones idiosincrásicas, puede ser particularmente problemático para el subconjunto de pacientes bipolares involucrados en profesiones creativas, como la escritura, la música y el arte [61].
Cáncer.
La presentación de cáncer asociada al uso de litio, no se había relacionado de manera consistente ; sin embargo, en 2015 en un documento publicado por la Agencia Europea de Medicina basado en el Comité de Evaluación de Riesgos de Farmacovigilancia, concluyó que hay evidencia suficiente para considerar que el uso prolongado de litio podría inducir tumores renales microquistes, oncocitomas y carcinomas renales del conducto colector [62].
Litio y embarazo.
La bioexposición al carbonato de litio durante periodos de maternidad, también ha evidenciado eventos adversos en el lactante. Entre los mencionados destacan las alteraciones tiroideas, hipotermia o hipotonía [63].
Efectos adversos de los estabilizadores del ánimo en pacientes con covid 19.
El brote actual del síndrome respiratorio agudo severo coronavirus-2 (SARS-CoV-2) se informó por primera vez en la ciudad china de Wuhan el 31 de diciembre de 2019. La propagación del SARS-CoV-2 fue categorizada como pandemia por la OMS el 11 de marzo de 2020; en septiembre de 2020 aproximadamente 54 millones de personas habían sido infectadas con el virus y más de 1,3 millones de personas habían muerto [64-67].
Los pacientes con Covid-19 pueden ser tratados con psicofármacos por dos razones principales. En primer lugar, los antipsicóticos se utilizan para tratar las consecuencias neuropsiquiátricas del SARS-CoV-2. En segundo lugar, los pacientes con trastornos preexistentes que desarrollan Covid-19 continuarán su tratamiento psicotrópico durante el curso de la infección [67].
El Covid-19 representa un desafío importante en el campo de la psiquiatría, ya que tanto el virus como los medicamentos utilizados para tratarlo pueden inducir síntomas neurológicos y psiquiátricos [68]. En un estudio poblacional de todos los residentes de hogares de ancianos en Ontario, Canadá; se encontró un aumento en la prescripción de psicotrópicos al inicio de la pandemia de Covid-19 que persiste hasta septiembre de 2020 [65].
Dentro de los hallazgos reportados se encontró que los efectos adversos y toxicidad del ácido valproico está estrechamente relacionada con la función hepática alterada, pero sigue siendo compleja [70, 71]. En un estudio informaron sobre una pequeña muestra de pacientes con Covid-19 en los que un tercio de los pacientes presentaban una función hepática anormal [72]. Estos pacientes tenían más probabilidades de ser hombres y tenían niveles más altos de procalcitonina y proteína C reactiva. La elevación de las enzimas hepáticas fue subnormal al nivel habitual de tres veces. Schaefer y sus colegas describieron varios mecanismos combinados en respuesta a las infecciones por SARS-CoV-2 que podrían explicar el impacto en la función hepática [73]: el efecto viral directo del SARS-COV-2 en el hígado, una respuesta inflamatoria localizada y sistémica, lesión muscular, isquémica, miocardiopatía y lesión hepática inducida por fármacos, como es posible con el ácido valproico [67].
Una revisión sistemática que siguió las directrices sobre elementos de notificación preferidos para revisiones sistemáticas y metaanálisis (Prisma) donde se encontró un caso de hiperamonemia por ácido valproico una semana después de la introducción del fármaco (1500 mg/día), el paciente presentó desorientación espacial, confusión leve con estado de estupor y retraso psicomotor severo asociado a mioclonía negativa bilateral y simétrica en ambos brazos. El tratamiento con ácido valproico solo se interrumpió durante un día después de una rápida mejora de la conciencia tras una dosis de lactitol (laxante osmótico). Se consideró el caso como una posible precipitación de encefalopatía por infección por SARS-CoV-2 [67]. Sheehan et al. informaron de un paciente con trastorno bipolar en tratamiento de mantenimiento con ácido valproico que experimentó síntomas de manía pocos días después de iniciar el régimen antivírico ritonavir y lopinavir, posiblemente debido a una disminución en la concentración sérica del valproato, También de acuerdo con las directrices de los NIH, el AUC el lopinavir aumenta en aproximadamente un 75% su concentración con el uso concomitante de ácido valproico. Por lo tanto, los pacientes bajo terapia combinada deben ser monitoreados por la toxicidad de lopinavir y la respuesta virológica [69].
Según la revisión de la literatura se encontró que el litio se tenía en cuenta como una posible alternativa terapéutica para la infección por SARS-CoV-2 debido a su uso como medicación antiviral, principalmente en terapia combinada; El fundamento de la combinación de cloruro de litio y rapamicina consiste en reducir la posibilidad de replicación viral en su nivel más bajo al reducir la entrada viral a las células y la síntesis de ARN viral (el efecto del litio debido a la inhibición de la síntesis de proteínas a través de la desactivación de la glucógeno sintasa quinasa 3ß), debido al estrecho margen terapéutico del litio, las distintas interacciones medicamentosas en pacientes polime-dicados, la deshidratación y disminución de la función renal, además la hipotensión, la hipoxemia, la sepsis y los fármacos nefrotóxicos que surgen en el contexto de Covid-19 pueden aumentar los efectos adversos y la toxicidad por litio. Dado que el litio es secretado principalmente por los riñones, el riesgo de lesión renal aguda en el contexto de la infección por coronavirus es un problema importante [69, 70].
Debido a la limitada evidencia disponible y la reciente diversidad genómica y evolución del SARS-CoV-2, resulta difícil obtener recomendaciones basadas en la evidencia para el uso de psicofármacos en el contexto de la infección por este virus. En el estado actual de los conocimientos, no existe ninguna contraindicación para ningún fármaco psico-trópico. Se requiere precaución con respecto a la dosificación y, en particular, el control del, litio y el valproato [66].
CONCLUSIONES
Los estabilizadores del ánimo en especial los antiepilépticos en el tratamiento del trastorno bipolar son importantes en el control y prevención de recurrencia de la patología. Sin embargo, los efectos adversos severos al ser poco frecuentes no son reportados en la literatura. Adicionalmente, por su poca frecuencia se pasan por alto los controles regulares como métodos de evaluación de dichos efectos adversos, que pueden ser potencialmente letales y pueden dejar secuelas en los pacientes.
En la revisión se encontró que los efectos adversos más predominantes de los estabilizadores del estado del ánimo son los cutáneos, siendo carbamazepina la más comúnmente asociada a este tipo de manifestaciones (reacciones de hipersensibilidad, casi el 50% de los casos reportados del síndrome de DRESS están asociados a ésta).
Los efectos adversos referenciados en la revisión de la literatura efectuada, permiten inferir que existe un riesgo potencial o considerable debido al uso crónico de los moduladores del estado del ánimo, relacionado con la dosis y el uso concomitante de dos fármacos como el ácido valproico y carbamazepina, que generan un mayor riesgo de efectos adversos dermatológicos.
Se considera pertinente en futuros estudios, tener en cuenta variables como el acervo genético de la muestra seleccionada y la predisposición a otras patologías que resulten de la sensibilidad a los estabilizadores del estado de ánimo.
Con respecto a los medicamentos utilizados para la infección por SARS-CoV-2 y su riesgo con el uso concomitante con los psicofármacos, la información aportada en las revisiones efectuadas de la literatura del momento actual, aportan más información sobre los antipsicóticos y antidepresivos, que en mayor medida reportan datos sobre su posibilidad de prolongación del intervalo QTc, cuando se utilizan en terapia combinada con medicamentos como la hidroxicloroquina, cloroquina, lopinavir-ritonavir y azitromicina; y muy poco sobre el riesgo con el uso simultáneo de los estabilizadores del estado de ánimo.
La evidencia sobre los efectos adversos de los estabilizadores del estado del ánimo está basada en estudios de serie de casos y frecuentemente se superpone con la toxicidad a estos fármacos, un gran número de estudios basan sus conclusiones en inferencias, pero concuerdan en su mayoría que hasta el momento no existe contraindicación para el uso de los mismos. Es importante a la hora de la prescripción de los fármacos estabilizadores del estado del ánimo, tener en cuenta el riesgo probable de interacción fármaco-fármaco con los medicamentos utilizados para el manejo de Covid-19, debido a su estrecho margen terapéutico.
La farmacogenómica que juega un papel importante en la incidencia de eventos adversos por los estabilizadores del estado de ánimo, que puede explicarse por la interindivi-dualidad y la relación del alelo HLA-B*15:02. Es necesario llevar a cabo investigaciones originales locales, en los cuales se pueda dimensionar la realidad de los riesgos con el uso de los estabilizadores del ánimo, ya que las características farmacogenéticas de nuestra población en el uso de este tipo de medicamentos, pueden dar un comportamiento particular respecto al beneficio/riesgo de estos.














