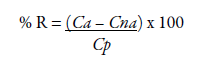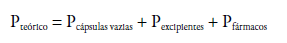INTRODUÇÃO
As Doenças Crônicas Não Transmissíveis (DCNTs) constituem importante problema de saúde pública no mundo, por serem a principal causa de morte da população. As DCNTs respondem pelas incapacidades dos indivíduos, baixa qualidade de vida, sobrecarga dos sistemas de saúde, aumento dos gastos com assistência médica e previdência social. [1,2]. As DCNTs têm preocupado a comunidade científica, pois a projeção para o ano de 2030 é de que estas responderão por 52 milhões de mortes global [3, 4]. A hipertensão arterial (HA), hipercolesterolemia e diabetes mellitus são consideradas as principais DCNTs [5].
O tratamento medicamentoso a custo aceitável possibilita controlar as DCNT, reduzindo a morbimortalidade melhorando a qualidade de vida das pessoas [6]. Fármacos anti-hipertensivos e antidiabéticos associados em uma mesma formulação, têm sido frequentemente prescritos e preparados de forma magistral [7]. A possibilidade de adquirir medicamentos com menor custo, diferentes dosagens e forma farmacêutica individualizada tem feito os consumidores procurarem as farmácias de manipulação [8-10]. Todavia, potenciais interações podem afetar a natureza química dos compostos, a solubilidade, a estabilidade das formulações e, podem ainda, afetar a segurança, eficácia e biodisponibilidade do medicamento [11].
Várias pesquisas relacionadas ao controle de qualidade vêm sendo realizadas, como o desenvolvimento de métodos analíticos eficazes e confiáveis [12-14]. Apesar disso, não foi encontrado na literatura científica, até o momento, métodos analíticos para associação ternária de fármacos antidiabéticos, anti-hipertensivos e antilipêmicos na mesa formulação. Dessa forma, o objetivo desse trabalho foi o desenvolvimento e validação de um método analítico por Cromatografia Líquida de Alta eficiência (CLAE) para a determinação quantitativa e simultânea de atorvastatina (ATO), losartana (LOS) e metformina (MET) em formulações farmacêuticas magistrais.
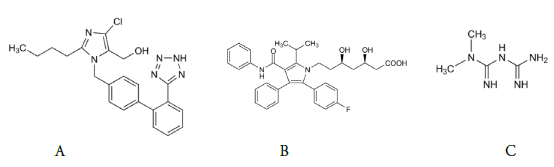
O LOS, quimicamente chamado de 2-Butyl-4-chloro-1-[[2'-(1H-tetrazol-5-il) [1,1'-bifenil]-4-il]metil]-1i/-imidazol-5-metanol, é um fármaco da classe dos antagonistas do receptor de angiotensina II (tipo AT1) utilizado para o tratamento da HA [3], apresenta alta solubilidade e baixa permeabilidade [15]. Trata-se de um fármaco que possúi dois pKas: pKa1 = 3,85 (base) e pKa2 = 5,85 (ácido), com aparência de um pó branco cristalino ou quase branco, facilmente solúvel em água, ligeiramente solúvel em isopropanol e pouco solúvel em acetonitrila, possui porcentagem de umidade < 0,5%, com faixa de fusão em torno de 263 °C a 265 °C [16]. A forma molecular do losartana é C22H23ClKN6O e massa molar de 422,91 g/mol [10]. A figura 1A ilustra a estrutura química do LOS.
O ATO, quimicamente chamado de [R-(R*,R*)]-2-(4-Fluorofenil)-ß,S-dihidroxi-5-(1-metiletil)-3-fenil-4-[(phenilamino)carbonil]-1H-pirrol-1-ácido heptanóico, é um fármaco da classe das estatinas, inibidor seletivo e competitivo da HMG-CoA redutase que reduz a produção do colesterol total [14, 17, 18]. É considerado um fármaco de baixa solubilidade e alta permeabilidade [4, 19, 20]. Apresenta-se como pó branco a quase branco, possui pKa 4,31 [21, 22], sendo muito pouco solúvel em água, pouco solúvel em etanol, levemente solúvel em acetonitrila e facilmente solúvel em metanol, com faixa de fusão entre 159,2 e 160,7 °C, pKa 4,46 e apresenta massa molar de 558,64 g/mol e fórmula molecular C66H68CaF2N4O10 [11]. A figura 1B ilustra a estrutura química do ATO.
O MTF ou A,A-Dimetilimidodicarbonimidico diamida é um fármaco hipoglice-miante da classe das biguaninas empregado no tratamento de diabetes mellitus não insulino-dependente para controle glicêmico, que age através da diminuição da absorção intestinal de glicose [23, 24]. Esse fármaco é descrito como um pó branco cristalino, facilmente solúvel em água, pouco solúvel em álcool etílico, com faixa de fusão de 222 °C a 226 °C [20]. Possui dois pKas: 2,8 e 11,5, com massa molar de =129,2 g/mol e fórmula molecular C4H11N5 [11]. MTF é considerado fármaco alta solubilidade e baixa permeabilidade [22-24]. A figura 1C mostra a estrutura química da metformina.
MATERIAL E MÉTODOS
Substâncias padrão de referência (SPR) e solventes
As matérias-primas empregadas como SPR ou padrão secundário de referência foram: atorvastatina cálcica (ATO) com pureza de 98,75 % e metformina (MET) com 100,02% de teor, foram adquiridas da distribuidora Gemini", enquanto Losartana potássica (LOS) foi adquirida da SM Empreendimentos Farm LTDA", com pureza declarada de 99,12 %. Todas as matérias-primas vieram acompanhadas do certificado de análise dos fornecedores e foram empregadas como tal, sem qualquer processo de purificação.
As amostras comerciais em forma de cápsula gelatinosa dura foram adquiridas em três farmácias de manipulação do comércio local. A composição das três fórmulas continha a associação dos mesmos fármacos nas mesmas dosagens teóricas: ATO (40 mg), LOS (50 mg) e MTF (500 mg). As formulações continham como os excipientes principais lauril sulfato de sódio, aerosil, celulose microcristalina, amido e carbonato de cálcio. Metanol (MeOH) da marca Sigma-Aldrich" e Dinâmica" foram de grau espectroscó-pico e água ultrapura foi obtida por sistema de filtração Direct-Q 3 UV" (18,2 [xO-cm-1, 25 °C - Merck Millipore", a qual empregada para o preparo de água acidificada a pH 3,0 com ácido ortofosfórico (grau analítico - Dinâmica").
EQUIPAMENTO E CONDIÇÕES CROMATOGRÁFICAS
O método foi desenvolvido e validado em um cromatógrafo modelo Dionex" Ultimate 3000 (Thermo Fisher Scientific, USA), equipado com detector de arranjo 33 de diodos (DAD) modelo Ultimate 3000 conectado ao software Chromeleon" 7.1 - Chromatography Data System, com "loop" fixo de 20 µL. As condições experimentais para a separação cromatográfica foram otimizadas com uma coluna Sigma-Aldrich" C18 (100 mm x 4,6 mm, 5,0 µm), no modo isocrático e em temperatura ambiente (25 ± 1,0 °C) com vazão de 0,3 mL-min-1. A fase móvel foi constituída por MeOH : H2O ácida (78:22 v/v), pH 3,0 ajustada com ácido ortofosfórico, com o peagâmetro Hanna Intruments" modelo pH/ ORP Edge. Os comprimentos de onda empregados foram 246 nm para ATO, 225 nm para LOS e 236 nm para MTF. A injeção foi de 20 µL e o tempo de corrida analítica foi menor que 8 minutos.
A melhor condição cromatográfica foi determina pela análise da conformidade do sistema, avaliando os parâmetros de pureza dos picos, o número de pratos, os fatores de assimetria, resolução e o tempo de retenção, conforme preconizado nos guias de validação de métodos cromatográficos [8].
Validação do método analítico
Para a validação do método cromatográfico desenvolvido, foram utilizados os seguintes guias como direcionamento: RDC 166/2017, a qual dispõe sobre a Validação de Métodos Analíticos, a Internacional Conference on Harmonization (ICH) e a Association of Official Analytical Chemists International (AOAC), segundo os parâmetros de linearidade, precisão, exatidão, limites de detecção (LD) e quantificação (LQ), robustez e seletividade. Os resultados foram estatisticamente analisados através dos softwares Microsoft Excel" (Microsoft, Washington-EUA) e OriginPro 9.0" (OriginLab, Northampton-UK).
Parâmetros analíticos
Linearidade
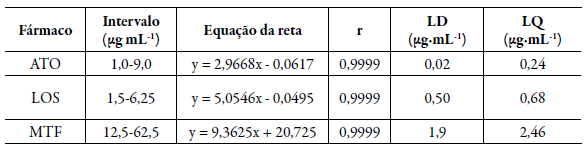
A linearidade do método foi avaliada através de curvas analíticas de calibração desenvolvida em triplicata à temperatura ambiente (25 ± 1,0 °C). Foram preparadas soluções de cada matéria-prima (ATO, LOS e MTF), primeiramente diluída com MeOH, em balões volumétricos de 100 mL, a partir de suas massas acuradamente pesadas em balança analítica Shimadzu" Ay 220. Diluições quantitativas foram feitas com MeOH:H2O (78:22 v/v), pH 3,0, a fim de obter as seguintes concentrações de soluções estoques: 100,0 µg-mL-1 para ATO, 150,0 µg-mL-1 para LOS e 125,0 µg-mL-1 para MTF. Posteriormente, alíquotas de 5 mL, 10 mL foram transferidas para balões de 50 mL e 100 mL, respectivamente, atingindo concentração de 10 µg-mL-1 para ATO, 15 µg-mL-1 para LOS e 125 µg-mL-1 para MTF. Então, alíquotas desta última solução foram precisamente transferidas para balões volumétricos de 10 mL, onde os volumes foram completados com fase móvel MeOH:H2O (78:22 v/v), pH 3,0. Assim, a faixa de concentração final para ATO foi de 1,0 a 9,0 µg-mL-1, para LOS de 1,5 a 6,5 µg-mL-1 e de 12,5 a 62,5 µg-mL-1 para MTF.
Precisão (intermediária e repetibilidade)
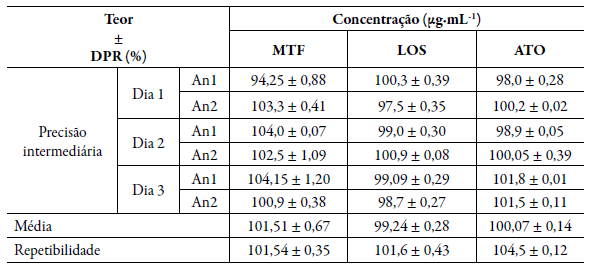
A precisão do método foi avaliada pela repetibilidade e precisão intermediária. A repetibilidade foi obtida pela análise no mesmo dia e pelo mesmo analista em sextuplicatas da mesma solução preparada a partir da amostra comercial nas concentrações de 37,5 µg-mL-1 de MTF, 3,75 µg-mL-1 de LOS e 3,0 µg-mL-1 de ATO conforme faixa linear do método. A precisão intermediária foi realizada por dois analistas em três dias diferentes nas mesmas concentrações utilizadas pela repetibilidade.
Exatidão
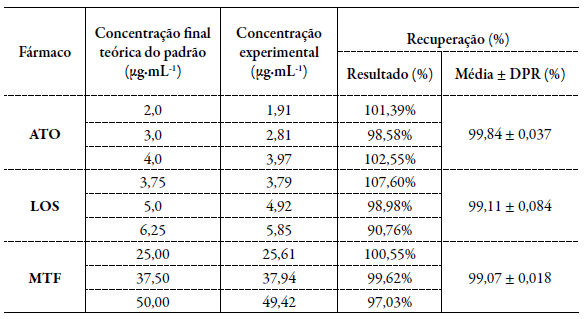
Este ensaio foi determinado através de análises de recuperação em três níveis de concentração (baixa, média, alta) para cada fármaco, em triplicata. Foram preparadas soluções a partir das amostras comerciais manipuladas contendo MTF, LOS e ATO em concentrações de 625, 62,5 e 50 µg-mL-1, respectivamente. Em seguida, foram transferidas alíquotas da solução padrão preparada com as matérias-primas dos fármacos, a fim de obter soluções de concentração iguais a 37,5, 50,0 e 62,5 µg-mL-1 para MTF; 3,75, 5,0 e 6,25 µg-mL-1 para LOS e 3,0, 4,0 e 5,0 µg-mL-1 para ATO. Os volumes foram completados com a fase móvel MeOH:H2O (78:22 v/v), pH 3,0 e as porcentagens de recuperações de cada fármaco foram calculadas conforme a equação de acordo com o guia [18].
A recuperação foi calculada de acordo com o indicado pela AOAC:
Onde: ca = Concentração de fármaco encontrada na amostra adicionada de padrão; Cna = concentração de fármaco encontrada na amostra não adicionada de padrão; Cp = concentração teórica de padrão.
Limites de detecção (LD) e quantificação (LQ)
Os limites foram determinados teoricamente através das equações: LD = 3,3 σ /c e LQ = (10 x σ) /c, sendo LD para limite de detecção e LQ para limite de quantificação, onde σ representa o desvio padrão do intercepto com o eixo y e c é o coeficiente angular que representa a inclinação da curva de calibração.
Robustez
A robustez foi determinada em triplicata de injeções da solução amostra com as concentrações de 37,5 µg-mL-1 de MTF, 3,75 µg-mL-1 de LOS e 3,0 µg-mL-1 de ATO. Os fatores ("perturbadores") do método e os respectivos níveis testados estão apresentados na tabela 1 conforme preconizado na RDC166/17 [19].
Tabela 1 Parâmetros analíticos "perturbadores" do método desenvolvido selecionados para teste de robustez
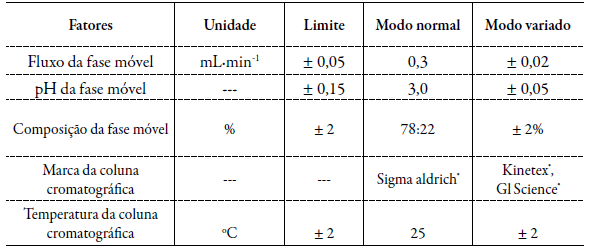
Os efeitos causados pelos "perturbadores" do método analítico foram avaliados sobre as áreas e sobre as características dos picos cromatográficos. O desvio padrão relativo (DPR) estabelecidos como aceitável foi de no máximo 2 %. A média obtida com os parâmetros normais foi comparada com a média correspondente aos níveis modificados para assim determinar o impacto das variações propostas nos resultados obtidos.
Seletividade
A seletividade foi avaliada pela análise de uma amostra simulada contento apenas os excipientes utilizados nas formulações de das amostras manipuladas, com o intuito de avaliar a interferência destes sob o método desenvolvido. Assim, uma mistura de lauril sulfato de sódio, aerosil, celulose microcristalina, amido e carbonato de cálcio na concentração de 10 µg-mL-1, foi preparada e injetada no cromatógrafo e o cromatograma resultante foi comparado com os cromatogramas das amostras comerciais, nos comprimentos de onda de interesse, isto é, 225 nm, 236 nm e 246 nm.
Controle de qualidade das amostras comerciais
Determinação do peso médio
Conforme RDC 67/2011, a determinação do peso médio foi realizada em três etapas: determinação do peso do invólucro, determinação do peso médio teórico e determinação da média e o desvio padrão relativo (DPR).
A determinação do peso do invólucro foi realizada pesando 20 cápsulas vazias separadamente e calculada a média. A determinação do peso médio teórico se dá pelo cálculo:
Em seguida, foram pesadas 10 unidades das cápsulas da amostra comercial na balança analítica da Zhimadzu" AY 220, individualmente, sabendo-se que o DPR para cápsulas iguais ou maior que 300 mg não podem ter uma variação maior que 7,5 %. Utilizando a equação determinada em literatura.
Determinação do teor
A determinação do teor das amostras comerciais foi realizada através do método proposto e validado. A partir do valor do peso médio de cada amostra, foram preparadas soluções diluídas na fase móvel MeOH:H2O (78:22 v/v), pH 3,0, contendo teoricamente 37,5 µg-mL-1 de MTF, 3,75 µg-mL-1 de LOS e 3,0 µg-mL-1 de ATO. O cálculo do teor dos fármacos foi obtido utilizando as respectivas curvas de calibração.
RESULTADOS E DISCUSSÃO
Conformidade do sistema cromatográfico e otimização do método
As condições cromatográficas que melhor eluiram os fármacos alvos desse estudo estão representadas na tabela 2. A figura 2 refere-se ao cromatograma de separação dos fármacos na coluna Sigma Aldrich" C18 (4,6 x 150 mm, 5 µm) com vazão de 0,3 mL-min-1 e fase móvel composta de MeOH:H2O, pH 3,0 ajustado com ácido fosfórico.
Tabela 2 Parâmetros avaliados na conformidade do sistema cromatográfico com a coluna Sigma-Aldrich" para a determinação simultânea de ATO, LOS e MTF
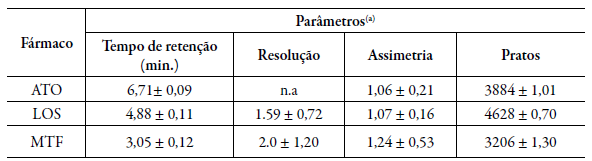
*a)Média de 6 determinações ± desvio padrão relativo (DPR); ATO: Atorvastatina na concentração de 3,0 µg-mL-1; LOS: losartana na concentração de 3,75 µg-mL-1; MTF: metformina na concentração de 37,5 µg-mL-1; CLAE: cromatografia líquida de alta eficiência.
Após a realização de testes com diversas condições cromatográficas empregando diferentes colunas C18, misturas e proporção de solventes, vazão e pH da fase móvel, o método para a determinação simultânea de LOS, ATO e MTF foi desenvolvido selecionando as condições que produziram melhores resultados nos parâmetros de conformidade do sistema: resolução, assimetria e pratos, garantindo a conformidade do sistema e a qualidade dos dados obtidos, indicando a seletividade do sistema, a precisão e a eficiência da coluna [10].
Na Tabela 2 estão descritas as condições cromatográficas selecionadas para o desenvolvimento e validação do método analítico proposto: coluna C18, 150 mm, Sigma-Aldrich" (4.6 x 250 mm, 5 µm) fase móvel MeOH:H2O (78:22 v/v), pH 3,0 ajustado com ácido ortofosfórico e vazão de 0,3 mL-min-1.
Uma vez definida a coluna cromatográfica, fase móvel e vazão para as análises dos fármacos, foram selecionados os comprimentos de onda para a quantificação dos fármacos. Para tanto, realizou-se varreduras espectrais com auxílio do detector de arranjo de diodos (DAD) no intervalo de 200 - 400 nm. Os comprimentos de onda selecionados para quantificação de LOS, ATO e MTD foram 225 nm, 246 nm e 236 nm, respectivamente, correspondendo às regiões de máxima absorção no UV de cada fármaco (figura 2).
A figura 2 ilustra da separação cromatográfica da solução dos fármacos LOS, ATO e MTD, sob as condições cromatográficas desenvolvidas, isto é, coluna C18 150 mm, Sigma-Aldrich* (4.6 x 250 mm, 5 µm) fase móvel MeOH: água (78:22 v/v), pH 3,0 ajustado com ácido ortofosfórico, modo isocrático, vazão de 0,3 mL-min-1 em 246 nm, volume de injeção de 20 µL e temperatura de 25 (±1) °C. Observando-a é possível notar a boa separação cromatográfica dos três fármacos, em um curto tempo de análise (menor que 8 minutos), indicando que o método está adequado para validação e determinação simultânea dos fármacos em formulações farmacêuticas magistrais.
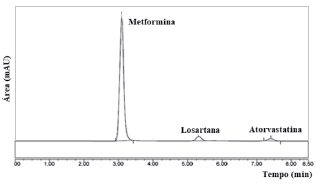
Figura 2 Cromatograma de solução padrão contendo os fármacos losartana (LOS 3,75 µg-mL1); atorvastatina (ATO 3,0 µg-mL-1) e metformina (MTF 37,5 µg-mL-1), obtida na coluna C18 150 mm, Sigma-Aldrich" (4.6 x 250 mm, 5 µm) fase móvel metanol: água (78:22 v/v), pH 3,0 ajustado com ácido ortofosfórico, modo isocrático, vazão de 0,3 mL-min-1 em 225 nm, volume de injeção de 20 e temperatura de 25 ± 1 °C.
Linearidade
A linearidade é a capacidade do método de demonstrar que os resultados experimentais obtidos são proporcionais à concentração do analito na amostra, sempre respeitando o intervalo especificado [11]. O método analítico é considerado linear quando o coeficiente de correlação for ≥ 0,99 [19]. Observa-se que o método foi linear para todos os fármacos, apresentando coeficientes de correlação próximos de 1,0. Os limites de detecção e quantificação foram determinados teoricamente e registrados na tabela 3.
Precisão
Os resultados obtidos na precisão intermediária e na repetibilidade foram apresentados na tabela 4.
Segundo Farmacopeia Brasileira, a especificação de teor para comprimidos de metformina (MTF), de 95,0 % a 105,0 % da quantidade declarada também pode ser adotada para as cápsulas magistrais. Para Losartana (LOS), o teor determinado é de no mínimo 98,5 % e máximo de 101,0% [13].
A Atorvastatina (ATO) deveria conter no mínimo 94,5 % e no máximo 105,0% da quantidade declarada [11]. Para os fármacos analisados obteve-se o teor dentre os limites indicados por suas respectivas monografias.
Exatidão
A exatidão de um método analítico obtida pela análise de nove determinações das quais dividem-se em 3 níveis de concentrações (baixa, média e alta) deve obter concordância entre os resultados individuais do método em estudo em relação a um valor aceito como verdadeiro [19]. Os valores obtidos para a recuperação dos fármacos estão apresentados na tabela 5.
Os valores obtidos na recuperação de ATO, LOS e MTF estão de acordo com os limites aceitáveis entre 98-102 % para os três níveis de concentração analisados [18]. O DPR da média dessas análises foi menor que 2 %. Sendo assim, o método proposto para a determinação simultânea dos três fármacos possui exatidão.
Robustez
Das cinco condições modificada, apenas uma afetou de modo a ser observado diferença nos picos cromatográficos. Quando foi alterado as colunas cromatográficas, os pratos teóricos diminuíram significativamente. Muito provável, devido a pureza da sílica usada nas colunas C18. Desta forma, a coluna cromatográfica passa a ser um fator que deve ser modificado com cautela quando o método for reproduzido em outros laboratórios, por outros analistas ou equipamentos diferentes. As outras alterações realizadas não modificaram os valores das áreas dos picos cromatográficos, bem como os perfis e também as outras características necessárias como os tempos de retenção, assimetria, resolução e número de pratos teóricos para a otimização do método. Sendo assim, não houve diferenças significativas quanto a quantificação dos fármacos nessas condições variadas.
CONCLUSÃO
O método desenvolvido e validado para a determinação simultânea da mistura ternária dos fármacos MTF, LOS e ATO em formulações farmacêuticas magistrais é linear, preciso, exato, robusto e seletivo. Além disso, é um método sensível, rápido e isocrático, podendo ser empregado na rotina de laboratórios de controle de qualidade de medicamentos para análise dos referidos fármacos de forma isolada ou combinada. Por último, há de se destacar que o método proposto é econômico e gera pouco resíduo de solventes, uma vez que a vazão é pequena (0,3 mL-min-1) e a separação corrida cromatográfica ocorre em menos de 8 minutos.