Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Obstetricia y Ginecología
versão impressa ISSN 0034-7434versão On-line ISSN 2463-0225
Rev Colomb Obstet Ginecol v.54 n.4 Bogotá out./dez. 2003
* Conceptum - Medicina Materno Fetal.
RESUMEN
El tamizaje prenatal de aneuploidías ha tenido una importante evolución desde los tiempos de la utilización de la edad materna como único método de tamizaje, hasta la época actual con el empleo de marcadores ultrasonográficos y serológicos de primer trimestre.
En esta revisión del tema, se hace énfasis en la utilización de la sonolucencia nucal como marcador ultrasonográfico del primer trimestre, la forma correcta de usar e interpretar los resultados, así como su interrelación con marcadores serológicos de primero y segundo trimestres.
Los estudios más relevantes sobre el tema revelan tasas de detección que varían con base en las diferentes estrategias escogidas para el tamizaje prenatal y las distintas tasas de falsos positivos.
Cada día aparecen nuevos marcadores y diferentes estrategias de tamizaje que demandan una evaluación exhaustiva antes de ponerlas en práctica en el ejercicio rutinario.
Palabras clave: sonolucencia nucal, análisis de riesgo, aneuploidías, primer trimestre.
SUMMARY
Prenatal screening of aneuploidies has showed important evolution since the time when the only form of screening was maternal age, up to the present with the use of ultrasound and first trimester serologic markers.
The present review emphasizes on the use of nuchal translucency as a first trimester ultrasound marker, its correct application, and the interpretation of results as well as its relationship with other first and second trimester serological markers.
The most relevant studies on the subject reveal detection rate that varies depending on the strategy chosen for the prenatal screening process and in accordance with the different false positive rates.
Each day new markers and strategies appear. However, they should be thoroughly reviewed before using them in everyday practice.
Key words: nuchal translucency, risk assessment, aneuploidy, first trimester.
INTRODUCCIÓN
Actualmente el diagnóstico prenatal de las anormalidades cromosómicas es percibido como una opción deseable y cada día más solicitada por la mayoría de mujeres gestantes.
Las anormalidades cromosómicas son la principal causa de mortalidad perinatal y de discapacidad en el recién nacido y la niñez; por tal razón su detección constituye la principal indicación para la realización de pruebas diagnósticas prenatales. Sin embargo, dichas pruebas, por ser invasivas, conllevan un significativo grado de riesgo, lo que hace deseable su aplicación exclusivamente en la población considerada de alto riesgo.
Mediante un consejo apropiado, una vez conocidos los potenciales riesgos y beneficios de los diferentes métodos de tamizaje y pruebas diagnósticas, la paciente obtendrá suficiente información para tomar una decisión apropiada y tranquilizadora, acorde con su condición particular.
Por lo tanto, el objetivo final del tamizaje prenatal es proveer un estudio del riesgo lo más exacto posible para cada caso individual.
Generalmente el tamizaje prenatal ha tenido su principal campo de acción en el segundo trimestre de la gestación. El primer método de selección, se basó en el trabajo de Shuttleworth,1 en el cual se reportó la asociación entre edad materna y síndrome de Down.
A partir de 1966 fue posible el diagnóstico de síndrome de Down con un método invasivo e inicialmente se consideró que la amniocentesis debía realizarse en mujeres mayores de 40 años. El desarrollo de esta técnica y su difusión cada vez más segura permitió redefinir el grupo de riesgo según la edad. Actualmente y según las diferentes políticas de salud de cada país, se considera como punto de corte entre los 35 y 38 años; el grupo de riesgo constituye cerca del 5-15% de la población de mujeres embarazadas.2
Hacia 1980 se introdujo un nuevo método de tamizaje, en el cual se tuvo en cuenta la concentración de diversas sustancias fetoplacentarias en el suero materno que son distintas en fetos sanos en comparación con fetos afectos de síndrome de Down. Dicho método, denominado tamizaje en suero materno (doble, triple o cuádruple marcador), se considera más efectivo que el solo uso de la edad materna y se aplica en el segundo trimestre de la gestación.3
En los últimos cinco-diez años se han desarrollado nuevas técnicas de tamizaje para ser aplicadas en el primer trimestre, entre ellas la medida de la sonolucencia nucal (SN) o translucencia nucal es una de las más promisorias como lo señala la literatura.
Paralelo al desarrollo de las técnicas ultrasonográficas se han producido avances en las técnicas serológicas maternas, lo que dio paso a los marcadores de primer trimestre.
El vertiginoso desarrollo de todas estas técnicas de tamizaje ha despertado gran interés acerca de cómo el empleo de uno u otro método afecta la aplicación de otros y cuál es la manera correcta de interpretar los diferentes resultados. Es así como se han propuesto diversas maneras de calcular el riesgo de aneuploidías, utilizando técnicas ultrasonográficas y serológicas, tanto de primero como de segundo trimestres.
Con base en la relevancia de las alteraciones cromosómicas en materia de salud pública, es de vital importancia conocer la evolución de las diferentes estrategias de tamizaje prenatal. Por lo tanto, esta revisión pretende dar a conocer las diferentes estrategias existentes, con el propósito de que las personas involucradas en el diagnóstico prenatal y en la consejería preconcepcional, tengan las herramientas necesarias para ofrecer información adecuada y seria.
SONOLUCENCIA NUCAL
La SN se define como una colección líquida subcutánea localizada entre la columna cervical y la piel en la región de la nuca, y que se visualiza con ultrasonido.
En la última década, diferentes estudios reportaron la asociación entre aumento en la SN durante el primer trimestre y diversas alteraciones fetales que van desde trastornos cromosómicos, síndromes genéticos y malformaciones estructurales.
Los estudios iniciales se llevaron a cabo en poblaciones de alto riesgo y revelaron que la prevalencia de alteraciones cromosómicas está directamente relacionada con el aumento en la SN y la edad materna. La tabla 1 resume los principales estudios realizados en la población de alto riesgo.4-21
En los últimos cuatro-cinco años se han desarrollado estudios en población no seleccionada.
La tabla 2 muestra los resultados de nueve estudios efectuados.15,22-29
Aun cuando la población incluida en cada uno de estos estudios es muy pequeña para sacar conclusiones respecto a la sensibilidad, un análisis combinado de los datos reveló una sensibilidad alrededor del 74%, con una tasa de falsos positivos del 1,6%.30,31
Una revisión detallada de cada uno de estos estudios fue realizada por Stewart y malone.32
La Fundación de Medicina Fetal en el Reino Unido llevó a cabo un estudio de tamizaje con SN. En la revisión preliminar de los primeros resultados se examinaron 100.311 embarazos y se obtuvo seguimiento adecuado en 96.127; se presentaron 326 casos de trisomía 21 y 325 de otras alteraciones cromosómicas. La SN se encontró por encima del percentil 95 para la longitud craneocaudal en 4.210 (4,4%) de los embarazos normales y en 234 (71,8%) de los embarazos con trisomía 21; el riesgo estimado para trisomía 21 con base en la edad materna y la SN se observó por encima de 1/300 en 7.907 (8,3%) de los embarazos normales y en 268 (82,2%) de los embarazos con trisomía 21. Con una tasa de tamizaje positivo del 5% la sensibilidad fue del 77% con un IC de 72- 82%.33
La tabla 3 muestra la prevalencia observada según el riesgo estimado con base en la edad materna y SN.33
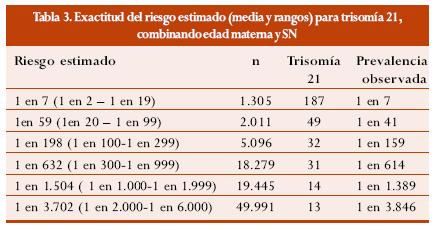
En este estudio se encontró un valor predictivo positivo (VPP) de 3,2% y un valor predictivo negativo (VPN) de 99,9 %; al calcular la razón de probabilidad (lr) para la prueba se observó una lr(+) de 9,88 y una lr(-) de 19,6. La exactitud de la prueba fue de 91,7.34,35
MEDIDA DE LA SONOLUCENCIA NUCAL
Para lograr una adecuada medición de la SN se requiere apropiado entrenamiento, un equipo óptimo, tener suficiente motivación y disposición de tiempo y, sobre todo, regirse estrictamente a los parámetros técnicos descritos para la toma y medida de la SN.
La medida de la SN se logra con éxito por vía transabdominal en cerca del 95% de los casos; por vía transvaginal la medida es satisfactoria.2
La SN incrementa con la edad gestacional y la longitud craneocaudal (LCC); por lo tanto, para determinar el grado de desviación con respecto a los valores de la media es esencial tener en cuenta el tiempo de gestación. Según lo expuesto, la medida de la SN se debe realizar entre 45 mm de LCC como mínimo y 84 mm de LCC como máximo; la medida ideal es de 11+0 a 13+6 semanas de edad gestacional.46-48,74
La figura 1 muestra los resultados del estudio SURUSS con respecto al porcentaje de fallas de la medición de la SN relacionado con la edad gestacional.74

El estricto cumplimiento de las normas técnicas establecidas por la Fundación de Medicina Fetal en el Reino Unido garantizan una adecuada medición y uniformidad en los resultados obtenidos por diferentes examinadores.36-42
En el estudio SURUSS se realizó evaluación de la importancia de la técnica y calidad de la medida de la SN entre los casos de síndrome de Down. Se evidenció que el resultado de los múltiplos de la mediana (MoM), entre los casos con medidas técnicamente insatisfactorias (mediana: 1,08 MoM), fue estadísticamente significativa más baja (p=0,005) que la encontrada en los casos con medidas técnicamente satisfactorias (mediana: 1,91 MoM)74 (figura 2).

Los estudios para mostrar la reproducibilidad de la técnica revelaron que la variabilidad intra e interobservador está por debajo de 0,5 mm en el 95% de los casos.43-45,74
Las siguientes son las principales conclusiones obtenidas en el estudio SURUSS respecto a la medición de la SN:74
1. El momento ideal para obtener la SN es en la semana 12; pero si se realiza en combinación con la PAPP-A es mejor cumplidas las 10 semanas.
2. La SN sola es menos efectiva que en combinación con otros marcadores.
3. La forma de realizar la medida de la SN, así como la maquina utilizada son de vital importancia.
4. Usar la media de las medidas tomadas mejora el desempeño de la prueba en comparación con el uso de una sola medida.
Con respecto al tiempo y uso de otros marcadores:
1. Todos los marcadores bioquímicos se comportan mejor en el segundo trimestre, excepto la PAPP-A.
2. El mejor sistema de tamizaje se obtiene integrando marcadores de primero y segundo trimestres.
ANÁLISIS DE RIESGO COMBINADO POR EDAD MATERNA Y SN
Toda mujer embarazada tiene un riesgo potencial de que el producto de su embarazo evidencie una anormalidad cromosómica. Para calcular el riesgo individual es indispensable tener en cuenta la edad materna, la edad gestacional y la historia de defectos cromosómicos previos.
En la actualidad este riesgo de base está directamente relacionado con la edad materna, tal como fue estudiado y demostrado por dos importantes revisiones hechas en Bélgica y en Suecia, cuyos datos se utilizaron para calcular el riesgo relacionado con la edad materna de tener un producto afecto de trisomía 21.49-51
También se estableció que los fetos con defectos cromosómicos tienen mayor probabilidad de morir in utero en comparación con fetos normales; por lo tanto, el riesgo de tener un defecto cromosómico disminuye con la edad gestacional.
Snijders y col. estimaron la tasa de pérdida fetal para trisomía 21 en 36% a la semana 10, 30% a la semana 12 y 21% a la semana 16. Métodos similares fueron utilizados para establecer la tasa calculada de pérdida fetal para otras alteraciones cromosómicas.52
El antecedente de un producto del embarazo afecto de trisomía hace que el riesgo de recurrencia sea mayor que el esperado solamente por la edad materna. En un estudio se determinó que el riesgo de recurrencia se incrementa en casos de trisomía 21 y 18 en un 0,75% con respecto al riesgo de base. El mosaicismo parental o una alteración o defecto que interfiera con la normal disyunción han sido los mecanismos utilizados para explicar este fenómeno; sin embargo, en el último caso el riesgo estaría sustancialmente aumentado, por lo cual y a la luz de la evidencia actual, se trata de una alteración específica de cromosoma y en la mayoría de los casos el mosaicismo parental es el más probable.53,54
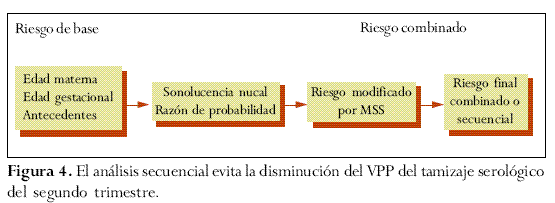
Una vez establecido el riesgo de base, teniendo en cuenta la edad materna, la edad gestacional y los antecedentes pertinentes, dicho riesgo podrá ser modificado secuencialmente al multiplicarlo por una serie de factores, producto de la aplicación de los diferentes métodos de tamizaje, con lo cual se obtiene un nuevo riesgo modificado. Cada vez que se aplique un nuevo método de selección se modifica el riesgo precedente.55
Por lo tanto, para cada edad gestacional, la medida de la SN determinará un factor por el cual es multiplicado el riesgo de base establecido y se obtendrá un nuevo riesgo modificado por la SN. A mayor medida de SN mayor será el factor y a la inversa (figura 3).

Para calcular el factor multiplicador o LR se debe conocer primero la distribución de la SN en la población cromosómicamente normal y en aquella con trisomía 21.56,57
SN AUMENTADA Y OTROS DEFECTOS CROMOSÓMICOS
Para la trisomía 21, la media de la SN se encuentra alrededor de 2 mm por encima de la media en la población normal; en la trisomía 18, 4 mm por encima; en la trisomía 13, 2,5 mm por encima; en la triploidía, 1,5 mm por encima y en el síndrome de Turner, 7 mm por encima.58
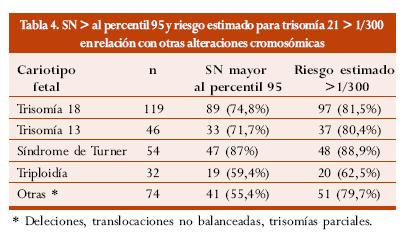
En el estudio de la Fundación de Medicina Fetal se identificaron 325 fetos con alteraciones cromosómicas diferentes a la trisomía 21; en 229 (70,5%) de estos, la SN se encontró por encima del percentil 95 para la edad gestacional, en 253 (77,9%) el riesgo estimado por análisis combinado de la edad materna y la SN fue mayor de 1/300.59
La tabla 4 muestra la distribución de la SN por encima del percentil 95 y el riesgo estimado para trisomía 21 mayor de 1/300 con relación a otras alteraciones cromosómicas.2
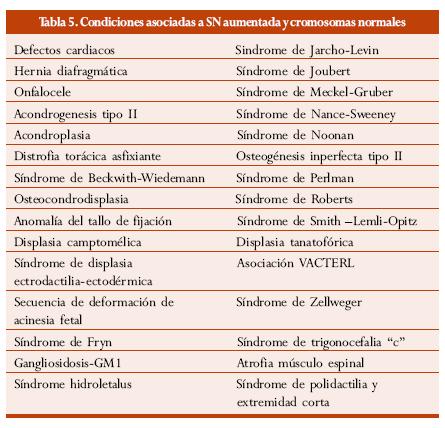
Según los resultados de diferentes estudios, en fetos cromosómicamente normales con SN aumentada se asocia una gran gama de defectos fetales y síndromes genéticos. La combinación de diferentes series, con un total de 510 casos cromosómicamente normales con SN aumentada, reveló 77 (15%) casos con diferentes defectos.2 El estudio multicéntrico del Reino Unido mostró 4.116 embarazos únicos con SN aumentada y cromosómicamente normales. Se encontró un amplio rango de alteraciones estructurales y síndromes genéticos en 161 (3,9%) de los casos; la prevalencia de defectos fetales incrementó a medida que aumentó la SN y se halló SN de 3 mm (2,4%), 4 mm (7,1%), 5 mm (12,3%), 6 mm (16,7%), 7 mm (35,6%).60
En la tabla 5 se enumeran las diferentes anormalidades fetales y síndromes genéticos asociados con SN aumentada y cromosomas normales.
SN Y TAMIZAJE SEROLÓGICO EN SEGUNDO TRIMESTRE
Con la utilización del tamizaje bioquímico de segundo trimestre, alrededor de la semana 16 y la medición de dos, tres o cuatro sustancias se ha reportado una tasa de detección que varía entre 40 a 70%, con una tasa de falsos positivos del 5%.
Los estudios que analizaron la utilización de ambos métodos en un mismo embarazo demostraron una importante reducción en el VPP del tamizaje serológico del segundo trimestre. Por lo tanto, es probable que mediante el uso indiscriminado de ambos métodos se aumente la tasa de falsos positivos, con incremento en el número de procedimientos invasivos.61,62
Sin embargo, publicaciones recientes describen diferentes metodologías para realizar un análisis secuencial, evitando el inconveniente de la disminución del VPP del tamizaje serológico de segundo trimestre (figura 4).
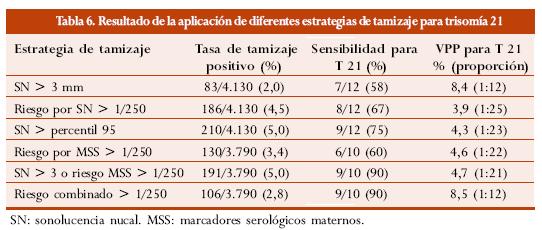
Audibert y col. en su estudio63 analizan y comparan diferentes estrategias de tamizaje para detección de trisomía 21 y proponen el análisis del riesgo combinado, utilizando el riesgo obtenido por edad materna y tamizaje serológico de segundo trimestre, modificado según la LR derivada por SN en el primer trimestre.
La tabla 6 muestra los resultados de las diferentes estrategias de tamizaje utilizadas.
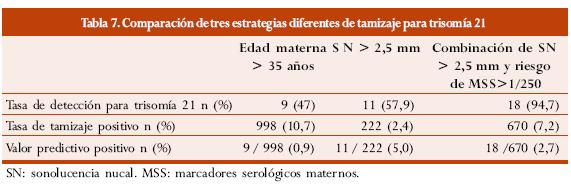
Schuchter y col.64 realizaron un estudio en el cual practicaron tamizaje secuencial mediante selección serológica de segundo trimestre a las 16 semanas, únicamente en pacientes sin biopsia de vellosidad coriónica (BVC) por SN aumentada en el primer trimestre. Reportaron que como punto de corte de la SN usaron un valor mayor o igual a 2,5 mm y obtuvieron una tasa de detección del 58%; a través del tamizaje secuencial alcanzaron una tasa de detección del 95% con una tasa de tamizaje positivo del 7,2%. Estos autores argumentan que la demora en la toma de decisiones ante una SN aumentada es el principal problema de implementar el tamizaje secuencial utilizando los marcadores serológicos de segundo trimestre en todas las pacientes, dado que en ocasiones es necesario esperar hasta el segundo trimestre para obtener un análisis de riesgo final. En este estudio el VPP del tamizaje serológico se mantuvo en 2,2%.
La tabla 7 muestra los resultados de las diferentes metodologías de tamizaje utilizadas por los autores.
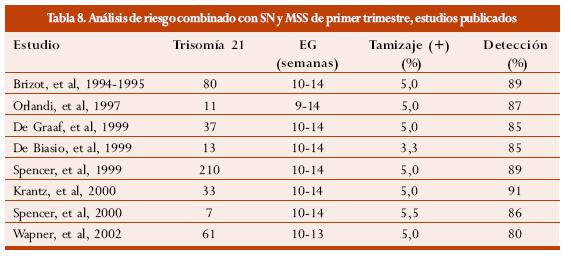
En la tabla 8 se enumeran los diferentes estudios que han revisado el riesgo combinado con SN y MSS de primer trimestre.68-73
HUESOS NASALES FETALES
Recientemente se propuso un nuevo marcador ultrasonográfico para el síndrome de Down, considerando la presencia o ausencia de huesos nasales fetales; este marcador puede ser evaluado durante el estudio ultrasonográfico del primer trimestre.75
Entre las semanas 11 - 14 de gestación, los huesos nasales no son visibles en cerca del 60 - 70% de los fetos con síndrome de Down y en menos del 1% en fetos normales.76-78
En un estudio reciente de 3.788 embarazos sometidos a BVC, entre 11 y 14 semanas de gestación, la incidencia de falta de huesos nasales fetales fue de 2,8% en 3.358 fetos normales, de 67% en 242 fetos con trisomía 21 y de 33% en 188 fetos con otros defectos cromosómicos. Sin embargo, se logró evidenciar cómo la incidencia de la falta de huesos nasales disminuye con el aumento en la l LCC, se incrementa con el aumento en la SN y es sustancialmente mayor en la población afrocaribeña en comparación con los caucásicos.79
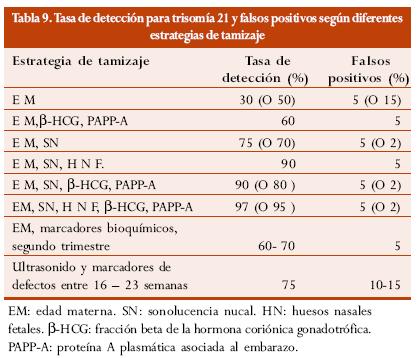
Algunos datos preliminares de la utilización de marcadores ultrasonográficos de primer trimestre (SN y huesos nasales fetales) con marcadores bioquímicos de primer trimestre (PAPP-A y b-HCH libre) sugieren una tasa de detección de 97% con falsos positivos de 5% o del 95% de tasa de detección con falsos positivos del 2%.80
La tabla 9 muestra el comportamiento de los diferentes esquemas de tamizaje de primer trimestre según los datos publicados recientemente por el Profesor K. Nicolaides, en los cuales está incluido la utilización de los huesos nasales como marcador de primer trimestre.81
SN Y MARCADORES SEROLÓGICOS DE PRIMERO Y SEGUNDO TRIMESTRES
Recientemente se conocieron los resultados del estudio SURUSS (First and second trimester antenatal screening for Down's syndrome: the results of the serum, urine and ultrasound screening study), en el cual se hace un análisis exhaustivo del funcionamiento de las diferentes combinaciones de marcadores en el primero y segundo trimestres. En la tabla 10 se muestra el comportamiento de las principales pruebas de tamizaje con una tasa de detección fija del 85% y las diferentes tasas de falsos positivos.74
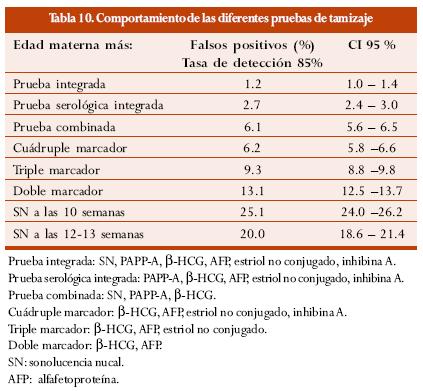
En el estudio SURUSS se analizó en forma amplia el comportamiento de los diferentes marcadores, tanto ultrasonográficos como bioquímicos durante el primero y/o segundo trimestres. Las siguientes son sus principales conclusiones:
Una vez estudiadas las diferentes opciones y teniendo en cuenta eficacia, seguridad y costos, la prueba integrada es el método de elección para el tamizaje prenatal; con un porcentaje de detección del 85% se obtiene una tasa de falsos positivos del 1,2%, siempre y cuando la medida de la SN sea satisfactoria, por lo menos en una ocasión, y si se realiza hacia la semana 10 cumplida, junto con la PAPP-A. Si la SN no está disponible, el siguiente método de elección es la prueba serológica integrada con los mismos marcadores bioquímicos integrados. Los beneficios de agregar los marcadores de primero y segundo trimestres son evidentes, dado que diminuyen la tasa de falsos positivos y la necesidad de pruebas invasivas y procedimientos diagnósticos y por ende la pérdida de fetos no afectados.
Para las pacientes que requieran el resultado de la prueba de tamizaje antes de la semana 14 de gestación, la mejor opción es la prueba combinada de selección.74
DISCUSIÓN
Las pruebas de tamizaje prenatal han experimentado grandes cambios en los últimos tiempos, gracias a su mayor tecnología es posible alcanzar tasas de detección alrededor del 90% con tasas de falsos positivos alrededor del 2%.
A la luz de los últimos estudios, queda planteada la controversia sobre el uso de marcadores en forma integrada en el primero y segundo trimestres, con tasas de detección muy satisfactorias y porcentajes de falsos positivos muy bajos, pero sacrificando quizá la precocidad en los resultados del tamizaje; o por el contrario, el uso de nuevos marcadores ultrasonográficos aún no evaluados exhaustivamente y aunados a los ya conocidos de primer trimestre, con tasas de detección muy satisfactorias y buenas tasas de falsos positivos, lo que redundará en resultados precoces y seguros.
Es quizá el momento de reafirmar que el uso de marcadores ultrasonográficos está supeditado a la calidad técnica en su medición, determinada por varios factores como tiempo disponible para el examen, entrenamiento y experiencia del operador, y calidad del equipo utilizado. Queda claramente demostrado que el no cumplimiento de los requisitos técnicos mínimos se refleja en un pobre desempeño de las diferentes estrategias de tamizaje.
Una vez conocido el desempeño de las diferentes estrategias de tamizaje prenatal para aneuploidías, es importante considerar y analizar con cuidado cuál estrategia de tamizaje estamos utilizando en nuestra práctica diaria, cuál es el consejo que debemos dar a nuestras pacientes y si ha llegado la hora de modificar nuestras conductas basadas en los resultados de los estudios actuales.
REFERENCIAS
1. Shuttleworth GE. Mongolian imbecility. Br Med J 1909; 2: 661-5. [ Links ]
2. Nicolaides KH, Sebire NJ, Snijders RJ. The 11- 14 week scan.The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 5. [ Links ]
3. Nicolaides KH, Sebire NJ, Snijders RJ. The 11- 14 week scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 6. [ Links ]
4. Johnson MP, Johnson A, Holzgreve W, Isada NB, Wapner RJ, Treadwell MC, et al. First trimester simple hygroma: cause and outcome. Am J Obstet Gynecol 1993; 168: 156-61. [ Links ]
5. Hewitt B. Nuchal translucency in the first trimester. Aust NZ J Obstet Gynecol 1993; 33: 389-91. [ Links ]
6. Shulman LP, Emerson D, Felker R, Phillips O, Simpson J, Elias S. High frequency of cytogenetic abnormalities with cystic hygroma diagnosed in the first trimester. Obstet Gynecol 1992; 80: 80-2. [ Links ]
7. Nicolaides KH, Azar G, Byrne D, Mansur C, Marks K. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. Br Med J 1992; 304: 867-89. [ Links ]
8. Pandya PP, Kondylios A, Hilbert L, Snijders RJ, Nicolaides KH. Chromosomal defects and outcome in 1015 fetuses with increased nuchal translucency. Ultrasound Obstet Gynecol 1995; 5: 15-19. [ Links ]
9. Szabo J, Gellen J. Nuchal fluid accumulation in trisomy 21 detected by vaginosonography in first trimester. Lancet 1990; 336: 1133. [ Links ]
10.Wilson RD, Venir N, Faguharson DF. Fetal nuchal fluid physiological or pathological? In pregnancies less than 17 menstrual weeks. Prenat Diagn 1992; 12: 755-63. [ Links ]
11.Ville Y, Lalondrelle C, Doumerc S, Daffos F, Frydman R, Oury JF, et al. First trimester diagnosis of nuchal anomalies: significance and fetal outcome. Ultrasound Obstet Gynecol 1992; 2: 314-16. [ Links ]
12.Trauffer ML, Anderson CE, Johnson A, Heeger S, Morgan P, Wapner RJ. The natural history of euploid pregnancies with first trimester cystic hygromas. Am J Obstet Gynecol 1994; 170: 1279-84. [ Links ]
13.Brambati B, Cislaghi C, Tului L, Alberti E, Amidani M, Colombo U, Zuliani G. First trimester Down's syndrome screening using nuchal translucency: a prospective study in patients undergoing chorionic villus sampling. Ultrasound Obstet Gynecol 1995; 5: 9-14. [ Links ]
14.Comas C, Martinez JM, Ojuel J, Casals E, Puerto B, Borrel A, et al. First trimester nuchal edema as a marker of aneuploidy. Ultrasound Obstet Gynecol 1995; 5: 26-9. [ Links ]
15.Szabo J, Gellen J, Szenere G. First trimester ultrasound screening for fetal aneuploidies in women over 35 and under 35 years of age. Ultrasound Obstet Gynecol 1995; 5: 161-3. [ Links ]
16.Nadel A, Bromley B, Benacerraf BR. Nuchal thickening or cystic hygromas in first and early second trimester fetuses: prognosis and outcome. Obstet Gynecol 1993; 82: 43-8. [ Links ]
17.Savoldelli G, Binkert F, Achermann J, Scmid W. Ultrasound screening for chromosomal anomalies in the first trimester of pregnancy. Prenat Diagn 1993; 13: 513-18. [ Links ]
18.Schulte-Vallentin M, Schindler H. Non-echogenic nuchal oedema as a marker in trisomy 21 screening. Lancet 1992; 339: 1053. [ Links ]
19.Van Zalen-Sprock MM, Van Vugt JMG, Van Geijn HP. First trimester diagnosis of cystic hygroma course and outcome. Am J Obstet Gynecol 1992; 167: 94-8. [ Links ]
20.Cullen MT, Gabrielli S, Green JJ, Rizzo N, Mahoney MJ, Salafia C, et al. Diagnosis and significance of cystic hygroma in the first trimester. Pren Diagn 1990; 10: 643-51. [ Links ]
21.Suchet IB, Van der Westhuizen NG, Labatte MF. Fetal cystic hygromas: further insights into their natural history. Can Assoc Radiol J 1992; 6: 420-4. [ Links ]
22.Bower S, Chitty L, Bewley S, Roberts L, Clark T, Fisk NM, Maxwell D, Rodeck CH. First trimester nuchal translucency screening of the general population: data from three centers [abstract]. Presented at the 27th British Congress of Obstetrics and Gynaecology. Dublin: Royal College of Obstetrics and Gynaecology, 1995. [ Links ]
23.Pandya PP, Goldberg H, Walton B, Riddle A, Shelley S, Snijders RJ, et al. The implementation of first trimester scanning at 10-13 weeks' gestation and the measurement of fetal nuchal translucency thicknes in two maternity units. Ultrasound Obstet Gynecol 1995; 5: 20-5. [ Links ]
24.Bewley S, Roberts LJ, Mackinson M, Rodeck CH. First trimester fetal nuchal translucency: problems with screening the general population. II. Br J Obstet Gynecol 1995; 102: 386-8. [ Links ]
25.Korman LH, Morssink LP, Beekhuis JR, DeWolf BTHM, Heringa MP, Mantingh A. Nuchal translucency can not be used as screening test for chromosomal abnormalities in the first trimester of pregnancy in a routine ultrasound practice. Prenat Diagn 1996; 16: 797-805. [ Links ]
26.Zimmerman R, Hucha A, Salvodelli G, Binkert F, Acherman J, Grudzinskas JG. Serum parameters and nuchal translucency in first trimester screening for fetal chromosomal abnormalities. Br J Obstet Gynecol 1996; 103: 1009-14. [ Links ]
27.Taipale P, Hiilesmaa V, Salonen R, Ylostalo P. Increased nuchal translucency as a marker for fetal chromosomal defects. N Engl J Med 1997; 337: 1654-8. [ Links ]
28.Hafner E, Schuchter K, Liebhart E, Philipp K. Results of routine nuchal fetal translucency measurements at 10-13 weeks in 4233 unselected pregnant women. Prenat Diagn 1998; 18: 29-34. [ Links ]
29.Pajkrt E, Van Lith JMM, Mol BWJ, Bleker OP, Bilardo CM. Screening for Down's syndrome by fetal nuchal translucency measurements in a general obstetrics population. Ultrasound Obstet Gynecol 1998; 12: 163-9. [ Links ]
30.Nicolaides KH, Sebire NJ, Snijders RJ. The 11-14 week scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 21. [ Links ]
31.Rodeck CH, Whittle MJ. Fetal medicine. Basic science and clinical practice.1ra ed, London, Churchill Livingstone; 1999. p. 574. [ Links ]
32.Stewart TL, Malone FD. First trimester screening for aneuploidy: nuchal translucency sonography. Sem in Perinatology 1999; 23(5): 369-381. [ Links ]
33.Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Lancet 1998; 352: 343-46. [ Links ]
34.Jaeschke R, Guyatt G, Sackett DL. How to use an article about a diagnostic test. Are the results of the study valid? JAMA 1994; 271: 389-391. [ Links ]
35.Jaeschke R, Guyatt G, Sackett DL. How to use an article about a diagnostic test. What are the results and will they help me in caring for my patients. JAMA 1994; 271: 703-707. [ Links ]
36.Whitlow BJ, Economides DL. The optimal gestational age to examine fetal anatomy and measure nuchal translucency in the first trimester. Ultrasound Obstet Gynecol 1998; 11: 258-61. [ Links ]
37.Braithwaite JM, Economides DL. The measurements of nuchal translucency with transabdominal and transvaginal sonography-success rates, repeatability and level of agreement. Br J Radiol 1995; 68: 720-3. [ Links ]
38.Braithwaite JM, Morris RW, Economides DL. Nuchal translucency measurements: frequency, distribution and changes with gestation in a general population. Br J Obstet Gynaecol 1996; 103: 1201-4. [ Links ]
39.Whitlow BJ, Chatzipapas IK, Economides DL. The effect of fetal neck position on nuchal translucency measurement. Br J Obstet Gynaecol 1998; 105: 872-6. [ Links ]
40.Herman A, Maymon R, Dreazen E, Caspi E, Bukovsky I, Weinraub Z. Nuchal translucency audit: a novel image- scoring method. Ultrasound Obstet Gynecol 1998; 12: 398-403. [ Links ]
41.Braithwaite JM, Kadir RA, Pepera TA, Morris RW, Thompson PJ, Economides DL. Nuchal translucency measurement: training a potential examiners. Ultrasound Obstet Gynecol 1996; 8: 192-5. [ Links ]
42.Monni G, Zoppi MA, Ibba RM, Floris M. Results of measurement of nuchal translucency before and after training. Lancet 1997; 350: 1631. [ Links ]
43.Pandya PP, Altman D, Brizot ML, Pettersen H, Nicolaides KH. Repeatability of measurement of fetal nuchal translucency thickness. Ultrasound Obstet Gynecol 1995; 5: 334-7. [ Links ]
44.Schuchter K, Wald N, Hackshaw AK, Hafner E, Liebhart E. The distribution of nuchal translucency at 10-13 weeks of pregnancy. Prenat Diagn 1998; 18: 281-6. [ Links ]
45.Pajkrt E, de Graaf IM, Mol BW, van Lith JM, Bleker OP, Bilardo CM. Weekly nuchal translucency measurements in normal fetuses. Obstet Gynecol 1998; 91: 208-11. [ Links ]
46.Braithwaite JM, Morris RW, Economides DL. Nuchal translucency measurements: frequency, distribution and changes with gestation in a general population. Br J Obstet Gynaecol 1996; 103: 1201-4. [ Links ]
47.Pandya PP, Snijders RJ, Johnson SJ, Brizot M, Nicolaides KH. Screening for fetal trisomies by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Br J Obstet Gynaecol 1995; 102: 957-62. [ Links ]
48.Koulisher L, Gillerot Y. Down's syndrome in Wallonia (South Belgium), 1971-1978: cytogenetics and incidence. Hum Genet 1980; 54: 243-50. [ Links ]
49.Hook EB, Lindsjo A. Down syndrome in live births by single year maternal age interval in a Swedish study: comparison with results from a New York state study. Am J Hum Genet 1978; 30: 19-27. [ Links ]
50.Hecht CA, Hook EB. The imprecision in rates of Down syndrome by 1-year maternal age intervals: a critical analysis of rates used in biochemical screening. Prenat Diagn 1994; 14: 729-38. [ Links ]
51.Snijders RJ, Sebire NJ, Nicolaides KH. Maternal age and gestational age-specific risks for chromosomal defects. Fetal Diag Ther 1995; 10: 356-67. [ Links ]
52.Nicolaides KH, Sebire NJ, Snijders RJ. The 11-14 week scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 11-12. [ Links ]
53.Acuña JM. Indicaciones de diagnóstico citogenético prenatal. En: Gómez PI, Ruiz AI. Temas de interés en ginecología y obstetricia.1 ra ed. Bogotá. Universidad Nacional de Colombia; 1999. p. 114. [ Links ]
54.Snijders RJ, Nicolaides KH. Assesment of risk. In: ultrasound markers for fetal chromosomal defects. Carnforth, UK: Parthenon Publishing; 1996. p. 109-13. [ Links ]
55.Nicolaides KH, Sebire NJ, Snijders RJ. The 11-14 week scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 8. [ Links ]
56.Nicolaides KH, Sebire NJ, Snijders RJ. The 11-14 week scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 29-30. [ Links ]
57.Thilaganathan B, Slack A, Wathen N. Effect of first trimester nuchal translucency on second trimester maternal serum biochemical screening for Down's syndrome. Ultrasound Obstet Gynecol 1997; 10: 261-4. [ Links ]
58.Kadir R, Economides D. The effect of nuchal translucency measurement on second trimester biochemical screening for Down's syndrome. Ultrasound Obstet Gynecol 1997; 9: 244-7. [ Links ]
59.Audibert F, Dommergues M, Benattar C, Taieb J, Thalabard JC, Frydman R. Screening for Down Syndrome using first trimester ultrasound and second trimester maternal serum markers in a low risk population: a prospective longitudinal study. Ultrasound Obstet Gynecol 2001; 18: 26-31. [ Links ]
60.Schuchter K, Hafner E, Stangl G, Ogris E, Philipp K. Sequential screening for trisomy 21 by nuchal translucency measurement in the first trimester and maternal serum biochemistry in the second trimester in a low risk population. Ultrasound Obstet Gynecol 2001; 18: 23-25. [ Links ]
61.Nicolaides KH, Sebire NJ, Snijders RJ. The 11-14 weeks scan. The diagnosis of fetal abnormalities. 1ra ed, London, Parthenon Publishing Group; 1999. p. 38. [ Links ]
62.Berry E, Aitken DA, Crossley JA, Macri JN, Connor JM. Screening for Down's syndrome: changes in marker levels and detection rates between first and second trimester. Br J Obstet Gynecol 1997; 104: 811-17. [ Links ]
63.Spencer K, Souter V, Tul N, Snijders R, Nicolaides KH. A screening program for trisomy 21 at 10-14 weeks using fetal nuchal translucency, maternal serum free B-human chorionic gonadotropin and pregnancy-associated plasma protein A. Ultrasound Obstet Gynecol 1999; 13: 231-7. [ Links ]
64.Brizot Ml, Snijders RJ, Butler J, Bersinger NA, Nicolaides KH. Maternal serum hCG and fetal nuchal translucency thickness for the prediction of fetal trisomies in the first trimester of pregnancy. Br J Obstet Gynaecol 1995; 102: 127-32. [ Links ]
65.De Graaf IM, Pajkrt E, Bilardo CM, Leschot NJ, Cuckle HS, Van Lith JM. Early pregnancy screening for fetal aneuploidy with serum markers and nuchal translucency. Prenat Diagn 1999; 19: 458-62. [ Links ]
66.Brizot ML, Snijders RJ, Bersinger NA, Kuhn P, Nicolaides KH. Maternal serum pregnancy associated placental protein A and fetal nuchal translucency thickness for the prediction of fetal trisomies in early pregnancy. Obstet Gynecol 1994; 84: 918-22. [ Links ]
67.Orlandi F, Damiani G, Hallahan TW, Krantz DA, Macri JN. First trimester screening for aneuploidy: biochemistry and nuchal translucency. Ultrasound Obstet Gynecol 1977; 10: 381-6. [ Links ]
68.De Biaso P, Siccardi M, Volpe G, Famularo L, Santi P, Canini S. First trimester screening for Down's syndrome using nuchal translucency measurement with free B-hCG and PAPP-A between 10 and 13 weeks of pregnancy: the combined test. Prenat Diagn 1999; 19: 360-3. [ Links ]
69.Wald NJ, Rodeck C, Hackshaw AK, Walters J, Chitty L, Mackinson AM. First and second trimester antenatal screening for Down's syndrome: the results of the serum, urine and ultrasound screening study (SURUSS). Health Technology Assessment 2003; Vol 7: No 11. [ Links ]
70.Cicero S, Curcio P, Papageorghiou A, Sonek J, Nicolaides KH. Absence of nasal bone in fetuses with trisomy 21 at 11-14 weeks of gestation: an observational study. Lancet 2001; 358: 1665 -1667. [ Links ]
71.Otano L, Aiello H, Igarzabal L, Matayoshi T, Gadow EC. Association between first trimester absence of fetal nasal bone on ultrasound on Down's Syndrome. Prenat Diagn 2002; 22: 930-932. [ Links ]
72.Orlandi F, Bilardo CM, Campogrande M, Krantz D, Hallahan T, Rossi C, et al. Measurement of nasal bone length at 11-14 weeks of pregnancy and its potential role in Down's syndrome risk assessment. Ultrasound Obstet Gynecol. En prensa, 2003. [ Links ]
73.Zoppi MA, Ibba RM, Axinan C, Floris M, Manca F, Monni G. Absence of fetal nasal bone and aneuploidies at first trimester nuchal translucency screening in 5425 unselected pregnancies. Prenat Diagn. En prensa, 2003. [ Links ]
74.Cicero S, Longo D, Rembouskos G, Sachini C, Nicolaides KH. Absent nasal bone at 11-14 weeks of gestation and chromosomal defects. Ultrasound Obstet Gynecol. En prensa, 2003. [ Links ]
75.Cicero S, Bindra R, Rembouskos G, Spencer K, Nicolaides KH. Integrated ultrasound and biochemical screening for trisomy 21 using fetal nuchal translucency and absent fetal nasal bone, free b-HCG and PAPP-A at 11-14 weeks. Prenat Diagn 2003; 23: 306-310. [ Links ]
76.Nicolaides KH. Screening for chromosomal defects. Ultrasound Obstet Gynecol 2003; 21: 3131-321. [ Links ]














