Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.55 no.1 Bogotá Jan./Mar. 2004
*Ginecólogo-Oncólogo, Jefe Sección de Ginecología Oncológica, Fundación Santa Fe de Bogotá, Bogotá, Colombia.
RESUMEN
El temor al riesgo de algunos tipos de cáncer, en especial el mamario relacionado con el uso de la terapia hormonal de reemplazo, a lo largo de las últimas tres décadas ha sido un tema de controversia e investigación permanente. Al comienzo del nuevo milenio la información publicada ha permitido obtener más claridad en la materia aunque no toda la que se quisiera a pesar de las nuevas metodologías utilizadas en la investigación; sin embargo, creemos que estamos lejos de conocer la verdad. Pero probablemente más que los mismos resultados, en muchos casos es la interpretación y difusión que se le da a los mismos lo que más impacta en la toma de decisiones en la práctica médica. Diferencias poblacionales, raciales y geográficas entre otras, han mostrado grandes desigualdades en relación con el riesgo de padecer un determinado cáncer, así como las barreras económicas han limitado también la exposición a noxas cancerígenas. El papel de las combinaciones de estrógenos más progesterona y el de los estrógenos equinos conjugados está ahora más definido en relación con la carcinogénesis, pero no así el relacionado con la información sobre las nuevas moléculas, las dosis bajas y las diferentes vías de administración que ya se están utilizando. El médico deberá acudir cada vez más a las herramientas que le facilita la epidemiología para comprender mejor la información y trasmitirla a sus pacientes y los sistemas de salud deberán facilitarle a ambos los espacios suficientes para una sana decisión.
Palabras claves: cáncer, menopausia, terapia hormonal.
SUMMARY
The fear towards some types of cancer in special the breast cancer related to the use of hormonal replacement therapy has been matter of controversy and permanent investigation during the last three decades. At the beginning of this new millennium the published information has permitted to obtain more clarity in the theme. In spite of new methodologies used in the studies we are still far from the truth. Probably more than the results themselves, it is the interpretation, diffusion and management that it is given to the results themselves which impacts the most the decision-making process in the medical practice. Population, racial, and geographic differences within others have also shown great differences in relation with the risk of suffering a specific cancer. Economic barriers have also limited the exposure to cancerous agents. The relationship between cancer and the combinations of estrogens plus progesterone and with the natural conjugated estrogens alone is more defined now; but it does not occur the same with the new molecules, the different combinations, the distinct ways of administration and the low doses that are being used. The physician must appeal each time more to the tools that epidemiology supplies to have a better comprehension of information transmitted to his patients. Also, health systems must facilitate to both of the sufficient space to make a healthy decision.
Key words: cancer, menopause, hormonal therapy
INTRODUCCIÓN
Los resultados de las investigaciones más recientes sobre los riesgos y beneficios de la terapia hormonal de reemplazo (THR) en la menopausia han tenido un gran impacto tanto en la comunidad médica como en las pacientes y en especial en su calidad de vida. El temor al riesgo de cáncer es el motivo por el cual la mayoría de los profesionales de la salud y las mujeres rechazan o abandonan la terapia hormonal. A pesar que cerca de la tercera parte de la vida de las mujeres transcurre durante la menopausia, la proporción que utiliza las hormonas no es tan alta como se puede presumir, pero es precisamente este grupo el más sensible a la información. En países desarrollados como Estados Unidos, en el año 2000 aproximadamente el 38% de estas mujeres usaban THR; para ese año se hicieron alrededor de 46 millones de prescripciones de estrógenos conjugados equinos naturales, por lo cual se convirtió en el segundo medicamento más prescrito en este país y se distribuyeron 23 millones de fórmulas de la combinación de estrógenos conjugados más acetato de medroxiprogesterona. En Colombia el empleo de THR durante la menopausia es aproximadamente del 5%. La indicación más importante para el inicio de THR es la presencia de síntomas vasomotores y atrofia vulvovaginal, típicamente estos síntomas duran entre 18 y 36 meses, pero aproximadamente el 15% de las mujeres permanecerán con ellos.
En la década de 1960, el medicamento más utilizado era el estrógeno solo, pero luego del marcado incremento del carcinoma de endometrio por la falta de oposición del progestágeno, se impulsó la utilización de esquemas combinados de estrógenos más progestinas en pacientes con útero intacto. También se dispone de nuevos esquemas, nuevas moléculas y nuevas vías de administración, así como de medicamentos no hormonales y medicinas alternativas utilizadas cada vez más.
Con base en varios estudios observacionales la THR se había utilizado para el control de los síntomas climatéricos, para la prevención de la enfermedad cardiovascular y de fracturas osteoporóticas. En 1992 aparece el concepto de medicina basada en la evidencia (MBE) definida como "el uso juicioso, explícito y concienzudo de la mejor evidencia para la toma de decisiones en el cuidado de pacientes individuales". Desde entonces, la investigación ha tenido la tendencia creciente de estandarizar sus métodos, aportando información para la práctica médica individual e institucional. También ha mostrado gran relevancia en casi todas las investigaciones sobre terapia hormonal la relación que los medicamentos utilizados tienen con algunos tipos de cáncer, especialmente con los tumores mamarios, endometriales, ováricos y colónicos, materia de esta revisión a la luz de la evidencia clínica, en la cual se incluye otro aspecto no menos interesante y polémico constituído por la información relacionada con la utilización de la terapia hormonal en las pacientes sobrevivientes de cáncer.
CÁNCER DE SENO
De acuerdo con los datos del SEER (Surveillance, Epidemiology and End Results) y con base en las estadísticas registradas entre 1997 y 1999 en los Estados Unidos, una mujer que nace hoy tiene una posibilidad de uno entre ocho de padecer un carcinoma mamario alguna vez en la vida y esa posibilidad está ligada a la edad (tabla 1); entre el 75 y el 85% de estos tumores se desarrollan después de la menopausia, y para una mujer de 50 años la posibilidad de desarrollar un carcinoma mamario es del 11% en el resto de su vida. En Colombia representa la segunda causa de morbilidad por cáncer en la mujer después del cáncer de cérvix y la tercera de mortalidad después del cáncer cervical y gástrico. En el año 2000 se reportaron 5.636 casos nuevos de carcinoma mamario en el país. La incidencia de cáncer de mama estandarizada por edad en el mundo es de 35,6 por 100.000 mujeres pero varía mucho entre países, en Colombia es de 30 x 100.000 y en USA es de 98 x 100.000 mujeres.

Hace más de 100 años George Beatson1 demostró que la ooforectomía bilateral podía producir la remisión de carcinomas mamarios en pacientes premenopáusicas y desde entonces se ha tratado de dilucidar la relación entre los estrógenos y el carcinoma mamario. Algunas evidencias clínicas como el efecto antiestrogénico del tamoxifeno y del raloxifeno en la reducción del carcinoma mamario en mujeres sanas por un lado y los marcadores clínicos de exposición a estrógenos como las concentraciones altas de estrógenos, la alta densidad mamográfica y la densidad ósea aumentada permiten intuir una relación entre estos dos factores.2 Los mecanismos de control de la producción de estrógenos en la postmenopausia no son claros, aunque se sabe que la pobre producción está relacionada con la aromatización de andrógenos adrenales y ováricos y en tejidos extragonadales como hígado, músculo y tejidos grasos.3
Las mujeres homocigotas o heterocigotas que tienen polimorfismo para citocromos aunque sin una mayor incidencia de carcinoma mamario, sí presentan tumores más agresivos; aquéllas con polimorfismo del gen P-450 de la aromatasa pueden tener un riesgo aumentado de cáncer mamario.4 Hay variaciones tejido específico relacionadas a la expresión de genes promotores de aromatasa que pueden implicar factores específicos de transcripción en las células del cáncer mamario; de esta manera una aromatización in situ en los tumores de seno puede incrementar los estrógenos en el tejido mamario lo que contribuye al crecimiento tumoral por producción autocrina o paracrina. La supresión de inhibidores específicos de los promotores, puede incrementar también la síntesis de RNA mensajero de la aromatasa.
Los estrógenos son catabolizados principalmente por reacciones de hidroxilación y metabolitos como la 4-hidroxiestrona y la 16-alfa-hidroxiestradiol que son conocidos por ser factores probablemente carcinogénicos. Los metabolitos 2-hidroxi son considerados como anticancerígenos. La 2-hidroxilación del estradiol está aumentada en las fumadoras, lo cual puede explicar al menos en parte por qué tienen un menor riesgo para cáncer mamario y uterino pero con mayor incidencia de osteoporosis. El polimorfismo del catecol O-metiltransferasa también ha sido asociado con un aumento de 4 veces el riesgo del cáncer mamario. La enzima 17 beta-hidroxiesteroide deshidrogenasa que cataliza la conversión de estrona a estradiol se encuentra en mayor concentración en tumores mamarios que en tejido normal y confiere a las células cancerosas un medio ambiente favorable para el crecimiento. La evaluación cuantitativa ha demostrado que en los tumores mamarios humanos la síntesis de E1 vía sulfatasa es mucho más precursora de E2 que la androstenediona vía aromatasa y clínicamente se ha reportado un riesgo mayor para cáncer mamario en las mujeres delgadas. La sensibilidad de los tejidos parece explicar la diferencia del riesgo para cáncer mamario. Existen dos tipos de receptores de estrógenos: alfa y beta, que mediante el complejo ligando-receptor se unen y activan secuencias específicas en la región regulatoria de los genes respondedores a estrógeno. Los niveles de estrógeno-receptor son bajos en el tejido mamario normal, varían de mujer a mujer y aumentan con la edad. Por otra parte, el complejo del ligando y el RE se unen a una proteína denominada "adaptador" que permite el contacto con la región del gen; se conocen al menos 15 diferentes adaptadores que pueden ser expresados exclusivamente en un único tipo de tejido. Para una sustancia estrogénica dada la magnitud de las acciones biológicas pueden cambiar dependiendo del contexto de la célula y algunos tejidos pueden convertir compuestos en otros más o menos activos.5 Probablemente las mujeres que tengan un genotipo de alto riesgo con prolongada exposición a estrógenos, con altas concentraciones séricas de estradiol y un alto índice de masa corporal tendrán una mayor posibilidad de desarrollar cáncer de seno.
En 1989, Bergvist y colaboradores6 publicaron los resultados de un estudio retrospectivo que buscaba determinar el riesgo de cáncer mamario en mujeres suecas después de recibir THR. El 56% de las pacientes habían recibido estradiol, el 22% estrógenos conjugados, el 31% estrógenos más progesterona y el 22% otros estrógenos. En el grupo de las pacientes tratadas solo con estrógenos el RR fue de 0,8 pero aumentó a 1,8 cuando estos se tomaron por más de nueve años y cuando se asoció el estrógeno con la progesterona el RR fue de 4,4. El estudio no discriminó el tipo de estrógeno. Tanto Steinberg y colaboradores,7 quienes revisaron los estudios publicados hasta entonces como Sillero-Arenas en España,8 en un metanálisis observaron una asociación ligeramente positiva entre THR y cáncer mamario, que se incrementaba con el tiempo de uso.
Colditz y colaboradores habían publicado en 1992 y 1993 los resultados del seguimiento de la cohorte de enfermeras de Harvard, y en 1995 presentaron los resultados con 725.550 personas-año de seguimiento y 1.935 casos de cáncer de seno. El riesgo relativo con solo estrógenos fue de 1,32 (IC 1,14 - 1,54) y con estrógenos mas progesterona 1,41 (IC 1,15 - 1,74); para pacientes que utilizaron solo progesterona el RR fue de 2,24 (IC 1, 26 - 3, 98). El riesgo aumentaba solamente con el uso de la THR por más de cinco años y se incrementaba en el grupo entre 65 y 69 años.9
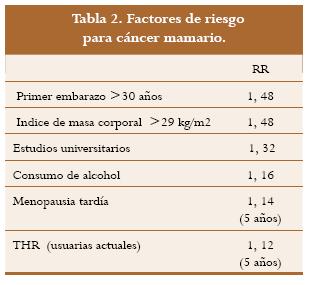
The Cochrane Collaborative Group10 en uno de los análisis mas ambiciosos reunió y revisó los datos epidemiológicos de 51 centros de varios países que incluían 52.705 pacientes con cáncer mamario y 108.411 mujeres sanas cuyos datos en relación con los factores de riesgo para cáncer mamario se anotan en la tabla 2 y gráfica 1. Se encontró una asociación positiva con el uso de la THR, pero el riesgo se incrementó después del quinto año de usarla y la divergencia de las curvas no fue tan marcada.

Según Dupont y Page, la hiperplasia proliferativa sin atipia confiere un RR de 1,37 y la hiperplasia atípica aumenta a 2,87 en las mujeres que reciben terapia estrogénica frente a 2,53 y 1,13 respectivamente en quienes no la reciben.11
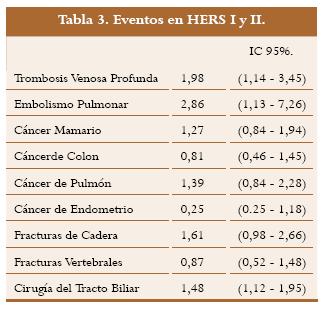
El HERS12 es un estudio aleatorizado, realizado para determinar los efectos de estrógenos más progesterona comparados con placebo en 2.763 pacientes ancianas posmenopáusicas con enfermedad coronaria previa y útero intacto. Los hallazgos del HERS no mostraron efectos en la cardiopatía con un riesgo aparente en el primer año después de la aleatorización y supresión del efecto protector dado por las hormonas encontrado en otros estudios observacionales. Luego de la publicación del HERS se reanalizaron sus datos y detectó una elevación temprana del riesgo cardiovascular entre mujeres con enfermedad previa. Se continuó la vigilancia de la afección en el estudio HERS II por 2,7 años adicionales. En el HERS se aleatorizaron 1.380 mujeres en el grupo de terapia hormonal y 1.383 en el grupo placebo. De estas, 1.156 y 1.165 se enrolaron en el HERS II, cifra que representaba el 93% de las 2.485 mujeres supervivientes. El estado de salud se conoció en el 99,8 % de las pacientes al final del HERS II y el promedio de duración de la vigilancia fue de 6,8 años.13
Se presentaron 261 muertes en el grupo de terapia hormonal y 239 en el de placebo; el 61% por enfermedad cardiovascular, el 19% por cáncer y el 20% por otras causas. Los análisis de este estudio permiten concluir que el tratamiento con estrógenos más progesterona en mujeres adultas con enfermedad coronaria incrementa las tasas de tromboembolismo venoso, por lo que la THR no debe utilizarse para prevención de enfermedad cardiovascular. (tabla 3)
El estudio WHI14 enroló 161.809 mujeres postmenopáusicas entre los 50 y 79 años entre 1993 y 1998 en 40 centros clínicos en los Estados Unidos. El principal objetivo era determinar los efectos del tratamiento con estrógenos equinos naturales conjugados a la dosis de 0,625 mgs más acetato de medroxiprogesterona 2,5 mgrs frente a placebo, sobre la enfermedad cardiovascular. El estudio se limitó a las 16.608 mujeres con útero intacto, aleatorizadas en dos grupos, uno de 8.606 asignadas al grupo de hormonas y otro de 8.112 a placebo. El análisis final de los datos estaba programado para el año 2005 después de un seguimiento promedio de 8,5 años pero en la última evaluación se observó un incremento del riesgo para cáncer mamario y enfermedad cardiovascular, que sobrepasaba los beneficios evidenciados para fracturas y cáncer de colon luego de un período de 5,2 años de seguimiento, razones que indujeron a detener la investigación tempranamente. Otro brazo que estudia los efectos de los estrógenos sin progesterona frente a placebo aún continua desarrollándose.
Se presentó un incremento de cáncer de mama invasivo del 26% (38 versus 30 por 10.000 personas-año) en el grupo de estrógenos más progesterona. Las tasas de carcinoma colorrectal se redujeron en un 37% (10 versus 16 por 10.000 personas año). La incidencia del carcinoma endometrial y del carcinoma pulmonar no se vieron afectadas. Las mujeres que informaron uso de estrógenos y progesterona en la postmenopausia tenían un riesgo mayor que las que nunca habían usado la terapia (114 versus 110; HR 1,06; 95% IC 0,81 - 1,38; para mujeres con menos de cinco años de uso previo 32 versus 15; HR 2, 13; 95% IC 1,15 - 3,94; para mujeres con cinco - diez años de uso previo 11 versus 2; HR, 4,61; 95% IC 1,01 - 21,02; y para mujeres con más de diez años de uso previo 9 versus 5; HR 1,81; 95% IC 0,60 - 5,43). No se observaron interacciones entre estrógenos más progesterona y edad, raza, historia familiar, paridad, edad del primer parto, índice de masa corporal, o el índice de Gail para cáncer invasivo. No hubo diferencias entre los dos grupos aleatorizados en relación con el carcinoma in situ de mama.
Todas las causas de mortalidad estuvieron balanceadas entre los dos grupos; sin embargo, se requiere más seguimiento para definir su verdadero impacto (tabla 4). Holli y colaboradores reportaron que los tumores mamarios en pacientes que utilizan THR eran usualmente más pequeños, mejor diferenciados y con una tasa de proliferación más baja medida por la fracción de la Fase S; así mismo Bonnier describió tumores bien diferenciados15 y Squitieri encontró un menor número de mitosis.16 Estos estudios y otros similares concuerdan con los resultados del Iowa Womens`s Health Study, cuyos análisis mostraron que la exposición a la THR estuvo más frecuentemente asociada con un riesgo de carcinoma invasivo de mama con pronóstico más favorable.17

En una investigación de cohorte de 331 mujeres postmenopáusicas que presentaron consecutivamente 349 cánceres invasivos, se encontró un mayor porcentaje de receptores de estrógeno positivo en quienes recibían THR asociados a una Fase S cinco veces más alta. Parece ser que la THR estimula el crecimiento de los tumores receptores de estrógeno positivo, asociados con un mejor pronóstico y no los tumores receptores de estrógeno negativo. Algunos estudios han indicado que la THR no actúa como un carcinógeno en sí, sino como promotora de carcinomas mamarios ocultos preexistentes, modificando su historia biológica natural para que se manifiesten más pronto. Estos hallazgos explicarían el mejor pronóstico en pacientes con cáncer mamario que reciben THR.18 Sin embargo, un análisis más detallado del WHI publicado por Chlebowski muestra que en las pacientes que recibieron estrógenos más progesterona los carcinomas mamarios fueron ligeramente de mayor tamaño (1,7 frente a 1,5 cms) y presentaban estados más avanzados comparados con las que recibieron placebo; el 25,4% de las pacientes que tomaban hormonas tenían diseminación fuera de la mama o a los órganos cercanos o a ganglios linfáticos comparado con 16% en quienes tomaban placebo.
El "Million Women Study", investigación de cohorte realizado en Inglaterra, con 1´084.1100 mujeres que representan la cuarta parte de las mujeres británicas entre 50 y 64 años, reportó resultados similares a los del WHI con un incremento para usuarias de THR (TE /TEP) en la incidencia de cáncer mamario: RR 1,66; IC 95% 1,58-1,75; y un aumento de la mortalidad por este cáncer: RR 1,22; IC 95% 1,00 - 1,48. El riesgo fue mayor para las mujeres que usaron la terapia combinada con estrógenos más progesterona: 1,30, 1,21-1,45 en mujeres que tomaron únicamente estrógenos y 2,00 1,88-2,12 para usuarias de estrógenos mas progesterona. El seguimiento fue de 2,6 años para incidencia de cáncer y de 4,1 años para mortalidad y en general el riesgo absoluto de cáncer mamario con solo estrógenos no se considera alto, pero tanto en este estudio como en el WHI se necesita un mayor tiempo de seguimiento para determinar el verdadero impacto de mortalidad por cáncer mamario. El MWS encontró muy pocas diferencias entre los diferentes tipos de estrógenos y de progestinas, las dosis y las vías de administración y el tipo de regimen continuo o cíclico. Se critica a este estudio observacional por incluir una amplia variedad de medicamentos y de esquemas al momento del ingreso sin precisarse si se presentaron o no cambios en el período de seguimiento.
El estudio francés publicado en Climateric en diciembre de 2002 y dirigido por Ligniéres, que incluyó una cohorte de 3.175 mujeres posmenopáusicas con un seguimiento promedio de 8,9 años no mostró incremento del riesgo de cáncer con el uso de la THR: RR 1,005 (95% IC 0,97 - 1,05). El aspecto más importante en esta investigación es que el 83% de las usuarias de THR combinada recibían principal o exclusivamente un gel de estradiol transdérmico y el 58% tomaron progesterona micronizada, mientras que solo el 3% utilizaban acetato de medroxiprogesterona. Estos resultados, reforzados por los menores efectos secundarios en el aparato cardiovascular con la terapia transdérmica y la progesterona natural micronizada favorecen su utilización en la menopausia, esquema con el cual también se han reportado menores efectos mitogénicos en biopsias mamarias, según las investigaciones de Foidar publicadas en Fertil Steril en 1998.
En marzo de 2004 el NIH (Instituto Nacional de Salud de los EEUU) paró el brazo del WHI que estudiaba el efecto de los estrógenos solos en cerca de 11.000 mujeres posmenopáusicas sanas con antecedente de histerectomía y luego de un promedio de 6,8 años de seguimiento no encontraron incremento del cáncer mamario en las usuarias de terapia con 0,625 mg de estrógenos naturales conjugados frente al grupo control y sí observó un efecto protector con un HR de 0,77 (0,59 - 1,01) para las mujeres tratadas, con 7 casos menos por 10.000 personas - año; aunque estos datos no alcanzan a representar una diferencia estadísticamente significativa, la información es muy alentadora. Este mismo estudio no encontró afectación del aparato cardiovascular con los estrógenos, pero si se documentó un incremento de los accidentes cerebrovasculares con doce casos más por 10.000 personas-año y una disminución del riesgo de fractura con seis casos menos por 10.000 personas-año.
Son varios estudios entre observacionales, de cohorte, prospectivos y aleatorizados, en los cuales se evidencia que las progesteronas sintéticas conllevan un mayor riesgo para carcinoma mamario en las usuarias de terapia combinada, riesgo que se incrementa con el tiempo prolongado de exposición.
Estos datos nos permiten evaluar los riesgos y los beneficios de una manera más clara y mediante un consentimiento informado se puede prescribir la terapia hormonal a pacientes sintomáticas, usando las dosis más bajas y por el menor tiempo posible.
THR en supervivientes de cáncer mamario
Un poco más de 2,5 millones de supervivientes de cáncer mamario en Estados Unidos son menopáusicas; además, el 25% de las 180.000 pacientes con diagnóstico anual de estos tumores se encuentran en edad reproductiva y entre el 70 y 80% de las pacientes premenopáusicas desarrollan falla ovárica prematura secundaria al tratamiento con quimioterapia.19 Los síntomas vasomotores producen en muchas pacientes una marcada alteración de la calidad de vida. En la Clínica Mayo se llevó a cabo un estudio con 650 supervivientes de cáncer mamario y la respuesta a placebo se estimó entre 20 y 25%. Algunas opciones terapéuticas utilizadas para el manejo sintomático de la menopausia son: velafaxine, fluoxetina,21 sertralina, clonidina, vitamina E, fitoestrógenos22, 23 y terapia hormonal.
Se han publicado estudios que suman cerca de 800 pacientes sobrevivientes de carcinoma mamario sometidas a tratamiento de síntomas menopáusicos con THR que han presentado recurrencias o nuevos carcinomas entre 0% y 19% para un promedio de 5%. En una revisión sistemática realizada por Col y colaboradores24 de once estudios elegibles, cuatro tenían grupo control e incluían 214 supervivientes de cáncer mamario, que recibieron THR después de un promedio de 52 meses de intervalo libre de enfermedad. Con un promedio de seguimiento de 30 meses, 17 (4,2% por año) de las 214 usuarias de THR presentaron recurrencia comparadas con 66 (5,4% por año). El RR de recurrencia para las usuarias fue de 0,64 (IC 0,36 a 1,15). Aunque este estudio sugiere que las pacientes con historia de cáncer mamario que toman THR no tienen un riesgo incrementado de recurrencia, los datos deben ser tomados con precaución por provenir de estudios pequeños, no aleatorizados, la mayoría sin grupo control y con factores pronóstico heterogéneos; aunque el estado de los ganglios en el 70% de los casos fue negativo, similar a lo reportado en el estudio nacional norteamericano de 1983 y en el regional de 1993. Además, el tipo de terapia utilizada no fue uniforme y algunas pacientes utilizaron parches y cremas entre otros. El 80% de las pacientes tenían estados I y II. Un estudio del Royal Mardsen Hospital que incluía 523 mujeres que usaban tamoxifeno y THR no halló interacción entre el uso de la THR y el efecto del tamoxifeno en el cáncer mamario. Hasta ahora el estudio más importante es el publicado por investigadores del MD Anderson Cancer Center donde se dirigió un estudio prospectivo, aleatorizado en pacientes con estados I y II de carcinoma mamario y con un período mínimo libre de enfermedad de dos años si los receptores de estrógeno eran negativos o diez años si eran desconocidos. Se siguieron a 77 pacientes tratadas con 0,625 mg de estrógenos conjugados naturales frente a 222 controles, los dos grupos tenían características similares en relación con estadio clínico, tamaño tumoral, compromiso ganglionar, tiempo libre de enfermedad, etc; se excluyeron las pacientes con receptores de estrógeno positivo. Dos de 56 pacientes en el grupo de estrógenos (3,6%) desarrollaron un nuevo carcinoma mamario contralateral y 33 de 243 pacientes en el grupo control (13,5%) presentaron recurrencia o nuevo tumor. El período libre de enfermedad para pacientes con enfermedad localizada varía entre 70 y 90% en los primeros diez años después del diagnóstico; sin embargo, en este grupo de pacientes se presentaron menos eventos.25 El estudio escandinavo HABITS (hormonal replacement therapy alter breast cancer-is it safe?) que se inició en 1997 e incluyó 345 supervivientes de cáncer mamario interrumpió el seguimiento luego de 2,1 años por encontrar un mayor incremento de recurrencias en el grupo tratado con THR: RH 3,5 ;95% IC 1,5 - 8,1; pero por la metodología empleada como no ser enmascarado, la pérdida de seguimiento en pacientes del grupo control y la no re-estadificación al entrar en el seguimiento mamográfico entre otros le restan valor. Por ahora la THR en sobrevivientes de cáncer mamario es controversial y solo podría administrarse a pacientes muy sintomáticas con mala calidad de vida que no respondan a otras terapias, bajo consentimiento informado e idealmente incluídas en estudios de investigación.
La investigación de preferencias acerca del uso de la terapia hormonal de reemplazo en supervivientes de cáncer mamario, realizada antes del WHI, indica que el 51% de las pacientes no la tomarían aun si no tuviera impacto en la recurrencia. Un tercio podría aceptar la THR si el efecto adverso de recurrencia es menor del 3%. El 12% podría considerar la THR si el riesgo de recurrencia es del 3 al 5% y finalmente solo el 4% de los pacientes podrían aceptar la THR si el efecto en el riesgo de recurrencia excede el 5%.26
CÁNCER DE ENDOMETRIO
El carcinoma de endometrio no es muy común en la población general. Aproximadamente 3% de las mujeres de 50 años podrán presentar un carcinoma de endometrio y con el uso de estrógenos sin oposición podría llegar hasta un 20%.27 Para el año 2000 el número de casos estimados de carcinoma de endometrio fue de 2.066 casos nuevos en Colombia.
Desde la década de los 70, luego del auge de la estrogenoterapia, se sabe por estudios observacionales que el uso de estrógenos sin oposición de progesterona por periodos cortos entre uno y cinco años puede triplicar el riesgo de carcinoma infiltrante del endometrio. Los datos sugerían que para aquellas pacientes que iniciaban estrógenos al presentar la menopausia y continuaban tomándolos por el resto de sus vidas para prevenir la osteoporosis y la enfermedad coronaria el riesgo podía incrementarse hasta diez veces. La posibilidad de carcinoma endometrial se incrementa con altas dosis de estrógenos sin oposición y hay un marcado incremento asociado al uso prolongado.28 El PEPI fue el primero y más grande estudio prospectivo aleatorizado para examinar los efectos del estrógeno sin oposición en un período de tres años de seguimiento. Durante la investigación, pacientes que tomaban 0,625 mg de estrógenos conjugados desarrollaron más fácilmente hiperplasia quística simple (27%), hiperplasia adenomatosa (22,7%) o hiperplasia adenomatosa atípica (11,8%) que el grupo placebo (<0,8%). Las pacientes que tomaron 0,625 mg de estrógenos conjugados en combinación con 10 mg de acetato de medroxiprogesterona al día por 12 días o 200 mg de progesterona micronizada oral al día por 12 días o 2,5 mg de acetato de medroxiprogesterona al día continua, tenían la misma tasa de hiperplasia que el grupo placebo. En las pacientes que desarrollaron hiperplasia adenomatosa o hiperplasia atípica adenomatosa el endometrio revirtió a la normalidad en el 94% de las mujeres después de tratamiento con 10 mg de acetato de medroxiprogesterona al día por tres meses. Desde entonces a las pacientes que conservan el útero se les debe administrar progestinas con esquemas cíclicos o continuos.29 Uno de los estudios más reconocidos para precisar el verdadero impacto de la THR sobre el carcinoma de endometrio es el metaanálisis de Grady publicado en 1995,30 pero tiene la limitante de estar basado en estudios observacionales con la excepción de la investigación prospectiva de Nachtigall.31 Con base en el análisis de los estudios publicados entre 1970 y 1994 al respecto y luego de excluir los que no tenían una metodología adecuada o un número de pacientes suficientes o sin grupo control entre otros, presenta los resultados que relaciona los diferentes esquemas y sus riesgos con respecto a dosis y tiempo de uso (tabla 5).
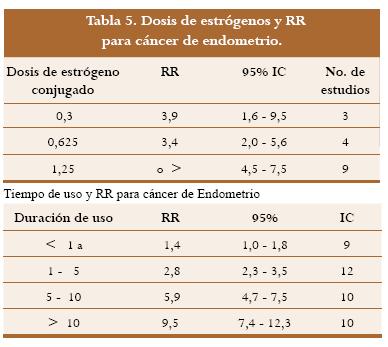
Para mujeres que utilizaron regímenes intermitentes y cíclicos, el RR fue de 3,0 (95% IC 2,4 - 3,8) y para quienes utilizaron el régimen continuo el RR fue de 2,9 (2,2 - 3,8). La no diferencia en este tópico beneficia a los regímenes cíclicos por permitir una menor dosis de progesterona, lo que implica no sólo el menor riesgo sobre la mama sino la posibilidad de no atenuar los efectos benéficos de los estrógenos, los cuales se ven neutralizados con la administración de progestinas en el metabolismo de los lípidos. El RR total estimado para mujeres que usaban estrógenos conjugados sin oposición es de 2,5 (95% IC 2,1 - 2, 9) mientras que para usuarias de estrógenos sintéticos es significativamente más bajo, RR 1,3 (95% IC 1,1 - 1, 6), hallazgo que no está claramente explicado. Una de las consideraciones es que en Europa se utilizan con frecuencia dosis bajas de estriol. Cuando se excluyeron los datos de los estudios que utilizaban estriol el RR para estrógenos sintéticos fue de 1,6 y cuando se excluyeron todos los estudios europeos el RR fue de 1,5 (95% IC 1,3 - 2,5). Con estos resultados se evidencia que la progesterona tiene sobre el epitelio endometrial un efecto antimitótico como se había intuido en estudios previos con diseño observacional.
THR en pacientes supervivientes de Ca de endometrio
Cuando la fuente de tejido endometrial ha sido removida luego de una histerectomía como parte del tratamiento del tumor, la recurrencia vendría a estar en función de las células tumorales residuales ocultas y probablemente no dependería de estimulación hormonal de novo relacionada a transformación neoplásica.
En las serie de Creasman32 de 221 pacientes con carcinoma de endometrio en estado I, 47 (21%) recibieron estrógenos después del tratamiento del carcinoma. Las pacientes que recibieron estrógenos presentaron un tiempo libre de enfermedad superior al grupo no tratado. Lee33 trató a 44 pacientes, el 31% de 114 con adenocarcinoma de endometrio en estado I. No hubo ninguna recurrencia ni muerte intercurrente en el grupo de pacientes tratadas con estrógenos; entre las 99 pacientes no tratadas hubo un 8% de recurrencias y muerte; las pacientes tratadas tenían factores de recurrencia bajos. Chapman34 publicó un estudio con 123 pacientes con adenocarcinoma de endometrio en estados I y II; prescribió estrógenos a 62 (50,5%) luego del tratamiento del cáncer; después de controlar los factores de riesgo de recurrencia, no encontró ninguna diferencia entre los dos grupos en cuanto a la tasa de tiempo de recurrencia. En abril de 2001 Suriano y colaboradores35 publicaron los resultados de una cohorte de 130 pacientes de un total de 249 mujeres con estados quirúrgicos I, II y III a quienes administraron THR iniciada luego de 1 año del tratamiento para el carcinoma de endometrio; en el 49% se adicionó progesterona al estrógeno. Los dos grupos fueron pareados y tenían las mismas características demográficas y de factores pronóstico de recurrencia. Después de un seguimiento superior a seis años se presentaron dos (1%) recurrencias entre las 75 pacientes tratadas con hormonas y once (14%) recurrencias entre las 75 no tratadas.
La información disponible permite concluir que la THR se puede administrar a pacientes con antecedente de carcinoma de endometrio y factores de recurrencia bajos, aunque faltan estudios con mayor número de pacientes que permitan obtener datos más significativos al respecto.
CÁNCER DE OVARIO
La incidencia de cáncer de ovario aumenta después de los 40 años y tiene su pico mayor entre los 70 y 75 años; mientras que para una mujer de 30 años es de 3/100.000, para una de 75 a 79 años es de 54/100.000. Actualmente es la causa más frecuente de muerte por tumores de origen ginecológico en Estados Unidos. En Colombia es la segunda causa de morbilidad y mortalidad por tumores ginecológicos después del carcinoma de cuello uterino; usualmente se presenta en estados avanzados y la sobrevida es pobre. Para el año 2000 se estimaron 1.050 casos nuevos en Colombia. El riesgo para que una mujer de 50 años en el resto de su vida desarrolle un carcinoma de ovario es de 1,7 %, relativamente bajo en relación con el carcinoma de mama (11,9%) y con el carcinoma de endometrio (2,8%). Mientras que la sobrevida a cinco años para una paciente con carcinoma mamario o de endometrio es alrededor del 80%, para una paciente con carcinoma de ovario es apenas del 35%.
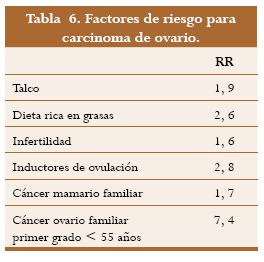
Existe información bien definida que indica la disminución de la incidencia del carcinoma de ovario con la utilización de contraceptivos hormonales orales,36 pero la relación con la THR brinda una información un poco diferente. La THR podría actuar directamente a través de receptores de estrógeno, los cuales han sido hallados tanto en tejido normal como en tumores ováricos malignos; no solo se han encontrado receptores alfa sino también beta y aun receptores de andrógenos.37 Se ha observado proliferación de líneas celulares de carcinoma ovárico in vitro expuestas a estrógeno y se han reportado niveles bajos de FSH en mujeres que posteriormente desarrollaron cáncer ovárico y también se sabe que la THR puede disminuir los niveles de FSH hasta en un 75% lo que podría aumentar el riesgo.38 El clomifeno, utilizado en fertilidad, incrementa el riesgo de cáncer y actúa por unión a los receptores de estrógeno (tabla 6); en contraste con el tamoxifén, un antiestrógeno que ha mostrado algún efecto antitumoral en el carcinoma de ovario.39
Cuatro estudios de cohorte y casos y controles realizados por Negri, Riman, Risch y Lee reportaron una asociación positiva entre el uso de terapia estrogénica y el carcinoma de ovario, mientras que Annegers y Hempling presentaron datos contrarios y las investigaciones de Whitemore, Rodríguez, Kaufman y Mink reportan nula relación.
Un meta-análisis de 15 estudios de Coughlin40 concluyó que la utilización de la terapia estrogénica no incrementa significativamente el riesgo; sin embargo, otro meta-análisis de nueve estudios reportó una asociación positiva entre el uso de THR y cáncer de ovario, con un OR de 1,15 (95% IC 1,05- 1,27) y para más de diez años de uso de 1,27 (95%IC 1,00 - 1,61).41 Un estudio prospectivo reciente de 944 carcinomas ováricos entre 211.585 mujeres postmenopáusicas reportó el doble de riesgo con la terapia estrogénica cuando se utilizó por más de diez años.42
En el estudio de Lacey y colaboradores43 con los datos de 44.139 mujeres de la cohorte del BCDDP (tabla 7) entre las cuales 329 desarrollaron carcinoma de ovario, se detectó un incremento significativo del riesgo de carcinoma de ovario especialmente para quienes la usaron por más de diez años.44

THR en supervivientes de carcinoma de ovario
La mayoría de los tumores malignos de ovario se presentan en la posmenopausia, pero un número importante ocurre en la pre y perimenopausia, por lo cual la casi totalidad de las pacientes comienzan a padecer los efectos de la deprivación hormonal a edades tempranas. Eeles y colaboradores,45 en una revisión retrospectiva en 78 de 373 pacientes evaluables con historia de carcinoma de ovario quienes habían recibido THR y no encontraron diferencia con el grupo control en la sobrevida general. Guidozzi y Daponte46 realizaron un estudio prospectivo aleatorizado con 130 pacientes menores de 59 años que tenían cirugía radical por carcinoma epitelial de ovario, seguida de al menos seis ciclos de quimioterapia con cisplatino-ciclofosfamida y un año de clorambucil, que distribuyeron en dos grupos para recibir estrógenos equinos conjugados un grupo y el otro no; todas las pacientes fueron seguidas por un mínimo de 48 meses al cabo de los cuales el tiempo promedio libre de enfermedad fue de 34 meses para el grupo que recibió estrógenos equinos conjugados y 27 para el grupo control. La sobrevida general fue de 44 meses para el grupo de estrógenos y 34 para los controles. Como era de esperarse, el mayor número de recaídas se presentó entre las pacientes con tumores mal diferenciados, estados avanzados y cirugía subóptima. Aunque las pacientes y los estudios son escasos, se observa que no solo no hay incremento del riesgo sino algún grado de protección.
CÁNCER DE COLON
El carcinoma de colon y recto es la tercera causa de muerte por cáncer en mujeres en Estados Unidos, seguido de los carcinomas de pulmón y seno. Una mujer tiene un riesgo de 5,72% en la vida de padecer un carcinoma colorectal y ese riesgo se incrementa con la edad. Los factores de riesgo para estos tumores se precisan en la tabla 8. El carcinoma de colon ha presentado una disminución del 6,6% en las mujeres estadoudinenses desde 1973 y una de las razones que explicarían el fenómeno es el uso de la THR.47

No está claro el mecanismo por el cual la THR reduce el riesgo de cáncer de colon; in vitro se ha visto proliferación de líneas celulares de carcinoma de colon en presencia de estradiol-E2, pero también se han observado diferentes respuestas en células premalignas y malignas. En la mucosa del colon normal se han encontrado altas concentraciones de 17-betahidroxiesteroide deshidrogenasa, mediadora del metabolismo de los estrógenos E2 por lo cual se ha postulado también que el metabolismo local de los estrógenos a nivel del colon puede tener un rol modulador en los tejidos.49 La disminución del carcinoma de colon en las usuarias de THR en el WHI, estudio que informa un riesgo absoluto de reducción de seis casos menos por cada 10.000 mujeres-año para un HR de 0,63 (IC 95% 0,43 - 0,92) es consecuente con varios estudios observacionales previos. La protección es mayor en quienes la tomaron recientemente, con un RR de 0,67 (95% IC 0,59-0,77) según el más reciente y completo meta-análisis llevado a cabo por Nanda y colaboradores,50 quienes revisaron los 25 estudios que hasta entonces cumplían los requisitos para evaluación. También observaron protección en las mujeres que alguna vez utilizaron la THR, pero la significancia estadística se presentó cuando se excluyó del meta-análisis el estudio de las mujeres chinas.51
OTROS MEDICAMENTOS PARA LA MENOPAUSIA
SERMS
Son moduladores selectivos de los receptores de estrógeno y tienen actividad agonista en el corazón y en el hueso mientras que en el seno y en el útero son antagonistas. Se han convertido en importantes agentes para tratamientos prolongados en sobrevivientes de tumores de mama. El tamoxifeno y el raloxifeno son los más estudiados y con mayor aplicación clínica.
El tamoxifeno compite por el receptor de estrógeno y tiene actividad paradojal tanto agonista como antagonista según el tejido donde actúe. Reduce la recurrencia en el 30 - 50 % del cáncer mamario y disminuye el riesgo de un nuevo carcinoma en cerca del 30%; puede incrementar las oleadas de calor y reduce la densidad mineral ósea en la premenopausia, pero en las pacientes posmenopáusicas con déficit estrogénico establecido incrementa la densidad ósea del 0,8 al 1,4%.52 Posee efectos antiestrogénicos a nivel mamario y estrogénicos en el endometrio por lo cual incrementa el riesgo de carcinoma de endometrio, RR de 7,5; además es un agonista sobre el colesterol sérico al producir reducción de las LDL en un 15%. Está aprobado por la FDA tanto para el tratamiento como para la prevención del carcinoma mamario.
El raloxifeno tiene actividad agonista o antagonista sobre los tejidos que responden al estrógeno. Actúa como agonista en hueso y reduce el colesterol total y las LDL. Está aprobado por la FDA para prevenir y tratar la osteoporosis pero no mejora los síntomas vasomotores. Tiene la ventaja de no estimular el endometrio y aunque el estudio MORE ha mostrado una reducción de carcinoma mamario en pacientes sanas hasta en un 70%, aún falta información que será conocida al final del estudio STAR que compara el raloxifeno con el tamoxifeno en 25.000 pacientes. El raloxifeno incrementa la densidad ósea en forma global en un 2 a 3% y reduce el riesgo de fractura en el 40%. En los primeros cuatro años del estudio MORE con una cohorte de 7.705 mujeres posmenopáusicas osteoporóticas con edad promedio de 67 años no se aumentaron los eventos cardiovasculares, pero sí hubo una disminución de los mismos entre las 1.035 pacientes con riesgo cardiovascular incrementado para un RR de 0,60 frente al grupo placebo.53
STEARS
La tibolona es un esteroide sintético con efectos estrogénicos, progestacionales y androgénicos clasificado como un STEAR (selective tissue estrogenic activity regulators). La molécula madre de la tibolona no se une a receptores de estrógeno pero su actividad estrogénica se realiza por dos metabolitos 3-OH-, 3alfa hidroxiesteroides dehidrogenasa(HSD) y 3beta HSD/isomerasa en hígado e intestino. Debido a la presencia de un grupo 3-OH en el anillo-A del esqueleto esteroideo ambos metabolitos se unen y activan el receptor de estrógeno con preferencia por el receptor alfa; además, una parte del metabolito sulfato 3-OH inactivado se encuentra en la circulación. La conjugación ocurre en el hígado vía sulfotransferasa y estas concentraciones pueden ser reactivadas en varios tejidos por sulfatasas. La tibolona y estos metabolitos inhiben la sulfatasa de manera tejido específico en tejidos como el mamario y el endometrial, pero no en el hueso donde la concentración de metabolitos sulfatados pueden servir como un reservorio de actividad estrogénica. El tercer metabolismo, el A4-isómero de la tibolona tiene actividad progestacional y expresa propiedades androgénicas cerebrales. Su actividad en hueso se facilita por la existencia en sus células de receptores de progesterona y andrógenos. No tiene actividad proliferativa en el endometrio ni en la mama y mejora la densidad mineral ósea de la columna en 8% después de dos años de tratamiento en pacientes con osteoporosis; luego de diez años de tratamiento la diferencia de la densidad mineral comparada con placebo fue del 12% para columna lumbar y cuello femoral;54 disminuye los marcadores de resorción y puede prevenir la pérdida ósea inducida por los tratamientos con análogos con dosis de 2,5 mg al día.55 El estudio de Eva Lundstrom con 166 mujeres aleatorizadas, de las cuales 48 pacientes recibieron E2/NETA, 51 tibolona y 55 placebo durante seis meses, la densidad mamográfica presentó un incremento del 2% en las pacientes que recibieron tibolona frente al 46% en el grupo que recibió E2/NETA de acuerdo con el índice de Wolf.
En los análisis del "Million Women Study" el RR para carcinoma mamario fue de 1,30 (1,21-1,45) en mujeres que tomaron unicamente estrógenos, 2,00 (1,88-2,12) con estrógenos más progesterona y el RR fue de 1,45 (1,25-1,68) con tibolona, riesgo que es superior al de estrógenos solos pero menor que la combinación de estrógenos mas progesterona.56 Desde el punto de vista cardiovascular no parece tener un efecto favorable en el endotelio, reduce el colesterol HDL y eleva la proteína C reactiva. Es un medicamento útil para controlar las oleadas de calor, la atrofia vaginal y se le atribuye mejoría de la libido. No hay estudios en supervivientes de cáncer mamario.
Bisfosfonatos
Son análogos de los pirofosfatos inorgánicos, inhiben la resorción ósea al disminuir el número y la actividad de los osteoclastos. Aumentan la densidad ósea del 4 al 9% en columna y del 1,6 al 6% en cuello femoral.
El alendronato, medicamento de segunda generación, se administra a dosis diarias de 5 mg para prevención y 10 mg para tratamiento. Se encuentran estudios con grupo placebo de control: en el estudio FIT 2 con 4.432 mujeres hubo una reducción del 44% y en el FOSIT que incluyó a 1.908 mujeres se observó un descenso del 47% en el riesgo relativo de fracturas no vertebrales.57 Hay una presentación para una dosis de 70 mg cada semana.
El risedronato, considerado de tercera generación, se prescribe a la dosis de 5 mg al día, con estudios también con grupo control se demostró una reducción en el riesgo relativo de fracturas vertebrales del 49% en el estudio VERT2 y del 30% en fracturas de cadera en el estudio HIP.58 Ahora se dispone también de una sola dosis de 35 mg semanales.
El etidronato, bisfosfonato de primera generación, según el metanálisis de Cranney y colaboradores,60 quienes incluyeron trece estudios que aleatorizaron mujeres con etidronato frente a placebo o calcio y/o vitamina D reportan un incremento de la densidad ósea en la columna lumbar en 4,06% después de uno a tres años de tratamiento y una reducción del riesgo de fracturas con un RR de 0,63 (95% IC 0,44-0,92) pero no muestran beneficio en la reducción de fracturas no vertebrales. Puede utilizarse cada dos y medio meses durante quince días a la dosis de 400 mg/día.
El ácido zoledrónico utilizado en el tratamiento de las metástasis óseas del carcinoma mamario, de próstata y en el mieloma múltiple ha mostrado una mejoría de la densidad ósea con tratamientos cíclicos. Reid61 publicó los resultados de un estudio aleatorizado, enmascarad frente a placebo y demostró que con una sola dosis anual de 4 mg de ácido zoledrónico se incrementa la densidad ósea en 5% en pacientes con osteopenia severa, resultados similares a los obtenidos con los otros bifosfonatos conocidos.
Calcitonina
Es una hormona polipeptídica producida por las células C parafoliculares del tiroides y tiene actividad osteoclástica, inhibe la resorción ósea en alrededor del 30% y aumenta la masa ósea en un 13%. La calcitonina de salmón a la dosis de 200 UI diarias en spray nasal por cinco años elevó la densidad ósea de 1 a 1,5% y la resorción ósea fue inhibida en el 12% según el estudio PROOF con 1.255 mujeres; hubo una reducción en el riesgo de fracturas vertebrales del 25,9%, pero no hubo significancia estadística para reducción del riesgo de fracturas de cadera y muñeca.
Flavonoides
Los flavonoides son benzogamapironas o fitoestrógenos que se encuentran en la mayoría de los vegetales y en mayor concentración en la soya. El más conocido es la Ipriflavona, sintetizada hace 40 años y es considerada como inhibidora de la resorción ósea. En Asia solo entre el 10% y el 20% de las mujeres experimentan calores en la menopausia comparado con el 70% a 80% en las occidentales, efecto atribuído al uso de la soya que hace parte de la dieta asiática. Para la osteoporosis posmenopáusica se utilizan dosis de 600 mg al día. En una investigación en el oeste de Washington y con apoyo del CDC de Atlanta, el 43,1% de mujeres entre 45 y 65 años habían empleado una terapia alternativa y el 22,9% productos de soya y el 7,4% de menopáusicas los usaban para el manejo de los síntomas climatéricos.62 Aunque hay muchas referencias en la literatura acerca de sus beneficios, los pocos estudios aleatorizados publicados son de poco peso por tener un número muy limitado de pacientes y con seguimientos cortos que impiden conocer además sus efectos secundarios.63 En un estudio aleatorizado, enmascarado, controlado con placebo, que utilizó una bebida de soya que contenía 90 mg de isoflavona, no se presentaron diferencias en el alivio de las oleadas de calor entre los dos grupos. En otro estudio aleatorizado con 252 participantes, en el que se usaron isoflavonas derivados del trébol rojo el efecto fue similar al obtenido en el grupo placebo aunque en este último la respuesta fue más tardía. En general, el efecto terapéutico apenas supera el obtenido con placebo pero es útil para aliviar los síntomas leves a moderados
Hormona paratiroidea
Es la principal hormona reguladora del metabolismo del calcio y estimula la formación ósea tanto en columna como en cadera. Está indicada en el tratamiento de la osteoporosis con dosis entre 20 y 40 µg subcutáneos al día y su efecto máximo se logra en doce meses.64 El teriparatide, un agente hecho de aminoácidos seleccionados hallados en la hormona paratiroidea, ha sido aprobado para el tratamiento de la osteoporosis en mujeres posmenopáusicas. No controla las oleadas de calor.
Calcio y vitamina D
Los suplementos de calcio han demostrado beneficio en la prevención de la osteoporosis y en la posmenopausia son útiles para ayudar a preservar la densidad ósea. El metanálisis (gráfica 2) que incluyó 15 estudios y 1806 pacientes postmenopáusicas reportó un RR de 0,77 (0,54 - 1,09) para fracturas vertebrales en el grupo tratado frente al grupo placebo.65 En adultos se recomiendan dosis entre 1.000 y 1.500 mg al día, dependiendo de los factores de riesgo. Para el tratamiento de las fracturas por osteoporosis 1000 mg de calcio no presentan beneficio protector sin adicionar medicamentos formadores de hueso. El citrato tiene mejor absorción y es considerado como el primer suplemento de calcio para preservar la densidad ósea en la menopausia.
La vitamina D es necesaria para la absorción del calcio en el tracto gastrointestinal; sus niveles declinan en las personas mayores, en el invierno y ante la baja exposición al sol. La mayoría de los adultos requieren 400 UI por día y después de los 61 años se recomiendan entre 600 y 1.000 UI al día, dependiendo de la exposición a los rayos solares y algunos estudios sugieren que solo es protectora si se usa en combinación con calcio. Debe anotarse que las dosis altas pueden ser tóxicas.
Otros medicamentos
Velafaxine: es un inhibidor selectivo de la recaptación de serotonina que disminuye de manera importante las oleadas de calor frente a placebo.
Fluoxetina: recomendada para disminuir los disturbios del sueño.
Sertralina: produce alguna disminución de los calores frente a estudios con placebo.
Extractos de hierbas: se han realizado algunos estudios utilizando extractos de hierbas frente a placebo y no se han encontrado beneficios más allá del efecto placebo.
Vitamina E: disminuye las oleadas de calor en cerca del 35% de las pacientes.
Clonidina: ofrece respuestas cercanas al 40% y no todas las pacientes toleran sus efectos secundarios.
Se han reportado mejorías de la sequedad vaginal y la dispareunia con una mezcla denominada Replens con resultados casi similares a los producidos por los estrógenos locales. También la utilización de geles hídricos como el KY-jelly produce mejoría de estas molestias.66
La decisión del manejo de la mujer menopáusica implica un juicioso análisis de la información disponible ante las condiciones sicobiológicas individuales y siempre en conjunto con la paciente. A cualquiera de las terapias se le debe anteponer un buen estilo de vida que incluyen una dieta balanceada rica en calcio, ejercicios antigravedad y la eliminación de elementos nocivos como el cigarrillo, el alto consumo de cafeína y el sedentarismo, con mayor énfasis en aquellas pacientes con factores de riesgo incrementados.
CONCLUSIONES
El aumento de la expectativa de vida implica que las mujeres vivan cerca de la tercera parte en la postmenopausia, etapa para la cual la THR ha sido considerada como la más efectiva en el manejo de los síntomas climatéricos severos; sin embargo, la literatura reciente la cuestiona por no haberse comprobado los efectos benéficos en relación con la protección coronaria y la enfermedad de Alzheimer y por confirmarse los riesgos carcinogénicos en relación con el carcinoma de mama. Y es precisamente el riesgo de padecer un cáncer mamario el que más ha influido en la decisión de utilizar o abandonar la terapia hormonal.
Desde hace dos décadas se vienen publicando investigaciones inicialmente observacionales, luego de cohortes y ahora estudios prospectivos, aleatorizados y enmascarados que han reportado un incremento del riesgo de cáncer mamario con el uso de la terapia hormonal, riesgo que se eleva cuando se utiliza por periodos prolongados, en especial por más de cuatro o cinco años, pero con cifras que a pesar de ser preocupantes no son consideradas tan altas por los investigadores como para proscribirlas. El mayor riesgo se ha presentado con la terapia combinada que utiliza además de estrógenos, progestágenos sintéticos, datos confirmados en la gran mayoría de los estudios. El brazo que investigaba la utilización de solo estrógenos en el WHI confirmó que después de 6,8 años en promedio de seguimiento no se encontró incremento del riesgo de cáncer mamario en cerca de 11.000 pacientes con antecedente de histerectomía y que utilizaban 0,625 mg de estrógenos equinos conjugados y los resultados dejan entrever un ligero efecto protector.
Se están investigando las bajas dosis de estrógenos que podrán producir menos efectos secundarios; también se busca evaluar el papel de nuevas progestinas y considerar la opción de la progesterona natural micronizada que en algunos estudios ha demostrado tener menos efectos indeseables que las sintéticas. Los estrógenos transdérmicos también se han convertido en una alternativa por tener menos implicaciones en el daño endotelial al evitarse el paso hepático. Los tumores malignos de ovario también presentan un ligero icremento con la terapia hormonal, el carcinoma de endometrio no se ve afectado con la terapia hormonal combinada que incluya al menos doce días de gestágenos cada mes; y el carcinoma de colon muestra un menor riesgo en las pacientes que la reciben. La tibolona es una molécula que también presenta buen control de la sintomatología climatérica, pero solo un estudio grande ha investigado su relación con el cáncer mamario y le confiere un riesgo mayor que con estrógenos solos pero menor que el de la terapia combinada de estrógenos mas progesterona.
Infortunadamente las demás terapias utilizadas en el manejo de la sintomatología climatérica severa presentan respuestas menos que satisfactorias incluyendo los fitoestrógenos. El empleo de la terapia hormonal deberá circunscribirse a las pacientes con síntomas de moderados a severos, por periodos no mayores de tres a cuatro años y con evaluación periódica cada año para considerar la necesidad de continuarla o no. Para pacientes que por sintomatología severa persistente no controlable con otras terapias y con necesidad absoluta de prolongar el tratamiento por más de cuatro años, se podrá continuar previa consideración de los riesgos individuales y con una juiciosa evaluación de los aspectos clínicos y paraclínicos con énfasis en la evolución mamográfica del tejido y desde luego mediante consentimiento informado suscrito por la paciente. La investigación sobre la utilización de terapia hormonal en supervivientes de cáncer mamario aunque es prometedora aun es insuficiente, deberá ser tema de decisión de una junta multidisciplinaria e idealmente las pacientes deberían entrar a un protocolo de investigación. Para pacientes con sintomatología climatérica menor se dispone de un buen grupo de medicinas descritas en esta revisión. Hoy también se encuentran medicamentos muy activos para la prevención y el manejo de la osteoporosis como los bisfosfonatos, el raloxifeno, la calcitonina y la PTH. De acuerdo con la investigación reciente, la terapia hormonal no está indicada en la prevención de enfermedades crónicas como la coronariopatía ni la enfermedad de Alzheimer. La historia familiar y los riesgos para trombosis venosa, embolismo pulmonar y accidentes cerebrovasculares siempre deberán evaluarse con base en la mejor evidencia y cuando se administre la terapia deberá hacerse con las dosis efectivas más bajas y por el menor tiempo posible. La juiciosa utilización de la información, la prevención y la calidad de vida de nuestras pacientes deberán constituir la base de nuestro trabajo siempre acorde con las condiciones sicobiológicas de cada paciente en particular.
REFERENCIAS
1. Clemons M, Goss P. Estrogen and the risk of breast cancer. N Engl J Med 2001;344;276-85. [ Links ]
2. Cosman F, Lindsay R. Selective estrogen receptors modulators: clinical spectrum. Endocr Rev 1999;20:418-34. [ Links ]
3. Santen RJ, Leszczynski D, Tilson-Mallet N, Feil PD, Wright C, Manni A, et al. Enzymatic control of estrogen production in human breast cancer: relative significance of aromatase versus sulfate pathways. Ann NY Acad Sci 1986;464:126-37. [ Links ]
4. Siegelmann-Danieli N, Buetow KH. Constitutional genetic variation at the human aromatase gene (Cyp 19) and breast cancer risk. Br J Cancer 1999;79: 456-63. [ Links ]
5. Khan SA, Rogers MA, Obando JA, Tamsen A. Estrogen receptor expression of benign breast epithelium and its association with breast cancer. Cancer Res 1994;54:993-7. [ Links ]
6. Bergkvist L, Adami HO, Persson I, Hoover R, Schairer C. The risk of breast cancer after estrogen and estrogen-progestin replacement. N Engl J Med 1989;321:293-7. [ Links ]
7. Steinberg KK, Thacker SB, Smith SJ, Stroup DF, Zack MM, Flanders WD, et al. A meta-analysis of the effect of estrogen replacement therapy on the risk of breast cancer. JAMA 1991;265:1985-90. [ Links ]
8. Sillero-Arenas M, Delgado-Rodriguez M, Rodigues-Canteras R, Bueno-Cavanillas A, Galvez-Vargas R. Menopausal hormone replacement therapy and breast cancer: a meta-analysis. Obstet Gynecol 1992;79:286-94. [ Links ]
9. Colditz GA, Hankinson SE, Hunter DJ Willett WC, Manson JE, Stampfer MJ, et al. The use of estrogens and progestins and the risk of breast cancer in postmenopausal women. N Engl J Med 1995;332:1589-93. [ Links ]
10. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative reanalysis of data from 51 epidemiological studies of 52,705 women with breast cancer and 108,411 women without breast cancer. Lancet 1997;350:1047-59. [ Links ]
11. Dupont WD, Page DL, Parl FF, Plummer WD Jr, Schuyler PA, Kasami M, et al. Estrogen replacement therapy in women with a history of proliferative breast disease. Cancer 1999;85:1277-83. [ Links ]
12. Hulley S, Grady D, Bush T, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart And Estrogen/ Progestin Replacement Study (HERS) Research Group. JAMA 1998:605-13. [ Links ]
13. Grady D, Herrington D, Bittner V, Blumenthal R, Davidson M, Hlatky M, et al. Cardiovascular disease outcomes during 6,8 years of hormone therapy: heart and estrogen/progestin replacement study follow-up (HERS II) JAMA 2002;288:49-57. [ Links ]
14. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women's Health Initiative randomized controlled trial. JAMA 2002;288:321-33. [ Links ]
15. Bonnier P, Romain S, Giacalone PL, Laffargue F, Martin PM, Piana L. Clinical and biological prognostic factors in breast cancer diagnosed during postmenopausal hormone replacement therapy. Obstet Gynecol 1995;85:11-7. [ Links ]
16. Squitieri R, Tartter PI, Ahmed S, Brower ST, Theise ND. Carcinoma of the breast in postmenopausal hormone user and nonuser control groups. J Am Coll Surg 1994;178:167-70. [ Links ]
17. Gapstur SM, Morrow M, Sellers TA. Hormone replacement therapy and risk of breast cancer with a favorable histology: results of the Iowa Women's Health Study. JAMA 1999;281:2091-7. [ Links ]
18. Cobleigh MA, Norlock FE, Oleske DM, Starr A. Hormone replacement therapy and high S phase in breast cancer. JAMA 1999;281:1528-30. [ Links ]
19. DiSaia PJ, Grosen EA, Kurosaki T, Gildea M, Cowan B, Anton-Culver H. Hormone replacement therapy in breast cancer survivors: a cohort study. Am J Obstet Gynecol 1996;174:1494-8. [ Links ]
20. Loprinzi CL, Sloan JA, Perez EA, et al. Fluoxetine reduces hot flashes. Program and abstracts of the 37 Annual Meeting of the American Society of Clinical Oncology, May 12-15, 2001; San Francisco, California, Abstract 199. [ Links ]
21. Jacobson JS, Grann VR, Troxel AB, et al. Randomized trial of an herbal remedy for hot flashes among women with breast cancer. Program and abstracts of the 37th Annual Meeting of the American Society of Clinical Oncology; May 12-15, 2001; San Francisco, California. Abstract 1593. [ Links ]
22. Baber RJ, Templeman C, Morton T, Kelly GE, West L. Randomized placebo-controlled trial of an isoflavone supplement and menopausal symptoms in women. Climacteric 1999;2:85-92. [ Links ]
23. Tice JA, Ettinger B, Ensrud K, Wallace R, Blackwell T, Cummings SR. Phytoestrogen supplements for the treatment of hot flashes: the Isoflavone Clover Extract (ICE) Study: a randomized controlled trial. JAMA 2003;290:207-14. [ Links ]
24. Col NF, Hirota LK, Orr RK, Erban JK, Wong JB, Lau J. Hormone replacement therapy after breast cancer: a systematic review and quantitative assessment of risk. J Clin Oncol 2001;19:2357-63. [ Links ]
25. Vassilopoulou-Sellin R, Cohen DS, Hortobagyi GN, Klein MJ, McNeese M, Singletary SE, et al. Estrogen replacement therapy for menopausal women with a history of breast carcinoma: results of a 5-year, prospective study. Cancer 2002;95(9):1817-26. [ Links ]
26. Santen R, Pritchard K, Burger H. The consensus conference on treatment of estrogen deficiency symptoms in women surviving breast cancer. Obstet Gynecol Surv 1998;53(10 Suppl):S1-83. [ Links ]
27. Grady D, Rubin SM, Petitti DB, Fox CS, Black D, Ettinger B, et al. Hormone therapy to prevent disease and prolong life in postmenopausal women. Ann Intern Med 1992;117:1016-37. [ Links ]
28. Mack TM, Pike MC, Henderson BE, Pfeffer RI, Gerkins VR, Arthur M, et al. Estrogens and endometrial cancer in a retirement community. N Engl J Med 1976;294:1262-7. [ Links ]
29. The Writing Group for the PEPI Trial. Effects of hormone replacement therapy on endometrial histology in postmenopausal women. The Postmenopausal Estrogen/Progestin Interventions (PEPI) Trial. JAMA 1996;370-5. [ Links ]
30. Grady D, Gebretsadik T, Kerlikowske K, Ernster V, Petitti D. Hormone replacement therapy and endometrial cancer risk: a meta-analysis. Obstet Gynecol 1995;85:304-13. [ Links ]
31. Nachtigall LE, Nachtigall RH, Nachtigall RD, Beckman EM. Estrogen replacement therapy II: a prospective study in the relationship to carcinoma and cardiovascular and metabolic problems. Obstet Gynecol 1979:54:74-9. [ Links ]
32. Creasman WT, Henderson D, Hinshaw W, Clarke-Pearson DL. Estrogen replacement therapy in the patient treated for endometrial cancer. Obstet Gynecol.1986;67:326-30. [ Links ]
33. Lee RB, Burke TW, Park RC. Estrogen replacement therapy following treatment for stage I endometrial carcinoma. Gynecol Oncol 1990;36:189-91. [ Links ]
34. Chapman JA, DiSaia PJ, Osann K, Roth PD, Gillotte DL, Berman ML. Estrogen replacement in surgical stage I and II endometrial cancer survivors. Am J Obstet Gynecol 1996;175:1195-200. [ Links ]
35. Suriano KA, McHale M, McLaren CE, Li KT, Re A, DiSaia PJ. Estrogen replacement therapy in endometrial cancer patients: a matched control study. Obstet Gynecol 2001;97:555-60 [ Links ]
36. The Cancer and Steroid Hormone Study of the Centres for Disease Control and National Institute of Child Health and Human Development. The reduction in risk of ovarian cancer associated with oral-contraceptive use. N Engl J Med 1987;316:650-5 [ Links ]
37. Lau KM, Mok SC, Ho SM. Expression of human estrogen receptor-alfha, and -beta, progesterone receptor, and androgen receptor mRNA in normal and malignant ovarian epithelial cells. Proc. Natl Acad Sci USA 1999;96:5722-7. [ Links ]
38. Mercuri N, Petraglia F, Genazzani AD, Amato F, Sgherzi MR, Maietta-Latessa A, et al. Hormonal treatments modulate pulsatile plasma growth hormone, gonadotrophin and osteocalcin levels in postmenopausal women. Maturitas 1993;17:51-62. [ Links ]
39. Markman M, Iseminger KA, Hatch KD, Creasman WT, Barnes W, Dubeshter B. Tamoxifen in platinum-refractory ovarian cancer: a Gynecologic Oncology Group ancillary report. Gynecol Oncol 1996;62:4-6. [ Links ]
40. Coughlin SS, Giustozzi A, Smith SJ, Lee NC. A meta-analysis of estrogen replacement therapy and risk of epithelial ovarian cancer. J Clin Epidemiol 2000;53:367-75. [ Links ]
41. Garg PP, Kerlikowske K, Subak L, Grady D. Hormone replacement therapy and the risk of epithelial ovarian carcinoma: a meta-analisys. Obstet Gynecol 1998;92:472-9. [ Links ]
42. Rodriguez C, Patel AV, Calle EE, Jacob EJ, Thun MJ. Estrogen replacement therapy and ovarian cancer mortality in a large prospective study of US woman. JAMA 2001;285:1460-5. [ Links ]
43. Lacey JV Jr, Mink PJ, Lubin JH, Sherman ME, Troisi R, Hartge P, et al. Menopausal hormone replacement therapy and risk of ovarian cancer. JAMA 2002;288:334-41. [ Links ]
44. Purdie DM, Bain CJ, Siskind V, Russell P, Hacker NF, Ward BG, et al. Hormone replacement therapy and risk of epithelial ovarian cancer. Br J Cancer 1999;81(3):559-63. [ Links ]
45. Eeles RA, Tan S, Wiltshaaw E, Fryatt I, A'Hern RP, Shepherd JH, et al. Hormonal replacement therapy and survival alter surgery for ovarian cancer. BMJ 1991;302:259-62. [ Links ]
46. Guidozzi F, Daponte A. Estrogen replacement therapy for ovarian carcinoma survivors. Cancer 1999;86:1013-8. [ Links ]
47. Potter JD. Hormones and colon cancer. J Natl Cancer Inst 1995;87:1039-40. [ Links ]
48. Calle EE, Miracle-McMahill HL, Thun MJ, Heath CW Jr. Estrogen replacement therapy and the risk of fatal colon cancer in a prospective cohort of postmenopausal women. J Natl Cancer Inst 1995;87:517-23. [ Links ]
49. English MA, Stewart PM, Hewison M. Estrogen metabolism and malignancy: analysis of the expression and function of 17beta-hydroxysteroids dehydrogenases in colonic cancer. Mol Cell Endocrinol 2001;171:53-60. [ Links ]
50. Nanda K, Bastian LA, Hasselblad V, Simel DL. Hormone replacement therapy and the risk of colorectal cancer: a meta-analysis. Obstet Gynecol 1999;93:880-8. [ Links ]
51. Wu-Williams AH, Lee M, Whittemore AS, Gallagher RP, Jiao DA, Zheng S, et al. Reproductive factors and colorectal cancer risk among Chinese females. Cancer Res 1991;51:2307-11. [ Links ]
52. Love RR, Barden HS, Mazess RB, Epstein S, Chappell RJ. Effect of tamoxifen on lumbar spine bone mineral density in postmenopausal women after five years. Arch Intern Med 1994;154:2585-8. [ Links ]
53. Delmas PD, Bjarnason NH, Mitlak BH, Ravoux AC, Shah AS, Huster WJ, et al. Effects of raloxifene on bone mineral density, serum cholesterol concentrations, and uterine endometrium in postmenopausal women. N Engl J Med 1997;337:1641-7. [ Links ]
54. Barrett-Connor E, Grady D, Sashegyi A, Anderson PW, Cox DA, Hoszowski K, et al. Raloxifene and cardiovascular events in osteoporotic postmenopausal women: four-year results from the MORE (Multiple Outcomes of Raloxifene Evaluation) randomized trial. JAMA 2002;287:847-57. [ Links ]
55. Rymer J, Robinson J, Fogelman I. Ten years of treatment with tibolone 2,5 mg daily; effects on bone loss in postmenopausal women. Climacteric 2002;5:390-8. [ Links ]
56. Kloosterboer HJ, Ederveen AGH. Pros and cons existing treatment modalities in osteoporosis: a comparison between tibolone, SERMs and estrogen (+/-progestogen) treatments. J Steroid Biochem Mol Biol 2002;83:157-65. [ Links ]
57. Beral V; Million Women Study Collaborators. Breast cancer and hormone-replacement therapy in the Million Women Study. The Lancet 2003;362:419-27. [ Links ]
58. Pols HA, Felsenberg D, Hanley DA, Stepan J, Munoz-Torres M, Wilkin TJ, et al. Multinational, placebo-controlled, randomized trial of the effects of alendronate on bone density and fracture risk in postmenopausal women with low bone mass: results of the FOSIT Study. Foxamax International Trial Study Group. Osteoporos Int 1999;9:461-8. [ Links ]
59. Reginster J, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporos Int 2000;11:83-91. [ Links ]
60. Cranney A, Guyatt G, Krolicki N, Welch V, Griffith L, Adachi JD, et al. A Meta-analysis of etidronate for the treatment of postmenopausal osteoporosis. Osteoporos Int 2000;12:140-51. [ Links ]
61. Reid I, Brown J, Burkhard P, et al. Intravenous Zoledronic Acid in Postmenopausal women with low bone mineral density. N Engl J Med 2002;346:653-61. [ Links ]
62. Newton K, Buist D, Keenan N, Anderson LA, LaCroix AZ. Use of alternative therapies for menopause symptoms: results of a population-based survey. Obstet Gynecol 2002;100:18-25. [ Links ]
63. Tice J, Ettinger B, Ensrud K, Wallace R, Blackwell T, Cummings SR. Phytoestrogen supplements for the treatment of hot flashes: the Isoflavone Clover Extract (ICE) Study. JAMA 2003;290:207-14. [ Links ]
64. Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Effect of parathyroid hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001;344(19):1434-41. [ Links ]
65. Shea B, Wells G, Cranney A, Zytaruk N, Robinson V, Griffith L, et al; Osteoporosis Methodology Group and The Osteoporosis Research Advisory Group. Meta-analyses of therapies for postmenopausal osteoporosis. VII. Meta-analysis of calcium supplementation for the prevention of postmenopausal osteoporosis. Endocr Rev 2002;23:552-9. [ Links ]
66. Ganz PA. Menopause and breast cancer: symptoms, late effects and their management. Semin Oncol 2001;28:274-83. [ Links ]














