Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.56 no.2 Bogotá Apr./June 2005
* Residente de IV año. Ginecología y Obstetricia. Universidad El Bosque. Hospital Simón Bolívar, Bogotá.
** Ginecólogo obstetra. Instructor asociado Universidad El Bosque. Hospital Simón Bolívar. Clínica Palermo. Bogotá. Correo electrónico: jarobg@yahoo.com
RESUMEN
La cirugía de abdomen abierto para el manejo de algunas patologías severas en obstetricia ha aumentado y actualmente es común en muchas de nuestras pacientes. Los beneficios incluyen la prevención y tratamiento del Síndrome de Hipertensión Intraabdominal (HIA), de las infecciones de la cavidad peritoneal y el del Síndrome Compartimental Abdominal (SCA) secundario a enfermedades potencialmente catastróficas como la preeclampsia severa y Síndrome de HELLP. La presente revisión explora los mecanismos de infección, las consecuencias fisio-patológicas del SCA y las nuevas técnicas quirúrgicas de la cirugía de abdomen abierto para el manejo adecuado de estas entidades.
Palabras clave: síndrome compartimiento abdominal, hipertensión intraabdominal, técnicas sutura.
SUMMARY
Intentional open abdominal management of severe pathologies is becoming increasingly common in obstetrics when dealing with our patients. The benefits include preventing and treating intra-abdominal hypertension (IAH), intra-abdominal infection and abdominal compartment syndrome (ACS) accompanying a frequent and catastrophic illness such as severe preeclampsia and HELLP syndrome. This review covers infection mechanisms, physiopathological consequences of ACS and traditional and new abdominal techniques for open abdominal surgery leading to their suitable treatment.
Key words: abdomen, compartment syndrome, intra-abdominal hypertension, suture techniques.
INTRODUCCIÓN
Es indiscutible el gran número y reciente incremento de las patologías ginecoobstétricas de alta morbimortalidad y tratamiento en Unidades de Cuidado Intensivo, que requieren un manejo intencional con abdomen abierto, debido al aumento importante de la presión intra abdominal. Entre éstas se cuenta la sepsis de origen obstétrico, los estados hipertensivos severos en el embarazo, el Síndrome de HELLP y la hemorragia pélvica que se produce durante los procedimientos ginecoobstétricos.
Definitivamente, la prevención de tales complicaciones es un aspecto fundamental en la práctica médica, y requiere un conocimiento adecuado de la fisiología, de la anatomía obstétrica y de la técnica quirúrgica, así como una valoración integral de la paciente. Sin embargo, tras la instauración de estas patologías, y debido a su carácter letal, dado por la caída del gasto cardíaco, la alteración de la mecánica respiratoria, la oliguria y la distensión abdominal, es necesaria la rápida y oportuna descompresión abdominal quirúrgica y la cirugía de abdomen abierto, pues como se referirá adelante, los índices de mortalidad pueden llegar hasta el 75%, siendo del 11 al 20% debidos a hemorragia pélvica postquirúrgica.
En el momento no se cuenta con evidencia científica concreta respecto a la incidencia exacta de estas entidades y su posterior manejo quirúrgico, ya que la información varía según el tipo de medición efectuada y el grupo de estudio seleccionado. Se estima que su incidencia oscila entre 0,1 a 33% de los pacientes sometidos a procedimientos quirúrgicos, y hasta el 10% de las patologías obstétricas no quirúrgicas, con un ingreso a la UCI promedio de 3 de cada 1.000 pacientes obstétricas atendidas.1,2
La mayoría de estas pacientes están críticamente enfermas, por lo tanto la cirugía de abdomen abierto no necesariamente disminuye la frecuencia de falla orgánica múltiple y muerte, pero sin su uso la oportunidad de que sobrevivan es extremadamente baja.3
El objetivo de la presente revisión es hacer una descripción detallada de la técnica de cirugía de abdomen abierto y los cambios fisiopatológicos, diagnóstico y manejo de diferentes patologías que nos indican su uso como el Síndrome Hipertensión Intra-Abdominal (HIA) y el Síndrome de Compartimiento Abdominal (SCA) relacionados y aplicados a la obstetricia de tercer nivel.
METODOLOGÍA
Con base en las consideraciones mencionadas, realizamos una búsqueda sistemática de la literatura publicada en idioma inglés a través de Medline, sin restricción de fecha, usando las palabras clave descritas. Debido a la gran cantidad de reportes de casos encontrados, y muy pocos relacionados con obstetricia, utilizamos parte de dicha literatura para el complemento de nuestra revisión incluyendo literatura nacional mencionada en los artículos internacionales.
ABDOMEN ABIERTO: GENERALIDADES Y ASPECTOS HISTÓRICOS
En ciertas entidades clínico-patológicas donde se hace necesaria la reexploración de la cavidad abdominal para lavado, revisión o descompresión rápida y permanente, la técnica de abdomen abierto surge como la principal alternativa. El cierre temporal del abdomen creando una laparostomía (término que se usaba para designar a la cavidad que se dejaba “abierta para granulación”), facilita un second-look, preserva la fascia y facilita la descompresión. En la actualidad se utiliza frecuentemente como sinónimo de una variedad de técnicas de cierre temporal abdominal (temporary abdominal closure).
En 1905 Price, y en 1906 Torek, demostraron la efectividad del debridamiento y el lavado de la cavidad peritoneal en pacientes con apendicitis, reduciendo su mortalidad. Sin embargo en un contundente artículo de la primera edición de Surgical Ginecology and Obstetrics en 1905, Jonathon Yates concluyó que era “(…) física y fisiológicamente imposible drenar toda la cavidad peritoneal…”.4 Schumer en 1960, introdujo la irrigación continua postoperatoria intraperitoneal. Steimberg fue el primero en proponer el manejo de la cavidad peritoneal como absceso, dejándola abierta por 48 a 72 horas, obteniendo una tasa de mortalidad de tan sólo 7% entre sus pacientes.
INDICACIONES
Las indicaciones de cirugía de abdomen abierto en ginecoobstetricia, en general, se resumen en circunstancias en donde la reexploración es mandataria tal como los casos de peritonitis (secundaria o terciaria), trauma (cirugía de control de daños) y Síndrome Compartimental Abdominal (SAC). La decisión de programar a un paciente para una reexploración abdominal secuencial podría basarse en un sistema de puntuación, como los sistemas APACHE II5 y el Índice de Peritonitis de Mannheim (MPI), que han demostrado una correlación con el resultado final de la patología establecida.6,7 El MPI es más específico para peritonitis y puede realizarse durante el acto quirúrgico inicial.7
Como se mencionó anteriormente, las principales indicaciones de abdomen abierto son la infección intraabdominal (57%) y el síndrome de hipertensión intraabdominal que conlleva al síndrome compartimental abdominal (16%), que relacionaremos a continuación de manera rápida y específica por seguimiento a 377 pacientes entre 1988 y 1999 en Alemania.8
Infecciones intra-abdominales
La superficie total del peritoneo es de 1,7 m2, estéril y contiene 50 mililitros de un líquido de color amarillo claro.9, 10
El peritoneo consta de una sola capa de células mesoteliales (Células Mesoteliales Peritoneales, CMP), sostenidas en una membrana basal sobre un lecho de tejido conjuntivo,11 formado a su vez por células adiposas, macrógafos, fibroblastos, linfocitos y algunas fibras de colágeno. Las CMP pueden expresar en su superficie marcadores que les permiten: a) promover la marginación y migración de neutrófilos, b) interactuar con la matriz extracelular proteínica, c) presentar antígenos a las células inmunitarias y d) producir biológicamente moléculas importantes como citoquinas proinflamatorias (IL-6, IL-8 FNT alfa), óxido nítrico, factores de crecimiento, activador del plasminógeno tisular, e inhibidor del activador del plasminógeno, para así mismo combatir la colonización y eliminar elementos extraños.4,12-14
La peritonitis se divide inicialmente en dos fases. La primera, la fase séptica, es el resultado de la defensa inicial del huésped al absorber las bacterias intraperitoneales a través de los estomas y conducirlos a través del conducto torácico al torrente circulatorio, resultando en una bacteriemia. Esta fase dura entre 1 a 9 días.15-17 Como mecanismos de defensa inicial, el peritoneo inicia la formación de fibrina y consecuente localización del proceso, desencadenando la segunda fase de absceso, que en promedio dura entre 3 a 14 días con una tasa de mortalidad del 43%.18
Existen a su vez tres clases de peritonitis, la primaria, secundaria y terciaria. La primaria se refiere a la contaminación del peritoneo de fuente extra-abdominal, con frecuencia por diseminación hematógena; se relaciona con el deterioro de las defensas inmunitarias del huésped. Frecuentemente es monobacteriana, y los principales patógenos en los adultos son los coliformes, correspondiendo cerca del 70% a Escherichia coli. Son ejemplos en adultos, la cirrosis hepática con ascitis secundaria y los pacientes en diálisis peritoneal.
La peritonitis secundaria se clasifica a su vez en aguda por perforación (80%), postoperatoria (1020%) y postraumática; cuando hay perforación, las vísceras más frecuentemente afectadas son las del tracto digestivo (perforación uterina postaborto). En el postoperatorio, como regla general se hace el diagnóstico entre el 5 a 7 día después de la intervención. Posterior a un trauma cerrado se puede presentar peritonitis en pacientes con heridas intraabdominales o ruptura del mesenterio con pérdida de irrigación del intestino delgado o grueso.
El tratamiento ideal de la peritonitis secundaria consiste en drenar el foco séptico, retirar el material necrótico y prevenir la formación de abscesos con un manejo antibiótico entre 5 a 7 días. Si la infección persiste o recurre después de 48 horas del tratamiento anterior, se puede considerar como una peritonitis terciaria.19
La peritonitis terciaria se define como la persistencia o recurrencia de la infección intraabdominal, luego de un tratamiento aparentemente adecuado de una peritonitis primaria o secundaria.19
En infecciones intraabdominales la indicación de la laparotomía es principalmente el lavado con irrigación para disminuir el inóculo bacteriano.20 Sin embargo, la irrigación peritoneal es controvertida, al igual que el uso de antibióticos intraperitoneales. Se han realizado recientemente varias revisiones sistemáticas acerca del lavado peritoneal que corroboran la falta de evidencia para sustentar su uso masivo. Algunos detractores sostienen que el lavado promueve la diseminación de una infección localizada a toda la cavidad. Tolhurst (1970), fue el primero en demostrar un efecto adverso del lavado peritoneal en un estudio experimental en animales, donde quienes fueron sometidos a irrigación continua tenían una disminución de la cicatrización de la herida quirúrgica, por el barrido celular continuo del proceso.13,21
Hipertensión intra-abdominal y síndrome compartimental abdominal
La Hipertensión Intra-Abdominal (HIA) se refiere sólo a una medida de presión elevada. Cuando ese aumento de la Presión Intra-Abdominal (PIA) se acompaña de disfunción progresiva generalizada se habla del Síndrome Compartimental Abdominal (SAC).17, 22, 23
Los primeros en establecer una relación entre aumento de la presión intraabdominal y disfunción del patrón respiratorio fueron Marie (1863) y Buró (1870). Henricius (1890) encontró a través de experimentos animales que el aumento de la PIA entre 27 a 46 cm HO se asociaba con una mortalidad significativa secundaria a disminución significativa de la movilidad diafragmática e incremento de la presión intra-torácica. Emerson (1911), demostró que el colapso cardiovascular progresivo era el responsable de la muerte. Gross, un cirujano pediatra, describió el “cierre abdominal por etapas” en neonatos, y así estableció de forma pionera el primer manejo con abdomen abierto.6 Las innovadoras técnicas de laparoscopia han inducido a la investigación de los efectos deletéreos del incremento súbito de la PIA sobre los diferentes órganos.
El nivel crítico de PIA no se conoce con exactitud, pero cifras superiores a 20 mmHg se relacionan con una disminución del índice cardíaco, oliguria y aumento de la presión de la vía respiratoria en los pacientes ventilados; esta cifra es el punto de corte aceptado en múltiples estudios y trabajos.24-27 (Tablas 1 y 2).
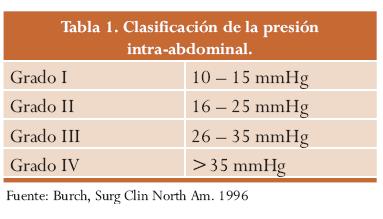
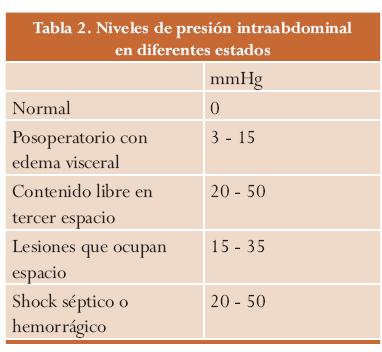
La expansión del contenido intraabdominal puede deberse a diversas causas o a la combinación de ellas, entre las cuales tenemos:
1. Líquidos como sangre (por cirugía o trauma), exudado por peritonitis, trasudado por disfunción endotelial o hepática (pre-eclampsia, síndrome HELLP), de un tercer espacio producto de reanimación excesiva o pérdida capilar (preeclampsia por disminución de presión oncótica).
2. Distensión de órganos de capacitancia (íleo de diversas causas, obstrucción intestinal en todas sus formas, útero grávido y visceromegalias benignas o malignas).
3. Lesiones o cuerpos que ocupan espacio (masas y neoplasias abdominales, hematomas contenidos o empaquetamiento abdominal).
4. Pérdida de elasticidad del componente abdominal (fajas abdominales manejadas por enfermería, el cierre prematuro o inadecuado en correcciones de la pared abdominal en hernias o evisceraciones, escaras o cicatrices retráctiles o quemaduras).
5. Acumulación de gas libre dentro de la cavidad abdominal (neumoperitoneo quirúrgico).
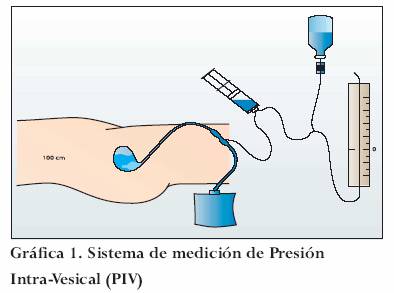
Es posible vigilar la presión intraabdominal de mediante la medición de la presión intragástrica, de presión de la vena cava inferior y de la presión intrevesical; las dos primeras no tienen gran acogida debido al riesgo de morbilidad asociada.28
La medición de la presión intravesical fue descrita por Kron;29 consiste en introducir una sonda flexible con neumotaponador (sonda Foley) en la vejiga e instilar con 50-100 ml de solución salina estéril y su drenaje a través de un sistema de tubos de polietileno (sistema de macrogoteo) adaptados a un censor de presión o un gravímetro usando la sínfisis púbica como nivel 0. Dada su poca invasión y bajo costo se considera como el “gold-standard” para la monitorización de la PIA (gráfica 1).
En la fisiopatología del síndrome compartimental abdominal es vital considerar alteraciones en los siguientes sistemas:
Cardiovascular: se evidencian cambios con elevaciones de la PIA superiores a 25 mmHg. Los cambios se inician con la desviación cefálica del diafragma, incremento de la presión intratorácica, y sobre presión en los vasos venosos, como la vena cava inferior y vena porta. La compresión cardíaca disminuye los volúmenes de fin de diástole, incrementa la poscarga con reducción del volumen de eyección ventricular, aumenta de la frecuencia cardíaca y posterior disminución del gasto cardíaco.30,31
Pulmonar: ante la presencia de una PIA mayor de 16 mm Hg se produce elevación del diafragma e incapacidad de la musculatura torácica para distenderse; hay compresión del parénquima pulmonar y desarrollo de disfunción pulmonar. En casos de shock hipovolemico o coagulopatía e hipotensión, se puede producir atelectasia pulmonar, caída del transporte de gases transmembrana e incremento del shunt intrapulmonar.7, 32 Así, se reduce el flujo capilar pulmonar y el volumen corriente, con disminución de la relación ventilación/perfusión y aumento de la excreción de dióxido de carbono e incremento del espacio muerto, que sumado al efecto cardiovascular induce mayor hipoxia, convirtiendo el metabolismo celular en anaeróbico, con lesión celular progresiva y permanente de acuerdo al tiempo de daño.27,33
Renal: al disminuir la presión de perfusión renal hay una caída directa de la tasa de filtración glomerular con PIA por encima de 15 mm Hg y anuria con PIA superior a 30 mm Hg. Estos cambios parecen reversibles al descomprimir la cavidad abdominal.7
Gastrointestinal: la disminución del flujo mesentérico con PIA por encima de 10 mm Hg promueve la compresión de las paredes de las venas mesentéricas, produciendo hipertensión venosa y edema de asas, que se agravan con shock e hipovolemia induciendo isquemia intestinal. Hay disminución del pH de la mucosa, generando acidosis metabólica sistémica, alterando la función de barrera de la mucosa y produciendo fenómenos de translocación bacteriana, sepsis y falla multi-orgánica.31,34
Presión intracraneana: se ha encontrado que presiones por encima de 25 mm Hg disminuyen de forma significativa la perfusión cerebral.35 Se propone que el aumento de la PVC a causa del incremento de la PIA, interfiere con el drenaje venoso cerebral, aumentado el tamaño del lecho vascular y por consiguiente de la presión intracraneala.32,34.
CIERRE TEMPORAL ABDOMINAL
La técnica de abdomen abierto o el cierre temporal abdominal involucra la utilización de dos tipos de coberturas: las absorbibles adhesivas y las no absorbibles no adhesivas; tanto unas como otras ofrecen ventajas y desventajas (tabla 3).
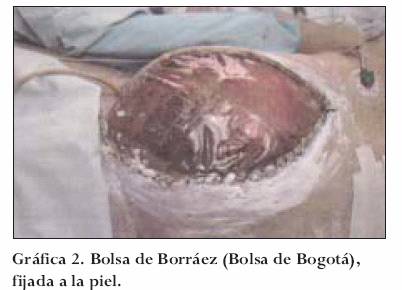
Bolsa de Borráez
En 1984 en Bogotá, Colombia, se realizó la colocación para cubrimiento de abdomen abierto de una lámina plástica de polivinilo, fijada a la aponeurosis, procedimiento sin precedentes en el mundo y conocida como Bolsa de Bogotá (Bogotá Bag).36,37 Las indicaciones son similares a las descritas anteriormente, y su técnica consiste en fijar la bolsa a la fascia preferiblemente para evitar su retracción con sutura continua de monofilamento dos ceros (00). Los accesos sucesivos se efectúan por la parte media del polivinilo, con aproximación posterior de los bordes de la lámina plástica con sutura continua de monofilamento y protección de la piel circundante. Sus ventajas son el bajo costo y su disponibilidad universal. Su utilidad no va más allá de 2 ó 3 lavados obligando a su cambio, lo que traumatiza su sitio de fijación (piel o fascia) (gráfica 2).
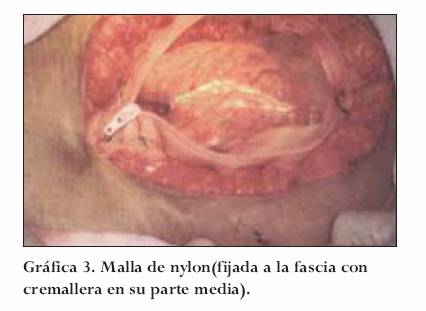
Malla de nylon
Posee una cremallera en su parte media que favorece múltiples intervenciones con rápido acceso y cierre. Su fijación se realiza con monofilamento a la piel o fascia. Debajo de la malla de nylon siempre se deja libre, sin fijación, una bolsa de polivinilo (solución salina) que se cambia en cada procedimiento, con el fin de utilizar la propiedad de este material de impedir la fijación de las asas a la misma y a la malla de nylon, evitando así posibles fístulas.
Las ventajas de la malla de nylon son su bajo costo (menos de 2 dólares), resistencia y durabilidad (5 a 7 procedimientos o dos semanas en tiempo), permitiendo la exploración total de la cavidad (Gráfica 3).17
Malla de velcro
Tiene dos hojas de este material, en una de las cuales hay una tela plastificada, la cual queda sobre las asas intestinales recubriéndolas e impidiendo que el velcro entre en la superficie total del peritoneo. Es de 1,7 m2, estéril y contiene 50 mililitros de líquido de color amarillo claro. En contacto con las mismas. Cada una de las hojas se sutura a la piel o fascia. Al afrontar las hojas queda cerrada la cavidad, al separarlas queda abierta y protegida por la tela plastificada. Si la presión intraabdominal aumenta se separan las hojas y si disminuye se tienden a afrontar para intentar disminuir el tamaño de la laparostomía.17
Cierre temporal abdominal con material absorbible
A los inconvenientes del material no absorbible en la utilización del abdomen abierto, se le debe sumar la necesidad de reintervenir para retirar dicho material. La utilización de materiales absorbibles en el abdomen abierto evita esta situación y reduce de forma importante la incidencia de fístulas intestinales. Tienen una pérdida de estabilidad hasta 3 semanas después de su colocación debido a su degradación por hidrólisis y absorción completa a las 6 semanas.35,38
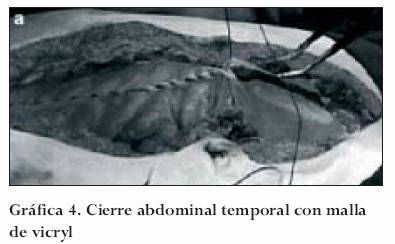
Poliglactina 910 (malla de vicryl) y ácido poliglicólico (malla de dexon)
Son los dos materiales más ampliamente utilizados. Su fijación se puede realizar en la fascia con sutura absorbible cero (0). La apertura a través de su parte media, similar a la bolsa de Borráez, cerrándola con material absorbible, es la forma común de utilización, favoreciendo la estabilidad de la malla. En el caso de disminuir la presión intraabdominal y el edema, la malla se puede ajustar a los bordes de la laparostomía para prevenir la lateralización de los músculos rectos y consecuente debilidad de la pared. Igualmente, aproximar los bordes de la malla permitirá el cierre definitivo de la pared. En casos en los que la estabilidad del paciente impida el cierre definitivo de la pared o la infección tarde en resolver, estos materiales absorbibles permiten la creación de material de granulación, contracción de la herida y el cierre espontáneo por parte de las células de la epidermis (gráfica 4).35,39
Politetrafluoretileno expandido (PTFE)
Este material no se adhiere a la superficie serosa del intestino, evitando de esta manera la creación de una fístula. El PTFE es suave, flexible y produce mínima adherencia y reacción a cuerpos extraños.40 Sin embargo, se ha asociado con infección persistente. La incidencia de hernias incisionales después de la implantación de PTFE es hasta del 43%.40, 41 Su costo es superior a cualquiera de los otros materiales absorbibles mencionados.
Otros materiales utilizados en el cierre temporal abdominal
Clips
Se colocan 1 cm atrás del borde de la piel y espaciados 1 cm entre ellos. Esta técnica es aplicable sólo si la piel permite la reaproximación sin producir HIA. Los clips son utilizables por un corto período, de 48 a 72 horas en la parte inicial de estabilización del paciente. Los cambios degenerativos en la piel al igual que los cambios constantes en la PIA, no pueden ser controlados a través de este sistema. Otro inconveniente es que los pacientes en quienes se utiliza este tipo de cierre tienen obvias limitaciones para estudios radiológicos posteriores.17
Adhesivos
Los adhesivos promulgados por la industria, son fijados a los bordes de la piel fácilmente. La estabilidad mecánica está comprometida limitando la movilización del paciente debido a una masiva evisceración. La tensión es transmitida a la piel, resultando en posible daño de la misma. Su duración, de 3 a 14 días igualmente es otro punto a considerar.40
CIERRE DE LA PARED ABDOMINAL
Cierre lejos-cerca-cerca-lejos
El cierre de la pared abdominal después de una laparostomía es de crucial importancia, tanto por el desarrollo de una HIA secundaria, como por la posibilidad de una evisceración secundaria al daño de la fascia, por el abdomen abierto o la distancia entre las hojas de las mismas. Para tal fin se recomienda la técnica reproducida en el Reino Unido (Malik y Scott), quienes realizan una decolación hasta visualizar 3 cm a cada lado de la línea media de los músculos rectos, delimitando una capa consistente en músculo, fascia y cicatriz de la laparotomía, colocando una serie doble de puntos separados de prolene uno (1) con la técnica lejos-cerca-cerca-lejos, para el cierre de la pared. Un total de 8 a 10 puntos son necesarios en la mayoría de casos. Se continúa con una sutura continua de nylon uno o cero (1 ó 0), sobre los puntos de prolene para aproximar igualmente los bordes del defecto. La piel se puede cerrar o dejar abierta para cierre por segunda intención.42
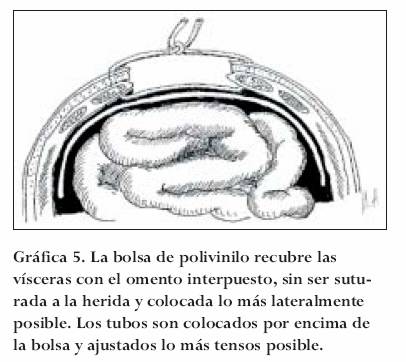
Técnicas de retención
Descrita en Tel-Aviv (Israel), consiste en recubrir la serosa intestinal con una bolsa de uromatic (polivinilo) extendiéndola lo más lateral posible, usualmente llagando al peritoneo parietal lateral.39 Posteriormente son colocados a través del espesor de la pared abdominal (que incluye piel, tejido celular subcutáneo y fascia), fragmentos recortados de tubos de macrogoteo separados entre sí, por unos 3 cm que se ajustan de acuerdo a la PIA y complacencia de los tejidos involucrados. Se pueden colocar toallas quirúrgicas, adhesivo (Op-Site) o tubos de drenaje según el caso. En la cama del paciente se pueden reajustar los tubos permitiendo de esta manera y bajo supervisión constante de la PIA, afrontar las capas y permitir el cierre de la pared cuando las condiciones lo permitan. Aproximadamente cada 7-10 días se pueden cambiar tanto los tubos (por necrosis de la piel) y la bolsa de polivinilo (para prevenir adherencias), realizando las incisiones en piel por sitios diferentes. La gráfica 5 esquematiza la técnica.
SEGUIMIENTO Y PRONÓSTICO
Es importante advertir que puede ocurrir un Síndrome de Reperfusión por la descompresión súbita de la HIA, produciendo aumento inmediato del volumen de ventilación pulmonar, alcalosis respiratoria y activación del metabolismo anaerobio. Se plantea la infusión pre y transoperatoria de 2 litros de solución salina isotónica al 45% con 50 gramos de manitol y 50 mEq de bicarbonato con el ánimo de disminuir estos efectos.43
Cuando el tratamiento a través de laparostomía ha finalizado, el cierre definitivo de la pared se puede considerar, permitiendo que las complicaciones y días de hospitalización se reduzcan y la recuperación a largo tiempo sea mejorada.
Los períodos de tiempo entre la primera laparostomía y el cierre definitivo de la pared se encuentran entre 3,1 a 15 días y el cierre definitivo oscila entre 8, 44, 45 Se pueden desarrollar cuadros de HIA posterior al cierre definitivo de la pared abdominal al igual que un decremento en el gasto urinario del 27% y aumento de la PVC. Sin embargo, se ha documentado que un nivel de hasta 10 mmHg en la PIA es permisible sin mayor detrimento visceral y sin riesgo de HIA secundaria.44
Las complicaciones de los sistemas de drenaje son principalmente fístulas intestinales (3-15%, según material usado), hemorragia en la herida (10%) y hernias incisionales, que se corrigen posteriormente hasta en un 47%.8
CONCLUSIONES
Las entidades clínicas obstétricas que implican aumento de la presión intraabdominal, son de gran importancia en la práctica clínica actual pero su tratamiento definitivo continúa siendo controversial e incierto, pues las muestras en los estudios son pequeñas y generalmente obtenidas de pacientes que presentan trauma o hemorragias pélvicas a consecuencia de cirugías abdomino pélvicas mayores. En nuestra población se observa que muchas pacientes (más del 50%) se benefician de la técnica de abdomen abierto y laparostomía, y el no utilizarla lleva a consecuencias casi siempre fatales. Nuestra experiencia, a pesar de ser limitada, indica que las pacientes deben ser manejadas de forma activa y oportuna a pesar de que conlleve costos adicionales y posibles complicaciones posteriores, generalmente con PIA mayores a 25 mmHg o mayores de 15 mm Hg si la clínica y el estado de la paciente así lo ameritan.
Por ende, consideramos que la medición de la PIA es mandatoria en todo paciente de riesgo, con indicación de laparostomía o en tratamiento con ella. De sus valores dependerá la detección temprana de la HIA y el abordaje adecuado del SCA.
No hay que desconocer las propiedades inmunológicas del peritoneo como órgano y primera barrera contra la infección. La técnica de la cirugía de abdomen abierto, bajo indicaciones precisas, ofrece una oportunidad que antes no se consideraba, para la recuperación del paciente con patología intraabdominal grave. Igualmente, la detección del SCA y su manejo, ofrece la posibilidad de minimizar los daños sobre la economía corporal. El advenimiento de las mallas absorbibles ofrece grandes ventajas sobre el manejo de laparostomías, disminuyendo el riesgo de complicaciones como por ejemplo fístulas. En nuestro medio, el polivinilo sigue ofreciendo sus servicios, sin desconocer las bondades de las nuevas técnicas.
Pensamos que el retiro suave y cuidadoso del material infectante, utilizando cantidades suficientes de líquido para evacuar los elementos macroscópicos es mucho más beneficioso que la aplicación indiscriminada y traumática de cientos de centímetros de solución salina, que busca dejar un peritoneo “impecable” pero indefenso. Las técnicas de cierre abdominal por medio de retención ofrecen posibilidades para evaluar el paciente de forma fácil y frecuente, generalmente cada 48 a 72 horas, sin necesidad de ser transportarlo a salas de cirugía para su valoración.
Teóricamente es indicativo un estudio aleatorizado controlado para resolver todas las dudas en cuanto al manejo de estas pacientes; sin embargo, sería muy difícil su realización, debido a implicaciones médico legales y la heterogeneidad de los grupos de pacientes.
REFERENCIAS
1. Moore A, Hargest R, Martin M. Intra Abdominal Hypertension and Abdominal compartment syndrome. Br J Surg 2004;91;1102-10. [ Links ]
2. Rodríguez J. Memorias Primer Congreso Nacional “Nuevos paradigmas en la atención del paciente de tercer nivel”. Compensar. Hospital Simón Bolívar. Bogotá, Colombia; 2004. [ Links ]
3. Nathens A, Brenneman F, Boulanger B. The Abdominal compartment syndrome. Can J Surg 1997;40;254-60. [ Links ]
4. Riese J, Denzel C, Zowe M, Mehler C, Hohenberger W, Haupt W. Secretion of IL-6, monocyte chemoattractant protein-1, macrophage inflammatory protein-1 alpha, and TNF-alpha by cultured intact human peritoneum. Eur Surg Res 1999;31:281-8. [ Links ]
5. Knaus WA, Draper EA, Wagner DP, Zimmerman JE. APACHE II: a severity of disease classification system. Crit Care Med 1985;13:818-29. [ Links ]
6. Ordóñez C, Ferrada R, Buitrago R. Cuidado Intensivo y Trauma. Capítulo 36. Hipertensión abdominal y síndrome de compartimiento abdominal. Distribuna; 2002. p. 667-84. [ Links ]
7. Maxwell RA, Fabian TC, Croce MA, Davis KA. Secondary abdominal compartment syndrome: an underappreciated manifestation of severe hemorrhagic shock. J Trauma 1999 47:995-9. [ Links ]
8. Schachtrupp A, Hoer J, Tons C, Klinge U, Reckord U, Schumpelick V. Intra- abdominal pressure: a reliable criterion for laparostomy closure? Hernia 2002;6:102-7. [ Links ]
9. Hall JC, Heel KA, Papadamitriou J, Platell C. The pathobiology of peritonitis. Gastroenterology 1998;114:185-96. [ Links ]
10. Chung-Welch N, Patton WF, Shepro D, Cambria RP. Human omental microvascular endothelial and mesothelial cells: characterization of two distinct mesodermally derived epithelial cells. Microvasc Res 1997;54:108-20. [ Links ]
11. Beavis J, Harwood JL, Coles GA, Williams JD. Synthesis of phospholipids by human peritoneal mesothelial cells. Perit Dial Int 1994;14:348-55. [ Links ]
12. Dobbie JW. Surfactant protein A and lamellar bodies: a homologous secretory function of peritoneum, synovium, and lung. Perit Dial Int 1996;16:574-81. [ Links ]
13. Platell C, Cooper D, Papadimitriou JM, Hall JC. The omentum. World J Gastroenterol 2000;6:169-76. [ Links ]
14. Ackermann PC, De Wet PD, Loots GP. Microcirculation of the rat omentum studied by means of corrosion casts. Acta Anat 1991;140:146-9. [ Links ]
15. Thompson JN, Paterson-Brown S, Harbourne T, Whawell SA, Kalodiki E, Dudley HA. Reduced human peritoneal plasminogen activating activity: possible mechanism of adhesion formation. Br J Surg 1989;76:382-4. [ Links ]
16. van Goor H, de Graaf JS, Kooi K, SluiterWJ, Bom VJ, van der Meer J et al. Effect of recombinant tissue plasminogen activator on intra-abdominal abscess formation in rats with generalized peritonitis. J Am Coll Surg 1994;179:407-11. [ Links ]
17. Ordóñez C, Ferrada R, Buitrago R. En: Cuidado Intensivo y Trauma; Peritonitis y sepsis intra-abdominal. Distribuna; 2002. p. 667-84. [ Links ]
18. Yates JL. An experimental study of the local effects of peritoneal drainage. Am Surg 1955;21:1048-72. [ Links ]
19. Quintero G, Nieto J, Lerma C. Infección en cirugía. Peritonitis Terciaria. Editorial Panamericana; 2001. p. 238-44. [ Links ]
20. Steinberg D. On leaving the peritoneal cavity open in acute generalized suppurative peritonitis. Am J Surg 1979;137:216-20. [ Links ]
21. Sanabria A. Controversias frente al lavado peritoneal y el uso de antibióticos en peritonitis. Revisión sistemática de la literatura. Revista Colombiana de Cirugía 2001;3:116-25. [ Links ]
22. Osorio M. Síndrome de Compartimiento Abdominal. Revista Colombiana de Cirugía 2001;3. [ Links ]
23. Cheatham ML. Intra-abdominal hypertension and abdominal compartment syndrome. New Horizons 1999;7:96-115. [ Links ]
24. Sugrue M, Jones F, Deane SA, Bishop G, Bauman A, Hillman K. Intra-abdominal hypertension is an independent cause of postoperative renal impairment. Arch Surg 1999;134:1082-5. [ Links ]
25.Ertel W, Oberholzer A, Platz A, Stocker R, Trentz O. Incidence and clinical pattern of the abdominal compartment syndrome after ‘‘damage-control’’ laparotomy in 311 patients with severe abdominal and/or pelvic trauma. Crit Care Med 2000;28:1747-53. [ Links ]
26. Ivatury RR, Porter JM, Simon RJ, Islam S, John R, Stahl WM. Intra-abdominal hypertension after life-threatening penetrating abdominal trauma: prophylaxis, incidence, and clinical relevance to gastric mucosal pH and abdominal compartment syndrome. J Trauma 1998;44:1016-21. [ Links ]
27. Burch JM, Moore EE, Moore FA, Franciose R. The abdominal compartment syndrome. Surg Clin North Am 1996;76:833-42. [ Links ]
28. Sugrue M, Buist MD, Lee A, Sanchez DJ, Hillman KM. Intra-abdominal pressure measurement using a modified nasogastric tube: description and validation of a new technique. Intensive Care Med 1994;20:588-94. [ Links ]
29. Kron IL, Harman PK, Nolan SP. The measurement of intra-abdominal pressure as a criterion for abdominal reexploration. Ann Surg 1984;199:28-30. [ Links ]
30. Ivatur y RR, Diebel L, Porter JM, Simon RJ. Intra-abdominal hypertension and the abdominal compartment syndrome. Surg Clin North Am 1997;77:783-800. [ Links ]
31. Cullen DJ, Coyle JP, Teplick R, Long MK. Cardiovascular, pulmonary and renal effects of masseively increased intra-abdominal pressure in critically ill patients. Crit Care Med 1989;17:118-21. [ Links ]
32. Blomfield JL, Dalton JM, Surgeman HJ, Ridings PC, DeMaria EJ, Bullock R. Treatment of increasing intracranial pressure secondar y to the abdominal compartment syndrome in patient with combined abdominal and head trauma. J Trauma 1995;39:1168-70. [ Links ]
33. Simon RJ, Fridlander MH, Ivantury RR. Hemorrhage lowers the threshold for intra-abdominal hypertension induced pulmonar y dysfunction. J Trauma 1997;42:398-405. [ Links ]
34. Eddy V, Nunn C, Morris JA Jr. Abdominal compartment syndrome. The Nashville experience. Surg Clin North Am 1997;77:801-12. [ Links ]
35. Blomstedt B, Jacobsson SI. Experiences with polyglactin 910 (Vicryl) in general surgery. Acta Chir Scand 1977;143:259-63. [ Links ]
36. Borráez O. Manejo del abdomen séptico. Utilización del polivinilo. XV Congreso en Avances en Cirugía e Infección: Bogotá, Colombia; 1989. [ Links ]
37. Billing A, Frohlich D, Schildberg FW. Prediction of outcome using the Mannheim peritonitis index in 2003 patients. Peritonitis Study Group. Br J Surg 1994;81:209-13. [ Links ]
38. Nagy KK, Fildes JJ, Mahr C, Roberts RR, Krosner SM, Joseph KT, et al. Experience with three prosthetic materials in temporary abdominal wall closure. Am Surg 1966;62:331-5 [ Links ]
39. A-Malik R, Scott NA. Double near and far prolene suture closure: a technique for abdominal wall closure after laparostomy. Br J Surg 2001;8:146-7. [ Links ]
40. Bleichrodt RP, Simmermacher RK, van der Lei B, Schakenraad JM. Expanded polytetra.uoroethylene patch versus polypropylene mesh for the repair of contaminated defects of the abdominal wall. Surg Gynecol Obstet 1993;176:18-24. [ Links ]
41. Schumpelick V, Klinge U, Welty G, Klosterhalfen B. Meshes within the abdominal wall. Chirurg 1999;70:876-87. [ Links ]
42. Paran H, Mayo A, Afasiev A, Epstein T, Neufeld D, Kluger Y. Staged primary closure of the abdominal wall in patient with Abdominal Compartment Syndrome. J Trauma 2001;51:1204-6. [ Links ]
43. Blomfield JL, Ridings PC, Blocher CR, Marmarou A, Sugerman HJ. Effects of increased intra-abdominal pressure upon intracraneal and cerebral perfusion pressure and after volume expansion. J Trauma 1996;40:936-41. [ Links ]
44. Ghimenton F, Thomson SR, Muckart DJ, Burrows R. Abdominal content containment: practicalities and outcome. Br J Surg 2000;87:106-9. [ Links ]
45. Tremblay LN, Feliciano DV, Schmidt J, Cava RA, Tchorz KM, Ingram WL, et al. Skin only or silo closure in the critically ill patient with an open abdomen. Am J Surg 2001;182:670-5. [ Links ]
Conflicto de intereses: ninguno declarado.