Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.57 no.3 Bogotá Sept. 2006
* Residente III año especialización en ginecología y obstetricia. Universidad de Caldas. Manizales, Colombia. Correo electrónico: pablovictoria1975@yahoo.com.
RESUMEN
Introducción y objetivo: desde la década del 80, las técnicas de ecografía Doppler han permitido en-tender de manera más precisa la hemodinamia fetoplacentaria y sus variantes fisiológicas. Igualmente han ayudado a reconocer los cambios patológicos generados en el feto ante diferentes tipos de lesión, permitiendo actuar de forma oportuna y así impactar de manera importante en la disminución de los índices de morbilidad y mortalidad neonatal. El objetivo de la siguiente revisión es ofrecer al médico una visión clara y concisa de las utilidades de la ecografía Doppler, lo cual le permitirá aplicarla en su práctica diaria.
Métodos: se realizó una búsqueda bibliográfica en diferentes bases de datos electrónicas (Pubmed, Ovid, Elsevier, Interscience, Cochrane) y libros de texto impresos, tratando de encontrar la mejor evidencia respecto a las utilidades de la ecografía Doppler.
Hallazgos de la revisión: la ecografía Doppler se ha convertido en un instrumento diagnóstico de gran aplicación en el campo de la medicina materno-fetal. Hoy en día es clave para el diagnóstico y seguimiento de fetos con anemia o con restricción del crecimiento fetal, tamizaje de aneuploidías realizado en el primer trimestre del embarazo, estudio de morfología fetal, diagnóstico de accretismo placentario, detección temprana de infección fetal y tamizaje para patologías derivadas de insuficiencia útero-placentaria (retardo del crecimiento intrauterino [RCIU] y preeclampsia) así como resultado perinatal adverso.
Conclusión: la ecografía Doppler es una herramienta diagnóstica que ha revolucionado la perinatología, ya que ha permitido disminuir de manera importante los procedimientos invasivos en el feto, así como conocer de manera clara los cambios fisiológicos que se dan en la unidad feto-placentaria, entre otras utilidades.
Palabras clave: ultrasonografía Doppler, restricción de crecimiento fetal, anemia fetal, aneuploidia, arteria uterina.
SUMMARY
Introduction: Doppler ultrasound techniques (available since the 1980s) have allowed a more precise understanding of foetal-placental haemodynamics and their physiological variants. They have also helped in recognising pathological changes produced in the foetus by different types of injury, allowing more precise action to be taken and decreasing neonatal morbidity and mortality. This article is aimed at offering a comprehensive review of Doppler technology in perinatal medicine and pointing out its practical usefulness in current obstetric practice.
Methods: electronic databases (PubMed, Ovid, Elsevier, InterScience, Cochrane) and text books were reviewed to obtain the best evidence regarding using Doppler technology in perinatal medicine. Results: Doppler ultrasonography has become a diagnostic tool having wide application in the field of maternal-foetal medicine. It is currently the key for diagnosing and managing foetuses affected by anaemia or foetal growth restriction (FGR), chromosomal abnormality screening during the first three months of pregnancy, studying foetal morphology, diagnosing placenta accreta, the early detection of foetal infection and screening for utero-placental insufficiency-derived pathologies (FGR and preeclampsia) and adverse perinatal outcomes.
Conclusion: Doppler ultrasonography used as a diagnostic tool has changed perinatal practice, allowing more precise handling of invasive foetal procedures (as well as reducing them) and giving us a better understanding of the physiological changes occurring at foetal-placental level.
Key words: Doppler ultrasonography, fetal growth restriction, foetal anaemia, aneuploidy, uterine artery.
INTRODUCCIÓN
En los últimos 20 años el ultrasonido Doppler ha incrementado sus aplicaciones; sin embargo, para un importante grupo de profesionales de la salud continúa siendo poco conocida. El objetivo de esta revisión es estudiar las bases fisiológicas y estructurales, así como las aplicaciones de esta herramienta con el fin de ofrecer una mejor atención a las pacientes gestantes.
BASES FISIOLÓGICAS
Circulación materna y fetal
a. Circulación fetal
El feto obtiene el oxígeno a partir de la placenta y a través de la vena umbilical. Este volumen de oxígeno debe ser distribuido de manera óptima a los órganos que requieren mayor aporte como son el corazón y el cerebro. Para lograr esto, el feto cuenta con cuatro shunts fisiológicos (ductus venoso, foramen oval, ductus arterioso y arteria umbilical) que permiten que la sangre con una concentración más alta de oxígeno llegue rápidamente a su destino y que, a nivel placentario se dé un intercambio adecuado de nutrientes y fluidos.1,2
Inicialmente, la sangre altamente oxigenada ingresa al feto por la vena umbilical, de allí, el torrente sanguíneo que viene por este vaso toma dos rutas: la vena hepática izquierda (que lleva los nutrientes al hígado) o el ductus venoso (que se une a la vena cava inferior). El ductus venoso es una estructura vascular muy pequeña (aproximadamente 2 mm a las 12 semanas de gestación) que por tener un calibre menor que el de la vena umbilical actúa como un acelerador de flujo o jet (similar a lo que sucede al ocluir parcialmente el orificio de una manguera). La sangre altamente oxigenada ingresa a una mayor velocidad a la vena cava y así evita ser mezclada con la sangre poco oxigenada que normalmente transporta este vaso;3 de la misma manera, esa mayor velocidad del flujo sanguíneo facilita su paso de la aurícula derecha a la aurícula izquierda a través del foramen oval. De esta forma, sangre con alto contenido de oxígeno llega de manera expedita al ventrículo izquierdo y a través de la aorta es transportada al corazón (arterias coronarias) y cerebro (tronco braquiocefálico). Sin embargo, no toda la sangre procedente del ductus venoso toma esta ruta. Parte de ese volumen pasa de la aurícula derecha al ventrículo derecho y de allí es eyectado por la arteria pulmonar. Para obviar la circulación pulmonar, poco funcional en el estado fetal, existe un tercer shunt que es el ductus arterioso, que une la arteria pulmonar con la aorta descendente y así facilita que esa sangre sea rápidamente distribuida al resto de la economía corporal. Finalmente, la sangre con poco contenido de oxígeno es llevada a la placenta a través de la arteria umbilical para que allí se genere un intercambio gaseoso y nutricio.
Vale la pena anotar que a medida que avanza la gestación, la circulación fetal se hace más parecida a la adulta. De esta manera la circulación pulmonar se vuelve funcional y contribuye, cada vez en mayor proporción, al llenado del ventrículo izquierdo.2
b. Circulación uterina materna
La arteria uterina es un ente dinámico durante todo el embarazo. Este vaso en estadios iniciales de la gestación presenta un patrón de bajo flujo y alta resistencia, asociado a presencia de incisura prediastólica en la valoración Doppler.4 Alrededor de la octava a novena semana de gestación se da la primera ola de invasión trofoblástica que genera cambios iniciales en la vasculatura placentaria. Luego, alrededor de la semana 15-16 de embarazo se da la segunda ola de invasión, la cual genera una pérdida de la capa muscular vascular de las arterias espirales llevando a un cambio profundo en los patrones de flujo de la arteria uterina, convirtiéndola en un vaso de baja resistencia, altos volúmenes diastólicos (aumento de hasta 10 veces sobre el flujo basal) y además con pérdida de la incisura.5
Desde el punto de vista anatómico, la arteria uterina es rama de la arteria hipogástrica (ilíaca interna) y cruza la arteria ilíaca externa. La forma de buscarla, consiste en la colocación del transductor en la fosa ilíaca materna por dentro de la espina ilíaca anterosuperior. Allí se visualiza la arteria ilíaca externa, luego se activa el power Doppler o el Doppler color y aparecerá la arteria uterina cruzando a la ilíaca. El punto exacto para ubicar el Doppler gate es justo antes del entrecruzamiento vascular.6
Los índices utilizados para valorar la arteria uterina son la relación sístole/diástole (S/D), el índice de pulsatilidad (IP), el índice de resistencia (IR) y el índice de la incisura (de poco uso en la actualidad)7 (Figura 1).
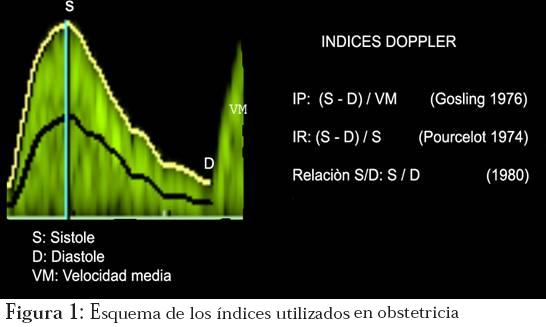
De todos ellos, el que tiene mayor uso y aplicabilidad es el IP. Los puntos de corte para la normalidad son los siguientes: S/D con valor menor de 2,4, IR menor de 0,56 e IP menor de 1,45.8 Esto se explica porque a medida que aumentan los flujos, las resistencias caen. Hasta hace poco tiempo se daba mayor valor al IP obtenido de la arteria correspondiente al lado placentario, sin embargo, en la actualidad se toma un promedio de los resultados de ambas arterias y ese es el reportado.
Hallazgos estructurales
a. Morfología y localizaciónde ductus venoso (DV)
Se puede localizar de dos maneras. La primera de ellas es realizando un corte sagital del producto y, utilizando el modo power Doppler o el Doppler color, se puede observar la turbulencia generada por la sangre a dicho nivel, usualmente distal al corazón. La segunda forma es tomando un corte axial (ligeramente diagonal) del feto entre el corazón y la cámara gástrica, allí el Doppler es ubicado en la porción central de la imagen y usualmente se obtiene el sonido y la morfología características del ductus venoso.
La onda del ductus venoso (Figura 2) en condiciones normales es de tipo bimodal (dos picos) monofásica (no traspasa la línea de base) y, quizá lo mas importante de ella, es que la contracción atrial es positiva (onda A). Cuando se dan alteraciones en su morfología, estas consisten básicamente en la pérdida de la positividad de la contracción auricular (Figura 2), lo cual podría suponer un mecanismo incipiente de falla cardiaca fetal y además un marcador de aneuploidías y cardiopatías.9
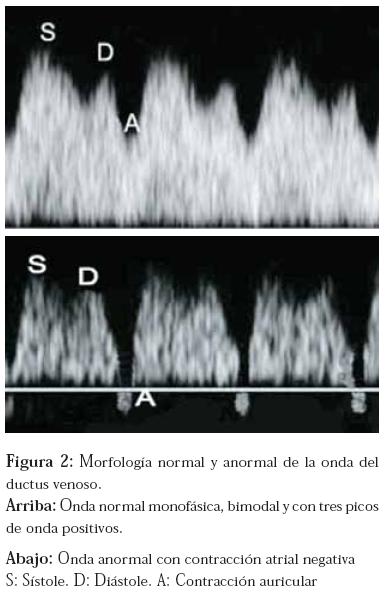
El diámetro del ductus venoso genera cierta dificultad en la valoración del mismo por lo que se requiere que el personal que realice este tipo de pruebas cuente con un entrenamiento especial, dado que una toma inadecuada puede permitir “contaminación” con vasos cercanos y terminar falseando el resultado.10
b. Regurgitación tricuspídea
El mecanismo fisiopatológico implicado dentro de la génesis de la regurgitación tricuspídea es similar al observado en la alteración del ductus venoso y básicamente corresponde a una falla cardiaca temprana.
Normalmente en el feto hay un grado de regurgitación fisiológica, cuya velocidad usualmente no excede los 50 cm/s. Se considera entonces que dicho parámetro es positivo cuando su velocidad sobrepasa los 80 cm/s.11
Su utilidad como marcador aislado de aneuploidías no ha podido ser comprobada, sin embargo, al combinarse con otros parámetros la sensibilidad de ellos en conjunto aumenta, llegando a ser del 95% con una tasa de falsos positivos menor del 5%.l2
c. Arteria umbilical
La arteria umbilical es el reflejo de la circulación placentaria y como tal presenta patrones de flujo similares a los de la arteria uterina y contrarios a los de la arteria cerebral media. Normalmente, la umbilical presenta una morfología de alto flujo y baja impedancia (Figura 3), no obstante, ante la presencia de obstrucción vascular a nivel placentario estos patrones comienzan a presentar cambios patológicos.13
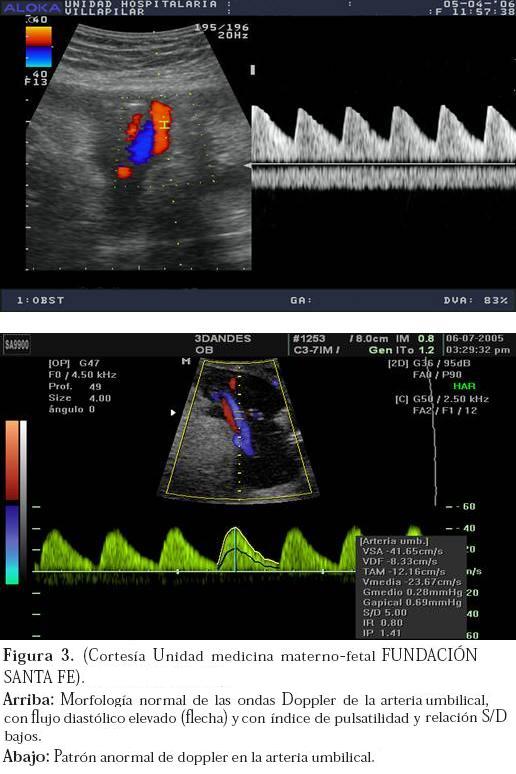
Sin embargo, es importante tener en cuenta que hay factores técnicos que pueden afectar los resultados obtenidos. Hoy en día se recomienda que el asa de cordón estudiada se encuentre en una posición lo mas vertical posible y cercano a la inserción placentaria para que el estudio sea suficientemente confiable.
Los índices a valorar en la arteria umbilical son los mismos descritos para la arteria uterina: IR, IP y relación S/D y también en este caso el de mayor importancia es el IP. Los hallazgos anormales para la arteria umbilical son un IP un IR y una relación S/D altos. (Figura 3).14
d. Arteria cerebral media (ACM)
Al contrario de lo descrito para la arteria uterina y la umbilical, el patrón de flujo normal en la ACM es de alta resistencia y bajos volúmenes diastólicos (Figura 4), de allí se deduce entonces que en caso de alteración los índices son anormalmente bajos.
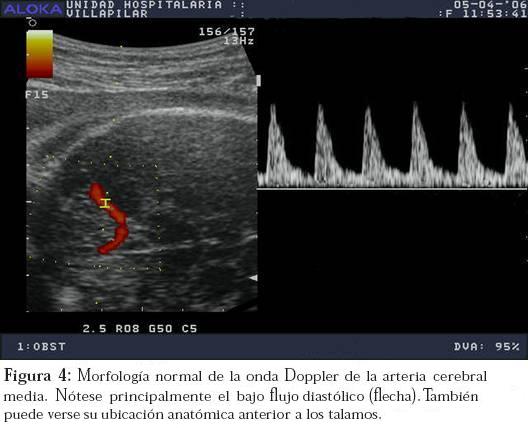
La arteria cerebral media es rama directa de la carótida interna y es el vaso que ofrece mayor aporte sanguíneo al tejido encefálico.
La ACM es el vaso en el cual se empiezan a evidenciar los fenómenos de redistribución que serán descritos más adelante y, de la misma manera, es el vaso de elección para el estudio de la anemia fetal.15
APLICACIONES
Pruebas de tamizaje
a. Tamizaje de aneuploidías
Según las recomendaciones actuales de la Fetal Foundation, se sugiere realizar un tamizaje secuencial a todas las mujeres embarazadas con el fin de detectar de manera ágil aquellas en riesgo de tener un feto con aneuploidías.12,16
El tamizaje secuencial se realiza de la siguiente manera: toda mujer tiene un riesgo de base, obtenido a partir de su edad cronológica y su edad gestacional.17 Este riesgo basal es modificado con la aplicación de pruebas bioquímicas (β-HCG libre, PAPP-A [Proteína plasmática A asociada al embarazo]) y ecográficas (sonolucencia nucal), cuyo resultado positivo o negativo brinda una razón de probabilidades (razón de verosimilitud) que proveen un nuevo valor de riesgo.18,19
Si este riesgo es mayor de 1:100 la paciente debe ir a una prueba invasiva de diagnóstico (amniocentesis, biopsia de vellosidades coriales o cordocentesis) para realización de cariotipo fetal. Si el valor de riesgo es menor de 1:1.000 esa paciente solo requiere el seguimiento rutinario.12,16
Sin embargo, si el valor de riesgo se encuentra entre 1:100 y 1:1.000 entra en juego el cuádruple marcador ecográfico con el fin de evitar procedimientos invasivos innecesarios. El cuádruple marcador consiste en la observación de la sonolucencia nucal, el hueso nasal, la morfología de la onda del ductus venoso, y la regurgitación tricuspídea (estas dos últimas valoradas con ecografía Doppler).12 Vale la pena recordar que cuando los ítems del cuádruple marcador se encuentran alterados pero el feto presenta un cariotipo normal, la posibilidad de una cardiopatía está alrededor del 50%.20
Recientemente se ha procurado simplificar el esquema de tamizaje. Como primera medida se utiliza la translucencia nucal; si esta se encuentra alterada se aplicará uno solo de los signos ecográficos que componen el cuádruple marcador (ductus venoso, hueso nasal o regurgitación tricuspídea) según las preferencias del ecografista. Con esto se recalcula el riesgo y se define la necesidad de procedimientos invasivos.
b. Tamizaje para insuficiencia placentaria
El estudio ultrasonográfico Doppler de la arteria uterina se ha utilizado como prueba de tamizaje para patologías derivadas de insuficiencia placentaria.21 Dentro del espectro de situaciones anómalas que pueden ser tamizadas mediante el estudio de la arteria uterina se encuentran: trastornos hipertensivos, RCIU, resultado perinatal adverso y muerte fetal; de la misma manera este método de screening también presenta utilidad como predictor de la severidad de los cuadros.
El momento ideal para realizar el examen de arterias uterinas es entre las 20 y las 26 semanas en mujeres de bajo riesgo. En mujeres de alto riesgo el examen se puede comenzar a realizar desde la semana 18; si este es reportado como normal, se puede ofrecer a la paciente un grado de tranquilidad importante acerca de la posibilidad de presentar alteraciones relacionadas con insuficiencia placentaria; sin embargo, si el examen reporta resultados anormales se debe recomendar a la paciente realizar una segunda evaluación a la semana 24-26, momento para el cual tienen que haberse generado los cambios de aumento del flujo diastólico, pérdida de la incisura e IP bajo.13 (Figura 5).
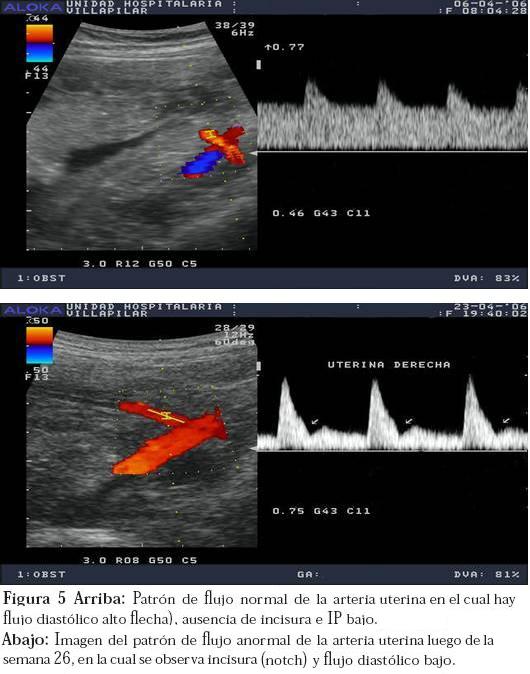
Si una paciente a las 26 semanas no ha presentado los cambios descritos, es muy poco probable que su situación cambie en las siguientes semanas de embarazo, por tanto debe ser catalogada como paciente de alto riesgo y amerita vigilancia estricta a las 28, 32 y 36 semanas de embarazo.
La principal ventaja de la prueba consiste en su alta especificidad (>90%), mientras que su mayor inconveniente es su baja sensibilidad (aproximadamente 60 - 70%). Esto quiere decir que aquellas pacientes con pruebas normales tienen pocas posibilidades de desarrollar insuficiencia placentaria, mientras que aquellas con pruebas anormales tienen un 60% de posibilidades de desarrollar la enfermedad.
Ante la situación actual de tamizaje un tanto tardío (segundo trimestre), los esfuerzos están encaminados a encontrar marcadores tempranos de disfunción placentaria. Recientemente se han publicado estudios que combinan la ultrasonografía Doppler de la arteria uterina en el primero y segundo trimestres del embarazo con la PAPP-A, la inhibina A y la activina A mostrando resultados alentadores al ser utilizados como método de screening, sin embargo aún se requieren estudios de mayor envergadura.22-24
Otra utilidad del estudio Doppler de la arteria uterina es su capacidad de predecir peso fetal según el momento en el cual desaparece la incisura. Entre más temprano desaparezca el notch, mejor será el peso fetal obtenido.25,26
Prevención Secundaria
a. Diagnóstico de RCIU
Quizá el campo donde mayor desarrollo ha tenido el estudio de ecografía Doppler vascular fetal ha sido en la vigilancia de la restricción del crecimiento intrauterino. En la actualidad se conoce de manera más o menos clara cuáles son los fenómenos vasculares acaecidos en un feto con restricción y cuál es la secuencia cronológica de ellos.4 Además el Doppler facilita la distinción entre aquellos fetos sanos pequeños para la edad gestacional y aquellos con patología establecida.27
A lo largo del tiempo se han dado diferentes criterios para definir la restricción del crecimiento intrauterino, sin embargo se considera que aquellos productos de la gestación con peso fetal estimado por debajo del percentil 10 para la edad gestacional, deberían ir a un estudio Doppler como rutina, para así establecer o descartar el diagnóstico.28
Establecer de manera clara el cuadro de restricción es de vital importancia, dado que a través del estudio Doppler podemos saber cuál es el momento adecuado para desembarazar a la paciente.
A pesar de que múltiples vasos han sido valorados tratando de encontrar cuál es el que mejor rentabilidad diagnóstica ofrece, hoy día se ha estandarizado de manera importante el estudio y los vasos que deben ser evaluados son la arteria umbilical y la arteria cerebral media. En caso que estos vasos presenten patrones anormales se deberá realizar además estudio de vasos venosos.6
Fisiopatología de los cambios en el Doppler de fetos con RCIU
A lo largo del proceso de descompensación hemodinámica el feto va presentando una serie de cambios secuenciales susceptibles de ser evaluados mediante ecografía Doppler, buscando conocer el momento óptimo para desembarazar a la paciente.
Dentro del estudio Doppler de este tipo de anormalidades, se puede hablar de unos cambios tempranos y otros tardíos.29 Cambios tempranos: el primer cambio que se da es una disminución en el flujo a través de la arteria umbilical debido al aumento de la resistencia vascular placentaria, esto lleva a que en el feto se disparen mecanismos compensadores buscando redistribuir su flujo sanguíneo hacia áreas críticas de su economía (cerebro, corazón, adrenal), mientras de la misma manera se deja de perfundir adecuadamente otras áreas, lo que genera disminución en la tasa de crecimiento y oligoamnios (hipoperfusión ósea, hepática y renal).30 Esto en el sistema nervioso central es conocido como efecto brain-sparing y es visible con ecografía Doppler, la cual muestra aumento del flujo diastólico en la arteria cerebral media, así como caída en su índice de pulsatilidad.31 Este cambio refleja el aumento del flujo sanguíneo cerebral generado por la redistribución activada por los quimio y barorreceptores ubicados en el cayado aórtico y en las carótidas.32 Es de anotar que este cambio en la morfología de las ondas de la ACM no es signo de acidosis fetal y por tanto no es de manera aislada criterio para desembarazar a la paciente, ya que no se ha comprobado que genere secuelas a largo plazo en el producto de la gestación.
El último paso de esta primera etapa de cambios tempranos, es la pérdida del flujo diastólico de la arteria umbilical.
Parece ser que esta serie de cambios obedecen a un proceso de hipoxia compensada y que se dan alrededor de 7 a 10 días antes que el feto presente cambios de descompensación y acidemia. Cambios tardíos: luego de los cambios descritos, se empieza a generar en el feto una alteración hemodinámica de tal magnitud que lleva a compromiso de la circulación venosa.
El primer cambio de esta segunda etapa consiste en la pérdida de la onda A (contracción auricular) a nivel del ductus venoso, lo cual refleja compromiso de la función miocárdica. Ya para este momento el feto ha comenzado a entrar en un proceso de acidosis que lo puede llevar a la muerte.
Solo hasta ahora, las pruebas de vigilancia fetal tradicionales (monitoría fetal sin estrés [Non-stress test NST], perfil biofísico) comienzan a alterarse. Posteriormente el feto presenta inversión del flujo a nivel de la arteria umbilical. Luego el compromiso venoso se hace más profundo, la redistribución es más severa y la hipoxia-acidosis se hace más marcada. El producto presenta luego inversión del flujo atrial a nivel del ductus venoso. Los cambios finales se dan cuando la función ventricular está tan comprometida que lleva a que se genere flujo pulsátil a nivel de la vena umbilical (es normal que haya pulsaciones hasta la semana 13 de gestación). Finalmente el feto pierde los mecanismos de autorregulación cerebral (brain-sparing), por lo cual el flujo diastólico que se había aumentado inicialmente, cae de nuevo a limites normales y la morfología Doppler de la ACM aparece con un aspecto normal (Figura 6).
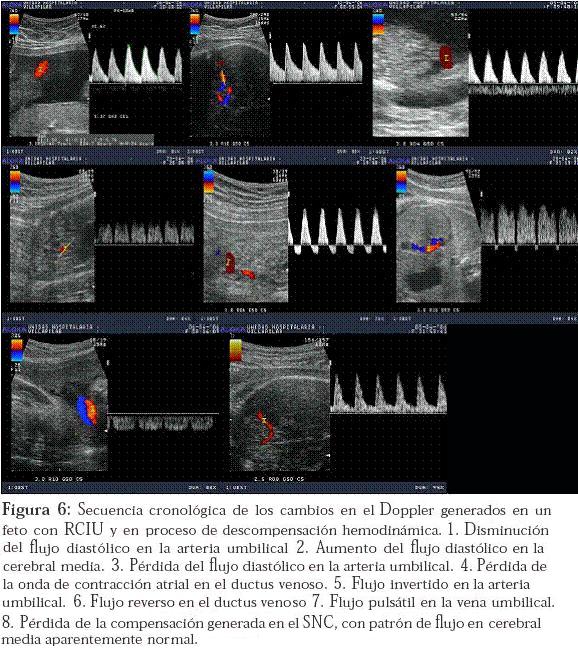
Es claro entonces que el proceso de descompensación hemodinámica fetal, en la mayoría de los casos, no se da al azar, y que por el contrario estos cambios llevan un orden secuencial lógico que ofrece la posibilidad de reconocer cuando el ambiente intrauterino es demasiado hostil para el feto y por tanto la madre debe ser desembarazada. Parece ser que el momento ideal para llevar a cabo el parto es cuando se empiezan a observar las alteraciones tardías en el Doppler; sin embargo, en este campo aún no se ha dicho la última palabra y el clínico debe sopesar el riesgo de prematurez contra el riesgo de hipoxia;33 lo que sí parece claro es que aquellos fetos con mas de 34 semanas de gestación y pruebas de vigilancia alteradas deben ser llevados a parto (en la mayoría de ocasiones por cesárea).34
Vale la pena anotar que las pruebas tradicionales de vigilancia fetal (perfil biofísico y prueba sin estrés) solo se alteran en estadios avanzados de compromiso fetal y por tanto no son óptimas para el seguimiento de este tipo de pacientes.35
b. Diagnóstico de anemia fetal
En la obstetricia moderna uno de los principales objetivos es tratar de disminuir la cantidad de procedimientos invasivos y buscar pruebas diagnósticas que los remplacen de manera confiable. Quizá uno de los campos en los que más se ha avanzado es en el diagnóstico de la anemia fetal.36
Es importante recordar que las principales causas de anemia fetal son los cuadros de isoinmunización, ya sea al factor Rh o a los subgrupos sanguíneos y la infección por el parvovirus B-19.37
Así como en la vida adulta, la anemia en el feto genera cambios hemodinámicos importantes. Inicialmente debido a la baja masa eritrocitaria se aumenta el gasto cardiaco tratando de suplir las demandas de oxígeno y de la misma manera al haber una menor cantidad de hematíes circulantes la viscosidad sanguínea disminuye llevando a una mayor velocidad de la sangre dentro del compartimiento intravascular.38
Este cambio de velocidad puede ser valorado con Doppler, siempre y cuando se conozca el ángulo al cual se va a insonar el vaso.
En la búsqueda de la arteria que cumpliera con dichas características, se empezó a estudiar la cerebral media, dado su trayecto lineal que ofrecía un ángulo conocido cercano a los 0º.
Los resultados han sido muy alentadores dado que se encontró que el pico de velocidad sistólico posee una clara relación con el grado de anemia fetal y que tenía una sensibilidad y especificidad por lo menos igual al estudio delta 450 en líquido amniótico y con la ventaja de ser una prueba no invasiva.
El estudio juicioso de la velocidad de la arteria cerebral media permite decidir cuál es el momento adecuado para tomar acciones terapéuticas en un feto (cordocentesis – transfusión in utero) sin realizar pruebas invasivas previamente.
Para hacer un diagnóstico preciso de anemia fetal se debe seguir una técnica estricta y estandarizada. La cerebral media debe ser observada en su totalidad, evidenciando un trayecto lineal (ángulo de insonación menor de 30º) y el Doppler gate debe colocarse 2 mm después de su nacimiento en la arteria carótida; idealmente se deben lograr 30 ondas de morfología similar y en la mayor de ellas tomar el pico de velocidad, el procedimiento se debe repetir en 2 ocasiones más y reportar el mayor valor obtenido.
Los cuadros anémicos fetales se pueden dividir en moderados y severos, y solo aquellos cuadros severos (usualmente acompañados de hidrops fetalis) deben ser llevados a transfusión. Se considera anemia severa cuando el pico de velocidad sistólico esta 1,55 múltiplos de la mediana por encima del valor de referencia para la edad gestacional.39
En fetos con procesos anémicos se debe hacer seguimiento del pico de velocidad sistólico de arteria cerebral media por lo menos una vez a la semana, tratando de descubrir en qué momento el feto requiere terapia invasiva. Hay que tener en cuenta dos consideraciones importantes respecto al seguimiento de estos pacientes; lo primero es que fetos en riesgo de anemia (por ejemplo con prueba de Coombs positiva) así tengan un pico de velocidad sistólico normal, requieren seguimiento semanal con Doppler (durante tres semanas). Si el aumento de velocidades entre una muestra y otra es mayor de 1,99 cm/s el feto es de alto riesgo, mientras que si la diferencia entre las tomas es menor, el feto puede ser seguido cada 10 a 14 días hasta la semana 35 de embarazo.40 Lo segundo es que el pico de velocidad sistólico sigue siendo un método confiable aún en aquellos fetos que ya han sido transfundidos.41
Finalmente hay que recordar que el estudio de la velocidad pico sistólica de la ACM no es una prueba de tamizaje y por tanto no debe aplicarse a población de bajo riesgo, ya que esto solo generaría preocupaciones innecesarias.
Se han revisado entonces algunas de las aplicaciones del ultrasonido Doppler, sin embargo todavía quedan por analizar varias de las otras utilidades de este instrumento diagnóstico que ha llegado a ocupar un lugar de privilegio dentro del ejercicio obstétrico.
AGRADECIMIENTOS
Clínica Villapilar (Manizales). Personal docente Universidad de Caldas. Departamento de ginecología, obstetricia y reproducción humana Fundación Santa Fe.
REFERENCIAS
1. Nicolaides K, Rizzo G, Hecher K, Ximenes R. Methodology of Doppler assessment of the placental & fetal circulationst. Tomado de Diploma in fetal medicine: Doppler in Obstetrics, Centrus 2004. Disponible en: http://www.centrus.com.br/DiplomaFMF/SeriesFMF/11-14weeks/index-11.htm [ Links ]
2. Baschat AA. The fetal circulation and essential organs – a new twist to an old tale. Ultrasound Obstet Gynecol 2006;27:349-54. [ Links ]
3. Kiserud T. Physiology of the fetal circulation. Semin Fetal Neonatal Med 2005;10:493-503. [ Links ]
4. Nicolaides K. Chapter 4. Diagnosis of fetal abnormalities, the 18-23 week scan. Small for gestational age. Tomado de Fetal foundation 2004. Disponible en: http://www.centrus.com.br/DiplomaFMF/SeriesFMF/11-14weeks/chapter-04/chapter-04-final.htm [ Links ]
5. Divon M, Ferber A. Doppler evaluation of the fetus. Clin Obstet Gynecol 2002;45:1015-25. [ Links ]
6. Harman CR, Baschat AA. Arterial and venous Doppler in IUGR. Clin Obstet Gynecol 2003;46:931-46. [ Links ]
7. Herrera M. Doppler arterial y venoso fetal. Curso de nivelación ultrasonido en Obstetricia y Ginecología. Fecopen; 2005. [ Links ]
8. Park YW, Cho JS, Choi HM, Kim TY, Lee SH, Yu J. Clinical significance of early diastolic notch depth: uterine artery Doppler velocimetry in the third trimester. Am J Obstet Gynecol 2000;182:1204-9. [ Links ]
9. Nicolaides KH. Nuchal translucency and other first-trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol 2004;191:45-67. [ Links ]
10. Malone FD, D`Alton M. First-trimester sonographic screening for Down syndrome. Obstet Gynecol 2003;102:1066-79. [ Links ]
11. Huggon I, DeFigueiredo D, Allan D. Tricuspid regurgitation in the diagnosis of chromosomal anomalies in the fetus at 11–14 weeks gestation. Heart 2003;89:1071-3. [ Links ]
12. Nicolaides K, Spencer K, Avgidou K, Faiola S, Falcon O. Multicenter study of first-trimester screening for trisomy 21 in 75821 pregnancies: results and estimation of the potential impact of individual risk-orientated two-stage first-trimester screening. Ultrasound Obstet Gynecol 2005;25:221-6. [ Links ]
13. Divon M, Ferber A. Doppler evaluation of the fetus. Clin Obstet Gynecol 2002;45:1015-25. [ Links ]
14. Konje J, Taylor D, Abrams K. Normative values of Doppler velocimetry of five major fetal arteries as determined by color power angiography. Acta Obstet Gynecol Scand 2005;84:230-7. [ Links ]
15. Nicolaides K, Rizzo G, Hecher K, Ximenes R. Chap 4: Doppler studies in fetal hypoxemic hypoxia. Tomado de Diploma in fetal medicine: Doppler in Obstetrics. Centrus 2004. Disponible en: http://www.centrus.com.br/DiplomaFMF/SeriesFMF/Doppler/capitulos-html/chapter_04.htm [ Links ]
16. Avgidou K, Papageorghiou A, Bindra R, Spencer K, Nicolaides K. Prospective first-trimester screening for trisomy 21 in 30564 pregnancies. Am J Obstet Gynecol 2005;192:1761-7. [ Links ]
17. Nicolaides K. Diagnosis of fetal abnormalities, the 18-23 week scan. Risk appendix. Tomado de Fetal Foundation 2004. Disponible en: http://www.centrus.com.br/diplomaFMF/18-23-weeks/appendix-01/appendix01-html. [ Links ]
18. Fortuny A, Borrell A, Casals E, Seres A, Sanchez A, Soler A. First trimester aneuploidy screening combining biochemical and ultrasound markers. The Ultrasound Review of Obstetrics and Gynecology 2005;5:9-17. [ Links ]
19. Malone F, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, et al. First-trimester or second-trimester screening, or both, for Down’s syndrome. N Engl J Med 2005;353:2001-11. [ Links ]
20. Souka AP, Kaisenberg CS, Hyett JA, Nicolaides KH. Increased nuchal translucency with normal karyotype. Am J Obstet Gynecol 2005;192:1005-21. [ Links ]
21. Nicolaides K, Rizzo G, Hecher K, Ximenes R. Chap 5: Screening for placental insufficiency by uterine artery Doppler. Tomado de Diploma in fetal medicine: Doppler in obstetrics. Centrus 2004. Disponible en: http://www.centrus.com.br/DiplomaFMF/SeriesFMF/Doppler/capitulos-html/chapter_05.htm [ Links ]
22. Spencer K, Yu CK, Cowans N, Nicolaides KH. Prediction of pregnancy complications by first-trimester maternal serum PAPP-A and free beta-hCG with second-trimester uterine artery Doppler. Prenat Diagn 2005;25:949-53. [ Links ]
23. Gomez O, Martinez JM, Figueras F, Del Rio M, Borobio V, Puerto B, et al. Uterine artery Doppler at 11-14 weeks of gestation to screen for hypertensive disorders and associated complications in an unselected population. Ultrasound Obstet Gynecol 2005;26:490-4. [ Links ]
24. Papageorghiou AT, Roberts N. Uterine artery Doppler screening for adverse pregnancy outcome. Curr Opin Obstet Gynecol 2005;17:584-90. [ Links ]
25. Carbillon L, Uzan M, Largilliere C, Perrot N, Tigaizin A, Paries J, et al. Prospective evaluation of uterine artery fl ow velocity waveforms at 12-14 and 22-24 weeks of gestation in relation to pregnancy outcome and birth weight. Fetal Diagn Ther 2004;19:381-4. [ Links ]
26. Campbell S, Doppler Ultrasound of the Maternal Uterine Arteries: Disappearance of Abnormal notching, Low Birthweight and Pregnancy Outcome. Acta Obstet Gynecol Scand 2000;16:171-8. [ Links ]
27. Resnik R. Intrauterine growth restriction. Obstet Gynecol 2002;99:490-6. [ Links ]
28. Loughna P. Intra-uterine growth restriction: investigation and management. Curr Obstet Gynaecol 2003;13:205-11. [ Links ]
29. Ferrazi E, Bozzo M, Rigano S, Bellotti M, Morabito A, Pardi G, et al. Temporal sequence of abnormal Doppler changes in the peripheral and central circulator y systems of the severely growth-restricted fetus. Ultrasound Obstet Gynecol 2002;19:140-6. [ Links ]
30. Bamberg C, Kalache KD. Prenatal diagnosis of fetal growth restriction. Semin Fetal Neonatal Med 2004:387-94. [ Links ]
31. Huhta JC. Fetal congestive heart failure. Semin Fetal Neonatal Med 2005;10:542-52. [ Links ]
32. Creasy R, Robert R. Fetal growth restriction. En: Creasy R, Resnik R. Maternal-fetal medicine principles and practice. 5th ed. Philadelphia: Saunders-Elsevier; 2004. p. 495-513. [ Links ]
33. GRIT Study Group. A randomised trial of timed delivery for the compromised preterm fetus: short term outcomes and Bayesian interpretation. BJOG 2003;110:27-32. [ Links ]
34. Illanes S, Soothill P.Management of fetal growth restriction. Semin Fetal Neonatol Med 2004;9:395-401. [ Links ]
35. Harkness U, Mari G. Diagnosis and management of intrauterine growth restriction. Clin Perinatol 2004;31:743-64. [ Links ]
36. Green P, Alfirevic Z. The evidence base for fetal medicine. Best Pract Res Clin Obstet Gynaecol 2005;19:75-83. [ Links ]
37. Segata M, Mari G. Fetal anemia: new technologies. Curr Opin Obstet Gynecol 2004;16:153-8. [ Links ]
38. Lopez J, Briceño F. Velocimetria Doppler. En: Cifuentes R. Ginecología y Obstetricia basados en la evidencia. Bogotá: Distribuna; 2002. p. 123. [ Links ]
39. Detti L, Mari G. Noninvasive diagnosis of fetal anemia. Clin Obstet Gynecol 2003;46:923-30. [ Links ]
40. Detti L, Mari G, Akiyama M, Cosmi E, Moise KJ Jr, Stefor T, et al. Longitudinal assessment of the middle cerebral artery peak systolic velocity in healthy fetuses and in fetuses at risk for anemia. Am J Obstet Gynecol 2002;187:937-9. [ Links ]
41. Mari G, Zimmermann R, Moise K, Deter R. Correlation between middle cerebral artery peak systolic velocity and fetal hemoglobin after 2 previous intrauterine transfusions. Am J Obstet Gynecol 2005;193:1117-20. [ Links ]
Conflicto de intereses: ninguno declarado.














