Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.57 no.4 Bogotá Dec. 2006
* Grupo de investigación en enfermedades cardiovasculares y metabólicas. Laboratorio de bioquímica y genética. Facultad de Ciencias de la Salud. Universidad del Quindío. Armenia, Quindío, Colombia. Carrera 15 Calle 12N. Correo electrónico: plandazu@uniquindio.edu.co.
** Facultad de Ciencias Básicas, programa de biología. Universidad del Quindío, Armenia, Quindío, Colombia
RESUMEN
Introducción: El embarazo se acompaña de cambios en el metabolismo materno de las lipoproteínas para satisfacer las demandas nutricionales del feto. El objetivo de este trabajo fue determinar el comportamiento del perfil lipídico durante los diferentes trimestres en una población de gestantes colombianas.
Metodología: el colesterol total, las lipoproteínas y los triglicéridos fueron estudiados en 422 mujeres durante los tres trimestres del embarazo. Colesterol, triglicéridos y lipoproteínas fueron medidos en suero por métodos enzimáticos.
Resultados: Los triglicéridos (128,2 ± 85,8; 238,6 ± 130,2; 305,1 ± 168,7 mg/dL), el colesterol total(180,3; 235,8; 270 ± 107,1 mg/dL), las lipoproteínas de muy baja densidad (25,6 ± 17,2; 47,5 ± 25,8; 59,9 ± 31,7 mg/dL) y las lipoproteínas de baja densidad (123,8 ± 69,2; 158,3 ± 77,6; 185 ± 102,6 mg/dL). Las diferencias en las variables fueron estadísticamente significativas trimestre a trimestre (todos las p <0,001).
Conclusiones: estos resultados muestran cambios metabólicos en el perfil lipídico durante el embarazo, los datos pueden ser de interés médico para hacer seguimiento a aquellas gestantes con perfil lipídico alterado, diabetes gestacional, hipertensión u otras enfermedades relacionadas.
Palabras clave: embarazo, metabolismo de los lípidos, dislipidemias, metabolismo, hipertrigliceridemia.
SUMMARY
Introduction: pregnancy is accompanied by changes in maternal lipoprotein metabolism which may serve for satisfying a foetus' nutritional demands.
Objective : studying quarterly lipid profile patterns in pregnant Colombian women.
Methods: total cholesterol, triglycerides and lipoproteins were investigated in this study in 422 healthy women during normal pregnancy in the first, second and third trimesters. Enzymatic methods were used for measuring cholesterol, triglycerides and lipoprotein concentrations in serum.
Results: triglycerides (128.2 ± 85.8; 238.6 ± 130.2; 305.1 ± 168.7 mg/dL), cholesterol (180.3 ± 70.8; 235.8 ± 72.5; 269.9 ± 107.5 mg/dL), very low density (25.6 ± 17.2; 47.5 ± 25.8; 59.9 ± 31.7 mg/dL) and low density lipoprotein (123.8 ± 69.2; 158.3 ± 77.6; 185.0 ± 102.6 mg/dL), increased from trimester by trimester. High density lipoprotein decreased (31.0 ± 13.4; 30.0 ± 12.8; 25.8 ± 10.3 mg/dL); this difference was significant (p values <0,001).
Conclusions: these results revealed metabolic changes in lipid profiles during pregnancy. This data will be used by physicians in following-up pregnant Colombian women who have an altered lipid profile, gestational diabetes, hypertension or other related diseases.
Key words: pregnancy, lipid metabolism, dyslipidemias, metabolism, hypertriglyceridemia.
INTRODUCCIÓN
Durante el embarazo el metabolismo materno debe satisfacer las demandas del desarrollo fetal además de los requerimientos energéticos de la madre. Al inicio el embarazo es considerado una fase anabólica, caracterizada por un aumento en la producción hepática de triglicéridos (TG), y la remoción de los TG circulantes, lo cual resulta en un incremento en los depósitos grasos de los adipocitos maternos; en contraste el último trimestre de embarazo es referido como una etapa catabólica, donde se aumenta la liberación de los ácidos grasos desde los adipositos debido al estímulo de la lipasa sensitiva a hormonas placentarias,1 estos cambios metabólicos permiten a la gestante almacenar energía en la primera etapa del embarazo para los altos requerimientos energéticos de la última etapa;2 como consecuencia de estos cambios el metabolismo lipídico materno está alterado en el embarazo; el colesterol total (CT) aumenta moderadamente, mientras los TG plasmáticos aumentan drásticamente.3,4
Aunque la hipertrigliceridemia del embarazo parece ser un estado fisiológico normal en respuesta a las necesidades metabólicas del feto y posteriormente de la lactancia, evidencia obtenida a partir de estudios epidemiológicos,5,6 experimentales y genéticos,7,8 muestra niveles elevados de colesterol, especialmente colesterol en las lipoproteínas de baja densidad (c-LDL) y niveles bajos de colesterol en las lipoproteínas de alta densidad (c-HDL), con un riesgo mayor de padecer enfermedad cardiovascular.
Los triglicéridos altos y las partículas ricas en triglicéridos como las lipoproteínas de muy baja densidad (VLDL), se han asociado a pancreatitis,9 preeclampsia10 y diabetes.11,12 Por lo tanto, es importante hallar en nuestra población los niveles normales de los lípidos plasmáticos para determinar cuándo una elevación de los mismos, deja de ser fisiológica y se convierte en un factor asociado a enfermedades cardiovasculares o desórdenes del embarazo.
MATERIALES Y MÉTODOS
Estudio descriptivo de corte transversal llevado en mujeres gestantes, que asistieron a la consulta prenatal del centro de salud La milagrosa ubicado en Armenia, Quindío, ciudad intermedia de la región cafetera de Colombia, durante el periodo de febrero de 2004 a mayo de 2006.
Aspectos éticos: aprobado por el Comité de Bioética de la Universidad del Quindío. Todas las participantes firmaron un consentimiento informado.
Sujetos de estudio: gestantes con embarazos sin alteraciones de la ciudad de Armenia-Quindío pertenecientes al régimen de salud subsidiado (sistema de aseguramiento público subsidiado por el Estado) y vinculado (sistema de atención de la población no asegurada, financiado por el Estado) de los estratos socioeconómicos 1, 2 y 3.
Criterios de exclusión: fueron excluidas todas aquellas gestantes con desórdenes hipertensivos y tiroideos previos, diabetes, y diabetes gestacional.
Diseño muestral: muestreo por conveniencia.
Procedimiento: el CT y los TG se cuantificaron por métodos enzimáticos colorimétricos estándar de la línea SERA-PAK® Plus, casa comercial Bayer S.A. El c-HDL se determinó mediante precipitación selectiva de las lipoproteínas que contienen Apo B-100 y posteriormente se determinó el CT en el sobrenadante. Se usaron controles normales y anormales línea Humatrol, casa comercial Human. El c-LDL fue calculado por la fórmula de Friedewald13 y el c-VLDL mediante la relación triglicéridos/5 derivado de la misma fórmula. Para todas las medidas de lípidos plasmáticos el coeficiente de variación intra e inter ensayo no fue mayor de 3%.
Variables a medir: edad, altura, peso, edad gestacional, medicación y número de embarazos previos, niveles de triglicéridos, colesterol sérico, colesterol LDL, colesterol HDL e índice de masa corporal (IMC).
Análisis estadístico: para el análisis se utilizó el paquete estadístico SPSS versión 10. Se estableció un nivel de confianza del 95% y un valor de p<0,05 se consideró estadísticamente significativo. Se utilizaron medidas de tendencia central; se calcularon medias y desviación estándar. Para determinar si las variables se distribuían según la curva normal, se realizó la prueba de Kolmogorov-Smirnov. Para ver si existían diferencias en las variables (colesterol total, TG, HDL etc,) entre dos trimestres se usó el test de Wilcoxon. Para determinar diferencias entre las variables anteriores en los tres trimestres se realizó el análisis de varianza (ANOVA) de Friedman. El análisis univariado se hizo utilizando los coeficientes de correlación de Pearson. El r2 se interpretó como la dependencia de una variable con la otra.
RESULTADOS
De las 422 gestantes que iniciaron el estudio, a 103 se les tomó una segunda muestra en la mitad del segundo trimestre y a 130 una tercera muestra en el tercer trimestre (tabla 1), solo 56 gestantes tuvieron primera, segunda y tercera muestra. Algunas de las razones de deserción y exclusión de las gestantes incluyeron voluntariedad (70%), abortos (8%), alguna condición de salud diferente a preeclampsia e hipertensión del embarazo (1%), preeclampsia o desórdenes hipertensivos (3%), cambios de empresa prestadora de servicios de salud o institución prestadora de servicios (1%), cambio de ciudad o dirección de contacto (16%), o razones desconocidas (1%).
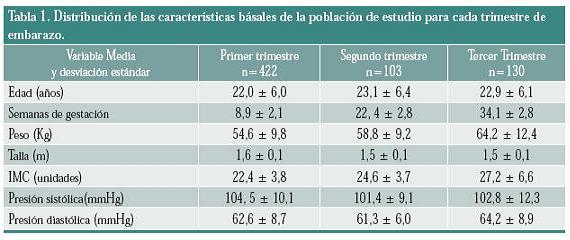
Los resultados de las variables de estudio en cada uno de los trimestres se muestran en la tabla 1; el 75% de la población que inició el estudio tenía una edad por debajo de los 25 años (50% por debajo de los 20 años). El aumento del peso corporal materno fue normal, solo se encontraron pocos casos con IMC mayor a lo esperado para su estado gestacional (1,2%, 1,9% y 1,5% para primero, segundo y tercer trimestre respectivamente).
La tabla 2 indica el comportamiento del perfil lipídico en los tres trimestres del embarazo. El CT aumentó un 30,8% entre el primero y el segundo trimestre y 49,7% entre el primer y tercer trimestre; con relación a los niveles de c-LDL, el porcentaje de incremento entre el primero y el segundo trimestre fue del 27,9% y entre el primero y tercer trimestre fue del 49,4%; para c-VLDL, el aumento fue 85,5%, entre el primero y el segundo trimestre y de 134% entre el primero y el tercer trimestre. El porcentaje de aumento para los niveles de TG, entre el primero y el segundo trimestre fue del 86%, y entre el primero y el tercer trimestre fue de 137,8%. Contrario a lo encontrado para el CT y las lipoproteínas, el c-HDL presentó una tendencia a disminuir. El porcentaje de disminución entre el primero y el segundo trimestre fue del 3,2%, mientras que el porcentaje entre el primero y tercer trimestre fue del 16,8%.
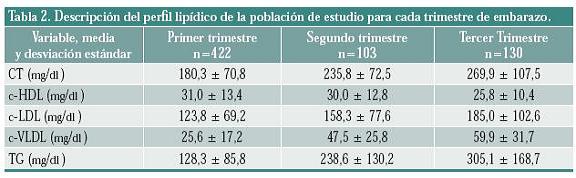
El coeficiente de correlación de Pearson (r2) entre las variables lipídicas c-VLDL ó TG y las semanas de gestación, mostró una débil relación (0,238 y 0,265 respectivamente) con p < 0.001; no existió ninguna relación para las variables CT (r2=0,143), c-LDL (r2=0,080) y c-HDL (r2=0,005) p< 0,001 (figura 1).
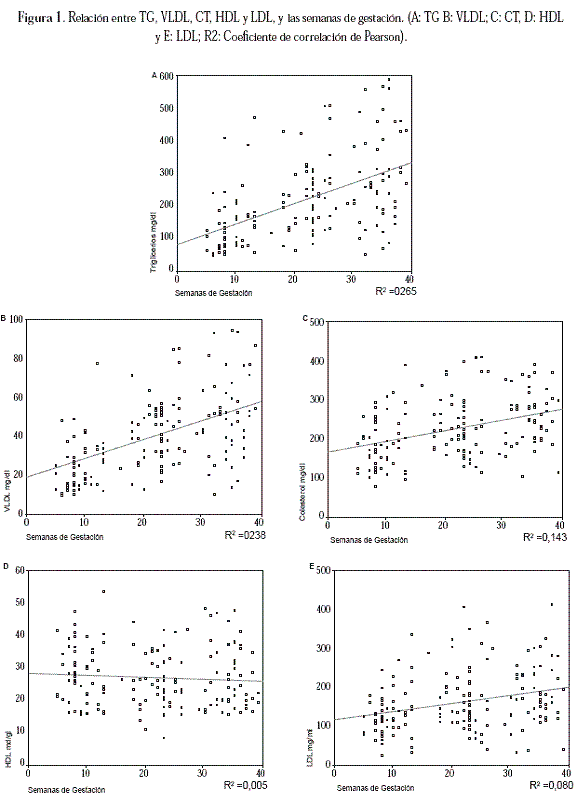
Cuando se analizaron los resultados del perfil lipídico en las 56 gestantes estudiadas en los tres trimestres (tabla 3) se encontraron resultados similares a los hallados para las muestras por trimestres independientes, CT, c-VLDL, c-LDL y TG elevados con c-HDL bajos en los tres trimestres.
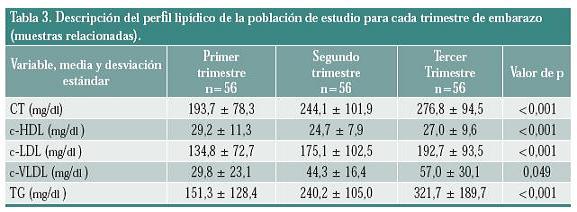
La tabla 3 indica para esta población que el CT aumentó un 26% entre el primero y el segundo trimestre y 42,9% entre el primer y tercer trimestre; siendo estadísticamente significativo (p < 0,001).
Con relación a los niveles de c-LDL, el incremento entre el primero y el segundo trimestre fue del 29,9%, y entre el primero y tercer trimestre fue del 43%, también estadísticamente significativo (p <0,001). Para el c-VLDL, el aumento fue 48,7%, entre el primero y el segundo trimestre y de 91,3% entre el primero y el tercer trimestre, con p < 0,049. El porcentaje de aumento para los niveles de TG entre el primero y el segundo trimestre fue del 58,8%, y entre el primero y el tercer trimestre fue de 112,6%, siendo estadísticamente significativo (p < 0,001).
Al igual que el c-HDL en las medidas anteriores, en las 56 gestantes presentó una tendencia a disminuir. El porcentaje de disminución entre el primero y el segundo trimestre fue del 15,4% mientras que el porcentaje entre el primero y tercer trimestre fue del 7,5% con significancia estadística (p < 0,001).
DISCUSIÓN
Este estudio se diseñó para definir el comportamiento de los lípidos y lipoproteínas durante la progresión del embarazo en una población de mujeres aparentemente sanas de origen colombiano.
Los datos fueron similares a lo descrito por Troisi y colaboradores14 quienes plantean en su estudio que durante el embarazo las concentraciones de CT aumentan hasta en el 43% como consecuencia del aumento de la demanda de precursores para el desarrollo de los procesos anabólicos propios de esta etapa y sufren una rápida caída después del parto. Sin embargo, King15 indica que el aumento en TG y CT es sólo del 20% en su población al finalizar el embarazo. Es importante anotar que el aumento del colesterol no fue dependiente de la edad. Los datos descritos aquí para CT y TG en las gestantes colombianas son muy superiores a los referenciados por King (2-3 veces mayores). Estos y otros estudios1,14-18 han descrito que el embarazo normal no solo se asocia a un incremento significativo en las concentraciones plasmáticas de CT (cerca del 50%), sino también de TG (2-3 veces o entre 50% y 200%), similar a lo encontrado en esta investigación.
Este aumento generalizado en los triglicéridos en el embarazo, vistos en todos los estudios poblacionales aquí descritos, es llamado hipertrigliceridemia del tercer trimestre del embarazo y es considerada normal; parece tener como función principal, el aporte energético requerido en la maduración fetal y en la preparación de la madre para la futura lactancia post-parto; posiblemente esta elevación de los TG sea debida a la inhibición de la actividad de la lipasa hepática por los estrógenos, con el consiguiente aumento del colesterol en las VLDL y LDL.15,19 Sin embargo, la severa hipertrigliceridemia vista en algunas gestantes en el tercer trimestre puede ser consecuencia de mutaciones genéticas, abuso de alcohol, diabetes o ganancia de peso; con respecto a estas últimas variables, la revisión de las historias clínicas y la encuesta de nuestro grupo de estudio, arrojó un bajo porcentaje (2%) de madres fumadoras antes del embarazo, además no abusaban del alcohol y ninguna de ellas era diabética (datos no mostrados). Aunque los lípidos correlacionaron con el IMC, este fue de acuerdo a lo esperado20 y en los casos en que fue alto no correspondía en su mayoría a una obesidad franca como se ha descrito en otras poblaciones.21
Aunque este aumento en los triglicéridos, CT y lipoproteínas ricas en TG parece ser fisiológicamente normal, surge la pregunta ¿hasta qué valor se deben considerar normales estas concentraciones de lípidos y lipoproteínas en las gestantes?, al respecto no existen parámetros claros que permitan diferenciar entre lo normal y lo patológico en la población de embarazadas, de tal manera que hasta ahora no ha sido posible determinar cuándo esos niveles altos de lípidos y lipoproteínas, se convierten en factores de riesgo de enfermedades propias del embarazo como la hipertensión del embarazo, la preeclampsia y la diabetes gestacional.
Adicionalmente, la población de este estudio presentó bajos niveles de colesterol HDL, datos contrarios a lo descrito en otros trabajos,1 pero parece que bajos niveles de HDL son usuales en nuestra población, lo que está sustentado por algunas investigaciones realizadas en población adulta colombiana,22 incluidas mujeres no gestantes donde se describe que los niveles de c-HDL son bajos comparados con poblaciones europeas o de América del Norte. Este patrón de comportamiento del c-HDL podría ser un factor de riesgo adicional de enfermedades cardiovasculares o gestacionales en las madres colombianas y sus hijos.23,24
TG, CT, y c-LDL altos, con c-HDL bajo fue el perfil metabólico que se encontró en general en la población de gestantes estudiadas; la evidencia originada de estudios epidemiológicos cardiovasculares relacionan tal modelo dislipidémico, directa e indirectamente con disfunción endotelial y un aumento del estrés oxidativo,25 además, este mismo modelo ha sido mostrado por otros en preeclampsia,26-28 hipertensión del embarazo29 y diabetes gestacional;11 claramente se necesita de estudios prospectivos que examinen de qué manera la magnitud de la desregulación lipídica en el tercer trimestre mostrada en este trabajo, en algunos casos mayor a la esperada en mujeres gestantes o mucho mayor a la esperada en mujeres no gestantes, se considera un factor de riesgo para enfermedades cardiovasculares o gestacionales.
La limitación del estudio fue la deserción de las gestantes, lo cual limita (debido al tamaño de la muestra y al diseño muestral en el segundo y tercer trimestre), el seguimiento de los lípidos durante el embarazo, de modo tal, que los resultados así obtenidos para los dos últimos trimestres, en las mismas pacientes podrían no ser concluyentes. La utilidad de contar con valores comparativos en la actualidad es indiscutible, especialmente para atender a aquellas gestantes que padecen de enfermedades graves, (diabetes mellitus o gestacional, dislipidemias, hipertensión crónica) que necesitan de apoyo nutrición parenteral y requieren de una vigilancia muy estrecha de diversas variables fisiológicas y metabólicas como son la presión sanguínea, el peso y los lípidos, en particular, el colesterol y los triglicéridos.
También son importantes estos resultados para monitorear aquellas gestantes que, sin presentar enfermedad conocida, en su primer trimestre tienen lípidos aumentados por encima de los valores descritos aquí; esto puede ser indicativo de una dislipidemia de origen no gestacional, por ejemplo genético, y podría complicar el desarrollo de su embarazo, dado que la hipertrigliceridemia normal del embarazo puede convertirse en un reto metabólico para aquellas madres que presenten mutaciones (desfavorables) en genes tan importantes como los de la lipoproteína lipasa (LPL), encargada del metabolismo de los TG, o de los receptores de apoproteína E (apoE), apolipoproteína B (apoB), entre otros.30,31 Esto ya ha sido demostrado para un grupo de gestantes europeas, donde se evidenció que los polimorfismos de la LPL y la apoE juegan un papel importante en el metabolismo de los lípidos en el embarazo;30 estudios futuros en nuestra población deberán orientarse en este sentido.
Finalmente, ¿cuáles son las implicaciones metabólicas si los lípidos, como los TG, no aumentan lo suficiente para satisfacer las necesidades del feto y de la madre? Al respecto, Sattar y colaboradores32 encontraron que en las madres de fetos con retardo intrauterino del crecimiento, en el tercer trimestre de embarazo, no ocurre una síntesis apropiada del c-VLDL y del colesterol unido a lipoproteínas de densidad Intermedia, precursoras de las LDL; estos datos sugieren que el seguimiento del perfil lipídico de las gestantes podría convertirse en una herramienta diagnóstica que permita monitorear aumentos por encima de lo normal o disminuciones no esperadas, llevando a un adecuado control prenatal y a la disminución de la morbi-mortalidad materno infantil.
AGRADECIMIENTOS
A las gestantes que participaron en el proyecto por su valiosa colaboración. Al personal médico y paramédico del Centro de Salud La Milagrosa. A la Dra. Ángela Liliana Londoño por su asesoría estadística y al Dr. Bayron Ruiz por la revisión crítica de este manuscrito.
Financiación
Este proyecto fue financiado por la Universidad del Quindío código 234-2003 y por Colciencias código 1113-04-14463, Contrato 432-2003.
REFERENCIAS
1. Winkler K, Wetzka B, Hoffmann MM, Friedrich I, Kinner M, Baumstark MW, et al. Low density lipoprotein (LDL) subfractions during pregnancy: accumulation of buoyant LDL with advancing gestation. J Clin Endocrinol Metab 2000;85:4543-50. [ Links ]
2. Stock MJ, Metcalfe J. Maternal physiology during gestation. En: Knobil E, Neill JD, eds. The physiology of reproduction. New York: Raven Press; 1994. p. 947-83. [ Links ]
3. Rached De Paoli I, Azuaje A, Henriquez G. Cambios en las variables hematológicas y bioquímicas durante la gestación en mujeres eutróficas. An Venez Nutr 2002;15:11-7. [ Links ]
4. Osorio JH. Metabolismo de los lípidos durante el embarazo. Rev Colomb Obstet Ginecol 2000;51:113- 7. [ Links ]
5. Stamler J, Wentworth D, Neaton JD. Is relationship between serum cholesterol and risk of premature death from coronary heart disease continuous and graded? Findings in 356,222 primary screenees of the Multiple Risk Factor Intervention Trial (MRFIT). J Am Med Assoc 1986;256:2823-8. [ Links ]
6. Anderson KM, Wilson PW, Garrison RJ, Castelli WP. Longitudinal and secular trends in lipoprotein cholesterol measurements in a general population sample. The Framingham Offspring Study. Atherosclerosis 1987;68:59-66. [ Links ]
7. Castelli WP. Epidemiology of triglycerides: a view from Framingham . Am J Cardiol 1992;70:3H-9H. [ Links ]
8. Wang XL, McCredie RM, Wilcken DE. Common DNA polymorphisms at the lipoprotein lipase gene. Association with severity of coronary artery disease and diabetes. Circulation 1996;93:1339-45. [ Links ]
9. Sanduende Y, Figueira A, Rama-Maceiras P, Bautista A, Diéguez M. Pancreatitis hipertrigliceridémica y embarazo. Rev Esp Anestesiol Reanim 2003; 50:477-80. [ Links ]
10. Enquobahrie DA, Williams MA, Butler CL, Frederick IO, Miller RS, Luthy DA. Maternal plasma lipid concentrations in early pregnancy and risk of preeclampsia. Am J Hypertens 2004;17:574-81. [ Links ]
11. Enquobahrie DA, Williams MA, Qiu C, Luthy DA. Early pregnancy lipid concentrations and the risk of gestational diabetes mellitus. Diabetes Res Clin Pract 2005;70:134-42. [ Links ]
12. Valdés L, Rodríguez BR, Márquez A, Santana O, Robaina M, Lang J. Hiperlipidemias asociadas al embarazo en diabéticas y no diabéticas. Rev Cubana Endocrinol 2000;11:153-9. [ Links ]
13. Winocour PH, Ishola M, Durrington PN. Validation of the Friedewald formula for the measurement of low density lipoprotein cholesterol in insulin-dependent diabetes mellitus. Clin Chim Acta 1989;179:79-83. [ Links ]
14. Troisi A, Moles A, Panepuccia L, Lo Russo D, Palla G, Scucchi S. Serum cholesterol levels and mood symptoms in the postpartum period. Psychiatry Res 2002;109:213-9. [ Links ]
15. King JC. Physiology of pregnancy and nutrient metabolism. Am J Clin Nutr 2000;71(5 Suppl 5):1218S-25S. [ Links ]
16. Alvarez JJ, Montelongo A, Iglesias A, Lasuncion MA, Herrera E. Longitudinal study on lipoprotein profile, high density lipoprotein subclass, and postheparin lipases during gestation in women. J Lipid Res 1996;37:299-308. [ Links ]
17. Sattar N, Greer IA, Louden J, Lindsay G, McConnell M, Shepperd J, et al. Lipoprotein subfraction changes in normal pregnancy: threshold effect of plasma triglyceride on appearance of small, dense low density lipoprotein. J Clin Endocrinol Metab 1997;82:2483-91. [ Links ]
18. Martínez MP, Lozano JG. Hipertrigliceridemia y preeclampsia: papel fisiopatológico y evidencia actual.MedUNAB 2005;8:118-24. [ Links ]
19. Julius U, Fritsch H, Fritsch W, Rehak E, Fucker K, Leonhardt W, et al. Impact of hormone replacement therapy on postprandial lipoproteins and lipoprotein(a) in normolipidemic postmenopausal women. Clin Investig 1994;72:502-7. [ Links ]
20. Sánchez FR, Trelles E, Castañedo R, Lugones M. Índice de masa corporal en embarazadas adolescentes. Rev Cubana Med Gen Integr 2003;19(1). [ Links ]
21. Ramsay JE, Ferrell WR, Crawford I, Wallace AM, Greer IA, Sattar N. Maternal obesity is associated with dysregulation of metabolic, vascular, and inflammatory pathways. J Clin Endocrinol Metab 2002;87:4231-7. [ Links ]
22. Rodriguez J, Cediel V. Factores de riesgo cardiovascular en la población de Risaralda. 1a. edición. Pereira: Impresiones Litográficas; 2001. [ Links ]
23. Wierzbicki AS, Mikhailidis DP. Beyond LDL-c- the importance of raising HDL-C. Curr Med Res Opin 2002;18:36-44. [ Links ]
24. Hersberger M, von Eckardstein A. Low high-density lipoprotein cholesterol: physiological background, clinical importance and drug treatment. Drugs 2003;63:1907-45. [ Links ]
25. Sattar N, Petrie JR, Jaap AJ. The atherogenic lipoprotein phenotype and vascular endothelial dysfunction. Atherosclerosis 1998;138:229-35. [ Links ]
26. Sattar N, Bendomir A, Berry C, Shepherd J, Greer IA, Packard CJ. Lipoprotein subfraction concentrations in preeclampsia: pathogenic parallels to atherosclerosis. Obstet Gynecol 1997;89:403-8. [ Links ]
27. Hubel CA , Lyall F, Weissfeld L, Gandley RE, Roberts JM. Small low-density lipoproteins and vascular cell adhesion molecule-1 are increased in association with hyperlipidemia in preeclampsia. Metabolism 1998;47:1281-8. [ Links ]
28. Kaaja R, Tikkanen MJ, Viinikka L, Ylikorkala O. Serum lipoproteins, insulin, and urinary prostanoid metabolites in normal and hypertensive pregnant women. Obstet. Gynecol 1995;85:353-6. [ Links ]
29. Forest JC, Girouard J, Masse J, Moutquin JM, Kharfi A, Ness RB, et al. Early occurrence of metabolic syndrome after hypertension in pregnancy. Obstet Gynecol 2005;105:1373-80. [ Links ]
30. McGladdery SH, Frohlich JJ. Lipoprotein lipase and apoE polymorphisms: relationship to hypertriglyceridemia during pregnancy. J Lipid Res 2001;42:1905-12. [ Links ]
31. Casulari L, Wesgueber M, Silva R, Soares HF, Domingues L. Severe familial hypertriglyceridemia during pregnancy. Rev Bras Ginecol Obstet 2001;23:397-402. [ Links ]
32. Sattar N, Greer IA, Galloway PJ, Packard CJ, Shepherd J, Kelly T, et al. Lipid and lipoprotein concentrations in pregnancies complicated by intrauterine growth restriction. J Clin Endocrinol Metab 1999;84:128-30. [ Links ]
Conflicto de intereses: ninguno declarado.














