Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.57 no.4 Bogotá Dec. 2006
* Médico interno. Universidad Industrial de Santander. Fundación Santa Fe de Bogotá. Dirección: Transversal 36 #122-86. Apartamento 401. Bogotá, Colombia. Correo electrónico: fernando.lopez@fundacionsantafe.edu.co.
** Médico interno. Universidad Industrial de Santander. Hospital Universitario de Santander.
RESUMEN
La ruptura prematura de membranas fetales se define como aquella que ocurre antes de haberse iniciado el trabajo de parto; puede ser previa a la semana 37 de gestación en cuyo caso recibe el nombre de ruptura prematura de membranas pretérmino, la cual aumenta la morbilidad y mortalidad tanto materna como perinatal. La evidencia actual sugiere que la RPM es un proceso multifactorial que puede ser afectado por factores bioquímicos, fisiológicos, patológicos y ambientales. Gracias a la identificación de las metaloproteinasas de la matríz, los inhibidores de tejido de metaloproteinasas y sus posibles mecanismos de acción se ha llegado a un mayor grado de comprensión de la fisiopatología de la enfermedad. Distintos factores han sido asociados con la ruptura prematura de membranas, siendo, hasta ahora, la infección intraamniótica la única causa reconocida de prematurez y de posible causa de ruptura prematura de membranas. Gracias a muchos estudios realizados en los últimos años, que han investigado distintos componentes fetales, maternos y de líquido amniótico que pudieran ser utilizados como marcadores tempranos, existe un futuro promisorio en la detección temprana de la misma y de sus complicaciones.
Palabras clave: rotura prematura de membranas fetales, metaloproteinasas, inhibidor tisular de metaloproteinasa, corioamionitis, líquido amniótico.
SUMMARY
Premature rupture of fetal membranes (PRFM) is defined as the rupturing of the placental membranes before the beginning of labor. The rupture is considered premature when it occurs before 37 weeks of gestation. It is defined as preterm premature rupture of fetal membranes and is known to increase maternal and perinatal morbidity and mortality.
Current evidence suggests that it is a multifactorial process that can be affected by biochemical, physiologic, pathologic and environmental factors. Due to the identification of matrix metalloproteinases and tissue inhibitors of metalloproteinases with their possible mechanisms of action, we now have a better understanding of the physiopathology of the disease. Many factors have been associated with premature rupture of fetal membranes. Intra-amniotic infection is one of the causes of prematurity and premature rupture of fetal membranes for which a cause-effect relationship has been described. Novel research published in the last few years and evaluation of new diagnostic techniques for the PRFM and premature birth overall hold a promise that in the near future early diagnosis and prevention of this prenatal complication might be possible.
Key words: fetal membranes, premature rupture, metalloproteinase, tissue inhibitor of metalloproteinases, chorioamnionitis, amniotic fluid.
INTRODUCCIÓN
Definición de términos
La ruptura prematura de membranas fetales (RPM) se define como la ruptura de membranas que ocurre espontáneamente antes del inicio del trabajo de parto. El término latencia se refiere al tiempo que transcurre entre la ruptura y la terminación del embarazo. Así, el periodo de latencia y la edad gestacional determinan el pronóstico y consecuentemente el manejo de la enfermedad de acuerdo a la posibilidad o no de terminación del embarazo.1 Cuando la RPM ocurre antes de la semana 37 es conocida como ruptura prematura de membranas fetales pretérmino (RPMF).1 Es así como muchos autores han clasificado la RPMF en distintas formas. En el momento una clasificación lógica y racional utilizada es: ruptura prematura de membranas fetales pretérmino previable (menos de 23 semanas en países desarrollados), ruptura prematura de membranas fetales pretérmino lejos del término (desde la viabilidad hasta aproximadamente 32 semanas de gestación), ruptura prematura de membranas fetales pretérmino cerca al término (aproximadamente 32-36 semanas de gestación).2
En aproximadamente 8 a 10% del total de los embarazos a término las membranas fetales se rompen antes del inicio del trabajo de parto. Si el trabajo de parto no es inducido, 60-70% de estos comienzan trabajo de parto espontáneamente en un periodo de 24 h y cerca del 95% lo hará en un periodo no mayor a 72 h.2 La RPMF ocurre en aproximadamente 1-3% del total de mujeres embarazadas, además se encuentra asociada con aproximadamente el 30-40% de partos pretérmino, por esta razón podría considerarse como el problema obstétrico de la actualidad debido a que está reportado que el 85% de la morbimortalidad fetal es resultado de la prematurez.3
Es muy importante conocer que así como el tiempo de latencia se hace cada vez mayor, el riesgo de infección fetal y materna se comporta de manera directamente proporcional. Debido a esto, el manejo para las pacientes es muy debatido, por un lado por la prematurez fetal y por otro por el riesgo de infección tanto materna como fetal.3
Tradicionalmente se ha atribuido la RPMF al estrés físico, particularmente asociado con el trabajo de parto. Sin embargo, nueva evidencia sugiere que es un proceso multifactorial en el que se incluyen procesos bioquímicos, biológicos y fisiológicos.1,3 Es necesario entonces hacer un esfuerzo para entender mejor la fisiopatología de la enfermedad e identificar intervenciones potencialmente significativas de la misma. El objetivo de este documento es revisar la fisiopatología y la potencial asociación de distintos procesos ya sean de naturaleza física, bioquímica, biológica o fisiológica con la posibilidad de encontrar marcadores tempranos de la enfermedad.
MATERIALES Y MÉTODOS
Se hizo una revisión de la literatura por medio de buscadores médicos como Pubmed, Proquest, Hinary y otras revistas científicas del área biomédica, utilizando términos como amnios, ruptura prematura de membranas fetales, infección intraamniótica, se seleccionaron los artículos de acuerdo a la categoría de publicación como investigaciones originales y artículos de revisión, metaanálisis, practica clínica, entre otras y fueron escogidos aquellos considerados por nosotros de gran relevancia científica y epidemiológica.
Estructura de las membranas amnióticas
El feto se encuentra dentro del útero rodeado de un líquido claro y ligeramente amarillento que está contenido dentro del saco amniótico. Durante el embarazo dicho líquido amniótico aumenta en volumen a medida que el feto crece. Este volumen alcanza su punto máximo aproximadamente en la semana 34 de gestación, cuando llega a un promedio de 800 ml. Aproximadamente 600 ml de líquido amniótico rodean al feto a término (a la semana 40 de la gestación). El feto hace circular constantemente este líquido al tragarlo e inhalarlo y reemplazarlo a través de la exhalación y la micción.1 El líquido amniótico cumple numerosas funciones para el feto: protección de las lesiones externas al amortiguar golpes o movimientos súbitos, permitir su libre movimiento y desarrollo músculo-esquelético simétrico, mantener una temperatura relativamente constante como protección de la pérdida de calor y por último permite el desarrollo apropiado de los pulmones.1,4
Las membranas fetales estructuralmente presentan dos capas conocidas y diferenciadas histológicamente como corion y amnios, las cuales pueden a su vez estratificarse en distintas láminas.5
Como se puede observar en la figura 1 el amnios está compuesto por cinco láminas distintas: la más cercana al feto es el epitelio amniótico, cuyas células secretan colágeno tipo III, tipo IV y proteoglicanos (laminina, fibronectina entre otros) que luego confluirán para conformar la segunda lámina conocida como membrana basal. En el siguiente estrato se encuentra la lámina compacta, compuesta por tejido conectivo, la cual se puede considerar como el esqueleto fibroso principal del amnios. Luego se encuentra la lámina fibroblástica en donde se observan macrófagos envueltos de una matriz extracelular y células mesenquimales que son responsables de la secreción del colágeno encontrado en la lámina inmediatamente anterior. Por último se encuentra la lámina intermedia o esponjosa, conocida así debido a su apariencia, la cual limita al amnios y el corion. Está lámina posee gran cantidad de colágeno tipo III y proteoglicanos hidratados lo que confiere su aspecto característico, su función principal es absorber el estrés físico, permitiendo que el amnios se deslice suavemente sobre el corion subyacente.6 Mientras que el corion es mas grueso que el amnios, este último posee una mayor fuerza tensil.5,6

MECANISMOS DE LA ENFERMEDAD
Fisiopatología
La ruptura de las membranas fetales durante el trabajo de parto, se ha atribuido a una debilidad generalizada de éstas debido a las contracciones uterinas y al estiramiento repetido. Se ha encontrado disminución de la fuerza tensil de las membranas luego del trabajo de parto, comparado con aquellas en las que se termina el embarazo por cesárea.1
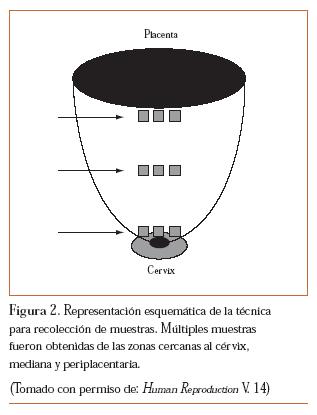
En la RPM ha sido más difícil establecer debilidad en las membranas fetales cuando ésta ocurre, al compararlas con membranas que fueron rotas artificialmente durante el trabajo de parto.6,7 Se ha identificado un área cercana al lugar de ruptura y se ha descrito como zona de morfología alterada, presente antes de la ruptura de la membrana y debida al trabajo de parto. Según Malak et al. es posible que esta zona represente el sitio desde donde se inicie el proceso de ruptura.7 Nuevos estudios han intentado determinar si estos cambios ocurrían previamente al trabajo de parto. McLaren et al. en su estudio publicado consideraron tomar muestras de las membranas fetales a diferentes regiones (figura 2), encontrando las siguientes diferencias: a) las membranas cervicales pudieran representar una región de debilidad estructural susceptible a la ruptura de membranas durante el trabajo de parto, y b) las relaciones paracrinas entre las membranas fetales y el miometrio pudieran estar afectadas cualitativamente entre diferentes regiones del útero.8
Degradación de la matriz extracelular
El colágeno es un componente importante, envuelto en la matriz extracelular de las membranas fetales, que contribuye a la elasticidad y fuerza tensil del amnios. La colagenasa es una enzima lítica que se encuentra en altas concentraciones en la placenta humana a término; su actividad aumenta a medida que avanza el trabajo de parto a término, el mecanismo propuesto es una falta de equilibrio entre factores de degradación y síntesis de la matriz extracelular. Se encuentran además otras enzimas que contribuyen al cambio en la estructura del colágeno como son la elastasa de neutrófilos, metaloproteasas, gelatinasa, proteoglucanasa y cisteinaproteinasas.9-11
Un amplio número de sistemas enzimáticos proteolíticos regulados finamente, incluyendo la cascada de activación del plasminógeno y metaloproteinasas de la matriz (MMP, por su sigla en inglés matrix metalloproteinases), juegan un papel esencial en la remodelación de la matriz extracelular durante el embarazo y el trabajo de parto. Se ha comprobado la existencia de inhibidores tisulares de las metaloproteinasas (TIMP, del inglés tissue inhibitors of metalloproteinases). Las MMP representan una familia de enzimas dependientes de zinc, capaces de degradar los componentes de la matriz extracelular incluyendo el colágeno.6,9-11
Las distintas MMP poseen diferentes actividades especiales y deben actuar conjuntamente entre si para poder llevar a cabo la degradación de la matriz extracelular de las membranas fetales.11,12
La integridad de las membranas fetales durante la gestación permanece sin alteraciones debido a una baja concentración de MMP y alta concentración de TIMP. Durante el trabajo de parto los estudios indican que se origina una relación inversamente proporcional a la anteriormente mencionada encontrándose así una alta concentración de MMP y baja de TIMP.6-8,13 Romero et al. en sus estudios encontraron que la concentración de MMP-9 en compartimentos fetales (plasma fetal y liquido amniótico) se encontraba elevada en pacientes con RPMF comparado con aquellas que presentaban trabajo de parto pretérmino sin RPMF, además descartaron que esta elevación fuera parte de una respuesta inflamatoria fetal. Así, dos hipótesis a considerar para nuevos estudios serían si el feto es responsable en parte por el proceso de RPMP y por qué en algunos embarazos se genera trabajo de parto pretérmino sin RPM.14
Enfermedades del tejido conectivo y deficiencias nutricionales como factores de riesgo
Las enfermedades del tejido conectivo se han asociado con membranas fetales más débiles y un incremento en la incidencia de RPM.15 Dentro de estas enfermedades se pueden encontrar el lupus eritematoso sistémico y el síndrome de Ehlers-Danlos, ambos asociados con una mayor ocurrencia de RPMP.16-18 El síndrome de Ehlers-Danlos es un grupo de al menos 11 desórdenes hereditarios del tejido conectivo, caracterizado por hiperelasticidad de las articulaciones, los tejidos y la piel.17 Un estudio en mujeres que padecían el síndrome de Ehlers-Danlos encontró que los tipos más frecuentes de este síndrome eran el I, III y IV. Adicionalmente, documentó una tasa de parto pretérmino de 23,1% y de aborto espontáneo de 28,9%. La tasa de parto por vía no vaginal fue de 8,4%, con 14,7% de estas con problemas para la coagulación.19 Estos resultados pudieran ser extrapolables cuando se compara con otros estudios con objetivos similares.18 Es por esto que se ha establecido que los embarazos con el Síndrome de Ehlers-Danlos tienen tasas mas elevadas de morbilidad tanto materna como fetal.19
Algunos autores han asociado deficiencias nutricionales como un factor predisponente para presentar RPMP. Estaría en relación con la formación de las fibras de colágeno y elastina ya que existen mecanismos enzimáticos dependientes de cobre.6,20 Según algunos estudios, las mujeres que han presentado RPM presentan bajas concentraciones de cobre en sangre materna como en muestras de cordón.21 También se ha asociado la deficiencia de ácido ascórbico con la ocurrencia de RPM; Siega-Riz et al. en el 2003 señalaron que las mujeres con niveles de vitamina C bajos antes de la concepción, presentaban el doble de riesgo para parto pretérmino debido a RPM y que este disminuía con la ingesta de vitamina C en el segundo trimestre, concluyendo que la dieta y nutrición son factores variables y por lo tanto pueden ser modificables, como intervención estratégica, para reducir la incidencia de RPM.21-23
La deficiencia de hierro y la anemia (que genera hipoxia) pudieran inducir a estrés materno y fetal, lo cual estimula la síntesis de hormona liberadora de corticotropina (CRH del inglés, corticotropinreleasing hormone). Las concentraciones elevadas de CRH son un factor de riesgo para presentar no solo RPM, sino también otras complicaciones como hipertensión inducida por el embarazo, eclampsia, retardo del crecimiento intrauterino e infección. Un mecanismo alternativo sugiere que la marcada disminución del hierro puede llevar a daño oxidativo de los eritrocitos y por consiguiente de la unidad feto-placentaria.24
Factores asociados
La prevalencia de vaginosis bacteriana en mujeres asintomáticas varía ampliamente. Esta ha sido asociada consistentemente con un incremento en el riesgo de parto pretérmino, pero permanece en estudio si es la causa del parto pretérmino o si es solo un marcador temprano de colonización. Aun cuando los estudios realizados en la década de los noventa sugerían que el tratamiento pudiera ser útil en las mujeres con alto riesgo de parto pretérmino o en embarazos de mujeres con pesos menores a 50 kg.25 Estas observaciones no fueron confirmadas por un experimento clínico controlado que comparó el uso de metronidazol contra placebo en mujeres embarazadas con vaginosis asintomática, en donde se concluye que no hay diferencia estadística entre el uso de metronidazol y de placebo para desarrollar trabajo de parto pretérmino. De la misma manera, el analisis de un subgrupo de 210 mujeres clasificadas con alto riesgo para trabajo de parto pretérmino falló en demostrar algún beneficio de la terapia farmacológica.25,26 Asimismo, una revisión sistemática en Cochrane concluyó que no hay beneficio en la realización de tamizaje universal y tratamiento para la vaginosis bacteriana en embarazo, pero que pudiera sugerirse algún beneficio en pacientes de alto riesgo,27 lo cual estaría de acuerdo con el U.S. Preventive Services Task Force quienes determinan que no hay evidencia suficiente para recomendar o no recomendar el tamizaje para vaginosis bacteriana en pacientes embarazadas, aun en aquellas con antecedente de trabajo de parto pretérmino.28 Así, también el Centro para el Control y Prevención de Enfermedades (CDC, del inglés, Centers for Disease Control and Prevention ) junto con el Colegio Americano de Obstetras y Ginecólogos consideran que el tamizaje universal de mujeres asintomáticas no es recomendado, sin embargo el CDC deja en consideración para tamizaje aquellas mujeres con alto riesgo.29,30
Un estudio encontró asociación de RPMP con las siguientes situaciones: raza negra, bajo índice de masa corporal, sangrado vaginal, contracciones, infección pélvica, vaginosis bacteriana, parto pretérmino previo, niveles de fibronectina fetal elevada y cérvix corto; siendo estas tres últimas las de mayor importancia como predictores, llegando a ser incluso factores potenciadores.25
Incluso el tabaquismo puede de ser tomado como factor de riesgo, considerado así por algunos estudios. Vitoratos et al. concluyeron que el hábito de fumar durante el embarazo aumenta el riesgo de parto antes de la semana 32, así como el riesgo de RPMP, independiente del número de cigarrillos consumidos por día.31 Por otra parte, Williams et al. encontraron en su estudio que el consumo de 3 o más tasas de café en mujeres embarazadas, presentaba una tendencia lineal de riesgo de RPMP, manteniendo una relación directamente proporcional al número de tazas de café consumidas por día.32
Hormonas
Estudios en animales indican que la progesterona y el estradiol teóricamente podrían descender la incidencia de RPMP ya que disminuyen la concentración de MMP y aumentan la concentración de sus inhibidores (TIMP). Además se ha encontrado en estudios con animales que estas hormonas tienen la capacidad de inhibir las colagenasas, enzimas importantes en la fisiopatología de la RPM. Por otro lado, durante el embarazo humano, generan disminución de la capacidad contráctil de miometrio, bloquean la acción de la oxitocina e inhiben la formación de uniones electrolíticas; incluso algunos estudios se han llevado a cabo utilizando análogos de progesterona obteniendo resultados variables.6,33 Otra hormona que juega un papel importante en los tejidos reproductivos es la relaxina, clásicamente conocida como una hormona producida por el cuerpo lúteo del embarazo con importancia en la remodelación de los tejidos. Estudios recientes indican que al exponer las membranas fetales in vitro a esta hormona se puede generar un incremento dosis dependiente de genes específicos de metaloproteinasas, sin embargo, es todavía un mecanismo desconocido.13
Infección
La infección intrauterina ha emergido como una causa mayor de parto pretérmino. Se estima que 25% de todos los partos pretérmino ocurren a madres que han tenido invasión microbiana en la cavidad amniótica, aun cuando estas infecciones son en su mayoría subclínicas en naturaleza,34 incluso otros estudios sugieren que puede llegar a ser responsable de hasta 40% de los casos de parto pretérmino, por lo cual es el único proceso patológico en el que se encuentra una relación firme de causalidad con prematurez y en el que el proceso fisiopatológico es conocido.6,34,35
Se ha postulado como posible teoría que la infección intrauterina es un proceso crónico y usualmente asintomático hasta que el trabajo de parto comienza o hasta que la RPMP ocurre. Se conoce a la infección intrauterina que ocurre junto a RPM como corioamnionitis,36 muchas veces este proceso puede estar ocurriendo mucho antes que se pueda evidenciar respuesta inflamatoria local o sistémica, por lo que se ha propuesto un nuevo término que abarcaría todas las entidades como es el de la infección intraamniótica.37
Los microorganismos pueden ganar acceso a la cavidad amniótica y al feto a través de distintos mecanismos de colonización: por medio de la migración de la cavidad abdominal a la trompa de Falopio, contaminación accidental durante la realización de procedimientos invasivos como amniocentesis o toma de sangre fetal, por diseminación hematógena a través de la placenta, o desde del cérvix por vía ascendente desde la vagina. Las mujeres que presentan vaginosis bacteriana, definida como una disminución de la especie de Lactobacilli y un incremento masivo de otros organismos incluyendo Gardnerella vaginalis, Bacteroides spp, Mobiluncus spp, Ureaplasma urealyticum, y Micoplasma hominis se encuentran en un riesgo significativamente mayor de presentar infección intrauterina y parto pretérmino.34,38,39
Un concepto importante a tener en cuenta es que la relación entre parto pretérmino e infección no es consistente a cualquier edad gestacional. El parto pretérmino espontáneo que ocurre entre las semanas 34 a 36 de gestación usualmente ocurre sin asociación con infección, mientras que los partos pretérmino que ocurren en la semana 30 o menos de gestación, presentan una asociación directa con infección.39
La vía ascendente de infección intrauterina consta de distintas etapas (figura 3).
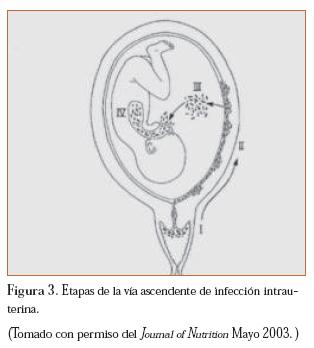
La invasión bacteriana del espacio coriodecidual activa monocitos en la decidua y en las membranas fetales produciendo finalmente un incremento en factores proinflamatorios, incluyendo entre otras TNF-a, IL-1a, IL-1ß, IL-6, IL-8 y factor estimulante de la colonia de granulocitos (G-CSF, sigla en inglés de granulocyte colony stimulating factor ).34,38,39.41
Algunas de éstas citocinas estimulan la síntesis y liberación de prostaglandinas, iniciando así la secuencia de la inflamación: quimioatracción, infiltración, activación de neutrófilos y liberación de MMP. Ocurre así un evento sinérgico ya que las prostaglandinas ayudan a maduración cervical y además, estimulan las contracciones junto con las citocinas; mientras tanto, las MMP degradan las membranas, produciendo consecuentemente ruptura de estas.10,25,38,41,42 Se han encontrado que otras infecciones del tracto genitourinario como son: la cervicitis gonocócica y la bacteriuria asintomática son también causa de parto pretérmino. El embarazo no incrementa la incidencia de bacteriuria asintomática; sin embargo la pielonefritis se desarrolla en el 20 a 40% de las mujeres embarazadas con bacteriuria asintomática no tratada, por lo tanto se estima que aproximadamente 40 a 80% de las complicaciones del embarazo debidas a pielonefritis aguda pueden ser prevenibles con el tratamiento de la bacteriuria asintomática. Es por esto que se debe estar muy atento ante la presencia de esta condición la cual puede ser fácilmente tratada.43
Marcadores tempranos de infección
Clásicamente el síndrome de respuesta inflamatoria sistémica evidenciable en la corioamnionitis es definido por elevación de la temperatura mayor a 38ºC con usualmente dos de los siguientes signos: distensión intrauterina, flujo vaginal fétido, aumento en el recuento de leucocitos y taquicardia materna o fetal. Usualmente la fiebre por sí sola sugiere el diagnóstico en pacientes con RPM. Debido a que los hallazgos histopatológicos y de cultivo indican que antes de que la corioamnionitis se exprese clínicamente existe un proceso previo de infección, el diagnóstico de infección intraamniótica es un reto y se requieren nuevos marcadores para la detección temprana de esta. Es teóricamente importante hacer un diagnóstico temprano de infección porque existe un incremento de 2 a 4 veces de morbilidad y mortalidad una vez la fiebre es evidenciada.38
Debido a la morbimortalidad que puede agregar la RPM tanto en el feto como en la madre, la vigilancia clínica clásica de las pacientes que cursan con esta enfermedad consta de control de signos vitales, perfil biofísico fetal,44,45 evaluación de la frecuencia cardiaca fetal y exámenes en sangre materna como la cuantificación de proteína C reactiva (PCR), recuento de leucocitos y la velocidad de sedimentación globular (VSG).1,46 La leucocitosis es un estándar clínico de infección sistémica grave, pero es una prueba inespecífica. Yoon et al. evaluaron el conteo de leucocitos correlacionándolo con cultivos positivos de líquido amniótico en mujeres con infección clínica y subclínica, concluyendo que ésta prueba presenta bajos niveles de sensibilidad y de valor predictivo positivo haciéndolo inadecuado para su uso en la práctica clínica.47
La PCR es un producto de la reacción hepática de fase aguda a la infección en respuesta a la síntesis de IL-6 sintetizada durante el curso de infección o daño tisular.48 Se han realizado estudios para cuantificar la PCR encontrándose resultados no concluyentes al compararlos.47,49 Nowak et al. en su estudio establecieron una sensibilidad que oscilaba entre 85-91% y un valor predictivo positivo entre 86-94% determinando distintos puntos de anormalidad en la cuantificación de PCR comparado con la presencia histopatológica de corioamnionitis. Estos investigadores concluyeron finalmente que la cuantificación de la PCR en sangre materna era el indicador de corioamnionitis histopatológica y de infección intrauterina más confiable comparado con el recuento de leucocitos y la VSG.49
La VSG es una prueba inespecífica de una reacción inflamatoria sistémica. Esta se aumenta durante cualquier infección o enfermedad autoinmune, además per se el estado de embarazo aumenta sus concentraciones. Se ha encontrado que una VSG > 60 mm3/hora es muy específica pero moderadamente sensible, lo cual limita su utilidad clínica.50
Las últimas investigaciones se han dedicado a la detección de mediadores de la inflamación como las citocinas. La IL-6 es una citocina pleiotrópica producida por una gran variedad de células en respuesta a productos microbianos y se piensa que tiene una regulación en la respuesta del hospedero ante la infección y el daño tisular.51 Por otra parte está en discusión si ésta citocina es producto materno, placentario o fetal; algunos estudios recientes indican que su origen es fetal. Algunos proponen utilizar niveles detectables de IL-6 en líquido amniótico como un método de tamizaje para la detección de infección intrauterina.1,40,50,52,53 Distintos estudios han indicado que los niveles de IL-6 en suero materno se encuentran elevados con una cifra mayor de 8 pg/ml en mujeres con infección intrauterina con un excelente valor predictivo positivo y negativo, sin embargo esta prueba todavía esta limitada para estudios y no es utilizada ampliamente en la práctica clínica.1,50
Por otra parte un mecanismo potencial de detección precoz de infección intra-amniótica posterior a una RPMP propuesto por distintos estudios, es la obtención de productos de degradación de los neutrófilos en plasma materno, como lactoferrina y defensina, obteniendo resultados favorables especialmente con éste últimamente mencionado.54
El cultivo del líquido amniótico ha sido calificado como el estándar ideal para identificar infección intrauterina. Su principal desventaja es el tiempo prolongado para la obtención de resultado, lo cual lo hace poco útil clínicamente. Además el cultivo no identifica infecciones localizadas en la decidua y corion que pudieran suceder sin la invasión bacteriana hacia cavidad amniótica.50
En cuanto a la tinción de Gram se requieren aproximadamente 10 organismos por mL para que sea positiva, sin embargo debe recordarse que ésta no identifica micoplasmas que son conocidos como un grupo importante de causa de infección intrauterina en RPM. La revisión de estudios indica gran variabilidad de resultados, limitando así su práctica clínica.38,50 Los niveles de glucosa bajos en el líquido amniótico se han propuesto para la detección temprana de infección debido probablemente a su metabolismo tanto bacteriano como de polimorfonucleares. Romero et al. usando niveles de glucosa menores de 14 mg/dl asociado a cultivos de líquido amniótico positivos, encontraron una sensibilidad de 87% comparado con la tinción de Gram sola con 65%.55,56 Otro método muy estudiado fue la medición de niveles de gonadotropina coriónica humana beta en secreciones vaginales, evidenciando que valores por encima de 39,8 mIU/ml tienen un valor predictivo positivo para diagnosticar RPM de 94,7% y un valor predictivo negativo de 95,5%, convirtiéndose en una prueba segura, sencilla y rápida para diagnosticar RPM en aquellos casos equívocos o poco claros.57
Así también se han realizado estudios para detectar biomarcadores para infección intra-amniótica utilizando la identificación de péptidos que se correlacionen en las mujeres embarazadas con esta enfermedad subclínica.58,59 Es por esto que Gravett M et al. realizaron un estudio en donde se usó un análisis basado en proteomics en líquido amniótico tanto en un modelo experimental en primates no humanos como en una cohorte de mujeres con trabajo de parto pretérmino e infección intra-amniótica; compararon los resultados de la identificación de péptidos y encontraron elevación de algunas proteínas y moléculas inmuno-reguladoras, siendo la primera vez reportadas. También se describió en este mismo estudio que estos péptidos podrían ser considerados candidatos para desarrollar inmunoensayos que pudieran ser tanto costoefectivos y no invasivos, debido a que estos se elevan tanto en líquido amniótico como en sangre materna, pero no en ausencia de infección.
Se han estudiado datos demográficos, exámenes de laboratorio y el examen físico como predoctores de parto pretérmino espontáneo. Su especificidad y sensibilidad son bajas y por esto son poco útiles. Sin embargo, se ha encontrado una asociación de parto pretérmino con la longitud cervical. La longitud promedio del cérvix en mujeres no embarazadas se encuentra reportada entre 3,1 y 3,8 cm, y en mujeres embarazadas en su primer trimestre se encontró una longitud mayor de 4,5 cm como factor que disminuía el riesgo de presentar parto pretérmino.60 Estudios recientes han comparado la longitud cervical y el riesgo de parto pretérmino, encontrando una asociación inversamente proporcional entre la longitud y el riesgo de presentar el evento.61 Este factor por sí solo no ha tenido el poder predictivo necesario y es por esto que en algunos estudios se le ha combinado con la medición de fibronectina fetal, encontrando una mayor asociación.62,63
Los marcadores tempranos de la enfermedad que se encuentran más avanzados en su investigación son, principalmente, los del campo de la infección intrauterina, sin embargo existen otros factores asociados con la RPMP mencionados previamente como son los nutricionales, genéticos y ambientales entre otros. Aun cuando varios estudios han buscado la distinta asociación de varios de estos factores es necesario continuar con una búsqueda más acuciosa de estos debido a que en el momento no hay estudios que sugieran una adecuada especificidad y sensibilidad para su uso.
CONCLUSIONES
La RPM es una complicación usual en la práctica médica. Esta puede aumentar la incidencia en la morbilidad y mortalidad materna y fetal. Múltiples estudios se están llevando a cabo para poder dilucidar completamente su fisiopatología, lo cual se hace cada vez más necesario para poder aplicar estos conceptos en la práctica clínica; sin embargo, aún queda camino por conocer totalmente el proceso real de la RPMF. Cada vez es más imperativo el estudio integral e individualizado de las pacientes con RPM debido a que deben ser clasificadas según la cantidad de factores de riesgo ya que algunos tienden a ser potenciadores. Así un método de tamizaje pudiera implementarse durante el seguimiento del embarazo como factores nutricionales, ambientales y genéticos o ante la sospecha de una posible RPMF pretérmino. Aun cuando se ha realizado un gran avance en el conocimiento de la fisiopatología y se realizan estudios cada vez más prometedores para el desarrollo de ensayos rápidos, no invasivos y costo efectivos, estas pruebas continúan en investigación pero el futuro tiende a ser promisorio frente a su manejo y pronóstico.
REFERENCIAS
1. Callahan TL, Caughey AB , Heffner L. Blueprints in obstetrics and gynecology. 2nd ed. Massachusetts : Blackwell Science;2001. [ Links ]
2. Steer P, Flint C. ABC of labour care: preterm labour and premature rupture of membranes. BMJ 1999;318:1059-62. [ Links ]
3. Wilkes P, Galan H. Premature Rupture of Membranes. Disponible en: http://www.e-medicine.com. [ Links ]
4. Marchiano D. Medical Encyclopedia MedlinePlus. ADAM Inc. Disponible en: http://www.nlm.nih.gov/medlineplus. [ Links ]
5. Reyna-Villasmil E, Torres-Montilla M, Reyna-Villasmil N, et al. Estructura y función de la matriz extracelular de las membranas fetales humanas. Rev Obstet Ginecol Venez 2003;63:19-30. [ Links ]
6. Parry S, Strauss JF 3rd. Premature rupture of the fetal membranes. New Eng J Med 1998;338:663-70. [ Links ]
7. Malak TM, Bell SC. Structural characteristics of term human fetal membranes: a novel zone of extreme morphological alteration within the rupture site. Br J Obstet Gynaecol 1994;101:375-86. [ Links ]
8. McLaren J, Malak TM, Bell SC. Structural characteristics of term human fetal membranes prior to labour: identification of an area of altered morphology overlying the cervix. Hum Reprod 1999;14:237-41. [ Links ]
9. Makrakis E, Grigoriou O, Kouskouni E, Vitoratos N, Salamalekis E, Chatzoudi E. Matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in plasma/serum and urine of women during term and threatened preterm labor: a clinical approach. J Maternal Fetal Neonatal Med 2003;14:170-6. [ Links ]
10. Ulug U, Goldman S, Ben-Shlomo I, Shalev E. Matrix metalloproteinase (MMP)-2 and MMP-9 and their inhibitor, TIMP-1, in human term deciduas and fetal membranes: effect of prostaglandin F(2alpha) and indomethacin. Mol Hum Reprod 2001;7:1187-93. [ Links ]
11. Goldman S, Weiss A, Eyali V, Shalev E. Differential activity of the gelatinases (matrix metalloproteinases 2 and 9) in the fetal membranes and decidua, associated with labour. Mol Hum Reprod 2003;9:367-73. [ Links ]
12. Lockwood CJ, Senyei AE, Dische MR, Casal D, Shah KD, Garite TJ, et al.. Fetal fibronectin in cervical and vaginal secretions as a predictor of preterm delivery. New Eng J Med 1991;325:669-74. [ Links ]
13. Br yant-Greenwood GD, Millar LK. Human fetal membranes: their preterm premature rupture. Biol Reprod 2000;63:1575-9. [ Links ]
14. Romero R, Chaiworapongsa T, Espinoza K, Gomez R, Yoon BH, Ewdwin S, et al. Fetal plasma MMP-9 concentrations are elevated in preterm premature rupture of the membranes. Am J Obstet Gynecol 2002;187:1125-30. [ Links ]
15. Polzin WJ, Brady K. The etiology of premature rupture of membranes. Clin Obstet Gynecol 1998;41:810-6. [ Links ]
16. Johnson MJ, Petri M, Witter FR, Repke JT. Evaluation of preterm delivery in a systemic lupus eithematosus pregnancy clinic. Obstet Gynecol 1995;86:396-9. [ Links ]
17. Diaz Arguello D, Reyes Cuervo H, Rojas Poceros G, von der Meden W, Kably Ambe A. Ehlers-Danlos syndrome in pregnancy. Report of a case and review of the literature. Ginecol Obstet Mex 1995;63:253-5. [ Links ]
18. Lind J, Wallenburg HC. Pregnancy and the Ehlers-Danlos syndrome: a retrospective study in a Dutch population. Acta Obstet Gynecol Scand 2002;81:293-300. [ Links ]
19. Sorokin Y, Johnson MP, Rogowski N, Richadson DA, Evans MI. Obstetric and gynecologic dysfunction in the Ehlers-Danlos Syndrome. J Reprod Med 1994;39:281-4. [ Links ]
20. Casey ML, MacDonald PC. Lysyl oxidase (ras recision gene) expression in human amnion: ontogeny and cellular localization. J Clin Endocrinol Metab 1997;82:167-72. [ Links ]
21. Kiilholma P, Gronroos M, Erkkola R, Pakarinen P, Nanto V. The role of calcium, copper, iron and zinc in preterm delivery and premature rupture of fetal membranes. Gynecol Obstet Invest 1984;17:194-201. [ Links ]
22. Siega-Riz AM, Promislow JH, Savitz DA, Thorp JM Jr, McDonald T. Vitamin C intake and the risk of preterm delivery. Am J Obstet Gynecol 2003;189:519-25. [ Links ]
23. Ferguson SE, Smith GN, Salenieks ME, Windrim R, Walker MC. Preterm premature rupture of membranes. Nutritional and socioeconomic factors. Obstet Gynecol 2002;100:1250-6. [ Links ]
24. Allen LH. Biological mechanisms that might underlie iron's effects on fetal growth and preterm birth. J Nutr 2001;131:581S-589S. [ Links ]
25. Vidaeff AC, Ramin SM. From Concept to practice: the recent history of preterm delivery prevention. Part II: Subclinical infection and hormonal effects. Am J Perinatol 2006;23:75-84. [ Links ]
26. Carey JC, Klebanoff MA, Hauth JC, Hillier S, Thom EA, Ernest JM, et al. Metronidazole to prevent preterm delivery in pregnant women with asymptomatic bacterial vaginosis. N Engl J Med 2000;342:534-40. [ Links ]
27. Brocklehurst P, Hannah M, McDonald H. Interventions for treating bacterial vaginosis in pregnancy (Cochrane Review). En: The Cochrane Library, Issue 1. Oxford , United Kingdom : Update Software; 2002. [ Links ]
28. US Preventive Services Task Forces. Screening for bacterial vaginosis in pregnancy: recommendation and rationale. Am J Prev Med 2001; 20:59-61. [ Links ]
29. Centers for Disease Control and Prevention. 1998 guidelines for treatment of sexually transmitted diseases. MMWR Recomm Rep 1998;47:1-111. [ Links ]
30. American College of Obstetricians and Gynecologists (ACOG). Assessment of risk factors for preterm birth. Practice bulletin No. 31. Washington, DC: American College of Obstetricians and Gynecologists; 2001. [ Links ]
31. Vitoratos N, Botsis D, Grigoriou O, Bettas P, Papoulias I, Zourlas PA. Smoking and preterm labor. Clin Exp Obstet Gynecol 1997;24:220-2. [ Links ]
32. Williams MA, Mittendorf R, Stubblefield PG, Lieberman E, Schoenbaum SC, Monson RR. Cigarettes, coffee, and preterm premature rupture of the membranes. Am J Epidemiol 1992;135:895-903. [ Links ]
33. Meis PJ, Klebanoff M, Thom E, Dombrowski MP, Sibai B, Moawad AH, et al. Prevention of recurrent preterm delivery by 17 Alpha-Hydroxyprogesterone caproate. N Engl J Med 2003;348:2379-85. [ Links ]
34. Romero R, Chaiworapongsa T, Espinoza J. Micronutrients and intrauterine infection, preterm birth and the fetal inflammator y response syndrome. J Nutr 2003;133:1668S-1673S. [ Links ]
35. Romero R, Ghidini A, Mazor M, Behnke E. Microbial invasion of the amniotic cavity in premature rupture of membranes. Clin Obstet Gynecol 1991;34:769-78. [ Links ]
36. Newton ER. Preterm labor, preterm premature rupture of membranes, and chorioamnionitis. Clin Perinatol 2005;32:571-600. [ Links ]
37. Asrat T. Intra-amniotic infection in patients with preterm prelabor rupture of membranes. Clin Perinatol 2001;28:735-51. [ Links ]
38. Goldenberg RL, Hauth JC, Andrews WW. Intrauterine infection and preterm deliver y. New Eng J Med 2000;342:1500-7. [ Links ]
39 Goldberg RL, Andrews WW, Hauth JC. Choriodecidual infection and preterm birth. Nutr Rev 2002;60:S19-25. [ Links ]
40. Yoon BH, Romero R, Park JS, Kim M, Oh SY, Kim C, et al. The relationship among inflammatory lesions of the umbilical cord (funisitis), umbilical cord plasma interleukin 6 concentration, amniotic fluid infection, and neonatal sepsis. Am J Obstet Gynecol 2000;183:1124-9. [ Links ]
41. Zhang W, Wang L, Zhao Y, Kang J. Changes in cytokine (IL8,IL-6, and TNF alpha) levels in the amniotic fluid and maternal serum in patients with premature rupture of the membranes. Zhongua Yi Xue Za Zhi (Taipei) 2000;63:311-5. [ Links ]
42. Keelan JA, Wang K, Chaiworapongsa T, Romero R, Mitchell MD, Sato TA, et al. Macrophage inhibitory cytokine 1 in fetal membranes and amniotic fluid from pregnancies with and without preterm labour and premature rupture of membranes. Mol Hum Reprod 2003;9535-40. [ Links ]
43. Cram LF, Zapata MI, Toy EC, Barker B. Genitourinary infections and their association with preterm labor. Am Fam Physician 2002;65:241-8. [ Links ]
44. Ott WJ. Current perspectives in antenatal fetal surveillance. Ultrasound Rev Obstet Gynecol 2003;3:1-18. [ Links ]
45. Park JS, Yoon BH, Romero R, Moon JB, Oh SY, Kim JC, et al. The relationship between oligohydramnios and the onset of preterm labor in preterm premature rupture of membranes. Am J Obstet Gynecol 2001;184:459-62. [ Links ]
46. Mercer BM. Preterm premature rupture of the membranes. Obstet Gynecol 2003;101:178-93. [ Links ]
47. Yoon BH, Jun JK, Park KH, Syn HC, Gomez R, Romero R. Serum C-reactive protein, white blood cell count, and amniotic fluid white blood cell count in women with preterm premature rupture of membranes. Obstet Gynecol 1996;88:1034-40. [ Links ]
48. Yoon BH, Romero R, Shim JY, Shim SS, Kim CJ, Jun JK. C-reactive protein in umbilical cord blood: a simple and widely available clinical method to assess the risk of amniotic fluid infection and funisitis. J Matern Fetal Neonatal Med 2003;14:85-90. [ Links ]
49. Nowak M, Oszukowski P, Szpakowski M, Malinowski A, Maciolek-Blewniewska G. [Intrauterine infections. The role of C-reactive protein, white blood cell count and erythrocyte sedimentation rate in pregnant women in the detection of intrauterine infection after preliminary rupture of membranes]. Ginekol Pol 1998;69:615-22. [ Links ]
50. Greig PC. The diagnosis of intrauterine infection in women with preterm premature rupture of the membranes (PPROM). Clin Obstet Gynecol 1998;41:849-63. [ Links ]
51. Hirsch E, Goldstein M, Filipovich Y, Wang H. Placental expression of enzymes regulating prostaglandin synthesis and degradation.Am J Obstet Gynecol 2005;192:1836-42. [ Links ]
52. Jacobson B, Mattsby-Baltzer I, Andersch B, Bokstrom H, Holst H, Nikolaitchouk N, et al. Microbial invasion and cytokine response in amniotic fluid in a Swedish population of women with preterm prelabor rupture of membranes. Acta Obstet Gynecol Scand 2003;82:423-31. [ Links ]
53. Poniedzialek-Czajkowska E, Leszczynska-Gorzelak B, Oleszczuk J. [Maternal serum cytokine levels in pregnancies complicated by PROM]. Ginekol Pol 2000;71:746:51. [ Links ]
54. Grable IA, Heine RP. Neutrophil granule products: can they identify subclinical chorioamnionitis in patients with preterm premature rupture of membranes. Am J Obstet Gynecol 2003;189:808-12. [ Links ]
55. Romero R, Yoon BH, Mazor M, Gomez R, Gonzalez R, Diamond MP, et al. A comparative study of the diagnostic performance of amniotic fluid glucose, white blood cell count, interleukin-6, and gram stain in the detection of microbial invasion in patients with preterm premature rupture of membranes. Am J Obstet Gynecol 1993;169:839-51. [ Links ]
56. Chaiworapongsa T, Romero R, Kim JC, Kim YM, Blackwell SC, Yoon BH. Evidence for fetal involvement in the pathologic process of clinical chorioamnionitis. Am J Obstet Gynecol 2002;186:1178-82. [ Links ]
57. Kim YH, Park YW, Kwon HS, Kwon JY, Kim BJ. Vaginal fluid beta-human chorionic gonadotropin level in the diagnosis of premature rupture of membranes. Acta Obstet Gynecol Scand 2005;84:802-5. [ Links ]
58. Gravett MG, Novy MJ, Rosenfield RG, Reddy AP, Jacob T, Turner M, et al. Diagnosis of intraamniotic infection by protemic profiling and identification of novel biomarkers. JAMA 2004;292:462-9. [ Links ]
59. Klein LL, Freitag BC , Gibbs RS, Reddy AP, Nagalla SR, Gravett MG. Detection of intra-amniotic infection in a rabbit model by proteomics-based amniotic fluid analysis. Am J Obstet Gynecol 2005;193:1302-6. [ Links ]
60. Zalar RW Jr. Early cervical length, preterm prelabor and gestational age at delivery. Is there a relationship? J Reprod Med 1998;43:1027-33. [ Links ]
61. To MS, Skentou C, Cicero S, Liao AW, Nicolaides KH. Cervical length at 23 weeks in triplets: prediction of spontaneous preterm delivery. Ultrasound Obstet Gynecol 2000;16:515-8. [ Links ]
62. Vidaeff AC, Ramin SM. From concept to practice: the recent history of preterm delivery prevention. Part I: cervical competence. Am J Perinatol 2006;23:3-13. [ Links ]
63. Goldenberg RL, Iams JD, Mercer BM, Meis PJ, Moawad AH, Copper RL, et al. The preterm prediction study: the value of new vs standard risk factors in predicting early and all spontaneous preterm births. Am J Public Health;1998;88:233-8. [ Links ]
Conflicto de intereses: ninguno declarado.














