Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.59 no.4 Bogotá Oct./Dec. 2008
Carlos Fernando Grillo-Ardila, M.D.*, Mercy Yolima Martínez-Velásquez, M.D.**, Buenaventura Morales-López, M.D. ***
Recibido: diciembre 5/07 - Aceptado: septiembre 30/08
* Residente tercer año, Departamento de Obstetricia y Ginecología, Universidad Nacional de Colombia. Bogotá, Colombia. Correo electrónico: drfaunago@hotmail.com
** Residente tercer año, Departamento de Obstetricia y Ginecología, Universidad Nacional de Colombia. Bogotá, Colombia.
*** Jefe Departamento Ciencias Fisiológicas, Universidad Nacional de Colombia. Ginecólogo Oncólogo Clínica Palermo. Bogotá, Colombia.
RESUMEN
Objetivo: realizar una revisión de los mecanismos implicados en la patogénesis y la oncogénesis del virus del papiloma humano sobre el epitelio cervical.
Metodología: se realizó una búsqueda electrónica para identificar la literatura relevante en Medline, publicada en inglés o español desde el año 2000 hasta el año 2007. Se eligieron artículos de investigación en cáncer, que evaluaran la patogénesis y la oncogénesis del virus del papiloma humano en el epitelio cervical; también se realizó una búsqueda de la literatura en textos reconocidos acerca del tema.
Resultados: el virus del papiloma humano constituye la infección de transmisión sexual más prevalente y su nexo con el cáncer de cérvix está lejos de toda duda. La biología molecular y la genética del cáncer constituyen una herramienta de vanguardia útil en la comprensión de los mecanismos involucrados en la carcinogénesis.
Conclusiones: sólo el profundo conocimiento de los aspectos relacionados con la infección por el virus del papiloma humano, permitirá el desarrollo de mejores y tempranos métodos diagnósticos, al tiempo que fomentará la aparición de nuevos blancos terapéuticos en la lucha contra el cáncer.
Palabras clave: virus del papiloma humano, cáncer de cérvix, ciclo celular, patogénesis, oncogénesis, p53, pRb, E6, E7.
SUMMARY
Objective: reviewing the mechanisms involved in pathogenesis and oncogenesis associated with human papillomavirus in cervical epithelium.
Method: an electronic search was made for identifying relevant literature in Medline, in English or Spanish, from 2000 to 2007. All original cancer studies assessing the oncogenesis and pathogenesis of human papillomavirus in cervical epithelium were chosen; recognised medical books were also searched for information regarding this topic.
Results: human papillomavirus is the most prevalent infection affecting the sexually-active population and its relationship with cervical cancer is well known. Molecular biology and cancer's genetics are useful tools in understanding carcinogenesis.
Conclusions: only the deepest knowledge regarding human papillomavirus infection will provide better and early diagnosis methods at a time leading to the appearance of newer therapeutical targets in the fight against cancer.
Key words: human papillomavirus, cervical cancer, cell cycle, pathogenesis, oncogenesis (p53, pRb, E6, E7).
INTRODUCCIÓN
El cáncer de cuello uterino constituye la primera causa de muerte por cáncer en el mundo, con una incidencia de medio millón de casos al año;1incidencia que varía en los distintos grupos poblacionales, pero cuya mayor mortalidad radica en los países en vías de desarrollo, en donde la conjunción de factores sociales, políticos, culturales y económicos, sumado al inadecuado registro y desconocimiento de la enfermedad, le han convertido en un problema de salud pública.2 Para Colombia, el cáncer de cuello uterino constituye la primera causa de patología maligna genital, con una incidencia de 48,2 por 100.000 mujeres al año y una mortalidad esperada de 273.000 mujeres al año.3
En la actualidad la biología molecular y la genética del cáncer hacen parte primordial de las herramientas de vanguardia para combatir este flagelo. Sólo el conocimiento y la investigación de los mecanismos implicados en la carcinogénesis asociada al virus del papiloma humano (VPH) han de generar mejores herramientas diagnósticas, al tiempo que brindarán nuevos blancos para la intervención terapéutica oportuna.
El objetivo de la presente publicación es desarrollar una revisión del mecanismo implicado en la patogénesis y oncogénesis del virus del papiloma humano sobre el epitelio cervical.
MATERIALES Y MÉTODOS
Pregunta de la revisión: ¿cuál es el mecanismo implicado en la patogénesis y oncogénesis del virus del papiloma humano sobre el epitelio cervical?
Estrategia de búsqueda: Se seleccionaron las siguientes palabras clave: human papillomavirus, cervical cancer, cell cycle, pathogenesis, oncogenesis, p53, pRb, E6, E7. Se realizó una búsqueda electrónica para identificar la literatura relevante en Medline desde el año 2000 hasta el año 2007; también se realizó una búsqueda de la literatura en textos reconocidos acerca del tema. Criterios de selección: artículos de investigación publicados en inglés o español que evaluaran la patogénesis y la oncogénesis del virus del papiloma humano en el epitelio cervical.RESULTADOS
Ciclo celular
Se define ciclo celular como el lapso de tiempo comprendido entre dos divisiones mitóticas (interfase), compuesto por los períodos G0 (punto de quiescencia del ciclo celular); G1 (síntesis de ácido ribonucleico y proteínas); S (síntesis y replicación del ácido desoxiribonucleico), y G2 (período de transición de la fase S al inicio de la mitosis).4 Figura 1.
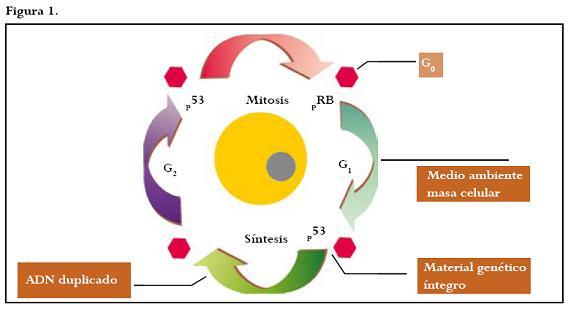
La proliferación celular es estrictamente regulada por un delicado balance entre señales activadoras e inhibitorias,4 papel desempeñado por la interacción de proteínas como las ciclinas, las quinasas dependientes de ciclinas (CDK por sus siglas en inglés) y los inhibidores de las quinasas dependientes de ciclinas (CDKI).5,6
Las CDK no son activas en forma autónoma, sino que requieren su asociación a subunidades reguladoras (ciclinas) como paso inicial para la activación del ciclo celular;6 subunidades reguladoras que poseen la característica de ser cíclicamente sintetizadas y destruidas por actividad proteolítica (de ahí su nombre).
En contraparte, el control negativo sobre el ciclo celular es ejercido por los inhibidores de las quinasas dependientes de ciclinas (CDKI);7 la expresión de estos inhibidores es mediada por la activación de genes supresores tumorales (p53 y pRb) en los puntos de control del ciclo celular, encargados de detenerlo en caso de existir una falla.7,8
Así pues, el proceso de transformación tumoral de una célula, es el resultado del compromiso en los mecanismos reguladores del ciclo celular,9 ya sea de forma congénita o adquirida,11 determinando la aparición de un clon celular inmortal, en continua transformación y con capacidad metastásica.11
El virus del papiloma humano
El VPH es un virus ADN de doble cadena circular, con cápside icosaédrica, fuertemente ligado como factor causal del cáncer de cérvix con fundamento en evidencia epidemiológica y soporte biológico plausible.5,12 Existen más de 80 tipos distintos de VPH, de los cuales, al menos 25 afectan al tracto genital femenino y, de acuerdo a su asociación con lesiones preinvasivas y cáncer, se agrupan en: alto (tipos 16, 18, 45, 56), moderado (tipos 31, 33, 35, 51, 52) y bajo riesgo (tipos 6, 11, 40, 42, 43, 44), siendo el VPH 16 el responsable hasta en el 50% de todos los cáncer cervicales.13,14
El genoma del VPH posee 8000bp de longitud y codifica ocho regiones de lectura abierta (ORF por sus siglas en inglés) que regulan la síntesis de proteínas tempranas (E1, E2, E5, E6, E7) y tardías (L1, L2) de acuerdo a su expresión durante el ciclo devidaviral. Tabla 1.14,15 Las secuencias reguladoras requeridas para la transcripción y la replicación del genomaviral se encuentran localizadas en una región no codificante denominada URR.16,17

Fisiopatología
La unión escamo-columnar del epitelio cervical es la zona más susceptible a la infección por VPH, de ahí que sea el lugar más frecuente (hasta el 90%) de localización del carcinoma.13 El epitelio cervical exhibe una organización estratificada, en donde las células de la capa basal conservan la capacidad mitótica.18 Como resultado de la división celular, se da origen a dos células idénticas; una de ellas migra al estrato inmediatamente superior para completar su diferenciación terminal y la segunda permanece en el estrato basal como célula de ciclado lento y de recambio.15,17
Al ocurrir la infección por VPH, el genoma viral es sintetizado en las células basales a partir de copias episomales,5 afectando a la progenie, en donde una célula perpetuará la infección, y aquella destinada al cambio de estrato epitelial, presentará la expresión de genes tardíos, dando inicio a la fase vegetativa del ciclo de vida del VPH.18 Finalmente, el ADN viral es empaquetado en la cápside y los viriones son liberados para reiniciar un nuevo ciclo de vida.15,19
Cabe anotar que la diferencia en el riesgo para la progresión a carcinoma cervical radica en la persistencia de la infección y, por ende, a la integración del ADN viral al de la célula huésped.20 Los tipos de VPH de bajo riesgo tienden a permanecer como episomas, en tanto que los de alto riesgo se integran de forma covalente al ADN hospedero.20 Evidencia experimental sugiere que la integración al genoma es consecuencia de la inestabilidad y el compromiso de la integralidad cromosómica en las células basales, todo ello auspiciado por la expresión de las oncoproteínas E6 y E7.5,21 La relativa expresión de los oncogenes y sus productos, podría estar directamente influenciada por el contexto de la secuencia en el sitio individual de integración.22
Oncoproteína E6
Codifica una proteína de 150 aminoácidos con un peso molecular de 16 kD con propiedad transcripcional, que le confiere el potencial de inmortalización celular.15 Dos mecanismos asociados a la oncoproteína E6 han sido implicados en la transformación e inmortalización del epitelio ante la infección por VPH, y comprenden acciones sobre o independientes a p53.20
En lo que respecta a su acción sobre p53, E6 promueve su degradación al reclutar el complejo enzimático necesario para la proteólisis,12 comprometiendo la señalización en el control del ciclo celular y favoreciendo la integración del ADN foráneo al de la célula huésped.23
Dentro de los mecanismos de acción independientes a p53, E6 posee la capacidad de interactuar con quinasas,24 incrementando la tasa de actividad mitótica, al tiempo que degrada complejos proteicos (proteínas con dominios PDZ)25 localizados en la interfase citoesqueleto-membrana, que regulan el crecimiento, la proliferación, la polaridad y la adhesión celular.26
E6 también posee la capacidad de inducir actividad telomerasa,27 favoreciendo su estado persistente activo, contribuyendo a la inmortalización de las células epiteliales, al mantener la longitud del telómero e incrementando el número de divisiones celulares.28,29 Otros oncogenes han sido recientemente ligados a los procesos de carcinogénesis inducida por E6, entre los cuales se encuentra la familia RAS (K-RAS, H-RAS, N-RAS), Notch-1 (procesos de maduración y diferenciación celular)30,31 y c-Myc, entre otros; todos ellos asociados a la transducción de señales celulares y con expresión variable a lo largo de los distintos estadios de la patología cervical.32,33
Oncoproteína E7
Codifica una proteína de bajo peso molecular compuesta por 100 aminoácidos organizados en tres regiones conservadas, fundamentales para la unión y degradación de pRb (la familia pRb actúa como supresora del crecimiento, al controlar factores de transcripción requeridos para la replicación del ADN).6,33 La evidencia experimental sugiere que la unión de E7 a pRb genera la síntesis en la fase S de ciclina A y E, favoreciendo la progresión del ciclo celular, al tiempo que atenúa la actividad de los inhibidores de las quinasas dependientes de ciclinas (CDKI: p21 y p27).16
E7 posee la capacidad de inducir inestabilidad genómica al generar un desbalance en la segregación cromosómica, como resultado de la inusual amplificación de los centrosomas y/o disfunción de los centrómeros (estableciendo la aneuploidía característica).5 Finalmente, estudios recientes han encontrado que E7 posee la capacidad de interactuar con p600, fomentando el crecimiento independiente del anclaje celular.16
CONCLUSIONES
El cáncer es una enfermedad compleja, que surge ante las alteraciones genéticas que interfieren con las funciones celulares encargadas de regular la proliferación, apoptosis y envejecimiento. El daño subyacente al desarrollo del cáncer tiene la vía común de la perturbación en los mecanismos reparadores del ADN que permiten el acúmulo de mutaciones, fomentando el desarrollo al interior del tejido huésped de un clon genéticamente distinto, con capacidad de crecimiento indefinido, independencia a los factores de crecimiento, ausencia en la inhibición dependiente de celularidad y cambios en la organización del citoesqueleto.
Sólo el conocimiento de los mecanismos implicados en los procesos de carcinogénesis, permitirá el avance y desarrollo de nuevas estrategias para derrotar este flagelo.
REFERENCIAS
1. Hacker NF. Cáncer cervical. En: Berek JS, Hacker NF, editores. Ginecología oncológica práctica. 4a. ed. México D.F.: McGraw Hill Interamericana; 2006. p. 337-95. [ Links ]
2. Aragón ME. Cáncer de cuello uterino. En: Texto de ginecología. 1a. edición. Bogotá: NET Educativa Editorial; 2007. p. 389-400. [ Links ]
3. Castro MA, Vera LM, Posso HJ. Epidemiología del cáncer de cuello uterino: estado del arte. Rev Colomb Obstet Ginecol 2006;57:182-9. [ Links ]
4. Lewin B. Cell cycle and growth regulation. En: Lewin B. Genes VIII. Upper Saddle River, NJ: Pearson Prentice Hall; 2004. p. 843-88. [ Links ]
5. Jo H, Kim JW. Implications of HPV infection in uterine cervical cancer. Cancer Ther 2005,3:419-34. [ Links ]
6. Clarke B, Chetty R. Cell cycle aberrations in the patogénesis of squamous cell carcinoma of the uterine cervix. Gynecol Oncol 2001;82:238-46. [ Links ]
7. Wolf JK, Franco EL, Arbeit JM, Shroyer KR, Wu T, Runowicz CD, et al. Innovations in understanding the biology of cervical cancer. Cancer 2003;98:2064-9. [ Links ]
8. Sanseverino F, Torricelli M, Petraglia F, Giordano A. Role of the retinoblastoma family in gynecological cancer. Cancer Biol Ther 2003;2:636-41. [ Links ]
9. Gasco M, Shami S, Crook T. The p53 pathway in breast cancer. Breast Cancer Res 2002;4:70-6. [ Links ]
10. Kim YT, Zhao M. Aberrant cell cycle regulation in cervical carcinoma. Yonsei Med J 2005;46:597-613. [ Links ]
11. Lewin B. Oncogenes and cancer. En: Lewin B. Genes VIII. Upper Saddle River, NJ: Pearson Prentice Hall; 2004. p. 889-937. [ Links ]
12. Elqui de Oliveira DE. DNA viruses in human cancer: an integrated overview on fundamental mechanisms of viral carcinogenesis. Cancer Lett 2007;247:182-96. [ Links ]
13. Janicek MF, Averette HE. Cervical cancer: prevention, diagnosis, and therapeutics. CA Cancer J Clin 2001;51:92-114. [ Links ]
14. de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen TR. Classification of papillomaviruses. Virology 2004;324:17-27. [ Links ]
15. Boulet G, Hor vath C, Broeck DV, Sahebali S, Vanden Bogers J. Human papillomavirus: E6 and E7 oncogenes. Int J Biochem Cell Biol 2007;39:2006-11. [ Links ]
16. Stanley MA.Human papillomavirus and cervical carcinogenesis. Best Pract Res Clin Obstet Gynaecol 2001;15:663-76. [ Links ]
17. Longworth MS, Laimins LA. Pathogenesis of human papillomaviruses in differentiating epithelia. Microbiol Mol Biol Rev 2004;68:362-72. [ Links ]
18. Motoyama S, Ladines-Llave CA, Luis Villanueva S, Maruo T. The role of human papilloma virus in the molecular biology of cervical carcinogenesis. Kobe J Med Sci 2004;50:9-19. [ Links ]
19. Man S, Fiander A. Immunology of human papillomavirus infection in lower genital tract neoplasia. Best Pract Res Clin Obstet Gynaecol 2001;15:701-14. [ Links ]
20. Narisawa-Saito M, Kiyono T. Basic mechanisms of high-risk human papillomavirus-induced carcinogenesis: roles of E6 and E7 proteins. Cancer Sci 2007;98:1505-11. [ Links ]
21. Yoshida T, Sano T, Kanuma T, Owada N, Sakurai S, Fukuda T, et al. Quantitative real-time polymerase chain reaction analysis of the type distribution, viral load, and physical status of human papillomavirus in liquid-based cytology samples from cervical lesions. Int J Gynecol Cancer 2008;18:121-7. [ Links ]
22. Sima N, Wang S, Wang W, Kong D, Xu Q, Tian X, et al. Antisense targeting human papillomavirus type 16 E6 and E7 genes contributes to apoptosis and senescence in SiHa cervical carcinoma cells. Gynecol Oncol 2007;106:294-304. [ Links ]
23. Wentzensen N, Vinokurova S, von Knebel Doeberitz M. Systematic review of genomic integration sites of human papillomavirus genomes in epithelial dysplasia and invasive cancer of the female lower genital tract. Cancer Res 2004;64:3878-84. [ Links ]
24. Scheffner M, Whitaker NJ. Human papillomavirus induced carcinogenesis and the ubiquitin-proteasome system. Semin Cancer Biol 2003;13:59-67. [ Links ]
25. Lee C, Laimins LA. Role of the PDZ domain-binding motif of the oncoprotein E6 in the patogénesis of human papillomavirus type 31. J Virol 2004;78:12366-77. [ Links ]
26. NguyenML, Nguyen MM, Lee D, Griep AE, Lambert PF. The PDZ ligand domain of the human papillomavirus type 16 E6 protein is required for E6's induction of epithelial hyperplasia in vivo. J Virol 2003;77:6957-64. [ Links ]
27. Wisman GB, deJong S, Meersma GJ, Helder MN, Hollema H, de Vries EG, et al. Telomerasa in (pre)neoplastic cervical disease. Hum Pathol 2000;31:1304-12. [ Links ]
28. Lewin B. Chromosomes. En: Lewin B. Genes VIII. Upper Saddle River, NJ: Pearson Prentice Hall; 2004. p. 545-69. [ Links ]
29. Zimmermann S, Martens UM.Telomeres and telomerase as targets for cancer therapy. Cell Mol Life Sci 2007;64:906-21. [ Links ]
30. Talora C, Sgroi DC, Crum CP, Dotto GP. Specific down-modulation of notch1 signaling in cervical cancer cells is required for sustained HPV-E6/E7 expression and late steps of malignant transformation. Genes Dev 2002;16:2252-63. [ Links ]
31. Yao J, Duan L, Fan M, Yuan J, Wu X.Notch1 induces cell cycle arrest and apoptosis in human cervical cancer cells: involvement of nuclear factor kappa B inhibition. Int J Gynecol Cancer 2007;17:502-10. [ Links ]
32. Wang L, Qin H, Chen B, Xin X, Li J, Han H. Overexpressed active Notch1 induces cell growth arrest of HeLa cervical carcinoma cells. Int J Gynecol Cancer 2007;17:1283-92. [ Links ]
33. Kuner R, Vogt M, Sultmann H, Buness A, Dymalla S, Bulkescher J, et al. Identification of cellular targets for the human papillomavirus E6 and E7 oncogenes by RNA interference and transcriptome analyses. J Mol Med 2007;85:1253-62. [ Links ]
Conflicto de intereses: ninguno declarado.














