Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.60 no.3 Bogotá JulySept. 2009
Mario Arturo Isaza-Ruget, M.D.*, Gonzalo Perez, M.D.**, Olga Lucía Morales-Reyes, MSc.***, Rodrigo Deantonio-Suárez, M.D., MSc.****, Catherine Alvarado-Heine, M.D.,*****, Lina María Trujillo, M.D.,******, Colaboradores******
Recibido: marzo 10/09 – Aceptado: agosto 31/09
* Médico Especialista en Patología Clínica y Anatómica. Bogotá (Colombia).
** Médico Especialista en Ginecología y Oncología, Epidemiólogo y Profesor de la Universidad del Rosario. San Pablo (Brasil).
***Bacterióloga, MSc en Infecciones y Salud en el Trópico, Investigación y Educación, Clínica Colsanitas S.A. Bogotá (Colombia). Correo electrónico: olmorales@colsanitas.com
****Médico, Máster en Economía de la Salud, Especialista en Epidemiología, Ciudad de Panamá (Panamá).
***** Médico Especialista en Patología Clínica y Anatómica, Directora del departamento de Patología, Clínica Colsanitas S.A. Bogotá (Colombia).
****** Médico Ginecólogo y Oncólogo, Especialista adscrito a Colsanitas S.A. Bogotá (Colombia).
******* Colaboradores (lista completa al final del documento).
RESUMEN
Objetivo: evaluar la exactitud de la prueba ADNHPV en el diagnóstico de lesiones premalignas cervicales de alto grado (HSIL, por sus siglas en inglés) en mujeres con alteraciones citológicas ASC-US (células escamosas atípicas de significado indeterminado) y LSIL (lesión escamosa intraepitelial de bajo grado).
Metodología: estudio de validez diagnóstica y de cohorte transversal, realizado en mujeres con diagnóstico citológico de ASC-US o LSIL entre octubre de 2006 y enero de 2008, pertenecientes al Programa de Tamizaje de Cáncer de Cérvix de una aseguradora privada en Bogotá (Colombia). Se comparó el resultado de la colposcopia y de la prueba de ADN-HPV con la patología del cérvix como patrón de oro.
Resultados: de las 429 mujeres, 344 (80,2%) presentaron ASC-US y 85 (19,8%) LSIL. Las prevalencias de infección por HPV de alto riesgo fueron 52,9% y 75,7% en pacientes con reporte citológico de ASC-US y LSIL, respectivamente. A las 379 de las 425 pacientes se les practicó biopsia, 24 (6,3%) dieron positivas para HSIL. La sensibilidad de la prueba ADN-HPV para detectar lesiones de alto grado (NIC 2+) en las mujeres con reportes de citología ASC-US y LSIL fue 88% y la especificidad fue 44%. En 21 (87.5%) de los 24 casos de HSIL se detectó la presencia de HPV de alto riesgo.
Conclusión: debido a que la prueba ADN-HPV tiene una sensibilidad superior a la citología cervicovaginal (CCV), ésta puede considerarse una alternativa útil para estratificar el riesgo y mejorar la aproximación diagnóstica de lesiones premalignas del cuello uterino en mujeres con reporte de ASC-US.
Palabras clave: sondas ADN HPV, infecciones por papillomavirus, neoplasia intraepitelial del cuello uterino, citología, colposcopia.
SUMMARY
Objective: evaluating the accuracy of the HPV DNA test as a complementary test for diagnosing highgrade cervical disease (high-grade squamous intra epithelia lesions-HSIL) in women with minor cytological abnormalities (atypical squamous cells of undetermined significance ASC-US) and low-grade squamous intraepithelial lesions (LSIL).
Methodology: a diagnostic validity study based on a cross-sectional design was applied to 429 women who had had a cytological report of ASC-US and/or LSIL who were attending a health maintenance organisation’s cervical cancer screening programme in Bogotá, Colombia between January 2006 and October 2008. Colposcopy reports and HPV-DNA testresultswerecomparedwithpathologicalreports which were considered the gold standard.
Results: 344 (80.2%) of the 429 women had a cytological report of ASC-US and 85 (19.8%) of them one for LSIL. High-risk HPV infection prevalence was 52.9% and 75.7% in patients having an ASC-US and LSIL report, respectively. A biopsy specimen was obtained in 379 of the 429 participants and 24 high-grade cases (6.3%) were diagnosed. DNA-HPV test sensitivity was 88% and specificity was 44% for detecting high-grade disease (CIN 2+) in women having an ASC-US and LSIL cytology report . The presence of high-risk HPV virus was detected in 21 of the 24 HSIL cases (87.5%).
Conclusion: the DNA-HPV test’s higher sensitivity compared to the PAP smear (due to high NPV) means that it could be considered a useful tool for stratifying risk and improving the diagnostic approach to premalignant lesions of the uterine cervix in patients having a cytological report of ASC-US.
Key words: DNA probe, HPV; papillomavirus infection, cervical intraepithelial neoplasia, cytology, colposcopy.
INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es la neoplasia más frecuente en países en desarrollo,1,2 y se ha demostrado su asociación causal con la infección por el virus del papiloma humano (VPH).3-7 En Colombia, la tasa de incidencia anual del CCU es de las más altas del mundo (36,4/100.000), con aproximadamente 6.815 casos nuevos y 3.300 muertes por año.8 La infección por algunos tipos del virus del papiloma humano se reconoce como la causa principal y necesaria para generar enfermedades preinvasivas e invasivas del aparato genital.9,10 Asimismo, la prevalencia del VPH en la mucosa cervical de mujeres con resultado normal de citología se estima en 14,9%.11 La aplicación de la citología cervical en programas sistemáticos de cribado, ha mostrado ser efectiva en la reducción de las tasas de incidencia y de mortalidad del cáncer de cérvix, en varios países del hemisferio norte.12 Sin embargo, esta experiencia está lejos de ser reproducida en países o regiones pobres, donde existen limitaciones para la implementación de programas de prevención secundaria. Además, la prueba está sujeta a múltiples errores potenciales que disminuyen su desempeño.13
Diversos estudios han evaluado la citología cervicalconresultadosdesensibilidadyespecificidad muy variables, como lo indica la revisión sistemática de Nanda K y colaboradores.14 Para la neoplasia intraepitelial cervical (NIC), la citología informada comoASC-US (Atypical Squamous Cells Of Undetermined Significance) o lesiones premalignas de bajo grado LGSIL (Low Grade Squamous Intraepithelial Lesion) tiene una sensibilidad de 72% y una especificidad de 75% y para lesiones NIC II y NIC III la sensibilidad es de 68% y la especificidad aumenta hasta 82%.14
Las pruebas de ADN se diferencian de la citología cervical, ya que pueden detectar la presencia o ausencia del VPH así como la persistencia de infección, condición necesaria para los procesos de integración genómica y transformación maligna; en la práctica significa que permiten la identificación de poblaciones en riesgo.15 Las indicaciones aceptadas para el empleo de las pruebas de ADN incluyen su uso en tamizaje primario en mujeres mayores de 30 años y en el seguimiento de mujeres postratamiento quirúrgico conservativo de lesiones intraepiteliales de alto grado.16
Las pruebas de ADN tienen mayor sensibilidad que la citología en todos los grupos etáreos; la especificidad es menor especialmente en el grupo de mujeres menores de 35 años, pero en adelante, las diferencias en especificidad de otros métodos se tornan pequeñas. El valor predictivo positivo (VPP) de ambas pruebas ha demostrado ser alto en mujeres jóvenes, debido a la alta prevalencia de infección.15,17
El manejo de las anormalidades citológicas ASC-US utilizando la detección ADN-HPV complementario contribuye positivamente al diagnóstico de lesiones precancerosas a un costo favorable para los sistemas de salud. Este ahorro se explica porque en las mujeres con pruebas VPH negativas el número de colposcopias realizadas es menor y el tamizaje cervical se practica por intervalos de tiempo mayores.14,17,18 Sin embargo, los estudios de costo-efectividad no son directamente extrapolables a diferentes escenarios.
En el programa de Tamizaje de Cáncer de la EPS Sanitas en Bogotá, viene aplicándose la metodología diagnóstica tradicional que involucra la práctica de citología cérvico-uterina seguida de la colposcopia y de la biopsia de lesiones sospechosas. Se considera importante evaluar el rendimiento de la prueba en nuestra población antes de adaptarlo como parte del proceso diagnóstico de nuestra unidad.
Por consiguiente, el propósito de este estudio fue determinar el grado de exactitud de la prueba diagnóstica AMPLICOR® Human Papilloma Virus (HPV) Test, comparada con el resultado de la biopsia en la detección de lesiones premalignas de alto grado (HSIL) o superiores (cáncer de cérvix), en pacientes con citología ASC-US y LSIL. Como objetivo secundario, se evaluaron los factores asociados con la infección del VPH.
METODOLOGÍA
Se llevó a cabo un estudio de cohorte transversal para evaluar la validez de una prueba diagnóstica en mujeres que consultaron entre octubre de 2006 y enero de 2008, usuarias del Programa de Tamizaje de Cáncer Cervical de la Entidad Promotora de salud (EPS) Sanitas, tercer pagador privado que tiene centros de atención para pacientes de la seguridad social privada ubicado en Bogotá (Colombia). Se incluyeron pacientes con reporte de citología ASC-US o LSIL sin antecedentes de alteración citológica previa a la citología actual. En contraste, se excluyeron aquellas que habían recibido vacunación contra el VPH, quienes presentaban enfermedades inmunosupresivas o neoplasias y antecedentes de histerectomía o embarazo.
Tamaño muestral: sobre una prevalencia de 27% de lesiones premalignas de alto grado11 con un poder de 80%, un nivel de confianza de 95% y un margen de error de 6%, se definió una muestra de 429 pacientes. El reclutamiento se realizó mediante muestreo consecutivo.
Procedimiento: a todas las participantes se les practicó colposcopia y a quienes presentaron hallazgos atípicos, se les practicó biopsia cervical. Previo al examen colposcópico, se recolectó una muestra cervical en un medio para citología en fase líquida (CFL) (PreservCyt®) que fue almacenada a 4ºC hasta su procesamiento de análisis de ADN-HPV en el Laboratorio de Biología Molecular de la Clínica Universitaria Colombia. De igual modo, las citologías y biopsias fueron analizadas en el laboratorio de patología de la misma institución.
Para la citología: este procedimiento se realizó mediante la coloración papanicolaou modificado (Cytocolor® Merck), siguiendo los criterios convencionales vigentes, Bethesda 2001.
Colposcopia: los exámenes fueron realizados por médicos ginecólogos oncólogos pertenecientes a la Organización Sanitas Internacional y con amplia experiencia en dicha metodología, quienes previamente recibieron entrenamiento de estandarización de los informes, usando el Índice de Reid.19
Para tal efecto, se realizó el examen colposcópico mediante la aplicación de solución de ácido acético al 3%-5%, continuando con la aplicación de solución de lugol, y siguiendo los criterios de Reid previamente documentados.19
A las pacientes que presentaron hallazgos colposcópicos patológicos se les practicó biopsia dirigida por colposcopia. Los análisis anatomopatológicos fueron realizados por tres médicos patólogos del Laboratorio de Patología, debidamente certificados, quienes permanecieron cegados a los resultados de la colposcopia y a la prueba de ADN durante la recolección de datos, hasta el momento del análisis de los resultados.
Detección ADN-HPV: las pruebas se realizaron utilizando la técnica AMPLICOR® HPV TEST (Roche Molecular Systems), de acuerdo con las instrucciones del fabricante. En cuanto a la recolección de muestras de células de cuello uterino se utilizó el Kit ThinPrep® (vial de líquido ThinPrep para Papanicolaou, Cytyc Corporation). La prueba AMPLICOR® HPV test se basa en cuatro procesos principales: extracción del ADN de la muestra, amplificación mediante PCR del ADN objetivo utilizando iniciadores complementarios específicos para el VPH, hibridación de los productos amplificados a sondas oligonucleótidas y detección de los productos amplificados fijados a las sondas mediante determinación colorimétrica. La mezcla de iniciadores del HPV ha sido diseñada para amplificar ADN de 13 genotipos del VPH de alto riesgo (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59 y 68). La prueba detecta 240 copia/mL de los genotipos 31, 52, 58 y 59, y 100 copias/mL de los genotipos 16, 18, 33, 35, 39, 45, 51, 56 y 68 del VPH. Como control de calidad de la prueba, el gen de la ß-globina se aísla de forma concurrente y sirve para evaluar la técnica en cuanto a la preparación celular, y a la extracción y amplificación de las muestras. Además, en cada montaje se procesa un control AMPLICOR® HPV (–) y un control AMPLICOR® HPV (+).20
Variables a medir: edadenaños,ocupación,estrato socioeconómico, nivel educativo, edad de inicio de las relaciones sexuales, métodos anticonceptivos, edad de menarquia, paridad, número de compañeros sexuales, resultado de informe de citología cervical (ASC-USyLSIL),resultadom de examen colposcópico (normal, bajo grado, alto grado, insatisfactorio), informe de la histopatología (normal, LSIL y HSIL) y del test HPV-ADN (positivo o negativo). Para la evaluación global de la prueba, el patrón de oro fue la biopsia dirigida por colposcopia mientras que para la evaluación del desempeño operativo de la prueba según el tipo de citología de base se consideró como patrón principal, el resultado de la histopatología o el resultado de la colposcopia (resultado normal que se asumió como negativo para NIC).
Análisis estadístico: se realizó un análisis descriptivo de las variables demográficas y clínicas de las pacientes del estudio. Las variables cualitativas se evaluaron utilizando las distribuciones de frecuencias y las distribuciones porcentuales. Para las variables cuantitativas, por su parte, se emplearon medidas de tendencia central (promedio, mediana y moda) y de dispersión o variabilidad utilizando el rango y la desviación estándar.
Seguidamente, se compararon los resultados de la prueba de ADN-VPH contra los resultados de la prueba de oro. Se calcularon puntualmente y con su respectivo intervalo de confianza de 95% los siguientes parámetros de exactitud: sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, prevalencia, exactitud de la prueba en verdaderos positivos y verdaderos negativos, así como la razones de verosimilitud positiva LR+ (sensibilidad/1-especificidad) y negativa LR-(1-sensibilidad/especificidad). Para la evaluación de los posibles factores asociados a la infección del VPH se utilizó el OR y el respectivo intervalo de confianza.
Consideraciones éticas: este estudio se realizó previamente a la aprobación del Comité de Ética en Investigación de la Organización Internacional Sanitas y, de acuerdo con la resolución 008430 de 1993 (normas científicas, técnicas y administrativas para la investigación en salud) del Ministerio de Salud, el cual la consideró una “Investigación con riesgo menor al mínimo”. Asimismo, siempre se garantizó la protección a la intimidad personal y el tratamiento confidencial de los datos, por lo que a todas las pacientes incluidas en el estudio se les suministró información respecto al VPH, las cuales finalmente decidieron firmar el consentimiento informado. Igualmente, se les brindó asesoría médica al instante de la entrega de los resultados de acuerdo con las Guías de Buena Práctica Clínica.
RESULTADOS
De 431 pacientes que cumplían con los criterios de inclusión, dos no aceptaron participar en el estudio porque preferían desconocer el resultado del examen del VPH. De este modo, se incluyeron 429 pacientes con reporte citológico de ASC-US (80,2% n=344) y de LSIL (19,8% n=85) a quienes se les practicó colposcopia-biopsia (según hallazgos) y toma de muestra cervical para el análisis de ADN-HPV durante la misma visita. En total, se les realizó la toma de biopsia cervical a 379 mujeres mientras que a 49 no se les practicó debido a un resultado de colposcopia negativo y porque en una paciente la muestra obtenida fue considerada no satisfactoria. Del mismo modo, se llevó a cabo curetaje endocervical a 184 pacientes. La figura 1 muestra el flujograma y la distribución de las pacientes incluidas en el estudio.
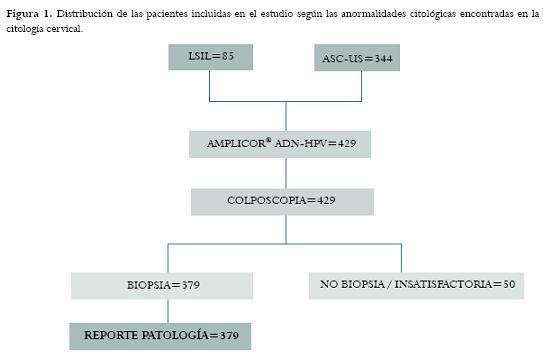
Características generales
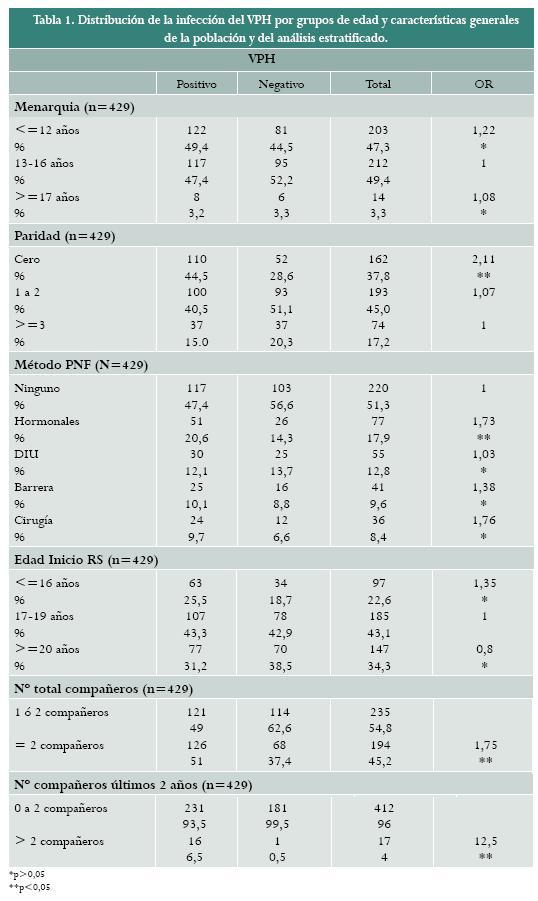
El rango de edad de las participantes fue 18 a 69 años con promedio de 30,5 años. 58,5% lo conformaron personas menores de 35 años y 70,5% de la población correspondía a estrato socioeconómico medio (estratos 3 y 4): 24% a estrato alto y 5,5 % a estrato bajo. Además, 92,6% de las participantes había completado educación secundaria y, de éstas, 22,4% habían realizado estudios universitarios. La edad media de la menarquia fue 12,8 años (rango 9–18 años). La tabla 1 ilustra la información referente a la edad de la menarquia, la paridad, la planificación, la edad de inicio de la actividad sexual y el número de compañeros sexuales.
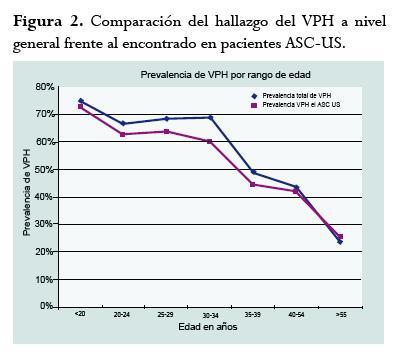
Infección por el VPH
La prevalencia global de infección por el VPH fue 57,6% (n=247/429). En mujeres con alteración citológica ASC-US fue 52,9% (n=182) y en LSIL fue 75,7% (n=65). La distribución de la prevalencia por grupos se observa en la figura 2.
De otra parte, los factores de riesgo relacionados con la infección por el VPH fueron el uso de anticonceptivos hormonales (OR=1,73; IC95% 1,02-3,08), antecedente de 2 o más compañeros sexuales a lo largo de la vida (OR=1,75; IC95% 1,16-2,63) y de más de 2 compañeros sexuales durante los dos últimos años (OR=12,5; IC95% 1,73-25,5). Las características generales y el análisis estratificado se resumen en la tabla 1.
Colposcopia
Un 59,4% (n=256) de las pacientes presentaba una lesión de bajo grado: cervicitis en 19% (n=82), atrofia en 3% (n=13), lesiones de alto grado en 3% (n=12), pólipos en 2,6% (n=10), sin anormalidad en 10,9% (n=47) mientras que 2,1% (n=9) tenían otros diagnósticos. Los valores del Índice de Reid se reportaron entre cero y dos (compatible con cambios de metaplasia o lesión intraepitelial de bajo grado) en 252 pacientes (58,7%), entre tres y cinco (lesión intraepitelial de bajo o alto grado) en 176 mujeres (41%) y una paciente tuvo un puntaje mayor de cinco (lesión de alto grado). Ante esto, se realizaron biopsias múltiples en 121 participantes (28,2%).
Reporte de biopsia
La prevalencia de reportes de lesiones cervicales de alto grado en esta población fue de 6,3% (24/379) de los cuales, 5,4% correspondió a la prevalencia de las pacientes que consultaron por ASC-US (n=16/296) y 9,6% a las pacientes que consultaron por LSIL (n=8/83). Los restantes reportes de biopsia correspondieron a lesiones de bajo grado en 153 pacientes (40,4%), cervicitis en 146 (38,5%), metaplasia en 24 (6,3%), pólipos en 7 (1,8%) y otros en 5 pacientes (1,3%). Como consecuencia, la concordancia entre el resultado de la anatomía patológica y el diagnóstico colposcópico (de acuerdo con el Índice de Reid) fue de 84,9%.
Evaluación de la Prueba AMPLICOR® ADN-HPV para lesiones de alto grado
La prueba de AMPLICOR® HPV Test fue positiva en 21 de los 24 casos reportados con lesiones de alto grado; por lo tanto, la sensibilidad de la prueba fue de 87,5% (IC95% 74%-100%). Además, la tasa de falsos positivos fue 199 de 355 sujetos para una especificidad de 44% (IC95% 39%-49%). En los tres casos con reporte de lesión intraepitelial de alto grado, en quienes la prueba fue negativa, el grupo de patología confirmó el diagnóstico. Asimismo, el valor predictivo positivo fue de 9% (IC95% 5%-12%) y el valor predictivo negativo fue de 98% (IC95% 97%-100%).
Al estratificar la población por el tipo de alteración citológica, la prueba tuvo una sensibilidad de 81% (IC95% 62%-100%) y una especificidad de 48% (IC95% 43%-54%) en las mujeres con lesiones ASC-US (n=344). El valor predictivo positivo fue 7% (IC95% 3%-11%) y el valor predictivo negativo fue 98% (IC95% 96%-100%). En comparación, en las 85 mujeres con citología LSIL, la sensibilidad fue de 100%, la especificidad fue 26% (IC95% 16%-36%); el valor predictivo negativo fue 100% y el valor predictivo positivo 12%.
DISCUSIÓN
Los resultados de este estudio confirman la alta sensibilidad de las pruebas de ADN en el diagnóstico de NIC2+ en pacientes que acuden por citología ASC-US y LSIL, una de las características de mayor utilidad en la práctica clínica, convirtiéndolas en herramientas útiles como parte de los programas de tamizaje de cáncer cérvico-uterino en el manejo de anormalidades citológicas de significado incierto. La especificidad (E=44%) es explicable dado que se trataba de mujeres usuarias de un programa de referencia para pacientes que presentaban alteraciones de la CCV que se asocian con alta prevalencia de infección, y que adicionalmente incluyó menores de 30 años en quienes la prevalencia de VPH de alto riesgo es más elevada (15,16). El valor predictivo positivo (VPP=10% en ASC-US y bajo grado, y VPP=8% en ASC-US) puede ser efecto de la baja prevalencia de enfermedad (NIC2+) en esta población de mujeres beneficiarias del programa de prevención secundaria, pero también puede deberse al hecho de que la mayoría de las pacientes están en un grupo etario con menor prevalencia del diagnóstico; aunque algunas de ellas probablemente desarrollarán infección persistente y estarán en riesgo de NIC2+ en el futuro.13
El objetivo último de las pruebas de tamizaje cérvico-uterino es el diagnóstico de HSIL (NIC2+).
Para ello, los programas de prevención secundaria se centran en la citología cervical, una prueba sujeta a múltiples errores potenciales durante los procedimientos de toma de la muestra, fijación y procesamiento, además de la subjetividad que influye sobre la interpretación, cuya concordancia intra e interobservador ha sido previamente evaluada.21,22 La concordancia entre patólogos es excelente en el caso de los carcinomas infiltrantes, y moderadamente buena en el caso del HSIL; sin embargo, en las lesiones de bajo grado, la concordancia entre observadores es baja (K=0,41).23-25
La aplicación diagnóstica complementaria de los test de ADN en casos de CCV, ASC-US y bajo grado, busca no sólo aumentar la sensibilidad del proceso de diagnóstico mediante la identificación de subpoblaciones en riesgo de enfermedad de alto grado (NIC2+) prevalente o futura, sino también reducir la carga asistencial y económica que representan la colposcopia y la biopsia complementarias.
El presente estudio tiene limitaciones, tales como la composición de la muestra integrada por mujeres que en su mayoría atienden regularmente a programas de prevención secundaria de cáncer cérvicouterino, lo cual puede explicar la baja prevalencia de NIC2+. De manera adicional, una importante proporción de ellas era menor de 30 años (45,7%; 196 de 429 participantes), lo cual se asocia con una alta prevalencia de infección por VPH de alto y bajo riesgo que en su mayoría corresponde a infecciones transitorias.
La secuencia diagnóstica a partir de una prueba de baja sensibilidad, seguida por otra de alta sensibilidad no parecería la más indicada, pero, siendo la citología el examen básico del programa de tamizaje, puede aceptarse esta estrategia, especialmente si ella permite optimizar la utilización de los recursos. No obstante, queda pendiente la evaluación económica de las dos alternativas de tamizaje en nuestro medio.
CONCLUSIONES
Mientras la citología cervical sea la prueba central del proceso de tamizaje, las pruebas de ADN, se presentan como herramientas diagnósticas útiles para aumentar la sensibilidad de la pesquisa en caso de obtener resultados de citología ASC-US.
Colaboradores
-
Mario Arturo Isaza-Ruget. Médico Especialista en Patología Clínica y Anatómica. Bogotá (Colombia).
-
Gonzalo Pérez-Amaya. Médico Especialista en Ginecología y Oncología, Epidemiólogo y Profesor de la Universidad del Rosario. San Pablo (Brasil).
-
Olga Lucía Morales-Reyes. Bacterióloga, MSc en Infecciones y Salud en el Trópico, Investigación y Educación, Clínica Colsanitas S.A. Bogotá (Colombia).
-
Rodrigo Deantonio Suárez. Médico, Máster en Economía de la Salud, Especialista en Epidemiología, Ciudad de Panamá (Panamá).
-
Catherine Alvarado Heine. Médico Especialista en Patología Clínica y Anatómica, Directora del departamento de Patología, Clínica Colsanitas S.A. Bogotá (Colombia).
-
Lina María Trujillo. Médico Ginecólogo y Oncólogo, Especialista adscrito a Colsanitas S.A. Bogotá (Colombia).
-
Victoria Eugenia Durán. Médico Ginecólogo y Oncólogo, Especialista adscrito a Colsanitas S.A. Bogotá (Colombia).
-
Sandra Johanna Echeverry-Coral. Bacterióloga, Especialista en Bioquímica Clínica, Coordinadora del Laboratorio de Biología Molecular de la Clínica Colsanitas S.A. Bogotá (Colombia).
-
Claudia Juliana Rodríguez-Socha. Bacterióloga, Especialista en Epidemiología, Clínica Colsanitas S.A. Bogotá (Colombia).
-
Germán Beltrán Galvis. Médico Especialista en Patología Anatómica, Patólogo de la Clínica Colsanitas S.A. Bogotá (Colombia).
-
Carmen Luz Bustos-Malaver. Citotecnóloga de la Clínica Colsanitas S.A. Bogotá (Colombia).
-
Yazmín Rocío Arias-Murillo. Bacterióloga, MSc en Microbiología, Bacterióloga del Laboratorio Biología Molecular, Clínica Colsanitas S:A. Bogotá (Colombia).
-
Oscar Martínez Nieto. Médico Especialista en Patología Clínica y Anatómica. Director Médico del Laboratorio de la Clínica Colsanitas S.A. Bogotá (Colombia).
AGRADECIMIENTOS
Agradecemos a las pacientes que participaron en este estudio,así como al personal del Clinisanitas Ginecobstétrico y al Dr. Milciades Ibáñez por su asesoría.
REFERENCIAS
1. Parkin DM, Pisani P, Ferlay J. Estimates of worldwide incidence of 25 major cancers in 1990. Int J Cancer 1999;80:827-41. [ Links ]
2. Ferlay J, Bray F, Pisani P, Parkin DM. GLOBOCAN 2002: Cancer Incidence, Mortality and Prevalence Worldwide. IARC Cancer Base Nº5, version 2.0 Lyon: IARC Press; 2004. [ Links ]
3. Van Den Brule AJ, Walboomers JM, Du Maine M, Kenemans P, Meijer CJ. Difference in prevalence of human papilloma virus genotypes in cytomorphologically normal cervical smears is associated with a history of cervical intraepithelial neoplasia. Int J Cancer 1991;48:404-8. [ Links ]
4. Muñoz N, Bosch FX, de Sanjosé S, Tafur L, Izarzugaza I, Gili M, et al.The causal link between human papillomavirus and invasive cervical cancer: a population-based case-control study in Colombia and Spain. Int J Cancer 1992;52:743-9. [ Links ]
5. Chichareon S, Herrero R, Muñoz N, Bosch FX, Jacobs MV, Deacon J, et.al. Risk factors for cervical cancer in Thailand: a case-control study. J Natl Cancer Inst 1998;90:50-7. [ Links ]
6. Ngelangel C, Muñoz N, Bosch FX, Limson GM, Festin MR, Deacon J, et.al. Causes of cervical cancer in the Philippines: a case-control study. J Natl Cancer Inst 1998;90:143-9. [ Links ]
7. Rolón PA, Smith JS, Muñoz N, Klug SJ, Herrero R, Bosch X, et.al. Human papillomavirus infection and invasive cervical cancer in Paraguay. Int J Cancer 2000;85:486-91. [ Links ]
8. Bosch FX, Lorincz A, Muñoz N, Meijer CJ, Shah KV. The causal relation between Human Papillomavirus and cervical cancer. J Clin Pathol 2002;55:244-65. [ Links ]
9. Walboomers JMM, Jacobs MV, Manos MM, Bosch FX, Kummer A, Shah KV, et.al. Human papillomavirus is a necessary cause of invasive cervical cancer worldwide. J Pathol 1999;189:12-9. [ Links ]
10. Bravo MM, Medina O, Melgarejo D, Serrano ML. Infección por virus del papiloma humano en una muestra de mujeres jóvenes con citología normal de la Liga Colombiana de Lucha contra el Cáncer-Seccional Bogotá. Rev Col Cancerol 2004;8:5-10. [ Links ]
11. Molano M, Posso H, Weiderpass E, van den Brule AJ, Ronderos M, Franceschi S, et al. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer 2002;87:324-33. [ Links ]
12. Quinn M, Babb P, Jones J, Allen E. Effect of screening on incidence of and mortality from cancer of cervix in England evaluation based on routinely collected statistics. BMJ 1999;318:904-8. [ Links ]
13. Murillo R, Almonte M, Pereiraq A, Ferrer E, Gamboa OA, Jerónimo J, et al. Cervical cancer screening programs in Latin America and the Caribbean.Vaccine 2008;26:L37-48. [ Links ]
14. Nanda K, McCrory DC, Myers ER, Bastian LA, Hasselblad V, Hickey JD, et al. Accuracy of the Papanicolaou test in screening for and follow-up of cervical cytologic abnormalities: a systematic review Ann Intern Med 2000;132:810-9. [ Links ]
15. Arbyn M, Buntinx F, Van Ranst M, Paraskevaidis E, Martin-Hirsch P, Dillner J. Virologic versus cytologic triage of women with equivocal pap smears: a metaanalysis of the accuracy to detect high-grade intraepithelial neoplasia. J Natl Cancer Inst 2004;96:280-93. [ Links ]
16. Mandelblatt JS, Lawrence WF, Womack SM, Jacobson D, Yi B, Hwang YT, et al. Benefits and costs of using HPV testing to screen for cervical Cancer. JAMA 2002;287:2372-81. [ Links ]
17. Solomon D, Schiffman M, Tarone R; ALTS Study group.Comparison of three management strategies for patients with atypical squamous cells of undermined significance: baseline results from a randomized trial. J Natl Cancer Inst 2001;93:293-9. [ Links ]
18. Cuzick J, Szarewski A, Cubie H, Hulman G, Kitchener H, Luesley D, et.al. Management of women who test positive for high-risk types of human papillomavirus: the HART study. Lancet 2003;362:1871-6. [ Links ]
19. Reid R, Scalzi P. Genital warts and cervical cancer. VII. An improved colposcopic index for differentiating benign papillomaviral infections from high-grade cervical intraepithelial neoplasia. Am J Obstet Gynecol 1985;153:611-8. [ Links ]
20. Cubie HA, Cuschieri K, Murray F, MooreC. Evaluation of the sensitivity and specificity of the Roche AMPLICOR® VPH test, the prototype line blot assay and the Digene Hybrid Capture 2 test for the detection of VPH in archieved cervical samples with borderline cytology. Specialist Virology Centre, Royal Infirmary of Edinburgh, UK. [ Links ]
21. Selvaggi SM.Implications of low diagnostic reproducibility of cervical cytologic and histologic diagnoses. JAMA 2001;285:1506-8. [ Links ]
22. Stoler MH, Schiffman M; Atypical Squamous Cells of Undetermined Significance-Low-grade Squamous Intraepithelial Lesion Triage Study (ALTS) Group. Interobserver reproducibility of cervical cytologic and histologic interpretations. Realistic estimates from the ASCUS-LSIL Triage Study. JAMA 2001;285:1500-5. [ Links ]
23. Parker MF, Zahn CM, Vogel KM, Olsen CH, Miyazawa K,O'Connor DM. Discrepancy in the interpretation of cervical histology by gynecologic pathologists. Obstet Gynecol 2002;100:277-80. [ Links ]
24. de Vet HC, Knipschild PG, Schouten HJ, Koudstaal J, Kwee WS, Willebrand D, et al. Sources of interobserver variation in histopathological grading of cervical dysplasia. J Clin Epidemiol 1992;45:785-90. [ Links ]
25. ASCUS-LSIL Triage Study (ALTS) Group. Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance. Am J Obstet Gynecol 2003;188:1383-92. [ Links ]
Conflicto de intereses: ninguno declarado.
Fuente de financiación: este trabajo fue parcialmente patrocinado por Roche Diagnostics.














