Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.60 no.3 Bogotá JulySept. 2009
Revisión de la literatura
Saulo Molina-Giraldo, M.D.*, Kenneth J. Moise Jr., M.D.**
Recibido: marzo 9/09 – Aceptado: agosto 17/09
* Especialista en Medicina Materno-Fetal. Fellow Intervención Fetal Baylor College of Medicine - Texas Children’s Fetal Center. Director Unidad de Terapia, Cirugía Fetal y Fetoscopia, Clínica Colsubsidio. Especialista en la Unidad de Terapia Fetal, Hospital de San José, Bogotá (Colombia). Correo electrónico: molina.saulo@ur.edu.co.
** Profesor de Gineco-obstetricia y Cirugía, Baylor College of Medicine – Miembro del Texas Children’s Fetal Center - Texas Children’s Hospital, Houston (Texas, EUA).
RESUMEN
Introducción: la aloinmunización Rh es una enfermedad frecuente en Colombia pese al uso de inmunoglobulina anti-D(Rho) en los embarazos de alto riesgo. Asimismo, es una condición que requiere la identificación temprana de los factores de riesgo, así como el adecuado tamizaje con el fin de lograr una remisión oportuna a una unidad materno-fetal con experiencia para disminuir las complicaciones fetales y brindar la terapia indicada en caso de ser necesario.
Objetivo: revisar la exactitud de los métodos de tamizaje y de diagnóstico temprano, así como también la efectividad de los métodos no invasivos e invasivos de tratamiento.
Metodología: se realizó una revisión de la literatura existente de acuerdo con las bases de datos PubMed, EBSCO, Ovid y ProQuest desde el año 2000 hasta el 2008, la cual incluyó artículos de revisión e investigaciones originales.
Resultados: la titulación de anticuerpos y el pico de velocidad máximo sistólico de la arteria cerebral media son las herramientas que permiten realizar la evaluación y la identificación de las pacientes en riesgo. El tratamiento incluye transfusión intrauterina y parto oportuno mientras que la prevención con la inmunoglobulina anti-D (Rho) continúa indicada.
Conclusión: la aloinmunización Rh aún es una patología de interés en el control de las pacientes obstétricas de bajo y alto riesgo. El conocimiento que se obtenga de la enfermedad permitirá realizar el diagnóstico oportuno y, de esta manera, identificar los fetos en riesgo que son susceptibles de terapia intrauterina.
Palabras clave: aloinmunización Rh, eritroblastosis fetal, anemia fetal, Doppler.
A literature review
SUMMARY
Introduction: rhesus alloimmunisation remains a common disease in Colombia in spite of universal immunisation having been implemented with immunoglobulin anti-D (Rho) for all susceptible pregnancies. Rh alloimmunisation is a condition requiring risk factors to be identified, all pregnancies to be suitably screened and timely referral to a maternal foetal medicine unit ensured to minimise foetal complications and provide foetal intervention as necessary.
Objective: this review was aimed at summarising the available data to provide the reader with tools helping to improve medical care by reviewing the exactitude of screening methods and early diagnosis and the effectiveness of non-invasive and invasive methods of treatment.
Methodology: the literature in PubMed, EBSCO, Ovid and Pro Quest databases was reviewed. Original papers, reviews, guidelines and bulletins published between 2000 and 2008 were included.
Results: antibody titres and middle cerebral artery Doppler were seen to be the screening tools usually used for identifying haemolytic anaemia in the foetus and neonates in Rh alloimmunisation. Rh alloimmunization treatment included close follow-up, intrauterine transfusion and timely delivery and prevention of Rh alloimmunisation by immunoglobulin anti-D (Rho).
Conclusion: knowledge of the disease will lead to early recognition of the risk factors and early diagnosis for identifying foetuses at risk which are susceptible to intrauterine therapy.
Key words: rhesus alloimmunisation, Rh disease, foetal anaemia, Doppler.
INTRODUCCIÓN
Pese al amplio uso de la inmunoglobulina anti-D(Rho), la aloinmunización Rh sigue siendo una condición que se presenta frecuentemente en nuestro medio en comparación con los países desarrollados.1Actualmente, se considera que en América del Norte la prevalencia de la enfermedad es de 6 casos por cada 1.000 nacidos vivos.2 Además, el tamizaje se enfoca en la identificación de aquellas pacientes con riesgo potencial de aloinmunización y en el manejo en una unidad materno-fetal en los casos confirmados, con el objetivo de disminuir las complicaciones fetales y dar el tratamiento indicado de acuerdo a la condición.1,3
Hasta hace poco menos de una década, los métodos disponibles para el diagnóstico de la aloinmunización Rh y la identificación del estado de hemólisis fetal eran invasivos.2 Surge entonces la necesidad imperiosa de un examen no invasivo, económico y de fácil realización con el fin de mejorar la capacidad diagnóstica, y por ende, la posibilidad de un tratamiento oportuno.4 Por lo tanto, el conocimiento de nuevas técnicas diagnósticas debe ser de carácter obligatorio para el médico responsable del control prenatal de modo que se encuentre en capacidad de definir el momento en el cual debe solicitarlas y cuándo la paciente debe ser valorada por el especialista.5,6
El propósito de este documento es, por consiguiente, revisar la exactitud de los métodos de tamizaje y de diagnóstico temprano como también la efectividad de los métodos de tratamiento no invasivos e invasivos.
METODOLOGÍA
Se realizó una revisión de la literatura registrada en las bases de datos PubMed, EBSCO, Ovid y Pro-Quest entre enero 1 de 2000 y julio 1 de 2008 y se consultaron los artículos publicados en inglés con los siguientes términos MeSH: “Rh alloimmunization and pregnancy”, “maternal red cell alloimmunization”, “rhesus disease” y “Rh immunization”. Se incluyeron aquellos artículos de revisión, boletines informativos y protocolos con relación al diagnóstico prenatal. Para tratamiento, se tuvieron en cuenta los ensayos controlados aleatorizados; para métodos diagnósticos, los estudios de validez diagnóstica; y para factores de riesgo y pronóstico, los estudios de cohorte, casos y controles. Además de ésto, se efectuó una búsqueda en la biblioteca virtual en salud LILACS y en Scientific Electronic Library Online (SciELO) con el fin de establecer datos de estudios latinoamericanos pertinentes. También se incluyeron artículos clásicos en la historia de la patología y páginas web pertinentes; y se llevó a cabo una revisión manual, incluyendo sólo aquellas publicaciones en las que se elaboró el análisis de la enfermedad en causas, patogenia, diagnóstico y tratamiento anteparto.
RESULTADOS
Aloinmunización Rh
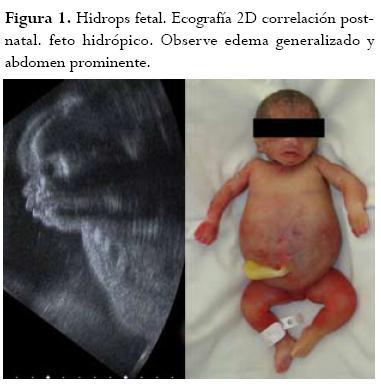
Históricamente, el primer caso de aloinmunización Rh fue reportado en 1609 en Francia en un embarazo gemelar. Aún no se conocía de la enfermedad sino la presencia de hallazgos morfológicos en los fetos o en los recién nacidos edematizados severamente que morían muy pronto. Sólo hasta 1932 Diamond describió el primer caso de hidrops fetal de causa inmunológica (figura 1). Este posible patrón etiológico no se evalúo hasta la mitad del siglo XX. En el mismo año, Darrow detalló la presencia de hemoglobina fetal en la circulación materna y sugirió la posible reacción “defensiva” de los sistemas maternos ante dicha noxa.7 Más adelante, en 1940, Landsteiner y Weiner describieron el factor Rh como el mecanismo de reconocimiento de células propias en el sistema circulatorio; y un año después, Levine demostró la presencia de una reacción inmunológica materna dada por los anticuerpos desarrollados en contra del feto y su sistema de reconocimiento hematológico. Posteriormente, en 1948, Fisher contribuyó con el sistema de nomenclatura tal como lo conocemos en la actualidad. Al conocer la relación de los anticuerpos IgG e IgM con el desarrollo de la patología hacia 1951, Wiener y Wexler indagaron por la posibilidad de relación genética en los locus y la presencia de éstos como biomarcadores de la entidad.2 Dichas investigaciones continuaron gracias a Rosenfield y su equipo de trabajo.7,8 En 1961, Liley introdujo el análisis espectrofotométrico del líquido amniótico como un excelente índice para medir la gravedad de la anemia fetal, método invasivo que se practicó hasta que aparecieron los métodos ultrasonográficos. Además, sólo hasta la década de los 80s se logró identificar el gen responsable del Rh en el brazo corto del cromosoma 1.9 Finalmente, en el año 2000, el Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses presentó la valoración mediante velocimetría Doppler de la arteria cerebral media como método no invasivo para la valoración de la anemia fetal, permitiendo su diagnóstico y seguimiento.10,11
Definición y prevalencia
-
La incompatibilidad Rh se define como la presencia de un feto Rh positivo en una madre Rh -negativa sin que haya paso de glóbulos rojos fetales a la madre y sin sensibilización.
-
Los isoanticuerpos son anticuerpos capaces de reaccionar contra hematíes de la misma especie pero no contra los hematíes del individuo que los produce.2,12
-
La aloinmunización es la producción de isoanticuerpos maternos como respuesta a la exposición de antígenos de glóbulos rojos diferentes a los propios.
La prevalencia exacta de la aloinmunización Rh es difícil de determinar. En el año 2007, el Centro Nacional de Estadística de los Estados Unidos reportó datos provenientes de los certificados de nacimientos. En dicho reporte se encontraron 68 casos por cada 1.000 nacidos vivos.2,13 Del mismos modo, en general se ha dicho que la aloinmunización Rh se presenta en 1,5% de todos los embarazos. Sin embargo, el conocimiento de la verdadera prevalencia para Latinoamérica aún no es claro. Por ejemplo, existen datos de publicaciones venezolanas en donde se ha informado de una frecuencia de 10%;14 no obstante, algunos reportes chilenos hablan de una disminución de la misma en los últimos años sin reportar una cifra exacta.15 Asimismo, algunos estudios argentinos han mencionado desde el año 1989 el riesgo de muerte in útero establecido en 23,8%, lo cual refleja la severidad de esta entidad.16 Por el contrario, las bases de datos consultadas para Colombia (Ministerio de Protección Social y Departamento Administrativo Nacional de Estadística) no han reportado datos al respecto.17, 18
Fisiopatología
Varios investigadores afirman que durante la gestación ocurren hemorragias espontáneas feto-maternas,2 y se cree que el volumen sanguíneo que pasa del feto a la circulación materna aumenta con la edad gestacional. Mediante el uso del test de Kleihauer, Bowman y colaboradores encontraron 0,01 mL o más de células fetales en 3% para el primer trimestre de embarazo, 12% para el segundo y 46% para el tercero.2 Sólo 15% de las personas son Rh - negativas.2 Inicialmente, Fisher y Race describieron seis genes de forma dominante y recesiva (Cc, Dd, Ee). El alelo D es el que determina el Rh - positivo, 45% de los Rh - positivos son homocigotos (DD) y 55% heterocigotos (Dd).2 En la mayoría de los casos, esta carga de material antigénico presente en la membrana del eritrocito (RhD) es insuficiente para estimular el sistema inmune materno.2 Los antígenos Rh aparecen hacia la sexta semana de vida embrionaria; sin embargo, en el caso de que la cantidad de sangre en la hemorragia feto-materna sea alta, como por ejemplo en el parto, los linfocitos B maternos reconocen el RhD, provocando una reacción inmunológica.2 De este modo, el sistema Rh puede contener hasta 43 antígenos distintos lo cual podría potenciar la respuesta inmunológica.2,6
A partir de ésto, se produce la IgM anti-D cuya vida media es corta con un rápido cambio a la IgG como respuesta.20 Los linfocitos B de memoria permanecen en reposo esperando el siguiente embarazo. Las células plasmáticas estimuladas por el RhD de los eritrocitos fetales proliferan rápidamente para producir anticuerpos IgG, incrementando los títulos maternos. La IgG materna atraviesa la placenta y destruye cualquier eritrocito RhD positivo, resultando en anemia fetal. Al presentarse la hemólisis en el feto aumenta la bilirrubina y la eritropoyetina, y se presenta una insuficiencia medular con aumento del sistema reticuloendotelial (hígado, bazo, glándula adrenal, placenta y mucosa intestinal). Posteriormente, se produce una obstrucción venosa portal y umbilical seguida de una alteración en la función hepática y una disminución en la síntesis de proteínas con la hipoalbuminemia subsecuente.2,6
La fisiopatología descrita explica la sensibilización después del primer embarazo; no obstante, existe la posibilidad de la sensibilización de niñas Rh - negativas por madres Rh - positivas desde su nacimiento. Igualmente, existen otras situaciones en las cuales se puede presentar paso de pequeñas cantidades de sangre fetal al torrente circulatorio materno causando producción de anticuerpos. Dichas situaciones son: amniocentesis, remoción manual de la placenta, maniobras obstétricas, cesárea, parto gemelar, abruptio de placenta, entre otras.13,19
Diagnóstico y titulación materna
Como se mencionó anteriormente, se proponía el concepto de tres genes codificados para la enfermedad Rh mayor, pero solamente dos genes han sido plenamente identificados: el RhD y el RhCE. Éstos son el producto de dos proteínas diferentes, el RhCE probablemente ocurre como la división de un ARNm alternativo. Un cambio de citosina a guanina en el exón 5 de este gen produce la formación del antígeno e en lugar del E. En contraste, un nucleótido diferente en el exón 2 cambia el aminoácido serina a prolina, lo cual produce la manifestación del antígeno C en lugar del c.20,21 Estos descubrimientos han resultado en cambios mayores en el manejo de la enfermedad Rh. El 50% de los individuos heterocigotos provienen de individuos heterocigotos por lo cual serán RhD - positivos y tendrán el potencial de ser afectados por los anticuerpos maternos.
Debido a que los genes RhC / c, E / e son heredados y se encuentran estrechamente ligados al gen RhD, se pueden emplear los antisueros junto con el antígeno para determinar la presencia del gen heterocigoto paterno basado en las tablas de frecuencias de acuerdo al origen étnico. Es posible también, emplear técnicas de ADN para logar, de una manera más precisa, la identificación de la presencia de uno o dos genes RhD. La reacción de polimerasa en cadena intensifica la señal en los exones 5 y 7 del RhD al compararlo con el exón control para determinar la presencia de hetero- u homocigocidad paterna. Una vez se establece el estado de heterocigoto y se confirma por la historia médica o por algún test directo (serológico o ADN), el siguiente paso es determinar el tipo de Rh del feto. La biopsia de vellosidad corial ha sido propuesta como un método para determinar el tipo de Rh fetal; sin embargo, el uso de esta técnica puede producir hemorragia fetomaterna que provocará una alteración en los títulos maternos, causando una muerte fetal aguda.
Por consiguiente, el ADN fetal debe obtenerse mediante amniocentesis, evitando en cuanto sea posible una obtención transplacentaria de la muestra del líquido amniótico y, de igual manera,sensibilizaciones subsecuentes.2Además, el método de reconocimiento del Rh fetal es la reacción de polimerasa en cadena (PCR). La sensibilidad global de la PCR para el diagnóstico del Rh fetal en líquido amniótico es de 98,7% y la especificidad es de 100% con un valor predictivo positivo de 100% y negativo de 96,9%. Estos últimos datos se sustentan en una prevalencia de 6,8 por cada 1.000 nacidos vivos.2,13
Asimismo, es importante tener en cuenta las inconsistencias que puedan presentarse como consecuencia de una paternidad errónea o de rearreglos en el locus del gen RhD2 (este último ocurre hasta en 2% de los casos). Para evitar lo anterior, es importante obtener una muestra de sangre paterna, lo cual permitiría verificar una fuente de rearreglos previa. En el caso en el que se desconozca la paternidad, se debe realizar el seguimiento con anticuerpos maternos. A este respecto, cualquier aumento en los mismos, 4 veces sobre el título inicial, debe confirmar el diagnóstico. Por otro lado, en 69% de sudafricanos de raza negra y 21% de afroamericanos se detectó un pseudogen RhD.2 En este caso, la paciente embarazada dio RhD -negativo en su test serológico, pero el gen completo RhD está presente en sus cromosomas. Debido a que el feto hereda el gen RhD de su madre, la PCR en líquido amniótico sería falsamente positiva; es decir, el feto es RhD negativo serológicamente pero RhD en su genotipo. Ésto aumentaría el número de intervenciones innecesarias. Por esta razón, es necesario enviar una muestra de sangre materna junto con una del líquido amniótico con el fin de tratar de encontrar la presencia de este pseudogen RhD. Ahora bien, si la muestra de sangre maternada positiva para esta variante, se debe realizar también un examen fetal.
De otra parte, la tecnología más reciente que se ha empleado para determinar el RhD fetal, en el caso de la heterocigocidad paternal, usa ADN libre en la circulación materna.2, 22 Así, los títulos maternossonlaprimeraaproximaciónenlaevaluación de la paciente sensibilizada. El test de Coombs Indirecto, por ejemplo, es utilizado para determinar el grado de aloinmunización; y su resultado es expresado en el número de diluciones, el cual puede variar de acuerdo al laboratorio. Como un control, el título en el mismo laboratorio no debe variar más de una dilución. En este orden de ideas, un aumento de titulación de 1:8 a 1:16 no representa un verdadero incremento en la cantidad de anticuerpos en la circulación materna.2 Sin embargo, un título crítico se definiría como el punto en el cual existe un riesgo significativo de hidrops fetal. A pesar de lo anterior, la mayoría de los centros de diagnóstico fetal no tienen suficientes números de casos para demostrar un nivel de titulación que muestre el verdadero riesgo; usualmente, el valor crítico usado en los diferentes centros es de 8 a 32. De manera general, se considera que el punto de inicio del seguimiento debe ser la titulación materna de 1:16.2
Amniocentesis
En los últimos 50 años, la amniocentesis ha jugado un papel muy importante en el establecimiento del diagnóstico y del manejo de la aloinmunización Rh. Este método se enfoca en la medición espectrofotométrica de la densidad óptica a 450 nm (ΔOD450) del líquido amniótico con el fin de evaluar la hemólisis fetal, la cual aumenta los niveles de bilirrubinas en el mismo. La curva de Liley original se dividía en tres zonas y proveía valores para ser usados después de la semana 27 de gestación hasta el término. Posteriormente, la curva de Queenan proponía una serie de datos que permitía la evaluación de embarazos más tempranos. En el año 2006, se publicó un estudio en el cual se compararon ambas curvas, mostrando que la segunda es superior en sensibilidad y especificidad.23 La sensibilidad de la Curva de Liley se encuentra entre el 75%-76% con una especificidad de 50%-77%, un valor predictivo positivo de 53%-73% y un valor predictivo negativo de 73%-79% según los estudios originales de Liley y Oepkes. En contraste, se ha reportado un 10% más de sensibilidad en la curva de Queenan. Actualmente, la introducción de métodos no invasivos y por lo tanto más seguros han relegado el uso de este método al pasado y sólo lo mencionamos por su importancia histórica en el entendimiento de la patología.22 Cabe anotar que en este apartado se discute el uso de la amniocentesis para la valoración de la hemólisis fetal ya que la amniocentesis para valoración del Rh fetal fue tratada previamente. La indicación actual de amniocentesis para la curva de Liley se discutirá más adelante.
Cordocentesis
La muestra de sangre que se obtiene del cordón umbilical mediante guía ultrasonográfica permite el acceso directo a la circulación fetal para obtener importantes datos de laboratorio tales como: hematocrito, coombs directo, tipo de sangre fetal, recuento de reticulocitos y bilirrubina total.24 Debido a que la cordocentesis esta asociada a 1%-2% de muerte fetal, este procedimiento se reserva para la detección de la anemia fetal una vez el pico de velocidad sistólico en la arteria cerebral media (PSV-MCA) excede 1,5 múltiplos de la mediana (MoM).6,11,12,18 Cuando esto ocurre, se le debe practicar al paciente una transfusión in útero (IUT, por sus siglas en inglés) en caso de que se detecte un hematocrito menor de 30% o menos de 2 desviaciones estándar para la edad gestacional.25 Es importante que dicho procedimiento se realice en una unidad materno-fetal con experiencia y por personal capacitado con un entrenamiento adecuado.
Velocimetría Doppler de la arteria cerebral media (PSV–MCA)
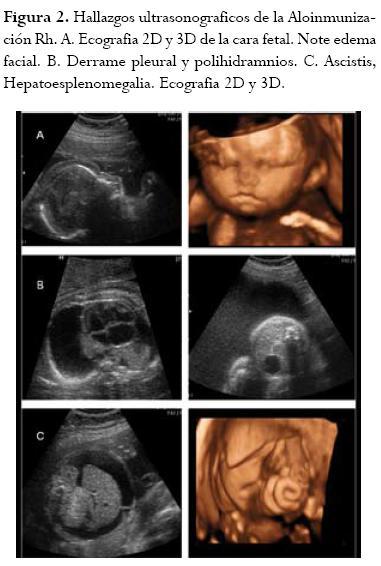
Desde el gran avance que representó el ΔOD450 en el diagnóstico y en el manejo de la enfermedad Rh, la búsqueda de un método no invasivo siempre fue unobjetivo.23 Muchos marcadores ultrasonográficos para la valoración de la anemia fetal han sido introducidos desde la aparición del ultrasonido como herramienta en el manejo de la patología de alto riesgo obstétrico.26 Desafortunadamente, los parámetros como el polihidramnios, la ascitis (figura 2), el derrame pericárdico, el diámetro intrahepático de la vena umbilical, y el espesor de la placenta son inespecíficos y fallan en la predicción de la anemia fetal.27, 28 Por otra parte, la disminución en los componentes sanguíneos sólidos causan una alteración en la viscosidad y un aumento del gasto cardíaco, produciendo falla cardíaca y el consecuente hidrops fetal. Cuando éste aparece, es fácilmente detectado pero es un signo tardío del estado anémico, evidenciando que el feto está gravemente enfermo y su pronóstico es pobre. La aparición de hidrops hace suponer que la hemoglobina fetal esta en menos de 7 g/dL.29
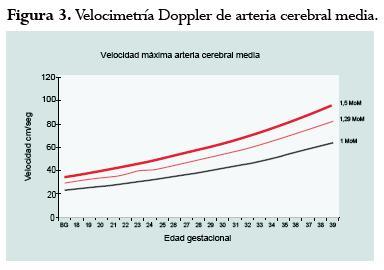
Mari y colegas propusieron, en el año 2000, que el PSV-MCA podría determinar de manera precisa la presencia de anemia en el feto (figura 3).11,30 Se estableció que un aumento del pico de velocidad máximo sistólico por encima de 1,5 MoM se relacionaba con un feto anémico con una tasa de falsos positivos de solamente 12% y con una sensibilidad de 98%.31 Asimismo, fueron varios los estudios observacionales que siguieron al anterior.31-34 Por ejemplo, Divakaren y su equipo de trabajo realizaron un metaanálisis para evaluar el papel de la ultrasonografía en la aloinmunización Rh. Los resultados revelaron que el test que mejor predecía la anemia fetal era el PSV-MCA (LR positivo 8,45, IC95% 4,7-15,6; LR negativo 0,02, IC95% 0,001-0,25).35 Recientemente, algunos investigadores llevaron a cabo una comparación entre los métodos invasivos y la arteria cerebral media. Este último demostró una sensibilidad de 88%, una especificidad de 82% y una precisión de 85%. En conclusión, se presenció una mejoría en la precisión de la curva de Liley en 9%. Además, en dicha serie, el uso del PSV-MCA habría evitado el uso de tests invasivos en 50%.33
Por otro lado, el PSV-MCA es una medida precisa y fácil de obtener si es realizada por personal entrenado y siguiendo las condiciones para ello. De este modo, es útil, no sólo en la aloinmunización Rh, sino en otras entidades que pueden producir anemia fetal.34 Por consiguiente, para realizar este test, es necesario buscar el ala del esfenoides localizada hacia la base del cráneo, y mediante el Doppler color o Doppler potenciado (power angio), localizar la arteria cerebral media como parte del polígono de Willis (figura 4A). El ángulo de insonación debe mantenerse tan cerca de cero como sea posible y no superar los 30°. Usualmente, el vaso más cercano al abdomen materno es el que se mide; sin embargo, el vaso contralateral ha mostrado iguales resultados (figura 4B).35 En este último, muchas veces es más fácil mantener el ángulo de insonación en cero que en el primero. Si este ángulo se mantiene con dichas características, no es necesario el uso de corrección de ángulo aunque puede ser usado siempre y cuando se requiera. Luego, se aplica el Doppler pulsado en la región M1, justo después del sifón carotídeo.36 Se debe esperar al estado de reposo fetal en el cual se pueda obtener la medida precisa,teniendoencuenta que las alteraciones de la frecuencia cardíaca fetal pueden también afectar los resultados del Doppler.37 Pese a esto, se escapa al objetivo de esta revisión brindar los aspectos técnicos ultrasonográficos de dicha medición.
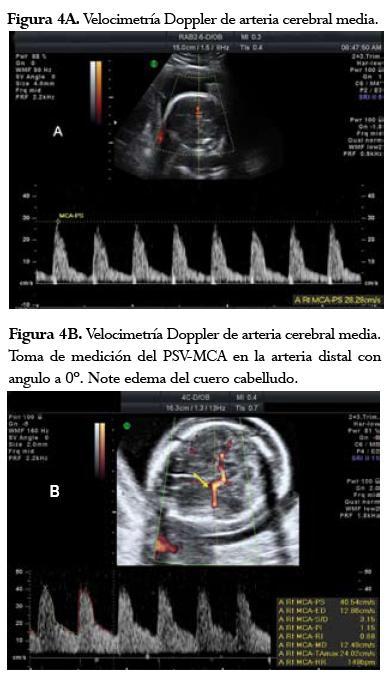
Las mediciones pueden iniciarse desde la semana 18 de gestación y deben repetirse cada 1 a 2 semanas de acuerdo a los hallazgos. Los resultados deben ser extrapolados según la edad gestacional en las curvas realizadas por Mari y colegas con el fin de encontrar los múltiplos de la media (MoM) que permitan determinar conductas. Después de la semana 35 de gestación, es muy probable encontrar falsos positivos en el PSV-MCA.38 Por esto mismo, es importante anotar que después de la semana 35 la sensibilidad de la PSV-MCA para el diagnóstico de la anemia fetal disminuye, por lo cual el uso de la espectrofotometría se debería considerar.2,6,34
Manejo clínico prenatal
Después de detectar que la paciente es Rh O -negativo, la hemoclasificación paterna es mandatoria. Debe indagarse por antecedentes tales como paridad, transfusiones, aplicación de inmunoglobulin aanti-D (Rho), ictericia neonatal, hidrops y muerte neonatal de causa desconocida.39, 40 Luego, se debe establecer la hemoclasificación paterna y de ser ésta negativa, se realizará la prueba a la semana 28. Si por el contrario ésta es positiva, se inicia el seguimiento con Coombs indirecto, el cual se repetirá mensualmente hasta la semana 24 y luego cada dos semanas. Igualmente, se debe indagar por la cigocidad. En caso de que el padre sea heterocigoto y su nivel de Coombs indique 1:16, se requiere una muestra de líquido amniótico con el fin de determinar la hemoclasificación fetal. Si el feto es RhD - negativo (genotipo) y el padre RhD -negativo, no se requerirán más intervenciones.
No obstante, si el feto es RhD - positivo, se debe llevar a cabo el test Doppler de arteria cerebral media cada 1 a 2 semanas de acuerdo al hallazgo. Si el PSV-MCA está por encima de 1,5 MoM entre la semana 24 a 34 estaría indicada la cordocentesis y de acuerdo al hematocrito y a la hemoglobina se indicaría IUT.41
Un grupo de la Universidad de Leiden en Holanda, publicó en el año 2000 una de las mayores series de IUT: realizaron un análisis de aquellos fetos transfundidos. Para el análisis de los datos, dividieron los fetos en tres grupos: el primero, fetos que fueron transfundidos antes de la semana 32; el segundo, fetos transfundidos antes y después de la semana 32; y por último, fetos transfundidos únicamente después de esta misma semana. Los resultados indicaron que la sobrevida fue de 48%, 100% y 91%, respectivamente con una pérdida fetal de 3,4% antes de la semana 32 y sólo de 1% después de dicha semana.42 Por tanto, hacia la semana 32 deben iniciarse las pruebas de bienestar fetal tales como monitoría sin stress y perfil biofísico ya que no hay evidencia que muestre la necesidad del uso del Doppler de perfusión placentaria en estos casos. Sin embargo, algunos autores recomiendan su uso en la semana 28 y si el resultado es normal se debe continuar con las pruebas convencionales.43
De igual manera, si el PSV-MCA permanece por debajo de 1,5 MoM, es necesario inducir el parto hacia la semana 38 de gestación, pero si el nivel de 1,5 MoM se alcanza después de la semana 34 a 35 se practicaría la amniocentesis para ΔDO450 debido a la alta tasa de falsos positivos del PSV-MCA en esta edad gestacional. Simultáneamente, se indicarían pruebas de maduración pulmonar. Asimismo, si el nivel de la curva de Queenan no indica hemólisis y hay madurez pulmonar, el parto estaría indicado para la semana 38. De esta manera, se alcanzaría la madurez hepática fetal, lo cual disminuiría el tiempo de fototerapia y la necesidad de exanguino transfusión al momento del nacimiento con mejores resultados perinatales.44
De igual forma, si el feto presenta maduración pulmonar y la curva de Queenan está por encima del punto de corte, se debe inducir el parto. Si por el contrario, el feto es inmaduro y la curva de Queenan está por encima del punto de corte, es necesario aplicar maduración pulmonar y fenobarbital 30 mg tres veces al día para disminuir la posibilidad de exanguino transfusión hasta en 75%45 con el objetivo de provocar el parto una semana después. Por último, si el feto es inmaduro y la curva de Queenan está por debajo del punto de corte, se debe realizar una nueva amniocentesis en 10 días, llevando un seguimiento del bienestar fetal como se describió anteriormente. Cabe anotar que en los sitios en donde no se encuentra disponible el Doppler de arteria cerebral media, la curva de Queenan sigue siendo parte del seguimiento de la paciente isoinmunizada.
Prevención
De acuerdo con el vademecum, son cuatro las inmunoglobulinas anti-D (Rho) disponibles para Colombia. Tres de ellas se encuentran en ampollas de 300 µg equivalentes a 1.500 UI, y la otra en ampollas de 250 µg. Dicho medicamento se encuentra incluído en el manual de medicamentos y terapéutica del Plan Obligatorio de Salud colombiano.46 La inmunoglobulina anti-D (Rho) es un derivado policlonal de plasma, por lo cual su origen debe ser informado a los pacientes. De otra parte, se cree que el mecanismo de acción se suscita por la reacción inflamatoria causada por la fracción FC de la inmunoglobulina, lo cual aumenta las inhibiciones y disminuye los estímulos secundarios a la respuesta inmunológica. Hay un estímulo de la reacción idiotipo anti-idiotipo y modulación de los sistemas inmunes.
Por otro lado, si no existe evidencia de aloinmunización anti-D en una mujer Rh - negativa, se deben administrar 300 µg de inmunoglobulina a las 28 semanas de edad gestacional. Dicha medida reduce la incidencia de aloinmunización antenatal de 2% hasta 0,1%,2 estrategia que pese a haber sido demostrada en los estudios de Bowman en el año 1988, sigue siendo cuestionada por su relación costo/beneficio. De manera adicional, algunos textos recomiendan el uso de una segunda dosis hacia la semana 40 de gestación; no obstante, no hay suficiente evidencia literaria que respalde esta medida.
De otra parte, entre algunas de las indicaciones para el uso antenatal de inmunoglobulina anti-D (Rho) se encuentran: el aborto, el embarazo ectópico, la amniocentesis genética, la biopsia de vellosidad corial, la cordoncentesis, la mola hidatidiforme, la amenaza de aborto, la muerte fetal en el segundo o tercer trimestre, el trauma cerrado de abdomen y la amniocentesis para perfil de maduración pulmonar.47 En estos casos, al ser embarazos menores de 12 semanas de gestación, una cantidad equivalente a 50 µg es suficiente debido a la poca cantidad de sangre fetal que pasa hacia la madre. Debido a la presentación farmacéutica en dosis de 300 µg, ésta es la dosis que universalmente se recomienda, seguida de una nueva dosis a la semana 28. Si se administró la dosis en el segundo trimestre o después de la semana 22, ésta debe repetirse en 12 semanas. También es importante saber que la dosis de inmunoglobulina anti-D (Rho) positiviza el Coombs indirecto, y siendo la vida media del medicamento 24 días, es posible encontrar títulos bajos positivos (1:2a1:4) al momento de posteriores evaluaciones. En caso de indicarse una nueva dosis de inmunoglobulina anti-D (Rho) se debe suministrar dentro de las primeras 72 horas del posparto. Dicha dosis es suficiente para producir protección para 30 mL de sangre traspasada del feto hacia el compartimento materno. Si no es posible dar esa dosis o se olvidó administrarla, debe aplicarse dentro los siguientes 13 días. Ante esto, algunos estudios han reportado seguridad en la efectividad de la inmunoglobulina anti-D (Rho) hasta 28 días posparto. Si el parto ocurre dentro de las tres semanas siguientes a la aplicación de la inmunoglobulina debido a indicaciones prenatales, no es necesario aplicar una dosis posnatal. Las indicaciones para aplicación de inmunoglobulina anti-D (Rho) en el posparto son: recién nacido Rh - positivo, Coombs directo negativo, y Coombs indirecto negativo.
De otra parte, la administración de inmunoglobulina anti-D (Rho) después de la realización de la ligadura de trompas en el posparto aún es controvertida. Las nuevas técnicas que permiten recanalización tubárica en caso de una nueva unión o una reversión de la decisión inicial, llama la atención a esta práctica como una práctica prudente. Sin embargo,nohaydatosenlaliteraturaquerecomienden o no su uso.2,48
CONCLUSIÓN
La aloinmunización Rh es aún una entidad de interés en el control de las pacientes obstétricas de bajo y alto riesgo. El conocimiento de la enfermedad y del uso adecuado de los métodos diagnósticos permitirá un reconocimiento precoz de los factores de riesgo y, de esta manera, un diagnóstico temprano que identifique los fetos en riesgo que por consiguiente son susceptibles de terapia intrauterina. El manejo de estas pacientes debe ser realizado en unidades materno-fetales con experiencia. Asimismo, la profilaxis ha sido un pilar fundamental en la prevención de la enfermedad. Aún así, los trabajos futuros deben enfocarse en conocer la prevalencia actual de la patología en nuestro medio.
REFERENCIAS
1. Reali G. Inadequate prophylaxis in anti-D immunisation. Blood Transfus 2008;6:169-70. [ Links ]
2. Moise KJ Jr. Management of rhesus alloimmunization in pregnancy. Obstet Gynecol 2008;112:164-76. [ Links ]
3. van der Schoot CE, Hahn S, Chitty LS. Non-invasive prenatal diagnosis and determination of fetal Rh status. Semin Fetal Neonatal Med 2008;13:63-8. [ Links ]
4. Maciuleviciene R, Gaurilcikas A, Simanaviciute D, Nadisauskiene RJ, Gintautas V, Vaitkiene D, et al. Fetal middle cerebral artery Doppler velocimetry in cases of rhesus alloimmunization. J Matern Fetal Neonatal Med 2008;21:361-5. [ Links ]
5. Li Y, Finning K, Daniels G, Hahn S, Zhong X, Holzgreve W. Noninvasive genotyping fetal Kell blood group (KEL1) using cell-free fetal DNA in maternal plasma by MALDI-TOF mass spectrometry. Prenat Diagn 2008;28:203-8. [ Links ]
6. Moise KJ Jr. The usefulness of middle cerebral artery Doppler assessment in the treatment of the fetus at risk for anemia. Am J Obstet Gynecol 2008;198:161.e-4. [ Links ]
7. Cunningham FG, MacDonald P, Gant N, Leveno K, Gilstrap l, Hankins G, et al. Williams Obstetrics, 21st ed. New York: McGraw Hill; 2002. [ Links ]
8. Landsteneir K. Visitado en 2009 Ago 04. Disponible en: http://historiadelamedicina.org/blog/2006/06/14/karl-landsteiner-1868-1943. [ Links ]
9. Chérif-Zahar B, Mattéi MG, Le Van Kim C, Bailly P, Cartron JP, Colin Y. Localization of the human Rh blood group gene structure to chromosome region 1p34.3-1p36.1 by in situ hybridization. Hum Genet 1991;86:398-400. [ Links ]
10. Liley A. Intrauterine transfusion of foetus in haemolytic disease. Br Med J 1963;2:1107-9. [ Links ]
11. Mari G, Deter RL, Carpenter RL, Rahman F, Zimmerman R, Moise KJ Jr, et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses. N Engl J Med 2000;342:9-14. [ Links ]
12. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 75: management of alloimmunization. Obstet Gynecol 2006;108:457-64. [ Links ]
13. Geifman-Holtzman O, Grotegut CA, Gaughan JP. Diagnostic accuracy of non invasive fetal Rh genotyping from maternal blood-a meta-analysis. Am J Obstet Gynecol 2006;195:1163-73. [ Links ]
14. Paravisini I, Morales J, Müller de ME, Bravo P. Aloinmunización por Rh: a propósito de un caso. Rev obstet ginecol Venezuela 2001;61:187-92. [ Links ]
15. Insunza Á, Carrillo J, Yamamoto M. ¿Amniocentesis seriada ó Vmax de la arteria cerebral media (ACM), en el manejo de la embarazada en riesgo de enfermedad hemolítica perinatal por isoinmunizacion Rh? Rev chil obstet ginecol 2008;73:286-9. [ Links ]
16. Gomez GW, Gutiérrez JC, De León JF. Plasmaféresis manual como tratamiento en pacientes Rh negativas sensibilizadas. Rev argent Transfus 1989;15:157-63. [ Links ]
17. Departamento Administrativo Nacional de Estadística -DANE. Visitado en 2009 Ago 12. Disponible en: http://www.dane.gov.co [ Links ]
18. Ministerio de Protección Social. Visitado en 2009 Ago 12. Disponible en: http://www.minproteccionsocial.gov.co/VBeContent/home.asp [ Links ]
19. Moise KJ Jr. Management of rhesus alloimmunization in pregnancy. Obstet Gynecol 2002;100:600-11. [ Links ]
20. Pirelli K, Pietz B, Johnson S, Pinder H, Bellissimo D. Molecular determination of RhD zygosity. Am J Obstet Gynecol 2006;195:S172. [ Links ]
21. Brown S, Kellner LH, Munson M, Yang Y, Klotzle B. Non-invasive prenatal testing: technical strategies to achieve testing of cell free fetal DNA (CFFDNA) RhD genotype in a clinical lab. Am J Obstet Gynecol 2007;197:S173. [ Links ]
22. Bianchi DW, Avent ND, Costa JM, van der Schoot CE. Noninvasive prenatal diagnosis of fetal Rhesus D: ready for Prime(r) Time. Obstet Gynecol 2005;106:841-4. [ Links ]
23. Berkley EM, Rappaport VJ, Hurley TJ. Discordant middle cerebral artery peak systolic velocity Doppler studies in a fetus with RhD alloimmunization. Obstet Gynecol 2007;110:493-5. [ Links ]
24. Howe DT, Michailidis GD. Intraperitoneal transfusion in severe, early-onset Rh isoimmunization. Obstet Gynecol 2007;110:880-4. [ Links ]
25. Oepkes D, Adama van Scheltema P. Intrauterine fetal transfusions in the management of fetal anemia and fetal thrombocytopenia. Semin Fetal Neonatal Med 2007;12:432-8. [ Links ]
26. Detti L, Mari G. Noninvasive diagnosis of fetal anemia. Clin Obstet Gynecol 2003;46:923-30. [ Links ]
27. Nagey D. Noninvasive diagnosis of fetal anemia by Doppler ultrasonography. The New England Journal of Medicine 2000;343:66. [ Links ]
28. Dukler D, Oepkes D, Seaward G, Windrim R, Ryan G. Noninvasive tests to predict fetal anemia: a study comparing Doppler and ultrasound parameters. Am J Obstet Gynecol 2003;188:1310-4. [ Links ]
29. van Kamp IL, Klumper FJ, Bakkum RS, Oepkes D, Meerman RH, Scherjon SA, et al. The severity of immune fetal hydrops is predictive of fetal outcome after intrauterine treatment. Am J Obstet Gynecol 2001;185:668-73. [ Links ]
30. Zimmerman R, Carpenter RJ, Durig P, Mari G. Longitudinal measurement of peak systolic velocity in the fetal middle cerebral artery for monitoring pregnancies complicated by red cell alloimmunisation: a prospective multicentre trial with intention-to-treat. BJOG 2002;109:746-52. [ Links ]
31. Mari G.Middle cerebral artery peak systolic velocity: is it the standard of care for the diagnosis of fetal anemia? J Ultrasound Med 2005;24:697-702. [ Links ]
32. Divakaran TG, Waugh J, Clark TJ, Khan KS, Whittle MJ, Kilby MD. Noninvasive techniques to detect fetal anemia due to red blood cell alloimmunization: a systematic review. Obstet Gynecol 2001;98:509-17. [ Links ]
33. Oepkes D, Seaward PG, Vandenbussche FP, Windrim R, Kingdom J, Beyene J, et al. Doppler ultrasonography versus amniocentesis to predict fetal anemia. N Engl J Med 2006;355:156-64. [ Links ]
34. Cosmi E, Mari G, Delle Chiaie L, Detti L, Akiyama M, Murphy J, et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia resulting from parvovirus infection. Am J Obstet Gynecol 2002;187:1290-3. [ Links ]
35. Abel DE, Grambow SC, Brancazio LR, Hertzberg BS. Ultrasound assessment of the fetal middle cerebral artery peak systolic velocity: a comparison of the near-field versus far-field vessel. Am J Obstet Gynecol 2003;189:986-9. [ Links ]
36. Mari G, Abuhamad AZ, Cosmi E, Segata M, Altaye M, Akiyama M. Middle cerebral artery peak systolic velocity: technique and variability. J Ultrasound Med 2005;24:425-30. [ Links ]
37. Sallout BI, Fung KF, Wen SW, Medd LM, Walker MC. The effect of fetal behavioral states on middle cerebral artery peak systolic velocity. Am J Obstet Gynecol 2004;191:1283-7. [ Links ]
38. Bartha JL, Abdel-Fattah SA, Hunter A, Denbow M, Kyle P, Soothill PW. Optimal interval between middle cerebral artery velocity measurements when monitoring pregnancies complicated by red cell alloimmunization. Fetal Diagn Ther 2006;21:22-5. [ Links ]
39. Detti L, Oz U, Guney I, Ferguson JE, Bahado-Singh RO, Mari G, etal. Doppler ultrasound velocimetry for timing the second intrauterine transfusion in fetuses with anemia from red cell alloimmunization. Am J Obstet Gynecol 2001;185:1048-51. [ Links ]
40. Mari G, Zimmermann R, Moise KJ Jr, Deter RL. Correlation between middle cerebral artery peak systolic velocity and fetal hemoglobin after 2 previous intrauterine transfusions. Am J Obstet Gynecol 2005;193:1117-20. [ Links ]
41. Scheier M, Hernández-Andrade E, Carmo A, Dezerega V, Nicolaides KH. Prediction of fetal anemia in rhesus disease by measurement of fetal middle cerebral artery peak systolic velocity. Ultrasound Obstet Gynecol 2004;23:432-6. [ Links ]
42. Klumper FJ, van Kamp IL, Vandenbussche FP, Meerman RH, Oepkes D, Scherjon SA, et al. Benefits and risks of fetal red-cell transfusion after 32 weeks gestation. Eur J Obstet Gynecol Reprod Biol 2000;92:91-6. [ Links ]
43. Molina S, Alfonso D. Vigilancia fetal ante parto. Medicina Perinatal. Ed Panamericana. 2009. En prensa. [ Links ]
44. De Boer IP, Zeestraten EC, Lopriore E, van Kamp IL, Kanhai HH, Walther FJ. Pediatric outcome in Rhesus hemolytic disease treated with and without intrauterine transfusion. Am J Obstet Gynecol 2008;198:54 e1-4. [ Links ]
45. Trevett TN, Dorman K, Lamvu G, Moise KJ. Antenatal maternal administration of phenobarbital for the prevention of exchange transfusion in neonates with hemolytic disease of the fetus and newborn. Am J Obstet Gynecol 2005;192:478-82. [ Links ]
46. Vademecum PLM. Visitado en 2009 Ago 12. Disponible en: http://www.prvademecum.com/PRData/NEWPrincipioActivo.asp?D=285 [ Links ]
47. Bowman JM. The prevention of Rh immunization. Transfus Med Rev 1988;2:129-50. [ Links ]
48. Bowman JM. Controversies in Rh prophylaxis. Who needs Rhimmune globulin and when should it be given? Am J Obstet Gynecol 1985;151:289-94. [ Links ]
Conflicto de intereses: ninguno declarado.














