Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.61 no.1 Bogotá Jan./Mar. 2010
Javier Andrés Ramírez, M.D.*, Óscar Suescún, M.D.**, María Cristina Palomino, M.D.***
Recibido: mayo 29/09 - Aceptado: febrero 1/10
* Médico Especialista en Obstetricia y Ginecología, Universidad Nacional de Colombia. Bogotá (Colombia). Correo electrónico: andrettyram@gmail.com
** Médico Ginecólogo y Oncólogo, Instituto Nacional de Cancerología (INC). Bogotá (Colombia).
*** Médico Residente de 1er año de Ginecología y Obstetricia, Universidad San Martín. Bogotá (Colombia).
RESUMEN
Introducción: el tumor de células esteroideas sin otra especificación es una neoplasia poco frecuente de los cordones sexuales del ovario, caracterizada por presentarse en cualquier edad y producir diferentes manifestacionesendocrinasporel influjohormonal de las pacientes que lo padecen. Su potencial de malignidad es de 50%.
Objetivo: informar el caso de una paciente de 50 años a la cual se le diagnosticó un tumor de células esteroideas sin otra especificación de comportamiento maligno por medio de un estudio histológico y de inmunohistoquímica. Asimismo, se pretende revisar la literatura disponible respecto a la presentación clínica, la genética, el diagnóstico y el tratamiento de este tipo de neoplasia.
Metodología: se realizó una búsqueda electrónica en las bases de datos MEDLINE, Embase, HINARI, Ovid, SciELO y BIREME, a partir de la cual se incluyeron artículos de investigaciones originales y artículos de revisión publicados entre 1987 y 2008.
Resultados: se encontraron 74 reportes de casos, para los cuales las manifestaciones clínicas eran variables e inespecíficas dadas según la producción de hormonas tales como la testosterona, los estrógenos o los progestágenos. Las pacientes también podían presentar dolor abdominal, ascitis severa, y síndrome de Cushing. De otro lado, el diagnóstico diferencial incluyó otros tumores esteroideos como: tecomas, luteinizantes, luteomas del embarazo, carcinoma primario de células claras, metastásico de células renales, tumores de células de Leydig y sus subtipos hiliares y no hiliares. Ante esto, el tratamiento requerido debió ser quirúrgico con tratamiento hormonal adyuvante con agonistas de receptores de la hormona liberadora de gonadotropina (GnRH).
Conclusión: el tumor de células esteroideas es infrecuente y está asociado con síndromes endocrinos. El manejo no se ha estandarizado y debe individualizarse según la histología tumoral, el estadio quirúrgico y el deseo de fertilidad de la mujer. Asimismo, se requieren estudios para avanzar en el conocimiento de estos tumores.
Palabras clave: tumor de células esteroideas, neoplasia ovárica, virilización.
SUMMARY
Introduction: ovarian steroid cell tumours, not otherwise specified (NOS), is a not very frequently occurring ovarian sex chord neoplasia. It is characterised by becoming presented at any age and producing different endocrine manifestations due to the hormonal influx of patients suffering it. It has 50% potential malignancy.
Objective: reporting the case of a 50 yearold patient diagnosed by histology and immunohistochemistry studies as having malign steroid cell tumour NOS. Carrying out a literature review for the clinical presentation, genetics, diagnosis and treatment of this not very frequently occurring type of neoplasia.
Methodology: an electronic search of the literature we carried out using the following databases: MEDLINE, Embase, HINARI, Ovid, SciELO y BIREME. The search was limited to include the most outstanding original research and review articles from 1987 to 2008.
Results: 74 pertinent case reports were found. Clinical manifestations were variable and nonspecific according to the production of hormones such as testosterone, oestrogen or progestagen. Abdominal pain, severe ascites and Cushing’s syndrome were also presented. Differential diagnosis included other steroid tumours such as luteinizing thecoma, luteoma during pregnancy, primary clear cell carcinoma, metastatic renal cell carcinoma and hilar and non-hilar Leydig cell tumours. Treatment is by surgery accompanied by gonadotropin-releasing hormone (GnRH) agonist treatment.
Conclusion: steroid cell tumours occur infrequently and are associated with endocrine syndromes. Their management has not been standardised and must be individualised according to tumour histology, surgical state and the desire to become fertile. Studies are required for making advances in gaining knowledge about these tumours.
Key words: ovarian steroid cell tumour, ovarian neoplasia, virilisation.
INTRODUCCIÓN
Los tumores de células esteroideas son neoplasias infrecuentes que representan 0,1% del total de los tumores ováricos.1 Éstos se dividen en 3 subtipos según el origen celular, así: luteoma estromal, tumor de células de Leydig y tumor de células esteroideas sin otra especificación, el cual representa 60% de estas neoplasias.1-3 Su principal característica es hormonal, causando diferentes síndromes endocrinos.4-6 En contraste, el curso clínico de estos tumores es desconocido debido a la poca evidencia disponible;7-9 por lo cual el objetivo de este reporte de caso es revisar la literatura médica disponible acerca de las características clínicas y genéticas, así como el diagnóstico y tratamiento de esta patología para dar un enfoque diagnóstico y un manejo adecuado.
REPORTE DE CASO
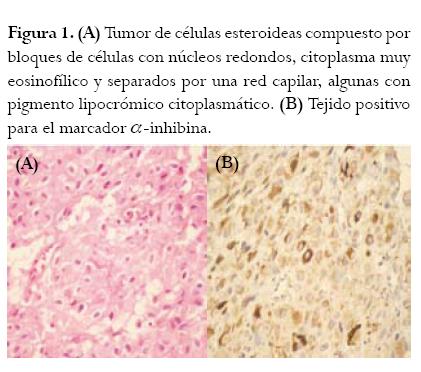
Paciente de 50 años con un antecedente de hace 10 años de histerectomía sin salpingo-ooforectomía por patología benigna. Dos años atrás se le realizó la resección de una masa pélvica compleja sin elevación de marcadores en una institución de III nivel. La patología reportó un tumor de células de la granulosa de tipo adulto, por lo cual la mujer recibió tratamiento adyuvante con platino-paclitaxel por 6 ciclos hasta febrero de 2006. Durante su seguimiento, ella asistió a controles con resultados negativos hasta junio de 2007, cuando se observó una masa pélvica. Acto seguido, la paciente fue reintervenida con citoreducción óptima, encontrándose una recidiva tumoral en el peritoneo e infiltración apendicular confirmada por patología. El marcador tumoral Ca-125 fue de 6,6 U/mL y la tomografía de tórax indicó un resultado normal. Inmediatamente después, se administró un segundo esquema de quimioterapia con carboplatino-docetaxel durante 6 ciclos hasta enero de 2008. Un mes más tarde la mujer fue intervenida quirúrgicamente, proceso durante el cual se halló un tumor residual en el ovario izquierdo y nodulaciones en la cúpula vaginal con un implante tumoral prerectal roto de 5 cm. La patología reportó un tumor de células de la granulosa recurrente. Al mes, la paciente asistió al Instituto Nacional de Cancerología, centro nacional de referencia para el manejo de las pacientes con cáncer. En el examen físico, se evidenció tres lesiones polipoides de 2 cm x 1 cm en la cúpula vaginal y se palparon masas en la región central de la misma y en el fondo del saco sin compromiso de parametrios ni tabique rectovaginal. Por tanto, se solicitó una rectosigmoidoscopia y una radiografía de tórax cuyos resultados fueron normales. Hubo elevación del Ca-125 a 9,7 U/mL e incremento de estradiol sérico a 472pg/mL. Las placas histológicas con inmunohistoquímica (figura 1) fueron positivas para α-inhibina y para cóctel de queratinas (AE1, AE3) de manera focal. La calretinina y la alfa feto proteína fueron negativas descartando tumor hepatoide. Asimismo, por los hallazgos histológicos y las características inmunohistoquímicas se descartó tumor de células de la granulosa y se diagnosticó tumor de células esteroideas sin otra especificación (S.O.E) Se evaluó el caso en la junta de oncología ginecológica considerándose persistencia de la enfermedad y se decidió realizar un seguimiento y tratamiento sintomático. Hasta el momento, la paciente no ha mostrado recaída tumoral.
METODOLOGÍA
Se realizó una búsqueda electrónica de la literatura en las bases de datos MEDLINE, Embase, HINARI, Ovid, SciELO y BIREME con base en los términos "tumor de células esteroideas", "neoplasia ovárica" y "virilización". Dicha búsqueda incluyó artículos de investigaciones originales y artículos de revisión publicados entre 1987 y 2008.
REVISIÓN DE LA LITERATURA
Los tumores de células esteroideas son poco estudiados por ser infrecuentes.10-12 Lo anterior quedó evidenciado cuando al revisar la literatura mundial desde 1979 hasta 2007 se encontraron 74 reportes de casos.13,14 De éstos, la serie más grande alguna vez publicada fue la de Hayes M con 63 casos.3
Estos tumores presentan manifestaciones clínicas variables e inespecíficas que se dan según la producción de hormonas tales como la testosterona, los estrógenos o los progestágenos.4,15,16 Asimismo, éstos son bilaterales en 5% de los casos y se les asocia con síntomas endocrinos (94%), síndromes paraneoplásicos como virilización e hirsutismo (77%), secreción de estradiol (23%), amenorrea primaria o secundaria y hemorragia uterina anormal.3,16,17
Otros síntomas incluyen dolor abdominal, ascitis severa asociada con niveles altos de Ca-125 y síndrome de Cushing en 10% de los casos, revelando un mal pronóstico. En pacientes virilizados, los niveles de testosterona sérica son un importante marcador de seguimiento.10,15 De igual modo, se indica que los niveles de dihidro-epi-aldosterona (DHEA) son normales y no se ha informado deficiencia de 21α-hidroxilasa ni de 17α-hidroxiprogesterona, los cuales, al ser positivos, indican tumor virilizante del ovario o hipertecosis ovárica.16,17 Por el contrario, 25% de las pacientes no presenta alteraciones hormonales al realizar el diagnóstico.18
Por su parte, el diagnóstico diferencial incluye otros tumores esteroideos tales como tecomas luteinizantes, luteomas del embarazo, carcinoma primario de células claras, metastásico de células renales, tumores de células de Leydig y sus subtipos hiliares y no hiliares.18,19
Ahora bien, en el estudio patológico estos tumores se caracterizan por ser grandes, sólidos y bien circunscritos, de color amarillo o pueden tener cambios secundarios a hemorragia y necrosis.13,14 Histológicamente, se diferencian de los tumores de células de Leydig por no poseer cristales citoplasmáticos de Reinke y del luteoma estromal porque este último está asociado con hipertecosis estromal.4,15 Microscópicamente, las células presentan un patrón difuso y trabecular de estroma escaso y tejido conectivo de soporte vascularizado (figura 1). Existen dos tipos básicos de células neoplásicas, el más común es el de células poligonales y el otro el de células vacuoladas con citoplasma esponjoso, membrana celular diferenciada y pequeño núcleo vesicular.5,16 Son estas características patológicas las que orientan el comportamiento tumoral.10
El diagnóstico patológico se realiza a partir del aspecto histológico, el cual es confirmado por medio de inmunohistoquímica tabla 1. Para esto, se recomienda utilizar la α-inhibina y la calretinina, las cuales presentan una sensibilidad de 71% y 97% y una especificidad de 97% y 85%, respectivamente.9,19,20,21 A nivel molecular, la telomerasa tiene un rol importante en la diferenciación ya que está presente en 95% de los tumores ginecológicos malignos y en 88% de los carcinomas epiteliales del ovario.12

Otros marcadores de menor utilidad por tener baja sensibilidad diagnóstica son: vimentina, anticitoqeratina, CD56, melanina-A, anticuerpos AE1/AE3, WT1, CD10 y sustancia inhibidora mulleriana.20,21
Por otro lado, el tratamiento de estos tumores debe individualizarse según la histología, el estadio quirúrgico y el deseo de fertilidad de la paciente.5,17,18 En general, la primera opción es realizar una histerectomía abdominal total con salpingo-ooforectomía bilateral para una estadificación quirúrgica completa.18 Igualmente, se han sugerido la quimioterapia combinada y la radioterapia pero su valor terapéutico es pobremente conocido.18
Por el contrario, en mujeres jóvenes con deseo de fertilidad se lleva a cabo una salpingoooforectomía unilateral con estudio de biopsia por congelación y seguimiento estricto de los niveles de las hormonas sexuales, especialmente en pacientes con elevación de los mismos antes de la cirugía.17,18 Además, se ha descrito el uso de un tratamiento hormonal adyuvante con agonistas de receptores de la hormona liberadora de gonadotropina (GnRH) para inducir la supresión hormonal y la apoptosis, evitando de este modo la cirugía.17,18 Dicho manejo se basa en la consideración de que algunos de los tumores que secretan hormonas no son autónomos y aparentemente dependen de la secreción de gonadotropinas, sugiriendo una relación entre los receptores de la GnRH y el crecimiento tumoral.22-23
Aunque los resultados de los casos reportados en la literatura son alentadores, en el momento este tipo de tratamientos ha sido probado en casos inoperables o en enfermedades recurrentes, considerándose aún experimentales.23
CONCLUSIÓN
El tumor de células esteroideas es poco frecuente y está asociado con síndromes endocrinos. De otro lado, el manejo no se ha estandarizado y debe individualizarse según la histología tumoral, el estadio quirúrgico y el deseo de fertilidad de la paciente. Por lo tanto, se deben llevar a cabo más estudios cuyos resultados permitan avanzar en el conocimiento de estos tumores.
REFERENCIAS
1. Guppy AE, Nathan PD, Rustin GJ. Epithelial ovarian cancer: a review of current management. Clin Oncol 2005;17:399-411. [ Links ]
2. Stephens JW, Fielding A, Verdaguer R, Freites O. A steroid-cell tumor of the ovary resulting in massive androgen excess early in the gonadol steroidogenic pathway. Gynecol Endocrinol 2008;24:151-3. [ Links ]
3. Hayes MC, Scully RE. Ovarian steroid cell tumors (not otherwise specified). A clinicopathological analysis of 63 cases. Am J Surg Pathol 1987;11:835-45. [ Links ]
4. Wang PH, Chao HT, Lee RC, Lai CR, Lee WL, Kwok CF, et al. Steroid cell tumors of the ovary: clinical, ultrasonic, and MRI diagnosis-case report. Eur J Radiol 1998;26:269-73. [ Links ]
5. Kim YT, Kim SW, Yoon BS, Kim SH, Kim JH, Kim JW, et al. Ovarian steroid cell tumor causing virilization and ascites. Yonsei Med J 2007;48:142-6. [ Links ]
6. Pathology and genetics of tumours of the breast and female genital organs. En: Tavassoli F, Devilee P, editors. World Health Organization Classification of Tumours. Tumours of the breast and female genital organs 2003. Chapter 2. p.160-61. [ Links ]
7. Lin CJ, Jorge AA, Latronico AC, Marui S, Fragoso MC, Martin RM, et al. Origin of an ovarian steroid cell tumor causing isosexual pseudoprecocious puberty demonstrated by the expression of adrenal steroidogenic enzymes and adrenocorticotropin receptor. J Clin Endocrinol Metab 1999;85:1211-4. [ Links ]
8. Haji AG, Sharma S, Babu M, Vijaykumar D, Chitrathara K. Androgen secreting steroid cell tumor of the ovary in a young lactating women with acute onset of severe hyperandrogenism: a case report and review of literature. J Med Case Reports 2007;1:182. [ Links ]
9. Deavers MT, Malpica A, Ordonez NG, Silva EG. Ovarian steroid cell tumors: an immunohistochemical study including a comparison of calretinin with inhibin. Int J Gynecol Pathol 2003;22:162-7. [ Links ]
10. Vulink AJ, Vermes I, Kuijper P, ten Cate LN, Schutter EM. Steroid cell tumor not otherwise specified during pregnancy: a case report in a pregnant patient. Eur J Obstet Gynecol Reprod Biol 2004;112:221-7. [ Links ]
11. Roth LM. Recent advances in the pathology of ovarian sex cord-stromal tumors. Int J Gynecol Pathol 2006;25:199-215. [ Links ]
12. Geisler JP, Geisler HE, Manahan KJ, Miller GA, Linnemeier G. Genetics of steroid cell tumors of the ovary. CME J Gynecol Oncol 2003;8:167-9. [ Links ]
13. Reedy MB, Richards WE, Ueland F, Uy K, Lee EY, Bryant C, et al. Ovariansteroid tumors,not otherwise specified: a case report and literature review. Gynecol Oncol 1999;75:293-7. [ Links ]
14. Liu AX, Sun J, Shao WQ, Jin HM, Song WQ. Steroid cell tumors, not otherwise specified (NOS), in an accessory ovary: a case report and literature review. Gynecol Oncol 2005;97:260-2. [ Links ]
15. Vadillo-Buenfil M, Ramírez-Mendoza P, Cárdenas-Cornejo I, González-Bárcena D. Tumor ovárico de células esteroideas: informe de caso. Ginecol Obstet Mex 2000;68:259-65. [ Links ]
16. Luque-Cuba E, García-Ramos F, Rechkemmer-Prieto A, Solis-Villanueva J, Rosas-Vargas L, Castillo-Sayan O, et al. Tumor de células esteroideas del ovario: reporte de caso. Rev Med Her 2005;16:80-6. [ Links ]
17. Wang PH, Chao HT, Lee WL. Use of a long-acting gonadotropin-releasing hormone agonist for treatment of steroid cell tumors of the ovary. Fertil Steril 1998;69:353-5. [ Links ]
18. Mironov S, Akin O, Pandit-Taskar N, Hann LE. Ovarian cancer. Radiol Clin North Am 2007;45:149-66. [ Links ]
19. Dowdy SC, O'Kane DJ, Keeney GL, Boyd J, Podratz KC. Telomerase activity in sex cord-stromal tumors of the ovary. Gynecol Oncol 2001;82:257-60. [ Links ]
20. Baker PM, Olive C. Immunohistochemistry as a tool in the differential diagnosis of ovarian tumors: an update. Int J Gynecol Pathol 2004;24:39-55. [ Links ]
21. McCluggage WG, McKenna M, McBride HA. CD56 is a sensitive and diagnostically useful immunohistochemical marker of ovarian sex cord-stromal tumors. Int J Gynecol Pathol 2007;26:322-7. [ Links ]
22. Tanaka YO, Saida TS, Minami R, Yagi T, Tsunoda H, Yoshikawa H, et al. MR findings of ovarian tumors with hormonal activity, with emphasis on tumors other than sex cord-stromal tumors. Eur J Radiol 2007;62:317-27. [ Links ]
23. Brewer CA, Shevlin D. Encouraging response of an advanced steroid-cell tumor to GnRH agonist therapy. Obstet Gynecol 1998;92:661-3. [ Links ]
Conflicto de intereses: ninguno declarado.














