Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.63 no.2 Bogotá Jul./Dec. 2012
Luisa Calderón-Mendoza1, Carlos Vivas-Ramírez, M.D.2, Lina De los Reyes, M.Sc.(c)3
Recibido: diciembre 19/11 – Aceptado: junio 22/12
1 Bióloga, Universidad del Tolima, Laboratorio de Biotecnología Animal de la Universidad del Tolima (Labioaut). Grupo de Modelos Experimentales para las Ciencias Zoohumanas. luisa.fernanda.cm@hotmail.com
2 Médico ginecólogo. Profesor Universidad del Tolima. Director Médico, Unidad de Fertilidad del Tolima (Unifertil). Ibagué, Colombia.
3 Bióloga, Facultad de Ciencias, Universidad del Tolima. Laboratorio de Biotecnología Animal de la Universidad del Tolima (Labioaut). Ibagué, Colombia.
RESUMEN
Objetivo: evaluar el efecto de las técnicas de capacitación espermática en la fragmentación del ADN.
Materiales y métodos: estudio experimental en el cual se describió el efecto de las técnicas de capacitación espermática swim up y gradientes de densidad de Isolate en la fragmentación del ADN. Se utilizaron las muestras de 41 pacientes remitidos a espermograma a la Unidad de Fertilidad del Tolima (Unifertil). Requisitos: 1) abstinencia sexual de 3 a 5 días, 2) no haber consumido medicamentos como antibióticos o antiparasitarios, 3) obtención de la muestra por masturbación, y 4) no presentar procesos virales o febriles. Después de realizar la primera evaluación de las muestras dentro de una hora posterior a su obtención se incluyeron aquellas que habían sido recolectadas completamente, que tenían una concentración mínima de 2 millones de espermatozoides/ml, y que no tenían contaminación con sangre. Se evaluaron la concentración, la movilidad, la morfología y la fragmentación del ADN de los espermatozoides, midiendo la longitud de los cometas resultantes del ensayo. Para el análisis estadístico se utilizaron análisis de varianza (ANOVA) y el coeficiente de correlación de Pearson, teniendo un valor de p < 0,05 como significativo estadísticamente.
Resultados: la media de edad de los pacientes fue 35,1 ± 7,9 años. Se encontró que las técnicas de capacitación espermática, tanto swim up como gradientes de densidad de Isolate, disminuyen la fragmentación del ADN de los espermatozoides (p < 0,0001). No se encontraron diferencias significativas en cuanto a la fragmentación del ADN entre las dos técnicas de capacitación estudiadas. No se observaron correlaciones significativas entre los niveles de fragmentación del ADN espermático y los diferentes parámetros del espermograma (concentración, movilidad y morfología) (p = 0,9061). El ensayo cometa detectó diferencias en el grado de la fragmentación del ADN de los espermatozoides entre las muestras frescas y capacitadas.
Conclusión: la capacitación espermática tanto por swim up como por gradientes de densidad de isolate tiene un efecto positivo al disminuir la fragmentación del ADN de los espermatozoides.
Palabras clave: fragmentación del ADN, ensayo cometa, swim up, gradientes de densidad, morfología espermática.
ABSTRACT
Objective: This study was aimed at evaluating the effect of sperm capacitation techniques on DNA fragmentation.
Materials and methods: This was an experimental study which observed and described the effect of two sperm capacitation techniques on DNA fragmentation (i.e. swim up and isolate density gradients). Samples from 41 patients were used; these were sent for spermogram analysis at the Tolima Fertility Unit (Unifertil), taking the following requirements into account: sexual abstinence for 3 to 5 days, not having taken drugs such as antibiotics or antiparasitics, samples obtained by masturbation and not presenting viral or febrile processes. The first evaluation of the samples was made one hour after they had been obtained; those which had been collected completely, which had a minimum 2 million spermatozoid/ml concentration and which were not contaminated by blood were included. Concentration, mobility, morphology and DNA spermatic fragmentation were evaluated by measuring comet length in the comet assay in fresh samples. Analysis of variance (ANOVA) and Pearson’s correlation coefficient were used for statistical analysis (p < 0.05 being statistically significant).
Results: It was found that sperm capacitation techniques reduced spermatozoid DNA fragmentation (p < 0.0001). No significant differences were found between the two different capacitation techniques studied regarding DNA fragmentation. No significant correlation was observed between sperm DNA fragmentation levels and spermogram parameters (concentrations, mobility and morphology) (p = 0.9061). The comet assay detected differences regarding the degree of spermatozoid DNA fragmentation between fresh and capacitated samples.
Conclusion: Both swim up and isolate density gradient sperm capacitation had a positive effect by reducing spermatozoid DNA fragmentation.
Key words: DNA fragmentation, comet assay, swim up, density gradient, sperm morphology.
INTRODUCCIÓN
La infertilidad es definida por la incapacidad de lograr un embarazo clínico con éxito después de doce meses o más de relaciones sexuales sin medidas anticonceptivas (1), esta afecta del 15 al 20% de parejas en todo el mundo (2-4). Aproximadamente la mitad de estos casos se deben a un factor de origen masculino (5-7). El diagnóstico inicial de la infertilidad masculina se lleva a cabo teniendo en cuenta la historia clínica del paciente, un examen físico y un espermograma (8). Este último es una valoración paraclínica definida por parámetros seminales estándar tales como concentración, motilidad y morfología espermáticas, entre otros (9), que brinda una visión más amplia de la capacidad reproductiva del varón (10, 11) y proporciona información fundamental acerca de la producción de espermatozoides (12), sobre la cual los especialistas en infertilidad se basan para decidir el tipo de tratamiento más adecuado para la pareja (13). Sin embargo, este estudio seminal no revela defectos espermáticos tales como el daño en el ADN, que pueden afectar la fertilidad (14, 15), por lo tanto, la evaluación del genoma paterno está recibiendo mucha atención por parte de los investigadores (16), ya que la integridad del ADN espermático es de gran importancia en la iniciación y el mantenimiento de un embarazo obtenido tanto in vivo como in vitro (17).
La fragmentación del ADN espermático se refiere a rupturas o lesiones en el material genético del espermatozoide (3). El origen de estas lesiones está bajo investigación, sin embargo, los mecanismos moleculares implicados más importantes son: el empaquetamiento anormal de la cromatina durante la espermiogénesis, apoptosis defectuosa antes de la eyaculación, y producción excesiva de especies reactivas de oxígeno (ROS) (18). Existen otros factores físicos y químicos que podrían estar involucrados en la fragmentación del ADN, tales como: temperatura testicular elevada (19), consumo de cigarrillo (20), exposición a tóxicos ambientales y pesticidas (19, 21), varicocele (15, 22), edad avanzada (15, 18, 19), cáncer (23, 24) y tratamientos como quimioterapia y radioterapia (25), entre otros.
Las altas tasas de daño en el ADN del espermatozoide humano pueden perjudicar el desarrollo embrionario y están asociadas con fallos en la implantación, pérdida temprana del embarazo (26, 27), y probablemente morbilidad en la descendencia (28). Adicionalmente, en las últimas décadas, los desarrollos en el campo de las tecnologías de reproducción asistida (TRA) han provocado un incremento en la demanda de tales servicios (29). De hecho, en el año 1992 se implementó la inyección intracitoplasmática de espermatozoides (ICSI) dando inicio a una nueva era en la medicina reproductiva, ya que se hizo posible el manejo de parejas con factor masculino severo (30, 31). De esta manera, el estudio del daño en el ADN espermático es particularmente relevante debido a que la ICSI es una técnica invasiva que sobrepasa el proceso de selección natural de espermatozoides (19) debido a que la escogencia está basada en el criterio del embriólogo, quien elige un espermatozoide móvil con una morfología aparentemente normal (32) después de la capacitación espermática, la cual busca seleccionar espermatozoides de mejor calidad (23, 33) sin garantizar la exclusión de aquellos con ADN anormal. De este modo, inyectar un ovocito que contenga un espermatozoide con un ADN anormal puede conllevar alteraciones en procesos tales como el desarrollo embrionario, fetal y posnatal (18).
Debido a que la calidad de los espermatozoides es uno de los factores que determinan el éxito de las técnicas de reproducción asistida (3), es necesario evaluar la integridad del ADN espermático y los parámetros seminales de rutina para tener una mayor información tanto diagnóstica como pronóstica de la muestra seminal (26). Se ha demostrado que aproximadamente el 15% de los varones de parejas infértiles sin factor femenino asociado presentan un espermograma normal (34), lo que sugiere que la subfertilidad en estos casos puede estar relacionada con factores ocultos como la fragmentación del ADN espermático (35, 36).
Existen metodologías que han sido implementadas para valorar la fragmentación del ADN de los gametos masculinos, una de estas técnicas es el ensayo cometa, el cual ha sido objeto de investigaciones para evaluar su utilidad en los laboratorios de reproducción asistida (4, 37). De esta manera, varios investigadores coinciden al afirmar que este método es sensible, confiable y reproducible para la detección del daño en el ADN espermático, y puede ser utilizado de manera rutinaria en el laboratorio una vez sea estandarizado su protocolo (38-40).
La información anterior sugiere que la fragmentación del ADN de los espermatozoides tiene implicaciones en los resultados de los tratamientos de reproducción asistida, así como también el uso de las técnicas de capacitación espermática. Sin embargo, estas implicaciones no están claramente establecidas. Por esta razón, es necesario proveer aproximaciones acerca de estos aspectos evaluando metodologías y técnicas que puedan ser útiles en la práctica diaria de las unidades de reproducción asistida.
Por tanto, este estudio evaluó el efecto de las técnicas de capacitación espermática en la fragmentación del ADN por medio del ensayo cometa, y su correlación con parámetros seminales como la concentración, la morfología y la movilidad.
MATERIALES Y MÉTODOS
Se realizó un estudio experimental en el cual se describió el efecto de las técnicas de capacitación espermática swim up y gradientes de densidad de isolate en la fragmentación del ADN. Se utilizaron las muestras de 41 pacientes remitidos a espermograma a la Unidad de Fertilidad del Tolima (Unifertil). Se realizó un muestreo no probabilístico de manera consecutiva en orden de llegada de los sujetos entre los meses de mayo y agosto de 2011. Los pacientes debían cumplir los siguientes requisitos: 1) abstinencia sexual de 3 a 5 días, 2) no haber consumido medicamentos como antibióticos o antiparasitarios, 3) obtención de la muestra por masturbación, y 4) no presentar procesos virales o febriles. Después de realizar la primera evaluación de las muestras dentro de una hora después de su obtención, se incluyeron aquellas muestras que: 1) habían sido recolectadas completamente, 2) tenían una concentración mínima de 2 millones de espermatozoides/ml, y 3) no tenían contaminación con sangre.
El proyecto de investigación fue expuesto ante el Comité de Bioética de la Universidad del Tolima, ente que aprobó el consentimiento informado que posteriormente fue firmado por los pacientes incluidos en el estudio.
Análisis del semen y preparación de muestras
Las muestras fueron analizadas en el Laboratorio de Andrología de la Unidad de Fertilidad del Tolima (Unifertil), y en el Laboratorio de Biotecnología Animal de la Universidad del Tolima (Labioaut), de la siguiente manera: después de la licuefacción de la muestra se procedió a realizar el espermograma teniendo en cuenta los parámetros de la Organización Mundial de la Salud (OMS) (41) para la concentración, movilidad y vitalidad, y la morfología de acuerdo con los criterios estrictos de Kruger (42), el cual fue clasificado como: 1) normozoospermia, 2) teratozoospermia, 3) astenoteratozoospermia, 4) oligoastenozoospermia, 5) astenonecroteratozoospermia, o 6) oligoteratozoospermia (43).
Después de realizar el espermograma cada una de las muestras fue dividida en tres alícuotas, y se procedió a la capacitación de dos de ellas teniendo así tres tratamientos: muestra fresca, muestra capacitada por swim up y muestra capacitada por gradientes de densidad de isolate. Luego, se utilizó una alícuota de cada muestra después de la capacitación espermática y se evaluaron nuevamente la concentración y movilidad finales y, adicionalmente, se valoró la morfología.
El ensayo cometa se llevó a cabo siguiendo el protocolo de McKelvey-Martin (37) modificado de acuerdo con las condiciones del laboratorio. Sobre un portaobjetos previamente recubierto de agarosa de punto de fusión normal se depositaron 80 µl de agarosa líquida de bajo punto de fusión que contenía las células espermáticas y se dejó solidificar a 4 ºC durante 10 min. A continuación, se depositó una capa final de 80 µl de agarosa de bajo punto de fusión. A partir de este momento, se utilizó luz amarilla para evitar perjudicar el material genético de las células espermáticas. Seguidamente, los portaobjetos se incubaron en solución de lisis (2,5 M NaCl2, 100 mM Na2EDTA, 10 mM Tris, Triton X-100 al 1% y DMSO al 10%, pH 10 y 50 µg/ml de proteinasa K) a 37 ºC por 20 h.
Después de la lisis, las placas se llevaron a una cámara de electroforesis horizontal, se le agregó el buffer de electroforesis (300 mM NaOH y Na2EDTA, pH 13). Se dejaron allí por 30 min para permitir que el ADN de los gametos se desenrollara. Posteriormente, se ejecutó la electroforesis a 25V y 200 mA por 2 h y 40 min. Una vez terminada, los portaobjetos se sacaron y se lavaron con buffer neutralizante (0,4 M Tris, pH 7,5).
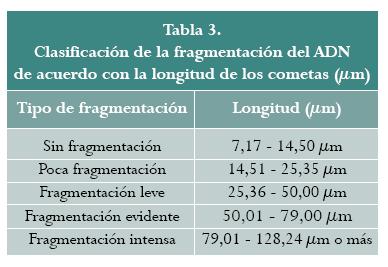
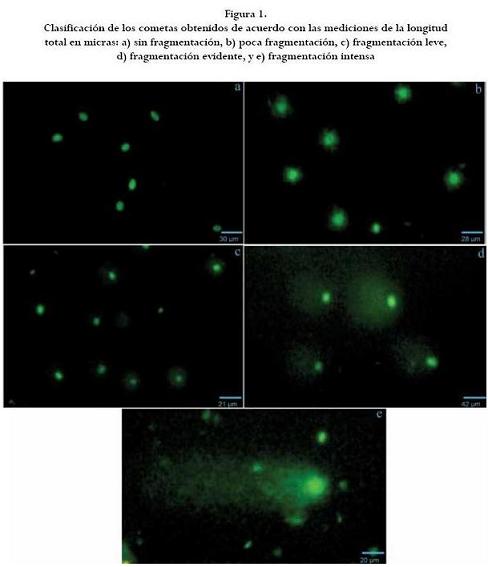
Para la evaluación de la fragmentación del ADN, las placas se tiñeron con naranja de acridina y posteriormente se visualizaron en un microscopio de fluorescencia a un aumento de 10x y se tomaron fotografías. A continuación, las fotografías fueron analizadas con el software ImageJ (versión 1.45 n) evaluando por tratamiento 200 células de acuerdo con McKelvey-Martin (37). De esta manera, se obtuvo la longitud en µm de cada uno de los cometas desde el inicio del núcleo hasta el final de la cola del cometa. Por último, se estableció un rango de fragmentación en micras teniendo en cuenta la clasificación de cometas obtenida en la investigación realizada por Rodrigues (44): a) sin fragmentación: células intactas, b) poca fragmentación: células con un halo pequeño a su alrededor pero sin cola de cometa evidente, c) fragmentación leve: células con formación y el núcleo un poco decolorado, d) fragmentación evidente: células con cola ya formada y el núcleo parcialmente decolorado, y e) fragmentación intensa: célula con núcleo decolorado observándose solo la cola del cometa.
Se evaluaron los siguientes parámetros del espermograma: volumen, pH, concentración, movilidad, vitalidad y morfología; estas últimas tres, además de la fragmentación del ADN, fueron medidas antes y después de la capacitación. Con el objeto de evaluar la fragmentación del ADN espermático de acuerdo con los parámetros seminales, los pacientes se dividieron en tres grupos: normozoospermicos, teratozoospermicos y astenoteratozoospermicos
Análisis estadístico
El análisis estadístico se llevó a cabo usando el paquete estadístico InfoStat Versión Profesional (2011). Se utilizó un análisis de varianza (ANOVA) empleando el método de comparación de Duncan cuando los datos se ajustaron a los supuestos de normalidad y homogeneidad de varianzas, y una varianza no paramétrica de Friedman cuando se rechazaron los supuestos anteriormente nombrados. Los resultados se presentaron en medias y valores de desviación o error estándar. Para las correlaciones entre los parámetros seminales y la fragmentación del ADN se utilizó el coeficiente de correlación de Pearson. El valor de p < 0,05 se consideró estadísticamente significativo.
RESULTADOS
La edad de los pacientes varió entre 23-65 años con una media y una desviación estándar de 35,1 ± 7,95, respectivamente. En la tabla 1 se presentan las medidas resumen de los parámetros seminales de la población estudiada.
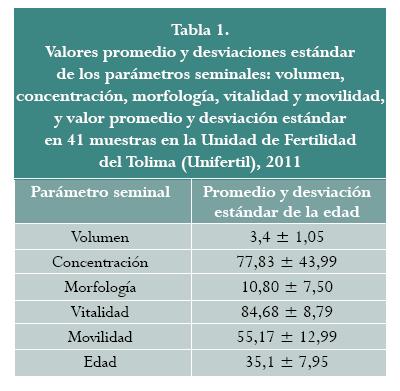
Los espermogramas fueron clasificados como: normozoospérmicos (31,7%), teratozoospérmicos (46,3%), astenoteratozoospérmicos (14,6%), oligoastenozoospérmicos (2,4%), astenonecroteratozoospérmicos (2,4%) y oligoteratozoospérmicos (2,4%).
Las capacitaciones espermáticas, tanto swim up como gradientes de densidad, se evaluaron en las muestras de 36 pacientes, ya que la calidad de las muestras seminales de los cinco pacientes restantes no permitió la recuperación de suficientes células espermáticas por la técnica de swim up, debido a que esta necesitaba una concentración y movilidad determinadas.
Capacitaciones espermáticas
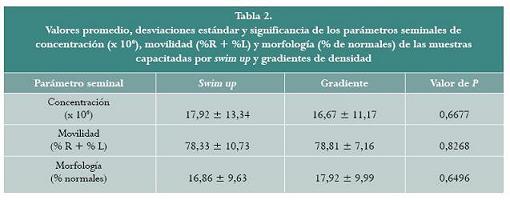
En la comparación de la concentración, la movilidad y la morfología espermáticas se encontraron diferencias estadísticamente significativas entre las muestras frescas y las capacitadas; la concentración espermática disminuyó en las muestras capacitadas (p < 0,0001), y la movilidad y la morfología espermáticas aumentaron (p < 0,0001). No se encontraron diferencias significativas en la concentración, la movilidad y la morfología entre las dos técnicas de capacitación (tabla 2).
La clasificación de la fragmentación del ADN de acuerdo con la longitud del cometa se describe en la tabla 3. Asimismo, en la figura 1 se muestran las fotografías de los cometas de acuerdo con las clasificaciones descritas anteriormente y la longitud en micras.
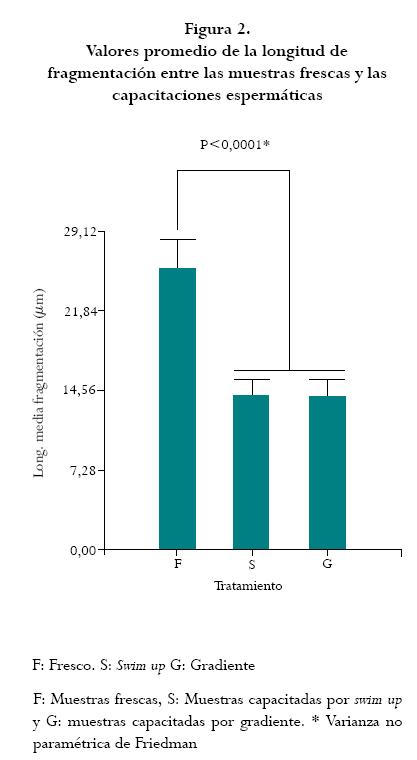
Se hallaron diferencias significativas en la fragmentación del ADN entre las muestras frescas y las muestras capacitadas, se encontró una disminución significativa de la fragmentación del ADN espermático en las muestras capacitadas con respecto a las muestras frescas (p < 0,0001). Sin embargo, cuando se compararon las muestras capacitadas no se encontraron diferencias significativas entre las dos técnicas utilizadas. En la figura 2 se observan las medias y el error estándar de cada uno de los tratamientos. El análisis de varianza no paramétrico de Friedman mostró que existen diferencias significativas entre el semen fresco y la capacitación por gradientes de densidad (p = 0,0015) en las muestras de los pacientes con concentración espermática disminuida.
La fragmentación del ADN espermático, de acuerdo con los parámetros seminales, no mostró diferencias estadísticamente significativas en la muestra fresca (p = 0,9061), e igualmente en el semen capacitado por swim up y por gradientes de densidad (p = 0,2291 y p = 0,2499, respectivamente). Por otra parte, el coeficiente de correlación no evidencia una relación estadísticamente significativa entre los parámetros seminales examinados y la fragmentación del ADN en las muestras frescas como en las muestras capacitadas. La correlación entre los parámetros seminales y la fragmentación del ADN en los tres grupos de pacientes tampoco mostró relaciones significativas.
DISCUSIÓN
Teniendo en cuenta los resultados obtenidos, las técnicas de capacitación espermática mejoran la calidad de la muestra al aumentar el número de espermatozoides móviles y morfológicamente normales. Estos resultados concuerdan con Ricci (45) y Michaeli (46) quienes evaluaron el swim up, y Prakash (47) y Hammadeh (48) quienes evaluaron la técnica de gradientes de densidad. Estos investigadores encontraron que la calidad de la muestra seminal aumenta después de la capacitación espermática al recuperar espermatozoides móviles, viables y morfológicamente normales.
En el presente estudio se encontró una disminución significativa de la fragmentación del ADN espermático en las muestras capacitadas con respecto a las muestras frescas, es decir, las técnicas de capacitación espermática tienen un efecto positivo al seleccionar espermatozoides con menor fragmentación del ADN para ser usados en las TRA. La influencia positiva de las técnicas de capacitación espermática en la fragmentación del ADN también fue demostrada por Donnelly (49) y por Ahmad (38) utilizando el ensayo cometa; estos investigadores encontraron que la integridad del ADN espermático fue significativamente mayor con la aplicación de los métodos de capacitación comparado con el semen fresco. Sakkas (50) y Tomlinson (51) aseguran que utilizando el método de gradientes de densidad se reduce el porcentaje de espermatozoides con daño en el ADN, mientras que Hammadeh (48) y Younglai (52) encontraron que a través del método swim up aumentó la integridad del ADN espermático.
Por otro lado, no se encontraron diferencias estadísticamente significativas en la fragmentación del ADN entre las técnicas de capacitación espermática, swim up y gradientes de densidad; es probable que los espermatozoides, al ser móviles, posean menos fragmentación en el ADN y sean capaces de cruzar los obstáculos de la capacitación, ya sea vencer la gravedad desde el plasma seminal al medio de cultivo por swim up y la separación por la fuerza centrífuga y la densidad por los gradientes (53). Por otra parte, Ahmad (38) sí encontró diferencias entre las técnicas de capacitación; en este estudio no utilizaron las dos técnicas de capacitación en la misma muestra y, adicionalmente, usaron varias medidas tales como: longitud del cometa, longitud de la cola, porcentaje de ADN en la cabeza del cometa, porcentaje de ADN en la cola del cometa, momento de la cola y el momento de la cola de Olive. Asimismo, se dificulta comparar los resultados obtenidos por diferentes investigadores que han usado el ensayo cometa ya que no existe un consenso sobre qué metodología utilizar para la evaluación de los cometas (54, 55). Por esta razón, es necesario implementar un protocolo de evaluación unificado para establecer comparaciones con otras investigaciones.
El hecho de no encontrar correlaciones estadísticamente significativas entre los parámetros seminales evaluados (concentración, movilidad y morfología) y la fragmentación del ADN tanto en las muestras frescas como en las capacitadas, indica la necesidad de evaluar la integridad del ADN espermático como análisis adicional, ya que el espermograma no revela las alteraciones en la organización de la cromatina tales como condensación irregular o daño en el ADN (56, 57). Adicionalmente, Saleh (58) demostró que hombres con parámetros seminales normales clasificados como idiopáticos tuvieron un alto porcentaje de espermatozoides con daño en el ADN cuando se compararon con hombres con fertilidad comprobada con parámetros seminales normales.
Uno de los parámetros más importantes en los tratamientos de reproducción asistida es la morfología espermática. Sin embargo, en este estudio no se halló una relación lineal entre la morfología y la fragmentación del ADN, esto se podría explicar según el trabajo realizado por Avendaño (59) quien asegura que espermatozoides con morfología normal podrían presentar daño en el ADN en algunos pacientes, particularmente en aquellos con teratozoospermia leve o moderada. Asimismo, Ahmad (38) y Tomlinson (52) encontraron en sus investigaciones que los pacientes teratozoospérmicos presentaron una fragmentación del ADN mayor en comparación con los otros grupos de pacientes analizados.
A diferencia de los resultados encontrados, Borini (57) halló correlaciones estadísticamente significativas entre los parámetros seminales (concentración, movilidad y morfología) y la fragmentación del ADN en muestras frescas así como en muestras capacitadas. Irvine (40) y Trisini (60) evidenciaron relaciones estadísticamente significativas entre la concentración y la movilidad, respectivamente.
Es importante resaltar que en esta investigación se evaluaron las dos técnicas en la misma muestra seminal, hecho que no ha sido ampliamente estudiado.
CONCLUSIÓN
Las dos técnicas de capacitación espermática: swim up y gradientes de densidad, tienen un efecto positivo sobre la calidad de la muestra fresca inicial, no solo al mejorar la movilidad y la morfología sino también al disminuir la fragmentación del ADN espermático. Es importante valorar la integridad del ADN en los tratamientos de reproducción asistida dado que el espermograma o el análisis convencional del semen no revela el daño en el material genético del gameto masculino.
AGRADECIMIENTOS
A la Oficina de Investigaciones y Desarrollo Científico de la Universidad del Tolima y a Unifertil por la financiación del proyecto de investigación. A María Carolina Hernández por su gran ayuda, colaboración, apoyo, enseñanza y amabilidad durante el trabajo realizado en Unifertil. A Beatriz Henao de la Universidad de Antioquia y al profesor Antonio Guio por transmitirme los fundamentos y las etapas del ensayo cometa a fin de aplicarlos en el trabajo de investigación. A Mariana de Paula Rodrigues de la Universidad de São Paulo, y al doctor Gustavo Vallejo por sus consejos y ayuda para la estandarización del protocolo de la técnica utilizada en el proyecto. A la Facultad de Ciencias y al Departamento de Biología de la Universidad del Tolima por su colaboración y por el préstamo de los equipos, así como también, al Laboratorio de Citogenética, Filogenia y Evolución de Poblaciones de la Universidad del Tolima.
REFERENCIAS
1. Zegers-Hochschild F, Adamson G, de Mouzon J, Ishihara O, Mansour R, Nygren K, et al. The International Committee for Monitoring Assisted Reproduction Technology (ICMART) and the World Health Organization (WHO). Revised glossary on ART terminology. Hum Reprod 2009;24:2683-7. [ Links ]
2. Erenpreiss J, Spano M, Erenpreisa J, Bungum M, Giwercman A. Sperm chromatin structure and male infertility: biological and clinical aspects. Asian J Androl 2006;8:11-29. [ Links ]
3. Rawe V. Columnas de anexina V como metodología de selección molecular de espermatozoides no apoptóticos durante ICSI. Reproducción Humana 2009;6:12-7. [ Links ]
4. Simon L, Lutton D, MacManus J, Lewis S. Sperm DNA damage measured by the alkaline comet assay as an independent predictor of male infertility and in vitro fertilization success. Fertil Steril 2011;95:652-7. [ Links ]
5. Frydman N, Prisant N, Hesters L, Frydman R, Tachdjian G, Cohen P, Fanchin R. Adequate ovarian follicular status does not prevent the decrease in pregnancy rates associated with high sperm DNA fragmentation. Fertil Steril 2008;89:92-7. [ Links ]
6. Pacey A. Male fertility and infertility. Obstetrics, Gynaecology and Reproductive Medicine 2008;19: 42-7. [ Links ]
7. Patel Z, Niederberger C. Male factor assessment in infertility. Med Clin North Am 2011;95:223-34. [ Links ]
8. Krausz C. Male infertility: Pathogenesis and clinical diagnosis. Best Practice and Research Clinical Endocrinology and Metabolism 2011;25:271-85. [ Links ]
9. Varghese A, Bragais F, Mukhopadhyay D, Kundu S, Pal M, Bhattacharyya A, et al. Human sperm DNA integrity in normal and abnormal semen samples and its correlation with sperm characteristics. Andrologia 2009;41:207-15. [ Links ]
10. Cooper T, Noonan E, von Eckardstein S, Auger J, Gordon H, Behre M, et al. World Health Organization reference values for human semen characteristics. Hum Reprod Update 2010;16:231-45. [ Links ]
11. Vásquez F, Vásquez D. Espermograma y su utilidad clínica. Salud Uninorte 2007;23:220-30. [ Links ]
12. Barratt C, Aitken R, Björndahl L, Carrell DT, Boer P, Kvist U, et al. Sperm DNA: Organization, protection and vulnerability: from basic science to clinical applications -a position report. Hum Reprod 2010;25:824-38. [ Links ]
13. van der Steeg J, Stevies P, Eijkemans M, Habbema J, Hompes V, Kremer J, et al. Role of semen analysis in subfertile couples. Fertil Steril 2011;95:1013-9. [ Links ]
14. Agarwal A, Erenpreiss J, Sharma R. Sperm chromatin assessment. En: Gardner D, Weissman A, Howles C, Shoham Z editors. Textbook of Assisted Reproductive Technologies. Laboratory and Clinical perspectives. 3th ed. United Kingdom: Informa; 2009. p. 67-84. [ Links ]
15. Collins J, Barnhart K, Schlegel P. Do sperm DNA integrity tests predict pregnancy with in vitro fertilization? Fertil Steril 2008;89:823-31. [ Links ]
16. Barratt C, De Jonge C. Clinical relevance of sperm DNA assessment: an update. Fertil Steril 2010;94;1958-9. [ Links ]
17. Sergiere M, Mieusset R, Daudin M, Thonneau P, Bujan L. Ten-year variation in semen parameters and sperm deoxyribonucleic acid integrity in a healthy fertile man. Fertil Steril 2006;86:11-8. [ Links ]
18. Agarwal A, Allamaneni S. Sperm DNA damage assessment: a test whose time has come. Fertil Steril 2005;84:850-3. [ Links ]
19. Zini A, Sigman M. Are tests of sperm DNA damage clinically useful? Pros and cons. J Androl 2009;30: 219-29. [ Links ]
20. Belcheva A, Ivanova-Kicheva M, Tzvetkova P, Marinov M. Effects of cigarette smoking on sperm plasma membrane integrity and DNA fragmentation. International J Androl 2004;27:296-300. [ Links ]
21. Evenson D, Wixon R. Clinical aspects of sperm DNA fragmentation detection and male infertility. Theriogenology 2006;65:979-91. [ Links ]
22. Smit M, Romijn J, Wildhagen M, Veldhoven J, Weber R, Dohle G. Increased sperm DNA fragmentation after surgical varicocelectomy is associated with increased pregnancy rate. J Urol 2010;183:270-4. [ Links ]
23. Agarwal A, Said T. Role of sperm chromatin abnormalities and DNA damage in male infertility. Hum Reprod 2003;9:331-45. [ Links ]
24. O'Flaherty C, Vaisheva F, Hales B, Chan P, Robaire B. Characterization of sperm chromatin quality in testicular cancer and Hodgkin´s lymphoma patients prior to chemotherapy. Hum Reprod 2008;23: 1044-52. [ Links ]
25. Sakkas D, Mariethoz E, St. John J. Abnormal sperm parameters in human are indicative of an abortive apoptotic mechanism linked to the Fas-mediated pathway. Experimental Cell Research 1999;251:350-5. [ Links ]
26. Shamsi M, Kumar R, Dada R. Evaluation of nuclear DNA damage in human spermatozoa in men opting for assisted reproduction. Indian J Med Res 2008;127:115-23. [ Links ]
27. Sakkas D, Álvarez J. Sperm DNA fragmentation: mechanism of origin, impact on reproductive outcome, and analysis. Fertil Steril 2010;93:1027-36. [ Links ]
28. Aitken R, Baker M. Oxidative stress, sperm survival and fertility control. Mol Cell Endocrinol 2006;250:66-9. [ Links ]
29.Vayena E, Rowe P, Griffin P, editors. Current practices and controversies in Assisted Reproduction. Geneva; 2002. [ Links ]
30. Hernández C. Inyección Intracitoplasmática del espermatozoide (ICSI). Una técnica de reproducción asistida con indicaciones. Rev Colomb Obstet Ginecol 2003;54:157-63. [ Links ]
31. Silber S, Repping S. Transmission of male infertility to future generations: lessons from the Y chromosome. Hum Reprod Update 2002;8:217-29. [ Links ]
32. Avendaño C, Franchí A, Duran H, Oehninger S. DNA fragmentation of normal spermatozoa negatively impacts embryo quality and intracytoplasmic sperm injection outcome. Fertil Steril 2010;94:549-57. [ Links ]
33. Selles E, Pérez I, Pellicer J, López M. Capacitación espermática. En: Remohí J, Romero J, De los Santos M, Pellicer A, editors. Manual práctico de esterilidad y reproducción humana. Laboratorio de Reproducción Asistida. 3th ed. España: McGraw Hill; 2008. p. 25-29. [ Links ]
34. Giwercman A, Richthoff J, Hjollund H, Bonde P, Jepson K, Frohm B, et al. Correlation between sperm motility and sperm chromatin structure assay parameters. Fertil Steril 2003;80:1404-12. [ Links ]
35. Agarwal A, Allamaneni S. Alteraciones de la cromatina espermática en la etiopatogenia de la infertilidad masculina. Revista Internacional de Andrología 2005;3:31-7. [ Links ]
36. Angelopoulou R, Plastira K, Msaouel P. Spermatozoal sensitive biomarkers to defective protaminosis and fragmented DNA. Reprod Biol Endocrinol 2007;5:36. [ Links ]
37. McKelvey-Martin V, Melia N, Walsh I, Johnston S, Hughes C, Lewis S, et al. Two potential clinical applications of the alkaline single-cell gel electrophoresis assay: (1) human bladder washings and transitional cell carcinoma of the bladder; and (2) human sperm and male infertility. Mutat Res 1997; 375:93-104. [ Links ]
38. Ahmad L, Jalali S, Shami S, Akram Z. Sperm preparation: DNA damage by comet assay in Normo and Teratozoospermics. Arch Androl 2007;53:325-38. [ Links ]
39. Morris I, Ilott S, Dixon L, Brison R. The spectrum of DNA damage in human sperm assessed by single cell gel electrophoresis (comet assay) and its relationship to fertilization and embryo development. Hum Reprod 2002;17:990-8. [ Links ]
40. Irvine D, Twigg J, Gordon E, Fulton N, Milne P, Aitken J. DNA integrity in human spermatozoa: Relationships with semen quality. J Androl 2000;21:33-44. [ Links ]
41. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 4th Edition. United Kingdom; 1999. [ Links ]
42. Kruger T, Menkveld R, Oettlé E, Swanson R, Acosta A, Oehninger S. Clinical application. En: Menkveld R, Oettlé E, Kruger T, Swanson R, Acosta A, Oehninger, S, editors. Atlas of human sperm morphology. 3th. ed. United States: Williams & Wilkins; 1991. p. 7-60. [ Links ]
43. World Health Organization. WHO laboratory manual for the examination and processing of human semen. 5th ed. Switzerland; 2010. [ Links ]
44. Rodrigues M. Perfil oxidativo e avaliação funcional de sêmen criopreservado de touros (Bostaurustaurus e Bostaurusindicus) criados em clima tropical [disertación]. São Paulo: Universidad de São Paulo; 2009. [ Links ]
45. Ricci G, Perticarari S, Boscolo R, Montico M, Guaschino S, Presani G. Semen preparations methods and sperm apoptosis: swim up versus gradient density centrifugation technique. Fertil Steril 2009;91:632-8. [ Links ]
46. Michaeli M, Peer S, Anderman S, Ballas S, Ellenbogen A. Post swim up versus original semen quality, and strict criteria morphology, it´s influence on fertilization rate in vitro fertilization program: a pilot study. International Congress Series 2004;1271:181-4. [ Links ]
47. Prakash P, Leykin L, Chen Z, Toth T, Sayegh R, Schiff I, et al. Preparation by differential gradient centrifugation is better than swim-up in selecting sperm with normal morphology (strict criteria). Fertil Steril 1998;69:722-6. [ Links ]
48. Hammadeh M, Kühnen A, Amer A, Rosenbaum P, Schmidt W. Comparison of sperm preparation methods: effect on chromatin and morphology recovery rates and their consequences on the clinical outcome after in vitro fertilization embryo transfer. Int J Androl 2001;24:360-8. [ Links ]
49. Donnelly E, O´Connell M, McClure N, Lewis S.Differences in nuclear DNA fragmentation and mitochondrial integrity of semen and prepared human spermatozoa. Hum Reprod 2000;15:1552-61. [ Links ]
50. Sakkas D, Manicardi G, Tomlinson M, Mandrioli M, Bizzaro D, Bianchi P, et al. The use of two density gradient centrifugation techniques and the swim up method to separate spermatozoa with chromatin and nuclear DNA anomalies. Hum Reprod 2000; 15.1112-6. [ Links ]
51. Tomlinson M, Moffatt O, Manicardi G, Bizzaro D, Afnan M, Sakkas, D. Interrelationships between seminal parameters and sperm nuclear DNA damage before and after density gradient centrifugation: implications for assisted conception. Hum Reprod 2001;16:2160-5. [ Links ]
52. Younglai E, Holt D, Brown P, Jurisicova A, Casper R. Sperm swim up techniques and DNA fragmentation. Hum Reprod 2001;16:1950-3. [ Links ]
53. Nieschlag E, Behre H, Nieschlag S, editors. Andrology Male Reproductive Health and Dysfunction. London: Springer; 2010. [ Links ]
54. García O, Romero I, González JE, Moreno D, Cuétara E, Rivero Y, et al. Visual estimation of the percentage of DNA in the tail in the comet assay: Evaluation of different approaches in an intercomparison exercise. Mutat Res 2011;720:14-21. [ Links ]
55.García O, Romero I, González JE, Mandina T. Measurements of DNA damage on silver stained comets using free Internet software. Mutat Res 2007; 627:186-90. [ Links ]
56. Blanco A, Ramis J, Aulesa C, Gris J. Estudio para la valoración diagnóstica del índice de fragmentación del ADN espermático en una población de pacientes del servicio de esterilidad. Revista Iberoamericana de Fertilidad 2011;28:55-9. [ Links ]
57. Borini A, Tarozzi N, Bizzaro D, Bonu M, Fava L, Flamigni C, et al. Sperm DNA fragmentation: paternal effect on early post-implantation embryo development in ART. Hum Reprod 2006;21:2876-81. [ Links ]
58. Saleh R, Agarwal A, Nelson D, Nada E, El-Tonsy M, Álvarez J, et al. Increased sperm nuclear DNA damage in normozoospermic infertile men: a prospective study. Fertil Steril 2002;78:313-8. [ Links ]
59. Avendaño C, Franchi A, Taylor S, Morshedi M, Bocca S, Oehninger S. Fragmentation of DNA in morphologically normal human spermatozoa. Fertil Steril 2009;91:1077-84. [ Links ]
60. Trisini A, Narendra P, Singh M, Duty S, Hauser R. Relationship between human sperm parameters and deoxyribonucleic acid damage assessed by the neutral comet assay. Fertil Steril 2004;82:1623-32. [ Links ]
Conflicto de intereses: ninguno declarado.














