Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Obstetricia y Ginecología
versão impressa ISSN 0034-7434
Rev Colomb Obstet Ginecol vol.64 no.2 Bogotá jan./jun. 2013
Hernando Guillermo Gaitán-Duarte, MD, MSc.1, Andrea Esperanza Rodríguez-Hernández, MD, MSc.2, Ingrid Arévalo-Rodríguez, PSc3, Edith Angel-Müller, MD.4, Hugo Enrique López-Ramos, MD Msc(c).5, Jesús Santiago Estrada-Mesa, MD.6, Colaboradores Grupo Desarrollador de la Guía de manejo sindrómico ITS y otras ITG*
Recibido: junio 10/12 - Aceptado: julio 11/13
1 Especialista en Obstetricia y Ginecología. MSc en Epidemiología Clínica. Profesor Titular, Departamento de Obstetricia y Ginecología e Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional de Colombia. Coordinador editorial Grupo Cochrane de Infecciones de Transmisión Sexual. Bogotá, Colombia. Líder de la Guía. hggaitand@unal.edu.co
2 Médica cirujana. Especialista en Estadística Aplicada. Magíster en Epidemiología Clínica. Docente auxiliar de posgrado, Instituto de Investigaciones Clínicas, Universidad Nacional de Colombia. Coordinadora Metodológica de la Guía. Bogotá, Colombia.
3 Psicóloga. Magíster en Epidemiología Clínica, Universidad Nacional de Colombia. PhD (c) en Pediatría, Obstetricia y Ginecología, Medicina Preventiva y Salud Pública, Universidad Autónoma de Barcelona. Bogotá, Colombia.
4 Médica cirujana. Especialista en Obstetricia y Ginecología. Fellow en Infectología Ginecoobstétrica y Perinatal. Profesora Asociada Departamento de Obstetricia y Ginecología, Universidad Nacional de Colombia. Representante de la Federación Colombiana de Obstetricia y Ginecología. Miembro Comité Editorial Grupo Cochrane de Infecciones de Transmisión Sexual. Bogotá, Colombia.
5 Médico cirujano. Especialista en Urología. Candidato a magíster en Epidemiología Clínica. Miembro de Número de la Sociedad Colombiana de Urología. Representante de la Sociedad Colombiana de Urología en la elaboración de la Guía. Bogotá, Colombia.
6 Médico cirujano. Especialista en Microbiología y Parasitología Médica. Director general Laboratorio Clínico Congregación Mariana, Fundación Santa María, Medellín, Colombia. Representante de la Asociación Colombiana de Infectología (ACIN). Medellin, Colombia.
* Colaboradores Grupo desarrollador de la "Guía de manejo sindrómico de infecciones de transmisión sexual y otras infecciones del tracto genital". Lista completa al final del documento.
RESUMEN
Objetivo: reducir la variabilidad de la práctica en el manejo de las infecciones del tracto genital y de las infecciones de transmisión sexual; apoyar a los profesionales de la salud que atienden pacientes con ITG/ITS, con la más reciente evidencia respecto a la efectividad y seguridad de las intervenciones para la prevención primaria, secundaria y terciaria, y generar indicadores de implementación de la guía y de su impacto en la salud pública.
Materiales y métodos: se constituyó un equipo desarrollador en el que participaron diferentes profesionales de la salud y representantes de pacientes. Se formularon preguntas clínicas relevantes y se realizó una búsqueda en repositorios nacionales e internacionales de Guías. Se evaluaron las Guías disponibles en cuanto a su calidad y aplicabilidad. Dado que ninguna guía cumplió con los criterios de adaptación, se decidió el desarrollo de una Guía de Novo. Se realizó una búsqueda de revisiones sistemáticas y metaanálisis, ensayos clínicos y estudios observacionales en las bases de datos pubmed, ovid, embase, cochrane y lilacs. Se elaboraron las tablas de evidencia y las recomendaciones con la aproximación grade por metodología de consenso formal e informal.
Resultados: se presenta la “Guía de práctica clínica” con las recomendaciones y la evidencia de soporte para la prevención, el diagnóstico, tratamiento en cuanto a efectividad y seguridad, y seguimiento de los síndromes de: cervicitis, uretritis, úlcera genital, flujo vaginal, inflamación escrotal y bubón inguinal.
Conclusiones: como recomendación central de implementación se plantea el manejo del paciente por medio de la dosis única y tratamiento expedito del compañero cuando sea posible. La Guía deberá actualizarse en tres años.
Palabras clave: guías de práctica clínica, infecciones de transmisión sexual, infecciones del tracto reproductivo, cervicitis, uretritis, flujo vaginal, úlcera genital.
ABSTRACT
Objective: To reduce practice variability in the management of genital tract infections and sexually transmitted infections, and provide healthcare practitioners that care for patients with GTIs/STDs with the most recent evidence on the effectiveness and safety of the interventions for primary, secondary and tertiary prevention; and to create indicators to track the implementation of the guideline and its impact on public health.
Materials and methods: A development team was set up with the participation of different healthcare professionals and patient representatives. Relevant clinical questions were asked and a search was conducted in the national and international guideline repositories. The existing guidelines were evaluated for quality and applicability. Considering that none of the guidelines met the criteria for adoption, it was decided to develop a de novo guideline. A search of systematic reviews and meta-analysis, clinical trials and observational studies was conducted in the pubmed, ovid, embase, cochrane and lilacs databases. Evidence tables and recommendations were prepared using the grade approach on the basis of the informal and formal consensus methodology.
Results: The “Clinical Practice Guideline” is presented, including the recommendations and support evidence for prevention, diagnosis and treatment in terms of effectiveness and safety, and follow-up of cervicitis, urethritis, genital ulcer, vaginal discharge, scrotal inflammation and inguinal bubo.
Conclusions: The core recommendation for implementation is patient management using a single dose and expedite treatment of the partner whenever possible. The Guideline must be updated in three years.
Key words: Clinical practice guideline, sexually transmitted infections, reproductive tract infections, cervicitis, urethritis, vaginal discharge, genital ulcer.
PROPÓSITO Y ALCANCE
La presente Guía busca apoyar al personal clínico asistencial que brinda cuidados a pacientes de ambos sexos susceptibles de presentar infecciones de transmisión sexual (ITS) y otras infecciones del tracto genital causadas por gérmenes endógenos (ITG), o quienes presentan síntomas y signos de estas infecciones. No incluye las infecciones del tracto genital causadas como consecuencia de procedimientos médicos.
Hace recomendaciones para los niveles de atención primaria, secundaria y terciaria. En el primer nivel se toman en cuenta acciones de prevención, evaluación de riesgos, detección temprana, manejo inicial y referencia. A nivel secundario y terciario hace referencia a las anteriores y provee el manejo de las complicaciones de las ITS/ITG, como también prevención de recaídas o cronificación (prevención secundaria). Los manejos de condiciones específicas por parte de subespecialistas ameritan recomendaciones específicas que exceden el alcance de la presente Guía.
La Guía está dirigida a la población residente en Colombia, entre los 14 y los 74 años, sin importar el régimen de aseguramiento al que pertenezca el/la paciente o si el/la paciente se encuentra asegurado/a o no.
Además de reducir la variabilidad de la práctica en el manejo de las infecciones del tracto genital y de las infecciones de transmisión sexual, esta Guía tiene como objetivos: apoyar a los profesionales de la salud que atienden pacientes con ITG/ITS, con la más reciente evidencia respecto a la efectividad y seguridad de las intervenciones para la prevención primaria, secundaria y terciaria. Además busca cortar la cadena de transmisión de las ITS, reducir la carga de la enfermedad asociada a las ITG/ITS en el territorio colombiano y generar indicadores de implementación de la Guía y de su impacto en la salud pública.
Los síndromes que acompañan las afecciones del tracto genital objeto de esta Guía son los siguientes:
1. Síndrome de infección cervical (mujeres).
2. Síndrome de úlcera genital (mujeres y hombres).
3. Síndrome de flujo vaginal (mujeres).
4. Síndrome de descarga uretral (hombres).
5. Síndrome de inflamación escrotal (hombres).
6. Síndrome de bubón inguinal (mujeres y hombres).
La guía para el manejo de la Enfermedad pélvica inflamatoria se publicará en una Guía aparte por haber seguido un proceso metodológico diferente de adaptación y no el desarrollo de Novo como fue el llevado a cabo para los síndromes antes mencionados.
Esta “Guía de práctica clínica” actualiza la “Guía de atención de infecciones de transmisión sexual” en la Resolución 412 del Ministerio de Salud de Colombia, la cual propuso un abordaje sindrómico para las personas con síndromes de ITS/ITG (1).
INTRODUCCIÓN Y JUSTIFICACIÓN DE LA GUÍA
Las ITG son causadas por microorganismos normalmente presentes en el tracto reproductivo o que son introducidos desde el exterior durante el contacto sexual o durante procedimientos medico-quirúrgicos los cuales afectan tanto a mujeres como a hombres (2, 3). En las mujeres, las ITG no transmitidas por vía sexual o infecciones endógenas son: la vaginosis bacteriana, la cual representa la causa más común de síndrome de flujo vaginal, seguida por la Candida albicans (4, 5). Respecto a las ITS son causadas por diferentes agentes etiológicos: bacterias como Neisseria gonorrhoeae o Chlamydia trachomatis y protozoarios como Trichomonass vaginalis; virus como el virus herpes simple, el virus de la inmunodeficiencia humana (VIH) o el virus del papiloma humano (VPH) (4).
Las infecciones endógenas o las ITS se manifiestan frecuentemente por síntomas tales como aumento de la secreción vaginal, secreción uretral, úlceras genitales, prurito, irritación, presencia de mal olor o dolor pélvico (6, 7). Los síntomas y los signos de infección han sido agrupados en los síndromes clínicos antes mencionados, bajo el supuesto de que estos son causados por grupos de agentes etiológicos específicos, y que este agrupamiento en síndromes permite una mayor efectividad en el diagnóstico y el tratamiento de las infecciones por el médico o agente de salud, el cual debe ocurrir idealmente en el primer contacto de la paciente con los servicios de salud y especialmente si no se tiene acceso a servicios de laboratorio. La Organización Mundial de la Salud (OMS) ha recomendado este enfoque de manejo sindrómico (8).
Los síndromes propuestos en la mujer son: el síndrome de flujo vaginal, que incluye la vaginitis causada por Candida sp., por la Trichomionas vaginalis (TV) y la vaginosis bacteriana (VB). El síndrome de cervicitis es causado principalmente por Neisseria gonorroheae (NG), Chlamydia trachomatis (CT), el virus herpes simple (VHS), el síndrome de enfermedad pélvica inflamatoria (EPI) causado por NG, CT, Mycoplasma (9), y gérmenes anaerobios que acceden al tracto genital superior (10). En el hombre se proponen: el síndrome de inflamación escrotal causado por CT y NG y bacterias gram negativas (9) y los síndromes que afectan ambos sexos tales como el síndrome de úlcera genital causado por el Treponema pallidum (TP), Hemophilus ducreyi (HD), CT serotipos 1, 2 y 3, Klebsiella granulomatis, el VHS, el síndrome de bubón inguinal causado por CT y HD, y el síndrome de descarga uretral causado por NG, CT y TV (9).
Desde el punto de vista epidemiológico, en países en vías de desarrollo las ITS son una de las principales causas de morbilidad, con consecuencias importantes a nivel sanitario, social y con un alto costo para el sistema de salud y para los pacientes (11). En Colombia, el informe sobre la situación de las ITS 1976-2000 está casi exclusivamente dedicado a la situación del VIH/SIDA y se informan 406.722 años de vida potencialmente perdidos por muerte (AVPP) entre 1991 y 1998 (12). La pérdida de años de vida y de años de vida ajustados por discapacidad de las ITS no VIH/SIDA está relacionada con la presencia de complicaciones a las que se asocian tales como: cáncer (13), enfermedad pélvica inflamatoria (EPI), embarazo ectópico, infertilidad y dolor pélvico crónico, o complicaciones del embarazo como embarazo ectópico, corioamnionitis o infección puerperal (11); complicaciones en el hombre como epididimitis y prostatitis (14). Por otra parte, el mantener el estado de portador asintomático se ha asociado a incremento en la transmisión y la recurrencia de la enfermedad en las comunidades (11), por esta razón se debe dar la mayor importancia a la identificación de los comportamientos de riesgo en la prevención, detección y manejo de las ITS, así como el tratamiento de los contactos sexuales (8).
La disponibilidad de una guía de práctica clínica para el diagnóstico y tratamiento sindrómico de las ITG ayudará a los administradores y profesionales de la salud a tener elementos para la toma de decisiones en salud, con el fin de garantizarles a las pacientes un manejo a través de intervenciones eficaces/efectivas, seguras y con la mejor relación costo-efectividad, mejorando así la calidad en todos los niveles de atención en salud sexual y reproductiva del territorio nacional.
MATERIALES Y MÉTODOS
El Grupo Desarrollador de la Guía (GDG) se conformó con expertos en: infecciones de transmisión sexual, epidemiología clínica, atención primaria, urólogos, infectólogos, ginecólogos, psicólogos, enfermeras, químicos farmacéuticos, comunicadores y expertos en salud pública y diseño de políticas. También se contó con representantes de pacientes quienes aportaron sus opiniones en diferentes fases del desarrollo de la guía.
Una vez formuladas las preguntas clínicas, el GDG procedió a realizar una búsqueda sistemática de guías de práctica clínica (GPC) orientada a identificar las GPC nacionales e internacionales disponibles. La búsqueda sistemática de GPC coincidentes con los tópicos incluidos en la GPC se realizó en los siguientes sitios de búsqueda: AHRQ-Clearinghouse, NHS, Guías Salud, Guidelines International Network, Scottish Intercollegiate Guidelines Network, National Institute for Clinical Excellence, Australian National Health and Medical Research Council, New Zealand Guidelines Group, Organización Mundial de la Salud, Organización Panamericana de la Salud, TRIP database, Medline vía pubmed, lilacs vía BVS (Biblioteca Virtual de la Salud), además se realizó búsqueda de literatura gris y en páginas de ministerios de Salud de la región vía Google. Los términos empleados en la búsqueda fueron Sexual* transmit* infection*; Sexual* transmit* disease*; Venereal*; STD*; infecciones de transmisión sexual con los filtros (Medline) “Practice Guideline”[ptyp] OR practiceguideline*[tiab] OR guideline*[ti] OR recommendation*[ti] OR “Practiceguidelines as topic”[MeSH].
Luego de evaluar la calidad de las guías obtenidas con el instrumento agree ii, y dado que su evaluación mostró que solo la guía para el manejo de la enfermedad pélvica inflamatoria del British College of Obstetricians and Gynaecologists cumplió con los criterios de calidad o pertinencia para el alcance de la guía propuesta para el país, se decidió la adaptación de la “Guía de enfermedad pélvica inflamatoria” y el desarrollo de novo de la guía respecto a los otros síndromes antes mencionados. Para esto se realizó una búsqueda de revisiones sistemáticas (RS) y metaanálisis en los últimos diez años en las bases de datos medline vía ovid, embase, cochrane y lilacs. Cuando no se encontraron artículos en este periodo de tiempo, fue necesario ampliar este criterio. La calidad de las RS fue evaluada por medio de la herramienta AMSTAR. Para aquellas preguntas en las que no se encontraron revisiones sistemáticas o donde estas no eran de alta calidad, se realizó una búsqueda de estudios primarios partiendo de ensayos clínicos, seguidos por estudios de cohorte, casos y controles, y estudios descriptivos, los que fueron evaluados por medio de las herramientas pertinentes del Scottish Intercollegiate Guidelines Network sign. Para algunos tópicos -principalmente las infecciones de baja prevalencia- fue necesario recurrir a recomendaciones de otras GPC pues la evidencia era muy escasa. Posteriormente se elaboraron las tablas de evidencia con ayuda del software gradepro Versión 3.6. Los niveles de evidencia fueron graduados según la clasificación grade (15) (tabla 1).
Para la elaboración de recomendaciones se llevaron a cabo consensos informales de expertos. Para elaborar y graduar las recomendaciones se utilizó la metodología grade con la cual se tuvieron en cuenta la calidad de la evidencia, el balance riesgo-beneficio, los costos y las preferencias de los pacientes (16). Las preguntas para las que no se logró generar la recomendación por consenso informal fueron sometidas a consenso formal de expertos (tabla 2).
RECOMENDACIONES GENERALES
1. ¿Cuál aproximación se debe dar al manejo de pacientes con alto riesgo o sospecha de tener una ITG / ITS?

Efectividad del manejo sindrómico de las ITS/ITG. Son pocos los estudios clínicos que permitan evaluar la efectividad del manejo sindrómico. Un estudio clínico aleatorizado (ECA) comunitario que comparó la efectividad del abordaje sindrómico con otras estrategias comunitarias de manejo de ITS/ITG a nivel poblacional mostró que el abordaje sindrómico disminuyó la incidencia de sífilis activa (RR = 0,58; IC 95%: 0,35-0,96) y la prevalencia de infecciones por NG (RR = 0,28; IC 95%: 0,11-0,70). Sin embargo, para las infecciones por CT el efecto no fue estadísticamente significativo (RR = 0,99; IC 95%: 0,71-1,39) (17). En este estudio hay un riesgo incierto de sesgos ya que no se aclara el método de asignación aleatoria a las comunidades, como tampoco si hubo ocultamiento. Otro estudio clínico con 8845 pacientes en donde encontró que el manejo sindrómico disminuyó la incidencia de VIH (RR = 0,58; IC 95%: 0,42-0,79) (18). Sin embargo, no se demostró disminución estadísticamente significativa en la prevalencia de otras ITS. Hubo pérdidas del 29% de los sujetos y limitaciones en el tamaño de la muestra (Nivel de evidencia: moderado).
2. ¿Cómo debe ser la atención del o la paciente que consulta por síntomas de infección del tracto genital?

La atención debe ser individual, en un área privada, en un ambiente totalmente confidencial. Se sugiere utilizar un lenguaje sencillo, neutro, sin hacer juicios de valor. La historia clínica deberá averiguar sobre la presencia de síntomas tales como: molestias en la zona genital, secreción por la uretra, flujo vaginal, mal olor, prurito, secreciones rectales, disuria, dolor abdominal o dolor testicular. Además se averiguará sobre la presencia de factores de riesgo para ITS, por ejemplo: no uso regular de condón, relaciones sexuales casuales, múltiples compañeros sexuales en los últimos seis meses, sexo anal, relaciones sexuales bajo el efecto de alcohol o drogas alucinógenas, entre otros. Se continúa con el examen físico en busca de adenopatías (en especial las inguinales), fiebre, dolor abdominal a la palpación o dolor de “rebote”. Con el examen pélvico se deberá buscar la presencia de úlceras o lesiones genitales en labios mayores, menores y ano en mujeres, o en el pene, escroto y ano en hombres, y la presencia de secreción uretral, anal o vaginal. Se deberá colocar un espéculo para visualizar el cérvix y allí evaluar la presencia de secreción endocervical o sangrado fácil, y examinar las paredes vaginales. Por último, en mujeres hacer un tacto vaginal para detectar dolor o masas anexiales. En hombres se deberá examinar el epidídimo y la región testicular, y realizar un examen rectal en caso de relaciones penetrativas anales.
Esta recomendación fue hecha en consenso por el grupo de expertos nacionales (Nivel de evidencia: muy bajo).
3. ¿Cuáles son las estrategias poblacionales más efectivas para la prevención de las ITS/ITG?
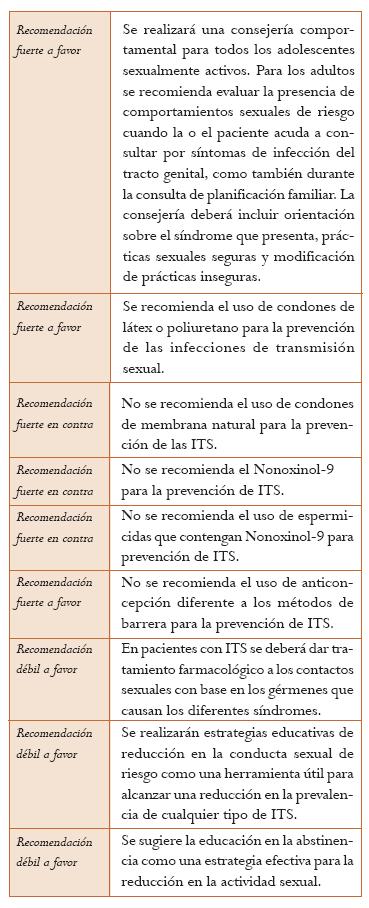
Consejería. Se ha descrito que en las pacientes que buscan utilizar métodos de planificación se debe aprovechar esta consulta para evaluar el riesgo y hacer consejería o detección de la infección en personas de alto riesgo. En caso de haber comportamientos de riesgo se deberá aconsejar su reducción usando una o varias estrategias entre las cuales se encuentran: la abstinencia, el uso del condón, limitar el número de compañeros sexuales, modificar las prácticas sexuales y la vacunación. La consejería puede ser una estrategia más efectiva si se acompaña de empatía y carece de prejuicios. La consejería puede ser realizada por todos los profesionales afines a la salud; no se requiere un entrenamiento extenso como prerrequisito, pero la calidad de la consejería mejora cuando el proveedor ha recibido entrenamiento y ha desarrollado las destrezas necesarias (4) (Nivel de evidencia: muy bajo).
Vacunación preexposición. La vacunación preexposición es una de las estrategias más efectivas para prevenir la transmisión de algunas ITS. En la actualidad se dispone de dos vacunas contra el VPH y una contra la Hepatitis B. Las estrategias y los esquemas de vacunación se encuentran fuera del alcance de esta guía, pero se invita a los lectores a consultar la guía de atención integral respectiva (4).
Uso del condón masculino. Cuando se usa consistente y correctamente, el condón masculino es altamente efectivo en prevenir las infecciones de transmisión sexual. Se ha demostrado que el uso del condón como parte de una política poblacional para la prevención de las ITS reduce la prevalencia de sífilis, NG y TV (19). La falla del condón para proteger contra una enfermedad de transmisión sexual o un embarazo no deseado usualmente resulta de su uso inconsistente o incorrecto más que de una ruptura (4). El condón masculino está usualmente hecho de látex, pero existen también condones a base de poliuretano y otros materiales sintéticos, los cuales proveen una protección efectiva contra las ITS y el embarazo no deseado con similar efectividad a los condones de látex (20); estos condones pueden ser utilizados en las personas alérgicas al látex. Existen también condones de “membrana natural” fabricados a base de tejido animal; estos condones poseen poros hasta de 1500 nm de diámetro que pese a que no permiten el paso del esperma poseen un diámetro mayor al del VIH y el HBV, lo que puede permitir la adquisición de enfermedades virales de transmisión sexual (20); el uso de este tipo de condones para la prevención de las ITS no es recomendado (4) (Nivel de evidencia: muy bajo).
Condón femenino. Los compañeros sexuales deben considerar el uso del condón femenino cuando el condón masculino no puede ser utilizado correcta o consistentemente. Adicionalmente, el condón femenino puede ser utilizado para la protección contra las ITS durante relaciones anales receptivas (21) (Nivel de evidencia: muy bajo).
Nonoxinol-9. Existe evidencia de que el N-9 no protege contra las infecciones de transmisión sexual y que podría ser dañino al incrementar la tasa de úlceras genitales; este producto no puede ser recomendado solo o en espermicidas para la prevención de ITS.Una revisión sistemática de la literatura (22), con puntaje AMSTAR de 9/11, que incluyó diez ensayos clínicos controlados para un total de 5909 pacientes, evaluó la seguridad y la efectividad del Nonoxinol-9 (N-9) comparado con placebo para la prevención de cualquier ITS (excepto el VIH) en las mujeres. No se encontraron diferencias estadísticamente significativas en el riesgo de adquirir una infección por NG (RR = 0,91; IC 95%: 0,67-1,24), de TV (RR = 0,84; IC 95%: 0,69-1,02), de CT (RR = 0,88; IC 95%: 0,77-1,01), de VB (RR = 0,88; IC 95%: 0,74 a 1,04) o de Candida (RR = 0,97; IC 95%: 0,84-1,12). Las mujeres que recibieron N-9 comparado con placebo experimentaron una mayor frecuencia de lesiones genitales (RR = 1,17; IC 95% 1,02-1,35). El metaanálisis mostró bajo riesgo de sesgos y alta heterogeneidad (Nivel de evidencia: moderado).
Los métodos anticonceptivos que no ofrecen una barrera mecánica no brindan protección contra el VIH y otras ITS. Mujeres sexualmente activas que utilizan métodos hormonales, dispositivo intrauterino, esterilización quirúrgica o tienen histerectomía deben ser aconsejadas con respecto al uso del condón y el riesgo de las infecciones de transmisión sexual, dado que estas mujeres pueden percibir, incorrectamente, que no se encuentran en riesgo de padecer de estas enfermedades. Los métodos de higiene genital tales como duchas vaginales y el lavado vaginal posteriores a una relación sexual no protegida no son efectivos para proteger contra las ITS o el VIH (4) (Nivel de evidencia: muy bajo).
Tratamiento del compañero sexual. Se refiere a un continuo de actividades diseñadas para incrementar el número de personas infectadas que reciben tratamiento interrumpiendo así la cadena de transmisión de la infección. Existe evidencia limitada con respecto al impacto que la notificación del compañero ejerce sobre la prevalencia de estas infecciones en la comunidad (23). Aun así, se disminuye la probabilidad de reinfección en el caso índice, por lo cual los proveedores deben aconsejar a las personas con ITS de notificar a sus compañeros sexuales y sugerirles la necesidad de buscar evaluación médica y tratamiento (19). Una revisión sistemática de la literatura (19) con puntaje AMSTAR de 9/11, que incluyó cuatro ensayos clínicos controlados para un total de 57.000 pacientes, evaluó la efectividad del tratamiento masivo para las infecciones de transmisión sexual en todos los individuos miembros de la comunidad, de la distribución de preservativos al interior de la misma, del manejo sindrómico de las infecciones de transmisión sexual y la consejería en ITS para reducir la prevalencia de las infecciones de transmisión sexual, el incremento en la utilización de los servicios de salud, la mejoría en la calidad de los servicios y el incremento de los comportamientos sexuales seguros en la comunidad incluyendo el uso del condón. Se encontró que las intervenciones poblacionales descritas reducen de forma significativa la prevalencia de sífilis (RR = 0,88; IC 95%: 0,80-0,96), de NG (RR = 0,49; IC 95%: 0,31-0,77), de TV (RR = 0,64; IC 95%: 0,54-0,77), pero no la de CT (RR = 1,03; IC 95%: 0,77-1,36); también se encontró un incremento significativo en la frecuencia del uso del condón (RR = 1,18; IC 95%: 1,04-1,33) y de la consulta en búsqueda de tratamiento por una enfermedad de transmisión sexual (RR = 1,22; IC 95%: 1,13-1,32) comparado con el control con el único efecto adverso de un pequeño incremento en el número de compañeros sexuales (RR =1,07; IC 95%: 1,01-1,13). Los estudios incluidos tienen moderado riesgo de sesgos y alta heterogeneidad (Nivel de evidencia: moderado).
Intervenciones educativas en adolescentes para reducir el riesgo de VIH e ITS. Una revisión sistemática con puntaje AMSTAR de 8/11 evaluó la efectividad de dos estrategias grupales educativas en adolescentes (reducción en la conducta sexual de riesgo: 64 ensayos clínicos controlados y educación en la abstinencia: 23 ensayos clínicos controlados) aplicadas en el ámbito escolar o comunitario centradas en la implementación de consejerías para la prevención de las ITS, la distribución de preservativos, el tamizaje de las ITS y la realización de campañas educativas con el ánimo de disminuir la prevalencia de VIH o de cualquier otra enfermedad de transmisión sexual. Esta aproximación se fundamenta en la educación del adolescente teniendo en cuenta sus actitudes y creencias con el ánimo de generar una comunicación fluida que se refleje en la adecuada toma de decisiones y en la adquisición de destrezas prácticas. La estrategia de educación en reducción de la conducta sexual de riesgo se asoció de forma significativa con una reducción en la actividad sexual (OR = 0,81; IC 95%: 0,72-0,90), un menor número de compañeros sexuales (OR = 0,83; IC 95%: 0,74-0,93), un menor número de contactos sexuales no protegidos (OR = 0,70; IC 95%: 0,60-0,82) y una menor frecuencia de infecciones de transmisión sexual (OR = 0,65; IC 9%: 0,47-0,90). Con respecto a la educación en la abstinencia, la intervención educativa se asoció con una menor actividad sexual (OR = 0,81; IC 95%: 0,70-0,94), pero no demostró diferencias estadísticamente significativas en el número de compañeros sexuales, el número de contactos sexuales no protegidos o el uso de condón durante la actividad sexual. En esta RS no es claro el riesgo de sesgos de los estudios incluidos y mostró alta heterogeneidad para los resultados de los metaanálisis en varios desenlaces (24) (Nivel de evidencia: moderado).
4. ¿Cuáles son los factores de riesgo asociados a las ITS?
Existen características sociodemográficas y comportamientos sexuales que aumentan el riesgo de contraer una ITS. Varios estudios de cohorte, y estudios de casos y controles han reportado determinados factores de riesgo para adquirir ITS. Con base en los estudios revisados (25-45) y en lo referido por diferentes GPC como los de la OMS-2005 (2), CDC-2010 (4) y Canadiense (9), se tienen los siguientes factores de riesgo (tabla 3).
RECOMENDACIONES GENERALES PARA TENER EN CUENTA EN EL MANEJO DE SÍNDROMES ESPECÍFICOS

Dosis única. Esta es una recomendación de los expertos nacionales basada en la evidencia que soporta el uso de la azitromicina y la ceftriaxona para los gérmenes que principalmente causan la cervicitis; el tinidazol y el fluconazol para aquellos que causan el flujo vaginal, y la penicilina benzatínica para la sífilis en el síndrome de úlcera genital, evidencia que se presenta en el manejo de cada uno de los síndromes específicos (Nivel de evidencia: muy bajo).
Tratamiento a los contactos sexuales. Una revisión sistemática referente a la efectividad de cuatro diferentes estrategias de notificación a las parejas de pacientes con ITS/ITG, con puntaje AMSTAR 10/11, incluyó 26 ECA con un total de 17.578 participantes. Las estrategias evaluadas fueron: a) la notificación simple por el (la) paciente al compañero (a) que necesita tratamiento. Si el anterior método va acompañado de folletos o kits de diagnóstico se denomina referencia por el paciente mejorada; b) tratamiento expedito, en el cual se envía el tratamiento al compañero con el paciente que consulta, sin necesidad de que el médico examine al compañero; c) referencia por el proveedor, en la cual la información sobre la necesidad de tratamiento es dada por el personal de salud, y d) referencia por contrato, en la cual el paciente es el encargado de comunicar al paciente la necesidad tratamiento, pero si no hay respuesta en un tiempo dado el proveedor busca al paciente.
En cuanto al número de compañeros tratados por paciente índice, el tratamiento expedito es mejor que la referencia simple en pacientes con cualquier síndrome causado por ITS (diferencia de medias = 0,5; IC 95%: 0,34-0,67). No hubo evidencia confiable sobre el beneficio de la referencia por el proveedor o el método de referencia de contrato con el paciente. No hubo evidencia de incremento de eventos adversos. Hubo riesgo de sesgos de selección por problemas en la asignación aleatoria y alto riesgo de sesgos de desempeño de los ECA incluidos por ausencia de enmascaramiento y pérdidas mayores al 20% en 7 estudios (46) (Nivel de evidencia moderado).
La recomendación sobre la consulta de salud sexual fue consensuada por los expertos(Nivel de evidencia: muy bajo).
SÍNDROME DE INFECCIÓN CERVICAL (CERVICITIS)
5. ¿Cuáles son los agentes etiológicos asociados al síndrome de infección cervical?
El manejo de la infección cervical se basa en el diagnóstico y tratamiento de los principales agentes etiológicos que son Chlamydia trachomatis y Neisseria gonorrhoeae (4).
6. ¿Cuáles son las manifestaciones clínicas de las ITS/ITG caracterizadas por síndrome de infección cervical?
De acuerdo con la “Guía canadiense para el manejo de las ITS”, los signos y síntomas de la infección cervical son: flujo mucopurulento cervical, friabilidad cervical, cérvix en fresa y flujo vaginal (9). Otros signos y síntomas asociados son: dispareunia y disuria (47). El manejo sindrómico de la infección cervical ha sido controvertido debido a que la infección por CT es asintomática en el 70% de las mujeres en edad reproductiva (48), los signos y síntomas de esta patología no cuentan con las características operativas deseadas llevando a un alto número de falsos negativos. Se ha encontrado que la sensibilidad del manejo sindrómico para el diagnóstico de infección cervical es de 13,3%. Además, el flujo vaginal reportado por la paciente y encontrado en el examen clínico es el signo más sensible para el diagnóstico sindrómico con un 49,7 y 78,3% de sensibilidad y especificidad respectivamente (49).

Se ha reportado que la sensibilidad de las pruebas rápidas aplicadas en el sitio de cuidado para C. trachomatis varía entre el 17 y el 49%, y la especificidad de estas pruebas varía entre el 90 y 100% (50-53). Sin embargo, un estudio costo-exactitud hecho en Colombia mostró que el uso de pruebas rápidas para NG y CT son la estrategia más costo-efectiva para el manejo de la cervicitis en relación con el diagnóstico sindrómico (54) (Nivel de evidencia: bajo).
7. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de infección cervical?

Tratamiento de pacientes con infecciones por CT. Un metaanálisis (55) comparó dos tratamientos (azitromicina 1 g, dosis única, frente a doxiciclina 100 mg cada 12 horas por 7 días) para el manejo de la descarga uretral o cervicitis causadas por Chlamydia trachomatis (CT). Incluyó 12 ensayos clínicos aleatorizados, con un total de 1543 pacientes. Puntaje AMSTAR 7/11. Fue calificada como de muy baja calidad debido al rigor de las búsquedas de información y las comparaciones indirectas realizadas en la población. Además, los autores declaran que la calidad de los estudios incluidos es dudosa debido a pequeños tamaños de muestra y falta de cegamiento en más de la mitad de los estudios incluidos además de las pérdidas al seguimiento que fueron superiores al 20%. El desenlace fue cura microbiológica o cultivo negativo para CT en un rango de seguimiento de 2 a 5 semanas postratamiento. Se encontró que el porcentaje de pacientes con diagnóstico etiológico de infección genital por CT tratados con azitromicina en los cuales se identifica cura microbiológica al cabo de un seguimiento de 3,7 semanas en promedio no difieren significativamente del porcentaje de pacientes que llegaron al mismo desenlace y que fueron tratados con doxiciclina. El porcentaje de cura microbiológica fue de 96,5 y 97,9% respectivamente, diferencia de proporciones 0,0014 (IC 95%: -0,007-0,022).
No se encontraron diferencias en la presencia de EA en los pacientes con infección genital por CT tratados con azitromicina (25%) en comparación con pacientes que reciben un tratamiento con doxiciclina (22,9%) (p = 0,533). Posterior a la publicación de esta RS se han publicado 3 ensayos clínicos aleatorizados. El primero de ellos fue realizado por Sendag et al. (56), estudio que presenta alto riesgo de sesgos e imprecisión. En este estudio se incluyeron 131 mujeres con diagnóstico de cervicitis, 42 de ellas tuvieron cultivo positivo para alguno de los patógenos analizados (Ureaplasma urealyticum, Chlamydia trachomatis, Mycoplasma hominis), de estas mujeres el 71,4% de las tratadas con Azitromicina y 77,3% de las tratadas con doxiciclina tuvieron cultivos negativos a las 2 semanas de seguimiento, estas diferencias son reportadas como no estadísticamente significativas. Respecto a los resultados de manejo sindrómico, 42,9% de las mujeres del grupo azitromicina con cultivo positivo (n = 21) y 54,5% de las mujeres del grupo doxiciclina con cultivo positivo (n = 23) se encontraban libres de signos clínicos de cervicitis a las 2 semanas de seguimiento. Otro ECA publicado (57) tenía por objeto comparar el efecto terapéutico del tratamiento con azitromicina 1 g dosis única (DU) frente a doxiciclina 100 mg c/12 horas por 7 días en mujeres que acudieron por diferentes síntomas -que los autores no aclaran-, y que fueron positivas para CT, Ureaplasmaurealyticum (UU) o Mycoplasmahominis (MH) según ensayos inmunoenzimáticos. De las 533 mujeres inicialmente estudiadas, solo 81 fueron positivas para algún patógeno de los mencionados. Hay alto riesgo de sesgos. Reportan tasas de erradicación del 87,3 y 93,5% en los grupos de azitromicina y doxiciclina respectivamente. El último ECA publicado por Rustomjee et al. (58) evaluó la efectividad del tratamiento con azitromicina (n = 45) frente al tratamiento con doxiciclina más ciprofloxacina (n = 37) para el manejo de la cervicitis causada por CT o NG en 82 mujeres diagnosticadas por examen clínico, inmunoensayo y gram de flujo endocervical. De las mujeres estudiadas, 26 estaban infectadas por CT, 19 tenían infección por CT y NG y 37 estaban infectadas por NG.
El análisis de los grupos se realizó según el agente etiológico aislado, de tal forma que reportan la curación microbiológica según la bacteria y no de acuerdo con los grupos asignados. El porcentaje de cura microbiológica en los grupos de infección por CT, CT + NG y NG para azitromicina fueron de 100, 90 y 100% respectivamente; para las mismas infecciones en el grupo de doxiciclina más ciprofloxacina fueron de 100% en los tres grupos. No se encontraron diferencias estadísticamente significativas en cuanto a incidencia de eventos adversos (Nivel de evidencia: muy bajo).
Tratamiento de pacientes con infección cervical por NG. En el ECA de Rehman et al. (59) se evaluó la cura microbiológica de pacientes de los dos sexos con signos y síntomas de uretritis o cervicitis, con diagnóstico etiológico positivo para NG. En total se estudiaron 300 pacientes de 14 a 55 años de edad, 229 mujeres y 71 hombres. Fueron asignados a uno de tres grupos de tratamiento: ciprofloxacina 500 mg, dosis única, ceftriaxona 500 mg IV, dosis única, o espectinomicina 2 g IM, dosis única. La cura fue determinada por ausencia de síntomas y tinción de gram más microscopía de fluido prostático o secreción vaginal. El porcentaje de eficacia clínica reportado fue de 90% en el grupo ceftriaxona, 94% en el grupo espectinomicina y 80% en el grupo de ciprofloxacina. Hubo alto riesgo de sesgos y evidencia indirecta. Los autores solo describieron proporciones, no calcularon medidas de asociación (Nivel de evidencia: muy bajo).
La “Guía de práctica clínica” de la CDC del 2010 (4) anota que la ceftriaxona y cefixime son altamente efectivas para el tratamiento de la uretritis y cervicitis causada por NG y constituyen la primera opción de tratamiento. Además, señalan que si bien la espectinomicina es efectiva y una opción de tratamiento útil en personas que no toleran las cefalosporinas, es un medicamento costoso, inyectable y que no está disponible en Estados Unidos por lo tanto no la incluyen en las recomendaciones. Sin embargo otras guías, como la Canadiense del 2008, recomiendan el tratamiento con espectinomicina como medicamento alternativo al uso de las cefalosporinas. Esta misma Guía no recomienda el uso de ciprofloxacina para el manejo de infecciones por NG debido a que este antibiótico se considera un inductor de resistencia (9). Esta dos guías están en contra del uso de ciprofloxacina para la infección por NG por las altas tasas de resistencia bacteriana (Nivel de evidencia: muy bajo).
8. ¿Cuáles son las complicaciones más frecuentes que se presentan en el síndrome de infección cervical?
El ascenso de la infección del cérvix al tracto genital superior hace se generen complicaciones como enfermedad pélvica inflamatoria, la cual a su vez puede causar infertilidad tubárica, embarazo ectópico y dolor pélvico crónico como secuelas de la infección no tratada (60). Los agentes etiológicos involucrados en el desarrollo de cervicitis uterina también se encuentran en la enfermedad pélvica inflamatoria (C. trachomatis, N. gonorrhoeae, Mycoplasmagenitalium) (61). En estudios que incluyeron seguimiento a largo plazo de la infección tratada por C. trachomatis se encontró una cohorte prospectiva en la que 443 mujeres con signos y síntomas de enfermedad pélvica inflamatoria moderada a severa fueron seguidas en un promedio de 84 meses, se demostró que estas mujeres tienen un riesgo cercano al 20% de desarrollar enfermedad pélvica inflamatoria dentro de los siguientes 3 años (HR = 2,48; IC 95%: 1,00-6,27). Este riesgo es acumulativo en relación con el número de infecciones por C. trachomatis (62). Sin embargo, aún no ha sido posible determinar si las secuelas se deben a mecanismos biopatológicos propios de la infección o si es atribuible a las limitaciones en el diagnóstico (60).
9. ¿Cuál es seguimiento indicado para las pacientes con síndrome de infección cervical?

Esta recomendación surgió del consenso de expertos (Nivel de evidencia: muy bajo).
10. ¿Cuál es la efectividad y seguridad del tratamiento para la pareja de la paciente con síndrome de infección cervical?
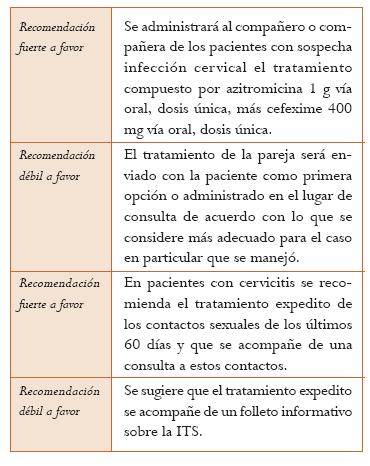
Tratamiento del compañero de la paciente con CT. La revisión sistemática de Ferreira et al., antes mencionada, sobre las estrategias de notificación al compañero mostró en pacientes con uretritis o cervicitis que la terapia expedita es mejor que la referencia con el paciente en términos de menor tasa de reinfección (6 ECA; RR = 0,71; IC 95%: 0,56-0,89; I2 = 39%). Cuando el análisis se restringe a CT no se encuentra beneficio (2 ECA; RR = 0,90; IC 95%: 0,60-1,35; I2 = 22%). En cuanto al número de compañeros tratados por paciente índice, el tratamiento expedito es mejor que la referencia simple en pacientes con infecciones por Chlamydia o N. gonorrhoeae (diferencia de medias = 0,43; IC 95%: 0,28-0,58). Sin embargo, la terapia expedita no fue superior a la referencia simple mejorada con folletos en prevenir la reinfección (3 ECA; RR = 0,96; IC 95%: 0,60-1,53; I2 = 33%) (Nivel de evidencia: moderado) (46).
La GPC del CDC de 2010 (4) recomienda que si el paciente tiene infección por NG debe ser tratado también para CT. Lo anterior debe ir acompañado de educación en salud sexual y reproductiva. En este documento se señala que si el paciente está sintomático y no han pasado más de 60 días luego de su última relación sexual, su pareja debe recibir tratamiento. Además, si son tratados se les debe decir a los pacientes que no pueden tener contactos sexuales hasta que el tratamiento haya terminado y los síntomas hayan desaparecido (Nivel de evidencia: muy bajo).
11. ¿Cuál es el tratamiento más efectivo y seguro para la paciente embarazada o en lactancia con síndrome de infección cervical?

Manejo de pacientes embarazadas o en lactancia con infección cervical (sospecha o confirmada) por CT. La revisión sistemática de Brocklehurst (63) incluyó 11 ECA, con un total de 1449 mujeres. Puntaje AMSTAR 10/11. En el estudio se evaluaron ECA que comparaban placebo o no tratamiento con esquemas antibióticos en mujeres gestantes con infección por CT. Los estudios evaluaron la cura microbiológica y solo uno de ellos los eventos adversos del neonato. Se encontró que el tratamiento produce menos fallas microbiológicas comparado con placebo o no tratamiento (OR = 0,06 IC 95%: 0,03-0,12). En cuanto a incidencia de parto pretérmino no se encontraron diferencias estadísticamente significativas (OR = 0,89 IC 95%: 0,51-1,56). Se evaluaron los eventos adversos que eran suficientes para suspender el tratamiento, los más frecuentes fueron los gastrointestinales (OR = 4,83 IC 95%: 0,60-38,67). Clindamicina y azitromicina parecen ser efectivos aunque los tamaños de muestra de los estudios son pequeños. La amoxicilina parece ser igual de efectiva a la eritromicina en cuanto a cura microbiológica (OR = 0,54 IC 95%: 0,28-1,02). La clindamicina (600 mg tres veces al día por 10 días) parece ser igual de efectiva a la eritromicina en cuanto a cura microbiológica (OR = 0,40 IC 95%: 0,13-1,18). La azitromicina 1 g, dosis única, parece ser más efectiva comparada con la eritromicina en cuanto cura microbiológica (OR = 0,38 IC 95%: 0,19-0,74). La estimación del efecto presenta riesgo de sesgos, evaluación indirecta e imprecisión en los estudios incluidos (Nivel de evidencia: bajo).
Manejo de pacientes embarazadas o en lactancia con infección cervical (sospecha o confirmada) por NG. La revisión sistemática de Brocklehurst (64), que incluyó 2 ECA, con una población total de 346 pacientes y un puntaje AMSTAR 9/11, evaluó los efectos de varios esquemas de tratamiento para la infección genital por NG en pacientes gestantes con respecto a la morbilidad materna y neonatal. Las fallas en la cura microbiológica fueron similares en todos los esquemas de tratamiento: amoxicilina más probenecid comparados con espectinomicina (OR = 2,29; IC 95%: 0,74-7,08), ceftriaxona comparado con cefixime (OR = 1,22; IC 95%: 0,16-9,01) y amoxicilina más probenecid comparado con ceftriaxona (OR = 2,29; IC 95%: 0,74-7,08). El autor señala que los tamaños de muestra son insuficientes por lo tanto es posible que esto haya dificultado la detección de diferencias en la efectividad de los tratamientos aunque asegura que la revisión confirma la posibilidad de utilizar ceftriaxona o cefixime en mujeres alérgicas a la penicilina, con una efectividad similar en cuanto a cura microbiológica. De los dos estudios incluidos en la revisión, solo uno (65) reportó un caso de suspensión del tratamiento por eventos adversos asociados al medicamento. La evaluación de la confianza en la estimación fue afectada por el riesgo de sesgos y alta imprecisión (Nivel de evidencia: muy bajo).
La GPC del CDC de 2010 (4) señala que a todas las mujeres gestantes que procedan de un área con alta prevalencia de infección por NG se les debe realizar tamización de rutina para esta bacteria en la primera consulta prenatal; igualmente, mujeres menores de 25 años con factores de riesgo para infección por NG deberían ser evaluadas nuevamente durante el tercer trimestre. Recomiendan tratamiento dual para NG y CT teniendo en cuenta la coinfección en la mayoría de los casos. Este mismo documento recomienda la administración de ceftriaxona 250 mg intramuscular, dosis única, o cefixime 400 mg vía oral, dosis única u otra cefalosporina en dosis única, acompañado de tratamiento con azitromicina 1 g vía oral, dosis única para la infección por CT (Nivel de evidencia: muy bajo).
12. ¿Cuáles son las complicaciones más frecuentes que se presentan en la mujer embarazada con síndrome de infección cervical?
Las complicaciones de la infección por C. trachomatis durante la gestación se relacionan con la transmisión vertical de los patógenos durante el momento del parto. Si ocurre la infección intraparto, el neonato puede desarrollar desde un cuadro ocular (conjuntivitis por C. trachomatis) hasta neumonía. Hammerschlag, en una revisión narrativa refiere que la tamización prenatal y el tratamiento antenatal de la infección han demostrado ser efectivos para la prevención de la oftalmia gonocócica y por C. trachomatis en el periodo neonatal (66) (Nivel de evidencia: muy bajo).
13. ¿Cuál es el manejo de infección cervical persistente o recurrente?

Manejo de la mujer con infección cervical persistente o recurrente (sospecha o confirmada) por Chlamydia trachomatis. El grupo de expertos sugiere el uso de la segunda opción en casos de sospecha de recurrencia. Se debe indagar acerca de tratamiento a la pareja, adherencia al tratamiento y las recomendaciones del mismo (relaciones sexuales con uso de condón durante el tratamiento con todas las parejas sexuales, administración del total de las dosis) (Nivel de evidencia: muy bajo).
Manejo de la mujer con infección cervical persistente o recurrente (sospecha o confirmada) por Neisseria gonorrhoeae. El grupo de expertos sugiere el uso de la segunda opción en casos de sospecha de recurrencia. Se debe indagar acerca de tratamiento a la pareja, adherencia al tratamiento y las recomendaciones del mismo (relaciones sexuales con uso de condón durante el tratamiento con todas las parejas sexuales, administración del total de las dosis) (Nivel de evidencia muy bajo).
SÍNDROME DE DESCARGA URETRAL
14. ¿Cuáles son los agentes etiológicos asociados al síndrome de descarga uretral?
Dentro de los patógenos más frecuentemente involucrados en el desarrollo de este síndrome se encuentran: N. gonorrhoeae, C. trachomatis, Mycoplasma genitalium, Ureaplasma urealiticum y Trichomonas vaginalis (9).
15. ¿Cuáles son las manifestaciones clínicas de las ITS/ITG caracterizadas por síndrome de descarga uretral?
Los signos y síntomas que caracterizan este síndrome son: disuria, irritación en la uretra distal o meato urinario acompañada o no de eritema y secreción uretral (9). El manejo sindrómico inicial no incluye la realización de pruebas de laboratorio.
16. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de descarga uretral?

Infecciones por C. trachomatis. La evidencia que soporta la recomendación de tratamiento de la CT ya fue descrita en la pregunta sobre cuál es el tratamiento más efectivo y seguro de la infección cervical. Se trata de un metaanálisis que comparó dos tratamientos: azitromicina 1 g, dosis única, frente a doxiciclina 100 mg cada 12 horas por 7 días para el manejo de la descarga uretral o cervicitis causadas por CT. No se encontraron diferencias en la cura microbiológica entre los dos medicamentos, con un porcentaje de cura microbiológica de 96,5 y 97,9% respectivamente, diferencia de proporciones 0,0014 (95% IC: -0,007-0,022) (55) (Nivel de evidencia: muy bajo).
Infección por N. gonorrhoeae. La evidencia que soporta la recomendación de tratamiento de la CT ya fue descrita en la pregunta sobre cuál es el tratamiento y seguro de la infección cervical. Se encontró un ECA que evaluó la cura microbiológica de pacientes con signos y síntomas de uretritis por NG. Fueron asignados a uno de tres grupos de tratamiento: ciprofloxacina 500 mg, dosis única; ceftriaxona 500 mg IV, dosis única, o espectinomicina 2 g IM, dosis única. El porcentaje de pacientes con diagnóstico de uretritis o cervicitis causada por NG en los cuales se identifica cura microbiológica al cabo de un seguimiento de 5 días fue de 90% en el grupo de ceftriaxona, 80% en el grupo de ciprofloxacina y de 94% en el grupo tratado con espectinomicina (59). Hubo alto riesgo de sesgos y evidencia indirecta (Nivel de evidencia: muy bajo).(Ver la sección correspondiente a cervicitis).
17. ¿Cuáles son las complicaciones del síndrome de descarga uretral?
La uretritis en el hombre puede complicarse a epididimitis aguda. La proctitis aguda se asocia frecuentemente a linfogranuloma venéreo, sin embargo, no existe evidencia acerca de asociación causal entre la infección por C. trachomatis y el desarrollo de prostatitis o infertilidad masculina (67). El síndrome de Reiter (uretritis, conjuntivitis, artritis y lesiones mucocutáneas) así como la artritis reactiva se asocian con las infecciones genitales por C. trachomatis (68).
18. ¿Cuál es el seguimiento para los pacientes con síndrome de descarga uretral?

Esta recomendación surge del consenso de expertos (Nivel de evidencia: muy bajo).
19. ¿Cuál es el tratamiento para la pareja del paciente con síndrome descarga uretral?

Estas recomendaciones se fundamentan a partir de la evidencia indirecta de la efectividad del tratamiento de la pareja con infecciones cervicales por CT y NG. (Ver la sección correspondiente a cervicitis).
SÍNDROME DE ÚLCERA GENITAL
20. ¿Cuáles son los agentes etiológicos asociados al síndrome de úlcera genital?
Los agentes responsables de la úlcera genital son: T. pallidum (TP) causante de la sífilis, el H. ducreyi (HD), CT serotipos 1, 2 y 3, Klebsiella granulomatis y el VHS (9).
21. ¿Cuáles son las manifestaciones clínicas de la úlcera genital?
El síndrome de úlcera comprende aquellas infecciones que se manifiestan con lesiones genitales ulcerativas, erosivas, pustulares o vesiculares acompañadas o no con linfadenopatía regional. Se localizan en la superficie del prepucio y el glande, escroto, periné y región perianal en el hombre, y la vulva, periné, región perianal y el resto de superficies mucosas (vagina y cuello) en las mujeres (69). Dependiendo del agente causal estas úlceras pueden presentar características diferentes. En infecciones por virus del herpes simple las úlceras se presentan después de la ruptura de vesículas o ampollas, tienen forma circular sobre un área con eritema con bordes y base difusos, son úlceras pequeñas, múltiples, que pueden confluir para formar úlceras de mayor tamaño. En este caso las úlceras pueden o no ser dolorosas, puede presentarse dolor en el área genital y el paciente puede presentar síntomas sistémicos como fiebre e inflamación de los ganglios inguinales. En el caso de la sífilis primaria se puede presentar una úlcera única en forma de chancro redondo, firme e indoloro, de bordes indurados y fondo limpio, acompañada o no de linfadenopatía. Por el contrario, en las infecciones por chancroide se presentan dos o más úlceras dolorosas necrosadas acompañadas de eritema y edema en la zona circundante; la úlcera, que al inicio se presenta como una protuberancia, puede acompañarse de inflamación de los ganglios inguinales y abscesos denominados bubones. La infección por linfogranuloma venéreo presenta los signos y síntomas de la uretritis o proctocolitis, con pápulas únicas autolimitadas seguidas de linfadenopatía femoral y edema en la región inguinal. Por último, el cuadro de la infección por granuloma inguinal presenta lesiones ulcerativas únicas o múltiples altamente vascularizadas, no dolorosas, las cuales sangran fácilmente al contacto, localizadas en un 50% en el área anal. Con el paso del tiempo las protuberancias iniciales se convierten en nódulos rojos denominados tejido de granulación que pueden extenderse hasta los pliegues inguinales (4, 9, 69). Es necesario resaltar que el abordaje sindrómico inicial de la úlcera no incluye la realización de pruebas de laboratorio.

Una revisión sistemática de pruebas diagnósticas que evalúa la sensibilidad y especificidad de las pruebas rápidas para diagnóstico de sífilis en clínicas de ITS y de control prenatal estima una sensibilidad y especificidad mediana de 86% (RIQ = 0,75-0,94) y 99% (RIQ = 0,98-0,99), respectivamente. Sin embargo, los estudios incluidos (13 estudios de corte transversal) son realizados para la identificación de sífilis de cualquier clase, y no es posible asegurar el rendimiento de las pruebas en el caso de la sífilis primaria (70). No se encontró evidencia referente a las características operativas o la efectividad de las pruebas para alergia a la penicilina en el contexto de cuidado primario de la sífilis primaria (Nivel de evidencia: bajo).
22. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de úlcera en mujeres y hombres?

Tratamiento de la sífilis primaria. La efectividad de la penicilina, en sus diferentes presentaciones, se ha establecido más por medio de la experiencia clínica que por la disponibilidad la disponibilidad de ensayos clínicos aleatorizados (ECAs) que evalúen su utilidad. Un ECA que reunió 326 pacientes con todo tipo de sífilis así como pacientes con VIH confirmado mostró que en pacientes con diagnóstico de sífilis primaria tratados con penicilina G benzatínica no se presentaba un mayor riesgo de falla terapéutica por serología en comparación con pacientes que reciben un tratamiento adicional con amoxicilina y probenecid (incidencias de falla del 17,8 y 17,2%, respectivamente) (OR = 1,11; IC 95%: 0,6-2,2). Este estudio presentó alto riesgo de sesgos relacionados con el seguimiento, adherencia al tratamiento y cointervenciones (71) (Nivel de evidencia muy bajo).
Se han estudiado otras opciones a la penicilina las cuales han mostrado un perfil de efectividad similar. Un metaanálisis (72), que incluyó 4 ECA y un total de 476 pacientes, con un puntaje AMSTAR 8/11, mostró que los pacientes con diagnóstico de sífilis primaria tratados con azitromicina muestran frecuencias similares de cura por serología en comparación con pacientes tratados con penicilina G benzatínica (RR = 0,68; IC 95%: 0,29-1,61). Otro metaanálisis con puntaje de AMSTAR 10 /11, encontró tres ECA que compararon penicilina benzatínica con la azitromicina. No hubo diferencias significativas en términos de cura clínica (OR = 1,04; IC 95%: 0,69-1,56), como tampoco a los tres meses. Tampoco hubo diferencias en términos de eventos adversos entre la azitromicina y la penicilina benzatínica (OR 1,43; 95% CI 0,42-4,95). En los dos estudios incluidos se afectó la confianza en la estimación ya que tuvieron riesgo de sesgos de reporte y precisión limitada, la heterogeneidad fue alta para la evaluación de eventos adversos (73) (Nivel de evidencia: moderado).
Dado que se han encontrado cepas de Treponema pallidum resistentes a azitromicina en diferentes partes del mundo, se recomienda el uso de este antibiótico con precaución, solo en los casos en que la penicilina o la doxiciclina no estén disponibles (4, 9).
En cuanto al tratamiento con ceftriaxona, un ECA que evaluó su uso en pacientes con sífilis primaria no muestra frecuencias diferenciales de cura clínica y serológica en comparación con pacientes tratados con penicilina G benzatínica (RR = 0,8; IC 95%: 0,32-1,99). Este ECA presenta un tamaño muestral insuficiente y pérdidas importantes al seguimiento, así como problemas de aplicabilidad directa ya que solo incluyó pacientes de género masculino (74). No se ha definido la dosis óptima ni el tiempo en ser utilizada (4) (Nivel de evidencia: bajo).
Manejo de los pacientes con alergia a la penicilina. Se encontró una cohorte retrospectiva de pacientes con diagnóstico de sífilis tratados con doxiciclina/tetraciclina. No se encontraron frecuencias diferenciales de cura serológica a 12-24 meses en comparación con pacientes tratados con penicilina G benzatínica (RR = 1,0; IC 95%: 0,953-1,067). Asimismo, tampoco se encontraron diferencias en el tiempo hasta la cura por serología en comparación con pacientes tratados con penicilina G benzatínica (Mediana 43 y 72, respectivamente; p = 0,16) (75). Este estudio presentó alto riesgo de sesgos de selección, de confusión y en la evaluación de la adherencia al tratamiento. No es claro si fueron incluidos pacientes con alergia documentada a la penicilina o cuál fue el criterio para la prescripción de la doxiciclina (Nivel de evidencia: muy bajo).
Tratamiento del chancroide. En un ECA en el que se incluyeron 184 hombres con sospecha de infección por cancroide -de los cuales en 127 se aisló H. ducreyi- se logró un seguimiento del 83%. Los pacientes tratados con azitromicina (n = 83) no muestran frecuencias diferenciales de cura clínica en comparación con pacientes tratados con eritromicina (n = 45) (OR = 0,97; IC 95%: 0,86-1,1) (76). El estudio presenta alto riesgo de sesgos por no describir el método de asignación aleatoria ni el método de ocultamiento y no utilizar enmascaramiento. Otro ECA en el que hay riesgo de sesgos relacionados con el reporte del cegamiento de los pacientes, así como con el seguimiento de la secuencia aleatoria, el cual incluyó 133 pacientes con infección por HD, tampoco mostró diferencias entre el uso de azitromicina o ceftriaxona en términos de la cura clínica (RR = 1,13; IC 95%: 0,98-1,30) o los eventos adversos (RR = 2,02; IC 95%: 0,92-4,43) (77) (Nivel de evidencia: moderado).
El uso de ciprofloxacina (500 mg vía oral, dosis única) en comparación con eritromicina (500 mg 3 veces al día por 7 días) fue evaluado en un ECA con 208 hombres y 37 mujeres con cultivos concordantes con infección por H. ducreyi. Las fallas del tratamiento fueron del 19% para el grupo de ciprofloxacina y de 12% para el grupo de eritromicina. No se encontraron diferencias significativas en términos de la cura clínica a los 21 días de inicio del tratamiento (RR = 0,97; IC 95%: 0,68-1,36) (78) (Nivel de evidencia: alto).
La guía del CDC (4) indica que se incrementan los informes de resistencia del HD a la ciprofloxacina y la eritromicina. Sugieren comenzar los estudios de resistencia bacteriana a estos medicamentos en caso de utilizarlos (Nivel de evidencia: bajo).
Tratamiento del linfogranuloma venéreo (CT serotipos L1, L2, L3). Un ECA que comparó diferentes tetraciclinas de similar perfil a la doxiciclina (chlortetraciclina, oxytetraciclina y sulfadiazina) frente a tratamiento sintomático (aspiración de los bubones más aspirina), mostró menor duración de las lesiones (31 frente a 69 días) y una mayor frecuencia en cura serológica en los pacientes tratados con antibiótico en comparación con otros pacientes (RR = 2,33; IC 95%: 1,4-4,1) (79). En dicho ECA el riesgo de sesgos no es claro ya que muchos elementos de la evaluación no están presentes al tratarse de un estudio publicado en 1957 (Nivel de evidencia: bajo).
El uso de azitromicina para esta ITS no se ha evaluado directamente, y la evidencia procede de otras infecciones causadas por C. trachomatis. Además de la evidencia ya descrita, dos ECA que incluyen 971 pacientes con infecciones por Chlamydia trachomatis (mayormente uretritis y cervicitis) no encontraron diferencias en términos de cura clínica (RR entre 1,03 a 1,06), cura bacteriológica (RR entre 0,97 a 1,01) o presencia de eventos adversos (RR entre 0,89 a 1,1), en comparación con pacientes tratados con doxiciclina (80, 81).Vale la pena anotar que la calidad de la evidencia disminuye debido a que los pacientes incluidos presentan infecciones por Chlamydia trachomatis en general, no específicamente debidas a las cepas relacionadas con el linfogranuloma venéreo serotipos L1, L2 y L3(Nivel de evidencia: moderado).
Respecto al uso de eritromicina se encontró un reporte de casos donde 2 pacientes de tres tratados con 1600 mg diarios presentan mejoría a los 12 y 14 meses (82) (Nivel de evidencia: muy bajo).
Tratamiento del granuloma inguinal.La evidencia sobre el uso de la azitromicina y ciprofloxacina es escasa; se identificaron dos reportes de casos para el uso de ciprofloxacina (83, 84) y un estudio piloto de un ECA para el uso de la azitromicina (85); no se encontró evidencia para el uso de trimetropin-sulfametoxazol. Expertos recomiendan el uso de doxiciclina como régimen de primera línea en esta infección, seguido por regímenes alternativos como azitromicina, ciprofloxacina, eritromicina y trimetropin-sulfametoxazol (4) (Nivel de evidencia: muy bajo).
Tratamiento de la primo infección por VHS. La efectividad del aciclovir se ha evaluado en 3 ECC (86-88) con un total de 259 pacientes con primer episodio de herpes simple, los cuales mostraron la disminución del tiempo de las lesiones en comparación con placebo. Los datos del ECA (87) con mayor número de pacientes (150 pacientes, 119 con primoinfección primaria y 31 con primo infección no primaria) muestran que el aciclovir disminuye significativamente el tiempo de curación completa de las lesiones (12 frente a 14 días, p = 0,005), reduce la formación de nuevas lesiones a 48 horas de inicio de la terapia (18% frente a 62%, p = 0,001) y reduce la duración del dolor (5 frente a 7 días, p = 0,05) y el viral shedding (2 frente a 9 días, p < 0,001). Dos de los estudios tienen tamaños de muestra pequeños (Nivel de evidencia: moderado).
Un ECA multicéntrico que evaluó el uso de valaciclovir (n = 323) frente al tratamiento con aciclovir (n = 320) no mostró diferencias en el tiempo hasta la resolución de los síntomas (HR = 1,0; IC 95%: 0,85-1,18), la duración de la virulencia (HR = 1,02; IC 95%: 0,85-1,22) o la duración del dolor (HR = 1,02; IC 95%: 0,84-1,18). Este estudio tiene bajo riesgo de sesgos (89). No hubo diferencias en los eventos adversos (Nivel de evidencia: alto).
Tratamiento del herpes recurrente. Se ha definido como herpes recurrente aquel que se presenta en al menos 6 episodios en un año en el mismo paciente (9). Una revisión sistemática que incluyó 14 ECA con un puntaje AMSTAR 9/11 muestra que la recurrencia de los episodios de herpes genital también se ve reducida tanto con el uso de aciclovir (RR = 0,46; IC 95%: 0,43-0,49), como de valaciclovir (RR = 0,56; IC 95%: 0,53-0,59) o famciclovir (RR = 0,57; IC 95%: 0,5-0,65) (90) (Nivel de evidencia: alto).
Expertos sugieren que el tratamiento con aciclovir o valaciclovir en profilaxis de recurrencia de herpes simple debe tener una duración de un año (4) (Nivel de evidencia: muy bajo).
23. ¿Cuáles son las complicaciones del síndrome de úlcera genital?
La primera complicación que puede presentarse con el abordaje sindrómico de la úlcera genital es la falla terapéutica, la cual puede registrarse en el momento del seguimiento o por una consulta del paciente posterior a la prescripción inicial; un ejemplo de ello es la aparición de infección sistémica (sífilis secundaria o terciaria) (91). Para determinar la conducta que se debe seguir es necesario considerar factores como el diagnóstico sindrómico inicial, la coinfección con otras ITS/ITG, la presencia de infección por VIH, la adherencia al tratamiento o la resistencia del agente etiológico al medicamento recomendado (4).
Por otra parte, existen complicaciones propias de la infección, algunas de ellas relacionadas con el medicamento aplicado. Una de las reacciones más frecuentes es la de Jarisch-Herxheimer, manifestación aguda de tipo febril acompañada por cefalea, mialgia o fiebre posterior a las 24 horas de inicio del tratamiento para sífilis. Se ha reportado una incidencia de 50% en los pacientes con sífilis primaria tratados con penicilina G con resolución del cuadro dentro de las 12-24 horas posteriores a su aparición (92). Las recurrencias también pueden incluirse en las complicaciones; estas son relativamente frecuentes en las infecciones por VHS, el cual puede tratarse de manera exitosa por medio de la terapia antiviral supresora antes descrita (93). Por último, algunos síntomas como la presencia de bubones en la infección por chancroide o por linfogranuloma venéreo pueden requerir un manejo adicional al farmacológico para prevenir las complicaciones derivadas de la linfadenopatía (94, 95).
24. ¿Cual es el seguimiento de pacientes con síndrome de úlcera genital?

El seguimiento óptimo de los pacientes con infecciones que cursan con úlceras genitales permanece como un aspecto clínico basado en opiniones de expertos más que en estudios clínicos. En el manejo sindrómico de la úlcera este aspecto presenta un reto a los clínicos atendiendo a las dificultades del seguimiento de estos pacientes, las oportunidades para el mismo y las barreras de acceso. El grupo de expertos consideró que para el manejo sindrómico de la úlcera genital -el cual debe tener en cuenta un número considerable de infecciones de diferente etiología- era deseable el examen clínico del paciente al menos a las dos semanas de administración del tratamiento recomendado a fin de revisar la efectividad del mismo y tomar decisiones clínicas adecuadas en cada caso en ausencia de mejoría (Nivel de evidencia: muy bajo).
25. ¿Cuál es el tratamiento de la pareja con síndrome de úlcera genital?

Tratamiento del compañero. Dos GPC de reciente aparición coinciden en la necesidad de la evaluación de los compañeros sexuales del paciente con alguna de las infecciones incluida en el síndrome de úlcera genital (4, 9). Esta valoración ayudará a revisar los signos y síntomas, y a determinar el tratamiento. En el caso de linfogranuloma venéreo, chancroide, granuloma inguinal y sífilis, las GPC coinciden en que el tratamiento debe hacerse en todos los casos, aun en ausencia de síntomas. En el caso de infecciones por herpes se promueve la valoración de la pareja pero el tratamiento queda como prioritario solamente para el paciente con síntomas (Nivel de evidencia: muy bajo).
La RS sobre métodos de notificación al compañero mostró un ECA en pacientes con sífilis en el cual el método de referencia por contrato logró localizar más compañeros que el método de referencia por el proveedor (diferencia de medias = 2,2; IC 95%: 1,95-2,45), pero el grupo de compañeros que recibió tratamiento fue igual en ambos grupos (46) (Nivel de evidencia: moderado).
26. ¿Cuál es el tratamiento del síndrome de úlcera genital en pacientes embarazadas o en lactancia?

Tratamiento de la sífilis temprana en la mujer embarazada. Una revisión sistemática de estudios observacionales (AMSTAR: 6/11) que incluye estudios en gestantes referentes al tamizaje y tratamiento de la sífilis activa con penicilina benzatínica, 2.400.000 UI en diferentes países, con una heterogeneidad moderada, mostró reducción en el riesgo de sífilis congénita (RR = 0,03; IC 95%: 0,02-0,07), mortinatos (RR = 0,18; IC 95%: 0,10-0,33), de parto pretérmino (RR = 0,36; IC 95%: 0,27-0,47) y muerte neonatal (RR = 0,20; IC 95%: 0,13-0,32) (96) (Nivel de evidencia: bajo).
Se realizó una revisión sistemática (AMSTAR: 9/11) que evalúa la efectividad AB en sífilis durante el embarazo (97). Si bien se localizan 29 estudios, estos no cumplen con criterios de calidad y diseño para ser considerados candidatos para la revisión.
Tratamiento del chancroide. No se encuentra evidencia de tratamiento de chancroide en mujeres embarazadas, solo se dispone información indirecta de efectividad en otras poblaciones con limitada validez externa; tampoco se encuentra evidencia de tratamiento de linfogranuloma venéreo o del granuloma inguinal en mujeres embarazadas o en lactancia; solo hay certeza acerca del tratamiento de la entidad en mujeres no embarazadas. La “Guía canadiense” (9) recomienda el uso de eritromicina para el tratamiento de la mujer gestante LGV. Sin embargo. nuestros expertos priorizaron la azitromcina para favorecer la adherencia (Nivel de evidencia: muy bajo).
27. ¿Cuál es el manejo de la mujer gestante o en lactancia con primer episodio de infección genital (sospecha) por el virus del herpes simple tipo 1 o 2?
No se encuentra evidencia de tratamiento del VHS en mujeres embarazadas, solo se dispone de la información antes mencionada de efectividad en mujeres no embarazadas con limitada validez externa (Nivel de evidencia muy: bajo).
28. ¿Cuáles son las complicaciones más frecuentes que se presentan en la mujer embarazada con síndrome de úlcera genital?
Adicional a las complicaciones mencionadas, las complicaciones más frecuentes para la mujer gestante con úlcera genital se relacionan con el trabajo de parto y el recién nacido (98). Las complicaciones asociadas a los medicamentos administrados para el tratamiento de los diferentes agentes infecciosos no han sido plenamente establecidas. Se conoce que en la sífilis materna algunas reacciones como Jarisch-Herxheimer afectan hasta un 40% de las gestantes y están asociadas con la aparición de contracciones uterinas, parto pretérmino y desaceleraciones de la frecuencia cardiaca fetal, sin haberse reportado incidentes mayores en su resolución. El acetaminofén ha mostrado ser de utilidad para el manejo del dolor y la fiebre asociados a dicha reacción (98).
La transmisión de la infección al feto durante la gestación o en el trabajo de parto puede representar una alta carga de morbilidad y mortalidad para el recién nacido. La sífilis congénita se encuentra dentro de tales condiciones, siendo esta una infección multiorgánica con alto impacto a nivel neurológico, esquelético, e incluso en la sobrevida del recién nacido (99). Se conoce que el tamizaje de la condición y el oportuno tratamiento de la gestante evitan efectivamente esta transmisión (96). Asimismo, el herpes neonatal representa una complicación similar especialmente en el último trimestre del embarazo (100).
SÍNDROME DE FLUJO VAGINAL
29. ¿Cuáles son los agentes etiológicos asociados al síndrome de flujo vaginal?
En la mayoría de las pacientes con flujo vaginal este no corresponde a infecciones de transmisión sexual (5, 101). Las causas del síndrome de flujo vaginal son principalmente tres: vaginosis bacteriana, candidiasis y tricomoniasis. Se ha descrito que hay infección concomitante de vaginosis bacteriana y Candida albicans en un 7,5% de las pacientes (5). En pacientes con factores de alto riesgo para ITS también podrían ser agentes causales de flujo vaginal C. trachomatis y N. gonorroheae (5) (Nivel de evidencia: moderado).
30. ¿Cuáles son las manifestaciones clínicas de las ITS/ITG caracterizadas por síndrome de flujo vaginal?
Para el diagnóstico de las patologías asociadas al síndrome de flujo vaginal se han descrito varios signos y síntomas que incluyen descarga vaginal fétida la cual es más frecuente en la vaginosis bacteriana, flujo de color amarillo en la TV y prurito vaginal o vulvar, eritema vaginal o vulvar y disuria, estos últimos síntomas son más frecuentes en la candidiasis (8, 49). El manejo sindrómico inicial no incluye la realización de pruebas de laboratorio.
31. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de flujo vaginal?

Tratamiento del síndrome de flujo vaginal. Se encontró un experimento clínico controlado aleatorizado abierto que comparó el manejo sindrómico del flujo vaginal en unidosis (tinidazol + fluconazol) con el manejo sindrómico de duración convencional (metronidazol + clotrimazol). Este estudio reclutó mujeres en establecimientos de atención primaria de cuatro países de África Occidental, dentro de las cuales se incluyeron trabajadoras sexuales y pacientes con infección por VIH (la asignación aleatoria fue estratificada según si eran trabajadoras sexuales). Pérdidas en el seguimiento: 20%. No se encontraron diferencias estadísticamente significativas en la mejoría clínica reportada por las pacientes a los 14 días (66,3% frente a 63,9%; p = 0,26), así como en la mejoría clínica reportada a los 28 días (80,9% frente a 81,1%; p = 1,00). El análisis por subgrupos según el estatus de la infección por VIH no evidenció diferencias significativas en la mejoría clínica reportada a los 14 días entre los dos tratamientos, ni en pacientes seronegativos ni en pacientes infectados (102) (Nivel de evidencia: moderado).
A partir de los resultados del estudio -que sugieren que no hay diferencias entre el tratamiento de unidosis comparado con el tratamiento convencional- se sugiere el uso de unidosis por preferencias de los pacientes y la posibilidad de generar mejores tasa de adherencia y mayores facilidades para seguir el tratamiento en las poblaciones en desventaja, por ejemplo, al tener en cuenta que la actividad laboral y los ingresos de las trabajadoras sexuales se relacionan con la viabilidad de mantener una vida sexual activa. La vigencia de esta recomendación estará abierta hasta la próxima actualización de la GPC. Con el fin de mejorar la evidencia se requieren estudios que incluyan análisis de subgrupos específicamente para las trabajadoras sexuales y para otro tipo de poblaciones vulnerables.
Tratamiento de la vaginosis bacteriana. Un metaanálisis que incluyó 24 ensayos clínicos controlados con un total de 4422 participantes, con un puntaje AMSTAR 8/11 comparó varios tratamientos contra placebo y entre sí para falla clínica. El metronidazol tópico fue superior al placebo (RR = 0,59; IC 95%: 0,44-0,79). La clindamicina vaginal fue superior al placebo (RR = 0,19; IC 95%: 0,09-0,41). Al comparar metronidazol y clindamicina se encontró igual porcentaje de falla clínica a los 7 días (RR = 1,06; IC 95%: 0,64-1,75) y a los 28 días (RR = 0,97; IC 95%: 0,75-1,27). La combinación metronidazol más azitromicina comparado con metronidazol fue más efectiva para evitar falla clínica a los 7 días (RR = 0,65; IC 95%: 0,46-0,92) e igualmente efectiva a los 28 días (RR = 1,22; IC 95%: 0,82-1,83). Por otro lado, no se encontraron diferencias entre el tinidazol una dosis y el metronidazol 7 días de tratamiento en cuanto a falla clínica (RR = 0,38-1,73) o eventos adversos (RR = 0,62; IC 95%: 0,13-2,98). No hay diferencia en el porcentaje de discontinuación entre metronidazol y clindamicina (RR = 0,50; IC 95%: 0,17-1,47), ni en la tasa de eventos adversos (RR = 0,75; IC 95%: 0,54-1,05), como tampoco en la sobreinfección por cándida (RR = 1,11; IC 95%: 0,78-1,58). Los eventos adversos menores son menos frecuentes con clindamicina que con metronidazol (RR 0,27; IC 95%: 0,11-0,69). No hay evidencia suficiente para evaluar el beneficio de lactobacilos, triple sulfonamida en crema, polihexametilene biguanide en ducha, el peróxido de oxígeno o el cefadroxil (103). En un ECA no se encontraron diferencias entre secnidazol una dosis y el MTZ por 7 días para cura clínica (RR = 0,97; IC 95%: 0,88-1,08), o cura bacteriológica (RR = 1,03; IC 95%: 0,91-1,17) a los 28 días o eventos adversos (RR = 0,94; IC 95%:0,74 -1,14) (104) (Nivel de evidencia: moderado).
Tratamiento de la Trichomonas vaginalis. Se evaluó un metaanálisis que incluyó 54 ensayos clínicos controlados para un total 5201 pacientes, el cual comparó varios tratamientos frente a no tratamiento en términos de persistencia de la infección de 4 a 14 días, con puntaje AMSTAR 9/11. Se demostró una mayor cura parasitológica a favor del brazo de tratamiento con imidazoles que en el grupo de no tratamiento (RR = 0,50; IC 95%: 0,43-0,56). Además, se comparó el tratamiento corto frente al tratamiento largo con imidazoles en términos de no lograr la cura parasitológica, no hubo diferencias entre los dos esquemas (RR = 1,12; IC 95%: 0,58-2,16), con un seguimiento hasta de 35 días. Al comparar el tratamiento oral contra vaginal para lograr la cura parasitológica se demostró menor riesgo de persistencia de la infección a 21 días para la vía oral (RR = 0,20; IC 95%: 0,07-0,56). La comparación metronidazol frente a tinidazol demostró un mayor porcentaje de mejoría clínica a favor del tinidazol con un seguimiento de 3 a 21 días (RR = 3,81; IC 95%: 1,83-7,90) y de cura parasitológica (RR = 3,24; IC 95%: 1,66-6,32). El porcentaje de cualquier efecto adverso secundario a la terapia fue más frecuente con metronidazol que con tinidazol (RR = 1,65; IC 95%: 1,35-2,02). En cuanto a los eventos adversos se asociaron más al uso del metronidazol que al tinidazol (RR = 1,65; IC 95%: 135-202). Un importante número de estudios tienen un riesgo no claro de sesgos y hay alta heterogeneidad en algunas de las comparaciones (105) (Nivel de evidencia: bajo).
Tratamiento de la Candida albicans.En el manejo de la Candida albicans se evaluó una metaanálisis que incluyó 19 ensayos clínicos controlados para un total de 2579 pacientes, con un puntaje AMSTAR 9/11. No se encontraron diferencias estadísticamente significativas entre la terapia oral y vaginal (fluconazol frente a clotrimazol) con respecto a la frecuencia de cura microbiológica a corto plazo (RR = 1,02; IC 95%: 0,98-1,07) o largo plazo (RR = 1,01; IC 95%: 0,93-1,09), mejoría clínica a corto plazo (RR = 0,92; IC 95%: 0,81 -1,05) o largo plazo (RR = 1,00; IC 95%: 0,92-1,08). Solo dos ensayos clínicos de los 19 incluidos en esta revisión sistemática reportaron abandono de la terapia debido a la presencia de una reacción adversa al tratamiento, lo que correspondió a un caso para cada estudio (no especificado). Los autores de la revisión manifiestan que no es posible concluir sobre la seguridad en el tratamiento con la terapia oral o vaginal para la candidiasis no complicada. Los estudios incluidos tienen alto riesgo de sesgos por no claridad sobre el método de ocultamiento, pérdidas mayores al 20% y frecuente financiación por la industria (106) (Nivel de evidencia: bajo).
32. ¿Cuál es el seguimiento indicado para las pacientes con síndrome de flujo vaginal?

No es necesario realizar seguimiento de rutina a las pacientes con vaginosis bacteriana a menos que presenten recurrencia de la sintomatología o que se trate de pacientes embarazadas (4, 9).
La vaginitis por Trichomonas resistente al metronidazol es un problema emergente cuya incidencia aún no ha sido establecida (107). Sin embargo, la infección recurrente por Trichomonas vaginalis suele ser explicada por la reinfección a partir de una pareja sexual no tratada o bien, en menor medida, por una recaída; si se trata de un episodio de recaída, en la mayoría de los casos esta suele ser consecuencia de una terapia inadecuada y rara vez como resultado de la resistencia a la misma (107). Así pues, el tratamiento consiste en administrar metronidazol 500 mg vía oral dos veces al día por 7 días, o bien tinidazol 500 mg vía oral cada 12 horas por 7 días. Se debe tener en cuenta, por supuesto, el uso del preservativo durante la fase de tratamiento al tiempo que se garantiza el tratamiento adecuado de la pareja sexual. Es importante mencionar que el tinidazol tendría ventajas potenciales sobre el metronidazol al poseer una mayor potencia in vitro y un mayor tiempo de vida media con una menor frecuencia de efectos adversos (108) (Nivel de evidencia: muy bajo).
Se considera candidiasis vulvo-vaginal recurrente a la presencia de cuatro o más episodios en un periodo de 12 meses (9). La resistencia de la Candida albicans al fluconazol suele ser poco frecuente, con una prevalencia estimada hasta del 13% al interior de algunas poblaciones (109); sin embargo, estudios epidemiológicos recientes indican que las especies de Candida no albicans suele encontrarse en el 10 al 20% de las pacientes con candidiasis vulvo-vaginal recurrente y es bien conocido que la terapia antifúngica convencional no es efectiva contra estas especies (9); es por ello que el aislamiento y la identificación de la especie respectiva debe ser la regla en las pacientes con candidiasis vulvo-vaginal recurrente o persistente, con el ánimo de otorgar una terapia dirigida (9) (Nivel de evidencia: muy bajo).
33. ¿Cuál es la efectividad y seguridad del tratamiento del flujo vaginal persistente o recurrente?

Vaginosis bacteriana recurrente. Un solo ensayo clínico controlado multicéntrico evaluó en 112 pacientes la eficacia del metronidazol gel vaginal frente placebo en pacientes con vaginosis bacteriana recurrente, mostrando reducción en el riesgo al finalizar el tratamiento (RR = 0,43; IC 95%: 0,25-0,73) y a los 3 meses postratamiento (RR = 0,68; IC 95%: 0,49-0,93). Se encontró alto riesgo de sesgos e imprecisión (110) (Nivel de evidencia: bajo).
Candidiasis recurrente.Un ensayo clínico que incluyó 494 mujeres con candidiasis vaginal recurrente comprobada microbiológicamente comparó la terapia secuencial de fluconazol 150 mg semanal por 6 meses dosis con placebo. A los 6 meses el 90,8% los pacientes con fluconazol permanecieron libres de recurrencia en comparación con el 35,9% de las mujeres manejadas con placebo con un riesgo de recurrencia para el placebo (RR = 2,53; IC 95%: 2,02-3,17). El tiempo medio de recurrencia clínica después de la asignación fue de 10,2 meses en el grupo de fluconazol y 4,0 meses en el grupo placebo (p < 0,001) (111) (Nivel de evidencia: alto).
Otro ensayo clínico evaluó la efectividad de la terapia intermitente mensual posmenstrual de clortrimazol 500 mg intravaginal comparada con placebo en 62 pacientes y encontró una menor frecuencia acumulada de candidiasis vaginal durante los 6 meses de duración de la terapia (profilaxis 30,3% frente a placebo 79,35%, p < 0,001). Este estudio tiene alto riesgo de sesgos y poca precisión (112) (Nivel de evidencia: bajo).
34. ¿Cuál es la efectividad y seguridad del tratamiento de la pareja de la paciente con síndrome de flujo vaginal?

No se encontraron revisiones sistemáticas que evaluaran la efectividad del tratamiento del compañero sexual de la paciente con infección por Trichomonas vaginalis o candidiasis vaginal.
Tratamiento del compañero de la paciente con Trichomonas. Se encontró un ensayo clínico controlado para el tratamiento del compañero sexual de 137 mujeres con Trichomonas vaginalis que comparó la administración de tinidazol frente al placebo. Se demostró que el tinidazol fue más efectivo en reducir la persistencia o recurrencia de la infección en el caso índice a los 30 días (RR = 4,66; IC 95%: 1,41-15,39) (113). Estudio con bajo riesgo de sesgos y buena precisión. La RS sobre estrategias de notificación al compañero mostró que el tratamiento expedito incrementó el número de pacientes tratados comparado con el método de referencia en pacientes con trichomonas (diferencia de medias = 0,51; IC 95%: 0,35-0,67) (46) (Nivel de evidencia: moderado).
Tratamiento del compañero de la paciente con candida. Se encontró un ensayo clínico controlado que comparó el tratamiento con itraconazol frente al no tratamiento en el compañero sexual de la paciente con candidiasis, que incluyó un total de 39 pacientes. No se encontraron diferencias estadísticamente significativas en términos de cura microbiológica en el caso índice a los 7 días (RR = 1,40; IC 95%: 0,36-5,46), a los 30 días (RR = 2,26; IC 95%: 0,22-22,55) ni tampoco en términos de mejoría clínica de 7 a 30 días (RR = 1,95; IC 95%: 0,61-6,13) (114) (Nivel de evidencia: alto).
Tratamiento del compañero de la paciente con VB. Una revisión sistemática de la literatura que incluyó seis estudios, con puntaje AMSTAR 4/11, evaluó el efecto del tratamiento en la recurrencia de la VB. Todos los estudios incluidos informan que no hay beneficio del tratamiento del compañero de las pacientes con VB; sin embargo, los estudios tienen importante riesgo de sesgos y precisión. Concluyen que no hay evidencia que soporte cualquier recomendación al respecto (115).
35. ¿Cuál es la efectividad y seguridad del tratamiento de la paciente embarazada o en lactancia con síndrome de flujo vaginal?
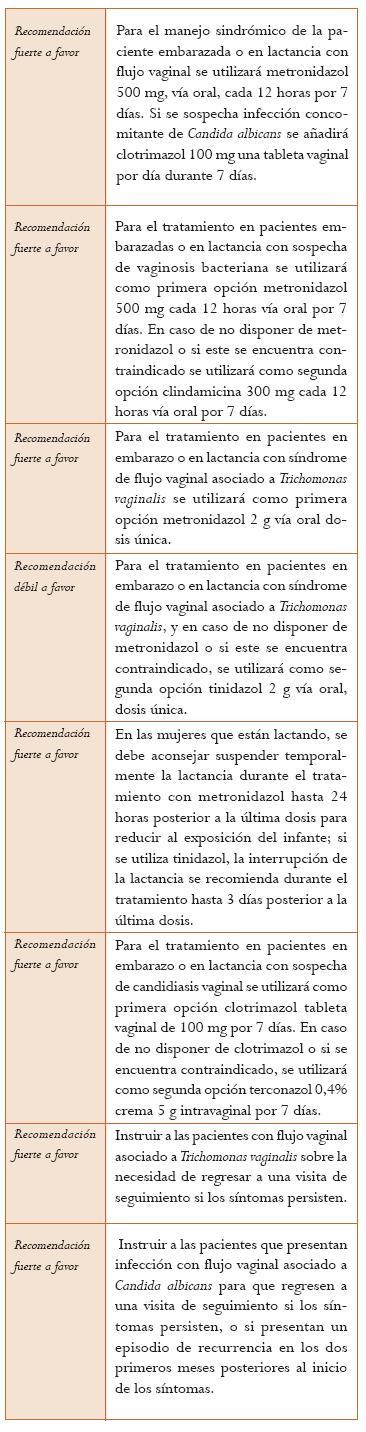
Tratamiento de la VB en la mujer gestante. Se encontró un metaanálisis que incluyo 15 ensayos clínicos controlados y un total de 5888 participantes, con puntaje AMSTAR: 8/11. La terapia antibiótica (amoxacilina o clindamicina o metronidazol) fue efectiva para erradicar la vaginosis bacteriana en mujeres embarazadas en comparación con el placebo (OR = 0,17; IC 95%: 0,15-0,20). El tratamiento no reduce el riesgo de parto pretérmino menor a 37 semanas (OR = 0,91; IC 95%: 0,78-1,06), ruptura prematura de membranas antes del trabajo de parto (OR = 0,88; IC 95%: 0,61-1,28), a su vez, no reduce el riesgo de infección puerperal (OR = 0,67; IC 95%: 0,39, 1,17) ni disminuye la frecuencia de bajo peso al nacer (OR = 0,95; IC 95%: 0,77-1,17) o sepsis neonatal (OR = 1,4; 0,45-4,36). El estudio muestra que los antibióticos orales son efectivos para reducir la falla terapéutica (OR = 0,15; IC 95%: 0,13-0,17) al igual la clindamicina vaginal (OR = 0,27; IC 95%: 0,21-0,35). El tratamiento temprano, antes de las 20 semanas, tiene un efecto benéfico en reducir el riesgo de parto pretérmino antes de las 37 semanas (OR = 0,72; IC 95%: 0,55-0,95) y en bajo peso al nacer (OR = 0,31; IC 95%: 0,13-0,57). El estudio no encontró diferencia en el porcentaje de eventos adversos serios que obliguen a interrumpir el embarazo o eventos adversos no serios. Hay alta heterogeneidad en algunas de las comparaciones de esta RS (116). Un metaanálisis publicado posteriormente a dicha revisión sistemática muestra resultados similares (117) (Nivel de evidencia: moderado).
Tratamiento de la infección por Trichomonas vaginalis en la mujer gestante. Se evaluó una revisión sistemática de la literatura con un total de 842 pacientes, puntaje AMSTAR 10/11, que incluyó dos ensayos clínicos controlados, uno de los cuales fue realizado en un país en vía de desarrollo con mujeres sintomáticas y asintomáticas. Comparó tratamiento frente a no tratamiento y demostró una menor persistencia de la infección en el grupo tratado (RR = 0,11; IC 95%: 0,08-0,17) los estudios incluidos tienen alto riesgo de sesgos (118) (Nivel de evidencia: moderado).
Seguridad del uso de metronidazol en el embarazo. Se encontró otra revisión sistemática de la literatura que incluyó cinco estudios observacionales (cuatro estudios de cohorte y un estudio de casos y controles) para un total de 199.451 gestaciones, con puntaje AMSTAR 6/11, que comparó el riesgo de malformaciones congénitas en las gestaciones expuestas a metronidazol durante el primer trimestre. Se demostró que el tratamiento con metronidazol no incrementa la frecuencia de cualquier malformación congénita diagnosticada al momento del nacimiento (OR = 1,08; IC 95%: 0,90-1,29) (119) (Nivel de evidencia: muy bajo).
No existen estudios que evalúen la seguridad del uso del tinidazol durante la gestación (Nivel de evidencia: muy bajo).
Tratamiento de la infección por Candida en la mujer gestante. Se evaluó un metaanálisis que incluyó 10 ensayos clínicos controlados para un total 830 pacientes, con puntaje AMSTAR 9/11. Se demostró que el clotrimazol, el terconazol y el miconazol fueron más efectivos que la nistatina en prevenir la infección vaginal persistente (RR = 0,32; IC 95%: 0,25-0,41). Asimismo, el clotrimazol fue más efectivo que el placebo en erradicar la infección (RR = 0,2; IC 95%: 0,09-0,45); dos ensayos clínicos controlados incluidos en esta revisión, con un total de 81 gestantes, demostraron que la terapia por cuatro días se asoció a una mayor persistencia de la infección comparada con siete días de tratamiento (RR = 20,48; IC 95%: 2,89-145,19), pero que siete días de tratamiento no fueron más o menos efectivos que catorce días de terapia (RR = 0,54; IC 95%: 0,29-1,01). El terconazol fue tan efectivo como el clotrimazol (RR = 1,33; IC 95%: 0,34-5,16) (120). Esta revisión incluye ECA con alto riesgo de sesgos y alta imprecisión para algunos desenlaces (Nivel de evidencia: bajo).
36. ¿Cuáles son las complicaciones más frecuentes que se presentan en la paciente embarazada o en lactancia con síndrome de flujo vaginal?
Vaginosis bacteriana. En las pacientes embarazadas, las complicaciones asociadas a la vaginosis bacteriana que se han descrito son: parto pretérmino, corioamnionitis, endometritis y ruptura prematura de membranas (4, 9). Sin embargo, existe evidencia contradictoria sobre el verdadero beneficio de tratar a las pacientes embarazadas con vaginosis bacteriana con respecto a los desenlaces mencionados anteriormente. Según lo reportado en la literatura, el único beneficio que se ha podido establecer es el alivio de signos y síntomas relacionados con la infección (4). Adicionalmente se ha demostrado el beneficio de tratar a las pacientes gestantes con vaginosis que tienen un antecedente de parto pretérmino. En este caso, el tratamiento disminuiría el riesgo de parto pretérmino, bajo peso al nacer y ruptura prematura de membranas (9). Otras complicaciones pueden derivarse del tratamiento instaurado. Si bien el metronidazol y la clindamicina no están contraindicados durante la gestación (9), es conocido que la administración de clindamicina vaginal luego de la semana 20 del embarazo está asociada con desenlaces negativos para el neonato (4, 9).
Trichomonas vaginalis. La infección por Trichomonas vaginalis ha sido asociada con resultado perinatal adverso particularmente con la presencia de ruptura prematura de membranas, parto pretérmino (OR = 1,3; 95%: IC 95%: 1,1-1,4), bajo peso al nacer (OR = 1,3; CI 95%: 1,1-1,5) (121) e infección neonatal (122); aun así, el tratamiento de la infección durante la gestación no ha demostrado reducir la morbilidad perinatal (4). Pese a que algunos ensayos sugieren un incremento en el riesgo de prematurez y bajo peso al nacer posterior al tratamiento con metronidazol, limitaciones metodológicas serias en estos estudios no permiten emitir conclusiones sólidas al respecto (4). Puesto que la Trichomonas vaginalis es una enfermedad de transmisión sexual con síntomas molestos y asociada a resultados adversos, incluyendo facilitar la transmisión por VIH, sería prudente tratar las mujeres con infección durante la gestación. Los clínicos deben aconsejar a sus pacientes con respecto a los riesgos y beneficios de la terapia (118).
Candida albicans. La candida suele habitar en áreas tibias del cuerpo como la boca, la vagina, el periné y la ingle. Su presencia habitualmente es inofensiva y asintomática y no existe evidencia que sugiera que la infección deba ser tratada en mujeres asintomáticas. Pese a la disponibilidad de tratamientos de dosis única, su seguridad y efectividad durante la gestación no ha sido confirmada, y aquellos estudios que han comprobado la efectividad de la terapia han demostrado la necesidad de ciclos largos de tratamiento (7 días) sin que cursos de tratamiento de mayor duración demuestren una mayor efectividad (120). Un estudio clínico evaluó las posibles repercusiones del aislamiento de cándida en la piel y sus repercusiones sobre la salud del neonato, sin que la importancia de esta contaminación sea en la actualidad completamente entendida. La candidiasis vulvo-vaginal durante la gestación no ha demostrado ser dañina para el feto (123).
SÍNDROME DE INFLAMACIÓN ESCROTAL
37. ¿Cuáles son los agentes etiológicos asociados al síndrome de inflamación escrotal?
En general se considera que la epididimitis es una complicación de la infección por C. trachomatis o N. gonorrhoeae, también es producida por organismos entéricos en sujetos que tienen sexo penetrativo anal en rol activo sin protección (9).
38. ¿Cuáles son las manifestaciones clínicas de las ITS/ITG caracterizadas por síndrome de inflamación escrotal?
El síndrome de inflamación escrotal incluye las manifestaciones de la epididimitis, patología que se caracteriza por tumefacción o dolor testicular unilateral, con o sin descarga uretral, y aumento de la temperatura local; estos pacientes pueden presentar eritema y edema de la piel escrotal (11). En algunos pacientes este cuadro no siempre está precedido por síntomas como disuria o descarga uretral, en algunos casos solo se ha demostrado un leve aumento de la presencia de polimorfonucleares en la secreción uretral (124)
39. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de inflamación escrotal?
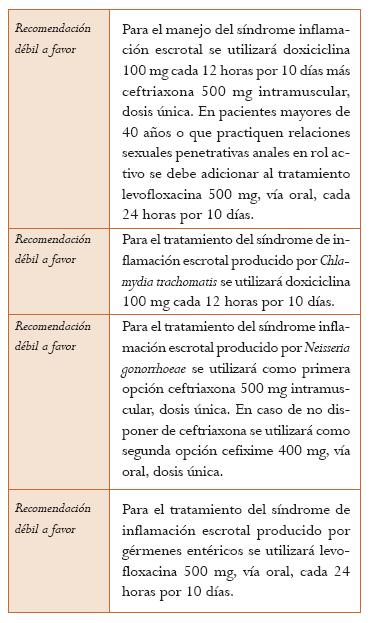
Por evidencia indirecta con otros estudios que analizan el uso de ceftriaxona comparado con otros antibióticos para el tratamiento de infecciones por Neisseria gonorrhoeae en síndromes similares se encontró efectivo el uso de ceftriaxona. En un ECA (59) se evaluó la cura microbiológica de pacientes con signos y síntomas de uretritis por NG, estos fueron asignados a uno de tres grupos de tratamiento: ciprofloxacina 500 mg dosis única, ceftriaxona 500 mg IV dosis única o espectinomicina 2 g IM dosis única. El porcentaje de eficacia clínica reportado fue de 90% en el grupo ceftriaxona, 80% en el grupo de ciprofloxacina y 94% en el grupo espectinomicina los cuales no cuentan con análisis estadístico posterior (Nivel de evidencia: muy bajo)
La evidencia para desarrollar recomendaciones es insuficiente, por tanto se acogieron las recomendaciones de la “Guía de infecciones de transmisión sexual” de la Agencia de Salud Canadiense y de la Guía del CDC de Atlanta (4, 9). Lo anterior fue sometido a un consenso de expertos temáticos (Nivel de evidencia: muy bajo).
Se debe anotar que una evolución tórpida del cuadro clínico, a pesar de un tratamiento adecuado, debe llevar al clínico a recurrir a diagnósticos diferenciales que cursan con signos y síntomas similares; tal es el caso de la torsión testicular la cual es una emergencia quirúrgica (125).
40. ¿Cuáles son las complicaciones más frecuentes que se presentan en el síndrome de inflamación escrotal?
El síndrome de inflamación escrotal se asocia con mayor frecuencia a la epididimitis crónica como complicación. Se han descrito otras complicaciones como dolor crónico e infertilidad pero la incidencia de estas patología es muy baja (126).
41. ¿Cuál es seguimiento indicado para los pacientes con síndrome de inflamación escrotal?

De acuerdo con el consenso de expertos se recomienda realizar seguimiento a las dos semanas del tratamiento (Nivel de evidencia: muy bajo).
42. ¿Cuál es la efectividad y seguridad del tratamiento para la pareja del paciente con síndrome de inflamación escrotal?

El grupo de expertos acogió las recomendaciones para el tratamiento del compañero sexual de pacientes con infección por NG y CT, así como la recomendación del tratamiento del compañero del sujeto con epididimitis por gram negativos (Nivel de evidencia: muy bajo).
SÍNDROME DE BUBÓN INGUINAL
43. ¿Cuáles son los agentes etiológicos asociados al síndrome de bubón inguinal?
El síndrome de bubón inguinal agrupa dos grandes patologías: el linfogranuloma venéreo y el cancroide (4). El primero es el resultado de la infección por los serovares L1, L2 o L3 de C. trachomatis, y el segundo es el resultado de la infección por H. ducreyi (95).
44. ¿Cuáles son las manifestaciones clínicas de las ITS/ITG caracterizadas con síndrome de bubón inguinal?
El cuadro típico es la presencia de una o más pápulas o úlceras en región inguinal, las cuales se acompañan de linfadenopatías unilaterales o bilaterales llamadas bubones (95).
En el caso del chancroide la úlcera se inicia como una pápula que evoluciona a una o más lesiones pustulares. La ruptura de las mismas genera ulceraciones dolorosas, con secreción purulenta y una base granulomatosa que puede o no presentar sangrado activo. La localización de las lesiones varía según el sexo del paciente, en hombres las lesiones se presentan a menudo en el prepucio, surco balanoprepucial y la base del pene. En mujeres, la lesión se localiza en los genitales externos y es poco frecuente encontrarla en la vaginal o en la región cervical (127). La linfadenitis dolorosa a nivel inguinal ocurre en el 30% de los pacientes con chancroide, se asocia a la sífilis pues simula esta infección en su fase de chancro blando; sin embargo, la úlcera del chancroide es dolorosa a diferencia del cuadro treponémico (9).
45. ¿Cuál es el tratamiento más efectivo y seguro del síndrome de bubón inguinal?

La evidencia para desarrollar recomendaciones es insuficiente, por tanto se acogieron las recomendaciones de la “Guía de infecciones de transmisión sexual” del CDC de Atlanta (4) y de la Agencia de Salud Canadiense (9) mediante un consenso de expertos temáticos (Nivel de evidencia: muy bajo).
46. ¿Cuáles son las complicaciones más frecuentes que se presentan en el síndrome de bubón inguinal?
La experiencia clínica señala que el linfogranuloma venéreo responde adecuadamente al tratamiento antibiótico, pero si este no es tratado oportunamente puede ocurrir una lesión extensa del tejido, llevando al desarrollo de abscesos complicados, fístulas crónicas y dolor pélvico-abdominal crónico (128). La proctitis por linfogranuloma venéreo es una complicación de la infección que ocurre en hombres y mujeres, puede presentarse con ulceraciones rectales, descarga anal sanguinolenta, fisuras anales y fístulas en región anal, lo que puede desencadenar síntomas constitucionales (129).
47. ¿Cuál es seguimiento indicado para los (las) pacientes con síndrome de bubón inguinal?

El panel de expertos recomendó realizar seguimiento a las dos semanas del tratamiento (Nivel de evidencia: muy bajo).
48. ¿Cuál es la efectividad y seguridad de dar tratamiento a la pareja del (de la) paciente con síndrome de bubón inguinal?

Esta recomendación se basa en la evidencia provista en el manejo sindrómico de la úlcera genital (Nivel de evidencia: muy bajo).
49. ¿Cuál es el tratamiento más efectivo y seguro de la paciente embarazada o en lactancia con síndrome de bubón inguinal?

Esta recomendación se basa en la evidencia provista en el manejo sindrómico de la úlcera genital en la mujer embarazada (Nivel de evidencia: muy bajo).
50. ¿Cuáles son las complicaciones más frecuentes que se presentan en la paciente embarazada con síndrome de bubón inguinal?
Es muy poco lo descrito en la literatura acerca de las complicaciones de la paciente gestante con síndrome de bubón inguinal, sin embargo, si se extrapolaran los datos obtenidos de infecciones por C. trachomatis, se tiene que las complicaciones se relacionan con ascenso de la infección hacia el útero y anexos, razón por la cual se desarrolla la enfermedad pélvica inflamatoria. Por otra parte, si se presenta transmisión vertical de la infección, el neonato puede desarrollar un cuadro oftalmológico (conjuntivitis) o pulmonar, en cualquiera de los dos casos se recomienda remitirse a la “Guía de control prenatal” (130).
INDICADORES DE AUDITORÍA
Los indicadores se muestran a continuación agrupados por el ente o los entes a cargo.
Ministerio de Salud
• El Ministerio de Salud deberá desarrollar un formulario de reporte, una base de datos y presentar informes del análisis de los datos recogidos.
• Disponibilidad de las pruebas rápidas para C. trachomatis y N. gonorrhoeae por institución y nivel de atención.
• Porcentajes de cepas resistentes a los antibióticos de las recomendaciones.
Secretarías de Salud
• Número de sujetos que recibieron actividades de promoción y prevención por institución.
• Número de actividades de capacitación a usuarios por organismo local o regional de salud.
• Número y tipo de diagnósticos sindrómicos reportados al sistema de vigilancia epidemiológica por institución.
• Disponibilidad de las pruebas rápidas para C. trachomatis y N. gonorrhoeae por institución y nivel de atención.
• Número de pacientes remitidos a los laboratorios de salud pública regionales o instituciones centinela por recurrencia para estudio etiológico y de resistencia.
• Porcentajes de cepas resistentes a los antibióticos de las recomendaciones.
IPS-EPS
• Disponibilidad de consulta de salud sexual y reproductiva en las instituciones (IPS ESE).
• Disponibilidad de consulta de infecciones del tracto genital en las instituciones (IPS ESE).
• Oportunidad de las citas en salud sexual y reproductiva.
• Oportunidad en las citas de las infecciones de transmisión sexual y otras infecciones del tracto genital.
• Número de actividades de capacitación a usuarios por institución.
• Disponibilidad de las pruebas rápidas para C. trachomatis y N. gonorrhoeae por institución y nivel de atención.
• Número de pacientes que recibieron los medicamentos para manejo sindrómico en la misma institución el mismo día de la consulta.
• Número de pacientes que recibieron los medicamentos para manejo de la pareja por tipo de manejo sindrómico (cuando se requiera), en la misma institución, el mismo día de la consulta.
• Número de tratamientos para la pareja que fueron negados por las EPS.
• Número de tratamientos para la pareja que fueron glosados por las EPS.
• Número de quejas por no disponibilidad del tratamiento de la (el) paciente o la pareja en entidades relacionadas con el manejo sindrómico de las infecciones de transmisión sexual.
• Número de pacientes remitidos a los laboratorios de salud pública regionales o instituciones centinela por recurrencia para estudio etiológico y de resistencia.
Pacientes
• Número de quejas por no disponibilidad del tratamiento de la (el) paciente o la pareja en entidades relacionadas con el manejo sindrómico de las infecciones de transmisión sexual.
ACTUALIZACIÓN DE LA GUÍA
Las recomendaciones de esta Guía deben actualizarse en los próximos tres años o previamente en caso de disponer de nuevas evidencias que modifiquen las recomendaciones aquí anotadas.
FUENTE DE FINANCIACIÓN
El desarrollo de la presente Guía ha sido financiado por el Ministerio de Salud y Protección Social y por colciencias, mediante contrato 159 de 2010 suscrito con la Universidad Nacional de Colombia, institución seleccionada entre quienes se presentaron a la Convocatoria 500 de 2009 para la elaboración de Guías de Atención Integral (GAI) en el Sistema General de Seguridad Social en Salud (sgsss). Esta Guía hace parte de un grupo de 25 GAI basadas en la evidencia que incorporan consideraciones económicas y para su implementación en el contexto del Sistema General de Seguridad Social en Salud colombiano, y que se desarrollaron por iniciativa del Ministerio de Salud y la Protección Social en temas prioritarios y de alta prevalencia en el país, mediante contrato otorgado a la Universidad Nacional de Colombia miembro de la Alianza CINETS.
DECLARACIÓN DE INDEPENDENCIA EDITORIAL
Las entidades financiadoras han brindado acompañamiento a la elaboración del presente documento garantizando con ello la transferibilidad y aplicabilidad de su contenido al contexto del SGSSS. El trabajo científico de investigación, así como la elaboración de las recomendaciones incluidas en el presente documento, fueron realizados de manera independiente por el Grupo Desarrollador de Guías de la Universidad Nacional de Colombia. Todos los miembros del Grupo Desarrollador, así como las personas que han participado tanto en la colaboración experta y en la revisión externa, han realizado la declaración de conflictos de interés.
Nota: este artículo hace parte de la versión completa de la “Guía de práctica clínica para el abordaje sindrómico del diagnóstico y tratamiento de los pacientes con infecciones de transmisión sexual y otras infecciones del tracto genital” (código ISBN 978-958-57937-1-2) y de la versión para profesionales de la misma guía (código ISBN 978-958-8838-12-0). Este documento es publicado con autorización de colciencias y del Ministerio de Salud y Protección Social.
* GRUPO DESARROLLADOR DE LA "GUÍA DE MANEJO SINDRÓMICO DE INFECCIONES DE TRANSMISIÓN SEXUAL Y OTRAS INFECCIONES DEL TRACTO GENITAL".
1 Hernando Guillermo Gaitán Duarte. MD, MSc. Especialista en Obstetricia y Ginecología. MSc en Epidemiología Clínica. Profesor Titular, Departamento de Obstetricia y Ginecología e Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional de Colombia. Coordinador editorial Grupo Cochrane de Infecciones de Transmisión Sexual. Bogotá, Colombia. Líder de la Guía. hggaitand@unal.edu.co
2 Andrea Esperanza Rodríguez-Hernández. MD, MSc. Médica cirujana. Especialista en Estadística Aplicada. Magíster en Epidemiología Clínica. Docente auxiliar de posgrado, Instituto de Investigaciones Clínicas, Universidad Nacional de Colombia. Coordinadora Metodológica de la Guía. Bogotá, Colombia.
3 Ingrid Arévalo-Rodríguez. PSc, Psicóloga. Magíster en Epidemiología Clínica, Universidad Nacional de Colombia. PhD (c) en Pediatría, Obstetricia y Ginecología, Medicina Preventiva y Salud Pública, Universidad Autónoma de Barcelona. Bogotá, Colombia.
4 Edith Ángel-Müller, MD. Médica cirujana. Especialista en Obstetricia y Ginecología. Fellow en Infectología Ginecoobstétrica y Perinatal. Profesora Asociada Departamento de Obstetricia y Ginecología, Universidad Nacional de Colombia. Representante de la Federación Colombiana de Asociaciones de Obstetricia y Ginecología. Miembro Comité Editorial Grupo Cochrane de Infecciones de Transmisión Sexual. Bogotá, Colombia.
5 Hugo Enrique López-Ramos, MD, MSc(c). Médico cirujano. Especialista en Urología. Candidato a magíster en Epidemiología Clínica. Miembro de Número de la Sociedad Colombiana de Urología. Representante de la Sociedad Colombiana de Urología en la elaboración de la Guía. Bogotá, Colombia.
6 Jesús Santiago Estrada-Mesa, MD. Médico cirujano. Especialista en Microbiología y Parasitología Médica. Director general Laboratorio Clínico Congregación Mariana, Fundación Santa María, Medellín, Colombia. Representante de la Asociación Colombiana de Infectología (ACIN). Medellin, Colombia.
7 Francisco Fernández-Rincón. Médico cirujano. Especialista en Computación para la docencia, Alcaldía de Villavicencio. Coordinador de Salud Sexual y Reproductiva de la Secretaría Local de Salud. Docente de la Facultad de Medicina, Universidad Cooperativa de Colombia. Experto en Atención Primaria. Villavicencio, Colombia. Villavicencio, Colombia.
8 Jimmy Castañeda-Castañeda. Médico cirujano. Especialista en Obstetricia y Ginecología. Profesor Universidad Militar Nueva Granada. Representante de la Federación Colombiana de Obstetricia y Ginecología. Bogotá, Colombia.
9 Edwar Eugenio Hernández-Vargas. Psicólogo. Secretario de la Red Interuniversitaria por la Diversidad de Identidades Sexuales (reddes). Afiliado a la Sociedad Colombiana de Sexología. Experto en Psicología. Bogotá, Colombia.
10 Carol Zussandy Páez-Canro. Médico cirujano. Candidata a Magíster en Epidemiología Clínica. Docente becaria del Instituto de Investigaciones Clínicas, Universidad Nacional de Colombia. Monitora de la Guía. Bogotá, Colombia.
11 Carlos Fernando Grillo-Ardila. Médico cirujano. Especialista en Obstetricia y Ginecología. Candidato a magíster en Epidemiología Clínica. Docente de Cátedra, Departamento de Ginecología y Obstetricia, Universidad Nacional de Colombia. Miembro del Comité Editorial Grupo Cochrane de Infecciones de Transmisión Sexual. Monitor de la Guía. Bogotá, Colombia.
12 Juan Manuel Reyes-Sánchez. Químico Farmacéutico. Candidato a magíster en Epidemiología Clínica. Docente becario del Instituto de Investigaciones Clínicas, Universidad Nacional de Colombia. Monitor de la Guía. Bogotá, Colombia.
13 Miguel Hernando Díaz-Ortega. Bacteriólogo y Laboratorista Clínico. Candidato a magíster en Epidemiología Clínica. Contratista de la Universidad Nacional de Colombia. Monitor de la Guía. Coordinador de búsquedas del Grupo Cochrane de Infecciones de Transmisión Sexual. Bogotá, Colombia.
14 Natalia Marcela Calderón Benítez. Enfermera Jefe. Magíster en Enfermería. Asesora Liga Colombiana de Lucha Contra el SIDA. Experta en Enfermería. Bogotá, Colombia.
15 Constanza Collazos-Vidal. Médico cirujano. Magíster en Epidemiología. Asesora externa, Subdirección Científica, Sociedad Colombiana de Anestesiología. Especialista en Investigación Cualitativa. Bogotá, Colombia.
AGRADECIMIENTOS
Ministerio de Salud y Protección Social
Isabel Cristina Idárraga Vásquez, consultora Estrategia Para La Eliminación de la Transmisión Materno-Infantil del VIH y la Sífilis Congénita, Dirección General de Salud Pública, Ministerio de Salud y Protección Social.
Johana Castrillón, Gestión de la Demanda, Ministerio de Salud y Protección Social.
Daniel M. García, unfpa, Ministerio de Salud y Protección Social.
Tevia Moreno, Observatorio de VIH, Ministerio de Salud y Protección Social
Instituto Nacional de Salud
Amparo Sabogal,Vigilancia y Control en Salud, Grupo ITS, Instituto Nacional de Salud.
Constanza Cuéllar, Vigilancia y Control en Salud, Grupo ITS, Instituto Nacional de Salud.
Rubén Robayo, Vigilancia y Control en Salud, Grupo ITS, Instituto Nacional de Salud.
Jeny Carolina Peralta, Vigilancia y Control en Salud, Grupo ITS, Instituto Nacional de Salud.
Lida Martínez, Vigilancia y Control en Salud, Grupo ITS, Instituto Nacional de Salud.
Secretaría Distrital de Salud - Bogotá
Manuel González, Odontólogo, magíster en Salud Pública, Grupo Técnico Salud Sexual y Reproductiva, Secretaría Distrital de Salud.
Blanca Lilia Méndez,Grupo Técnico Salud Sexual y Reproductiva, Secretaría Distrital de Salud.
Asociación Colombiana de Empresas de Medicina Integral (ACEMI)
Juan Manuel Díaz Granados, presidente Ejecutivo ACEMI
Asociación Nacional de Enfermeras de Colombia (ANEC)
Esperanza Morales Correa, enfermera Jefe, presidenta de la Asociación Nacional de Enfermeras ANEC.
Centro Internacional de Entrenamiento e Investigaciones Médicas (IDEIM)
Adriana Cruz, médica dermatóloga, Research Fellow en Inmunología. Coordinadora Investigación en Sífilis, Centro Internacional de Entrenamiento e Investigaciones Médicas (IDEIM), Cali, Colombia
Otros profesionales
Jorge Eliécer Duque Martínez, médico cirujano, magíster en Salud Pública (Unicáncer).
Mercy Yolima Martínez Velásquez, médica cirujana, especialista en Ginecología y Obstetricia, Ultrasonido Obstétrico, Clínica de Maternidad Saludcoop.
Nidia Patricia Espíndola, bibliotecóloga, coordinadora de Circulación y Préstamo, Biblioteca Pública Virgilio Barco.
Escuela de Estudios de Género - Universidad Nacional de Colombia
Florence Thomas, psicóloga, magister en Psicología Social, docente e Investigadora de la Escuela de Estudios Género, Universidad Nacional de Colombia
Juan Simbaqueba Vargas, psicólogo, magíster en Salud Pública, director de la Red Colombiana de Personas Viviendo con VIH.
Juanita María Barreto Gama, trabajadora social, magister en política Social. Docente e investigadora de la Escuela de Estudios Género, Universidad Nacional de Colombia.
Martha Clemencia Buriticá Céspedes, docente e investigadora de la Escuela de Estudios de Género, Universidad Nacional de Colombia
EQUIPO DE DIRECCIÓN
Director general
Rodrigo Pardo Turriago, médico cirujano, especialista en Neurología Clínica, magíster en Epidemiología Clínica. Profesor Asociado, Departamento de Medicina Interna e Instituto de Investigaciones Clínicas, Facultad de Medicina, Universidad Nacional de Colombia.
Coordinadora académica
Paola Andrea Mosquera Méndez, psicóloga, especialista en Epidemiología, magíster en Política Social, candidata a doctora en Salud Pública. Investigadora asociada, Instituto de Investigaciones Clínicas, Universidad Nacional de Colombia.
Coordinador de Guías
Edgar Cortés Reyes, fisioterapeuta-economista, magíster en Epidemiología Clínica. Profesor asociado, Departamento del Movimiento Corporal Humano e Instituto de Investigaciones Clínicas. Director del Departamento de Movimiento Corporal Humano, Facultad de Medicina, Universidad Nacional de Colombia.
Gerente administrativo
Ricardo Losada Sáenz, ingeniero industrial, magíster en Suficiencia Investigadora y magíster en Salud Pública. Anterior Gerente de la Federación Colombiana de Obstetricia y Ginecología.
Asesora
Beatriz Stella Jiménez Cendales, médico cirujano, especialista en Auditoría en Salud-Gerencia de IPS, magíster en Evaluación Tecnológica Médica Internacional, Investigador, Universidad Nacional de Colombia.
Documentalista
Miguel Hernando Díaz Ortega, bacteriólogo y laboratorista clínico, magíster en Epidemiología Clínica. Contratista de la Universidad Nacional de Colombia. Coordinador de búsquedas del Grupo Cochrane de Infecciones de Transmisión Sexual.
Asesores externos
Carlos Gómez Restrepo, médico psiquiatra, magíster en Epidemiologia Clínica. Profesor asociado Departamento de Epidemiología y Bioestadística, Pontificia Universidad Javeriana.
Paul Brown, economista, magíster en economía, doctor en Economía, professor, University of California, Merced, School of Social Sciences, Humanities and Arts.
Cindy Farqhuar, médica, especialista en Ginecoobstetricia, Subespecialista en Endocrinología Reproductiva e Infertilidad, Universidad de Auckland. Editora Grupo de Desórdenes Menstruales e Infertilidad, Cochrane.
Anne Lethaby, investigadora en Proyectos de Medicina Basada en la Evidencia, New Zealand Guidelines Group. Editora Grupo de Desórdenes Menstruales e Infertilidad, Cochrane.
Evaluación externa de la guía
Mario Tristán, médico epidemiólogo; director ihcai Foundation-Cochrane Central America & Caribbean Branch.
Sociedades científicas participantes
Federación Colombiana de Obstetricia y Ginecología (FECOLSOG)
Sociedad Colombiana de Urología (SCU)
Asociación Colombiana de Infectología (ACIN)
REFERENCIAS
1. Ministerio de Salud República de Colombia Resolución Número 412 de 2000. [ Links ]
2. OMS. Infecciones de trasmisión sexual y otras infecciones del tracto reproductivo. Una guía para la practica básica; 2005. [ Links ]
3. Ángel-Müller E, González MP, Núñez L, Pacheco J, Tolosa J E, Díaz LA, et al. Frecuencia de infecciones del tracto genital femenino en mujeres sintomáticas y uso de pruebas rápidas para su diagnóstico en dos poblaciones de Bogotá (Colombia) 2008: Estudio piloto. Rev Colomb Obstet Ginecol. 2010;61:220-30. [ Links ]
4. Workowski KA, Berman S. Centers for Disease Control and Prevention (CDC). Sexually transmitted diseases treatment guidelines. MMWR Recomm Rep. 2010;59:1-110. [ Links ]
5. Angel-Müller E, Rodriguez A, Nuñez- Forero L, Moyano Bohórquez LF, González MP, Osorio E, et al. Prevalencia de C. trachomatis, N. gonorrheae, T. Vaginalis, C. albicans, sífilis y Vaginosis bacteriana en mujeres con síntomas de infección vaginal en Bogotá, Colombia 2010. Rev Colomb Obstet Ginecol. 2012;63:14-24. [ Links ]
6. European STD guidelines European Branch of the International Union against Sexually Transmitted Infection and the European Office of the World Health Organization Int J STD AIDS. 2001;12(Suppl 3):1-94. [ Links ]
7. Eckert LO. Acute Vulvovaginitis. N Engl J Med. 2006;21:1244-52. [ Links ]
8. Guías para el tratamiento de las infecciones de transmisión sexual. Organización Mundial de la Salud; 2005 [visitado 2012 feb 15]. Disponible en: http://whqlibdoc.who.int/publications/2005/9243592653_spa.pdf [ Links ]
9. Canadian Guidelines on Sexually Transmitted Infections. Ottawa: Public Health Agency of Canada; 2010. [ Links ]
10. Gaitan H, Angel E, Diaz R, Parada A, Sanchez L, Vargas C. Accuracy of five different diagnostic techniques in mild-to-moderate pelvic inflammatory disease. Infect Dis Obstet Gynecol. 2002;10:171-80. [ Links ]
11. UnAIDS/WHO. Sexually transmitted diseases: policies and principles for prevention and care. UnAIDS Best Practice Collection Key Material Geneva: UnAIDS/ WHO; 1999. [ Links ]
12. Acosta JP, Rodriguez DCR. Situación de las infecciones de transmisión sexual, Colombia,1976-2000. Biomédica. 2002;22:77- 88. [ Links ]
13. Munoz N. Human papillomavirus and cancer: the epidemiological evidence. J Clin Virol. 2000;19:1-5. [ Links ]
14. Trei JS, Canas LC, Gould PL. Reproductive tract complications associated with Chlamydia trachomatis infection in US Air Force males within 4 years of testing. Sex Transm Dis. 2008;35:827-33. [ Links ]
15. Balshem H, Helfand M, Schunemann HJ, Oxman AD, Kunz R, Brozek J, et al. GRADE guidelines 3: rating the quality of evidence - introduction. J Clin Epidemiol. 2011;64:401-6. [ Links ]
16. Guyatt GH, Oxman AD, Kunz R, Falck-Ytter Y, Vist GE, Liberati A, Schünemann HJ, GRADE Working Group. Going from evidence to recommendations. BMJ. 2008;336:1049-51. [ Links ]
17. Kamali A, Quigley M, Nakiyingi J, Kinsman J, Kengeya-Kayondo J, Gopal R, Ojwiya A. Syndromic management of sexually-transmitted infections and behaviour change interventions on transmission of HIV-1 in rural Uganda: a community randomised trial. Lancet. 2003;36:645-52. [ Links ]
18. Grosskurth HMF, Todd J, Mwijarubi E, Klokke A, Senkoro K, Mayaud P, et al. Impact of improved treatment of sexually transmitted diseases on HIV infection in rural Tanzania: randomised controlled trial. Lancet. 1995;346:530-6. [ Links ]
19. Ng B, Butler L, Horvath T, Rutherford G. Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection. Cochrane Database of Systematic Reviews. 2011(Issue 3. Art. No.: CD001220. DOI:10.1002/14651858.CD001220.pub3). [ Links ]
20. NIAID. Workshop summary: scientific evidence on condom effectiveness for sexually transmitted disease (STD) prevention. 2001 Disponible en: www.niaid.nih.gov/about/organization/dmid/documents/condomreport.pdf. [ Links ]
21. Macaluso M, Blackwell R, Jamieson D. Efficacy of the male latex condom and of the female polyurethane condom as barriers to semen during intercourse: a randomized clinical trial. Am J Epidemiol. 2007:88-96. [ Links ]
22. Wilkinson DRG, Tholandi M, Rutherford GW. Nonoxynol-9 for preventing vaginal acquisition of sexually transmitted infections by women from men. Cochrane Database of Systematic Reviews. 2002 (Issue 1. Art. No.: CD003939. DOI:10.1002/14651858.CD003939. [ Links ]).
23. Camejo MDM. Prevalencia de hepatitis B, hepatitis C y sífilis en trabajadoras sexuales de Venezuela / Prevalence of hepatitis B, hepatitis C and syphilis in female sex workers in Venezuela. Rev saúde pública. 2003;37:339-44. [ Links ]
24. Chin H, Sipe TA, Elder R, Mercer SL, Chattopadhyay SK, Jacob V, et al. Community Preventive Services Task Force. The effectiveness of group-based comprehensive risk-reduction and abstinence education interventions to prevent or reduce the risk of adolescent pregnancy, human immunodeficiency virus, and sexually transmitted infections: two systematic reviews for the Guide to Community Preventive Services. Am J Prev Med. 2012;42:272-94. [ Links ]
25. Baeten JM, Nyange PM, Richardson BA, Lavreys L, Chohan B, Martin HL, et al. Hormonal contraception and risk of sexually transmitted disease acquisition: Results from a prospective study. Am J Obstet Gynecol. 2001;185:380-5. [ Links ]
26. Beigi RH, Meyn LA, Moore DM, Krohn Ma, Hillier SL. Vaginal yeast colonization in nonpregnant women: a longitudinal study. Obstet Gynecol. 2004;104:926-30. [ Links ]
27. Cherpes TL, Meyn La, Krohn Ma, Lurie JG, Hillier SL. Association between acquisition of herpes simplex virus type 2 in women and bacterial vaginosis. Clin Infect Dis. 2003;37:319-25. [ Links ]
28. Crosby Ra, DiClemente RJ, Wingood GM, Salazar LF, Rose E, Levine D, et al. Associations Between Sexually Transmitted Disease Diagnosis and Subsequent Sexual Risk and Sexually Transmitted Disease Incidence Among Adolescents. Sex Transm Dis. 2004;31:205-8. [ Links ]
29. DiClemente RJ, Crosby RA, Wingood GM, Lang DL, Salazar LF, Broadwell SD. Reducing risk exposures to zero and not having multiple partners: findings that inform evidence-based practices designed to prevent STD acquisition. International journal of STD & AIDS. 2005;16:816-8. [ Links ]
30. Ford CA, Pence BW, Miller WC, Resnick MD. Predicting Adolescents' Longitudinal Risk for Sexually Transmitted Infection. Archives of Pediatrics. 2005;159:657-64. [ Links ]
31. Fortenberry JD, Brizendine EJ, Katz BP, Wools KK, Blythe MJ, Orr DP. Subsequent sexually transmitted infections among adolescent women with genital infection due to Chlamydia trachomatis, Neisseria gonorrhoeae, or Trichomonas vaginalis. Sex Transm Dis. 1999;26:26-32. [ Links ]
32. Gallo MF, Warner L, Macaluso M, Stone KM, Brill I, Fleenor ME, et al. Risk factors for incident herpes simplex type 2 virus infection among women attending a sexually transmitted disease clinic. Sex Transm Dis. 2008;35:679-85. [ Links ]
33. Helms DJ, Mosure DJ, Metcalf Ca, Douglas JM, Malotte CK, Paul SM, et al. Risk factors for prevalent and incident Trichomonas vaginalis among women attending three sexually transmitted disease clinics. Sex Transm Dis. 2008;35:484-8. [ Links ]
34. Niccolai LM, Kopicko JJ, Kassie A, Petros H, Clark RA, Kissinger P. Incidence and predictors of reinfection with Trichomonas vaginalis in HIV-infected women. Sex Transm Dis. 2000;27:284-8. [ Links ]
35. Moss NJ, Harper CC, Ahrens K, Scott K, Kao S, Padian N, et al. Predictors of incident herpes simplex virus type 2 infections in young women at risk for unintended pregnancy in San Francisco. BMC Infect Dis. 2007;7:113. [ Links ]
36. Fleming DT, Levine WC, Trees DL, Tambe P, Toomey K, St Louis ME. Syphilis in Atlanta during an era of declining incidence. Sex Transm Dis. 2000;27:68-73. [ Links ]
37. Gottlieb SL, Douglas JM, Foster M, Schmid DS, Newman DR, Baron AE, et al. Incidence of herpes simplex virus type 2 infection in 5 sexually transmitted disease (STD) clinics and the effect of HIV/STD risk-reduction counseling. The Journal of infectious diseases. 2004;190:1059-67. [ Links ]
38. Ko NY, Liu HY, Lee HC, Lai YY, Chang CM, Lee NY, et al. One-year follow-up of relapse to risky behaviors and incidence of syphilis among patients enrolled in the HIV case management program. AIDS and behavior. 2011;15:1067-74. [ Links ]
39. Thurnheer MC, Weber R, Toutous-Trellu L, Cavassini M, Elzi L, Schmid P, et al. Occurrence, risk factors, diagnosis and treatment of syphilis in the prospective observational Swiss HIV Cohort Study. AIDS (London, England). 2010;24:1907-16. [ Links ]
40. Rich JD, Hou JC, Charuvastra A, Towe CW, Lally M, Spaulding A, et al. Risk factors for syphilis among incarcerated women in Rhode Island. AIDS Patient Care STDS. 2001;15:581-5. [ Links ]
41. Todd J, Munguti K, Grosskurth H, Mngara J, Changalucha J, Mayaud P, et al. Risk factors for active syphilis and TPHA seroconversion in a rural African population. Sexually transmitted infections. 2001;77:37-45. [ Links ]
42. Xu J-J, Zhang M, Brown K, Reilly K, Wang H, Hu Q, et al. Syphilis and HIV seroconversion among a 12-month prospective cohort of men who have sex with men in Shenyang, China. Sexually transmitted diseases. 2010;37:432-9. [ Links ]
43. Sahlu T, de Wit TR, Tsegaye a, Mekonnen Y, Beyene A, Hailu B, et al. Low incidence of syphilis among factory workers in Ethiopia: effect of an intervention based on education and counselling. Sexually transmitted infections. 2002;78:123-6. [ Links ]
44. Zhou H, Chen XS, Hong FC, Pan P, Yang F, Cai YM, et al. Risk factors for syphilis infection among pregnant women: results of a case-control study in Shenzhen, China. Sexually transmitted infections. 2007;83:476-80. [ Links ]
45. Radcliffe KW, Ahmad S, Gilleran G, Ross JD. Demographic and behavioural profile of adults infected with chlamydia: a case-control study. Sexually transmitted infections. 2001;77:265-70. [ Links ]
46. Ferreira A, Young T, Mathews C, Zunza M, Low N. Strategies for partner notification for sexually transmitted infections, including HIV. Cochrane Database of Systematic Reviews; 2013. Pub ahead of print. [ Links ]
47. Bignell C, Fitzgerald M, Group GD, UK BAfSHaH. UK national guideline for the management of gonorrhoea in adults, 2011. Int J STD AIDS. 2011;22:541-7. [ Links ]
48. Carey AJ, Beagley KW. Chlamydia trachomatis, a hidden epidemic: effects on female reproduction and options for treatment. Am J Reprod Immunol. 2010;63:576-86. [ Links ]
49. Tolosa JE, Rodríguez AE, Müller EA, Ruiz-Parra AI, Núñez-forero L, Moyano LF, Gaitán-Duarte H. Accuracy of syndromic diagnosis and management of vaginal discharge and cervicitis in women of reproductive age in Bogotá, Colombia. Int J Gynecol Obstet. 2012;119(S3):S729. [ Links ] BN00207292.
50. Núñez-Forero, Moyano LF, Angel-Müller E, Rodríguez A, Ruiz-Parra AI, Tolosa JE, Gaitán-Duarte H. Diagnostic accuracy of rapid tests for C. Trachomatis, N. Gonorrhoeae and Syphilis at the point of care in women with symptoms of lower genital tract infection Int J Gynecol Obstet. 2012;119(S3):S350. [ Links ]
51. Van der Helm JJ, Sabajo LO, Grunberg AW, Morré SA, Speksnijder AG, de Vries HJ. Point-of-care test for detection of urogenital chlamydia in women shows low sensitivity. A performance evaluation study in two clinics in Suriname. PLoS One. 2012;7:e32122. [ Links ] doi: 10.1371/journal.pone.0032122.
52. Van Dommelen L, van Tiel FH, Ouburg S, Brouwers EE, Terporten PH, Savelkoul PH, Morré SA, Bruggeman CA, Hoebe CJ. Alarmingly poor performance in Chlamydia trachomatis point-of-care testing. Sex Transm Infect. 2010;86:355-9. [ Links ]
53. Yin YP, Peeling RW, Chen XS, Gong KL, Zhou H, Gu WM, et al. Clinic-based evaluation of Clearview Chlamydia MF for detection of Chlamydia trachomatis in vaginal and cervical specimens from women at high risk in China. Sex Transm Infect. 2006;82:v33-7. [ Links ]
54. Díaz-Rojas J, García-Molina M, Chicaíza-Becerra L, Moreno-Calderón A, Prieto- Martínez V, Gaitán-Duarte H, et al. Costo-efectividad del diagnóstico etiológico con pruebas rápidas vs. síndromico en mujeres no gestantes con síntomas de infección cervical. Cuadernos de economía. 2012;39:2-48. [ Links ]
55. Lau C, Qureshi A. Azithromycin versus doxycycline for genital chlamydial infections: a meta-analysis of randomized clinical trials. Sex Transm Dis. 2002;29:497-502. [ Links ]
56. Sendag F, Terek C, Tuncay G, Ozkinay E, Güven M. Single dose oral azithromycin versus seven day doxycycline in the treatment of non-gonococcal mucopurulent endocervicitis. Aust N Z J Obstet Gynaecol. 2000;40:44-7. [ Links ]
57. Guven MA, Gunyeli I, Dogan M, Ciragil P, Bakaris S, Gul M. The demographic and behavioural profile of women with cervicitis infected with Chlamydia trachomatis, Mycoplasma hominis and Ureaplasma urealyticum and the comparison of two medical regimens. Arch Gynecol Obstet. 2005;272:197-200. [ Links ]
58. Rustomjee R, Kharsany A, Connolly C, Karim S. A randomized controlled trial of azithromycin versus doxycycline/ciprofloxacin for the syndromic management of sexually transmitted infections in a resource-poor setting. J Antimicrob Chemother. 2002;49:875-8. [ Links ]
59. Shams-ur-Rehman, Khan A, Amanullah, Akhter K. Clinical efficacy of the various drugs used in the treatment of gonorrhoeae. J Ayub Med Coll Abbottabad. 2009;21:28-30. [ Links ]
60. Ness RB, Soper DE, Richter HE, Randall H, Peipert JF, Nelson DB, et al. Chlamydia antibodies, chlamydia heat shock protein, and adverse sequelae after pelvic inflammatory disease: the PID Evaluation and Clinical Health (PEACH) Study. Sex Transm Dis. 2008;35:129-35. [ Links ]
61. Paavonen J. Pelvic inflammatory disease. From diagnosis to prevention. Dermatol Clin. 1998;16:747-56. [ Links ]
62. Haggerty CL, Gottlieb SL, Taylor BD, Low N, Xu F, Ness RB. Risk of sequelae after Chlamydia trachomatis genital infection in women. J Infect Dis. 2010;201(Suppl2):S134-55. [ Links ]
63. Brocklehurst P, Rooney G. Interventions for treating genital Chlamydia trachomatis infection in pregnancy Cochrane Database Syst Rev. 2000;2:CD000054. [ Links ]
64. Brocklehurst P. Antibiotics for gonorrhoea in pregnancy. Cochrane Database Syst Rev. 2002;2:CD000098. [ Links ]
65. Cavenee MR, Farris JR, Spalding TR, Barnes DL, Castaneda YS, Wendel GD. Treatment of gonorrhea in pregnancy. Obstet Gynecol. 1993;81:33-8. [ Links ]
66. Hammerschlag MR. Chlamydial and gonococcal infections in infants and children. Clin Infect Dis. 2011;53(Suppl 3):S99-102. [ Links ]
67. de Barbeyrac B, Papaxanthos-Roche A, Mathieu C, Germain C, Brun JL, Gachet M, et al. Chlamydia trachomatis in subfertile couples undergoing an in vitro fertilization program: a prospective study. Eur J Obstet Gynecol Reprod Biol. 2006;129:46-53. [ Links ]
68. Carter JD, Espinoza LR, Inman RD, Sneed KB, Ricca LR, Vasey FB, et al. Combination antibiotics as a treatment for chronic Chlamydia-induced reactive arthritis: a double-blind, placebo-controlled, prospective trial. Arthritis Rheum. 2010;62:1298-307. [ Links ]
69. OMS Módulos de capacitación para el manejo sindrómico de las infecciones de transmisión sexual. Ginebra OMS: Organización Mundial de la Salud; 2008. [ Links ]
70. Tucker JD, Bu J, Brown LB, Yin YP, Chen XS, Cohen MS. Accelerating worldwide syphilis screening through rapid testing: a systematic review. Lancet Infect Dis. 2010;10:381-6. [ Links ]
71. Rolfs RT, Joesoef MR, Hendershot EF, Rompalo AM, Augenbraun MH, Chiu M, et al. A randomized trial of enhanced therapy for early syphilis in patients with and without human immunodeficiency virus infection. New England Journal of Medicine. 1997;337:307-14. [ Links ]
72. Bai ZG, Yang KH, Liu YL, Tian JH, Ma B, Mi DH, et al. Azithromycin vs. benzathine penicillin G for early syphilis: a meta-analysis of randomized clinical trials. International journal of STD & AIDS. 2008;19:217-21. [ Links ]
73. Bai ZG, Wang B, Yang K, Tian JH, Ma B, Liu Y, Jiang L, Gai QY, He X, Li Y. Azithromycin versus penicillin G benzathine for early syphilis. Cochrane Database Syst Rev. 2012;13;6:CD007270. [ Links ]
74. Moorthy TT, Lee CT, Lim KB, Tan T. Ceftriaxone for treatment of primary syphilis in men: a preliminary study. Sexually transmitted diseases. 1987;116-8. [ Links ]
75. Wong T, Singh AE, De P. Primary syphilis: serological treatment response to doxycycline/tetracycline versus benzathine penicillin. Am J Med. 2008;121:903-8. [ Links ]
76. Tyndall MW, Agoki E, Plummer FA, Malisa W, Ndinya-Achola JO, Ronald AR. Single dose azithromycin for the treatment of chancroid: a randomized comparison with erythromycin. Sexually transmitted diseases 1994;21:231-4. [ Links ]
77. Martin DH, Sargent SJ, Wendel GD, McCormack WM, Spier NA, Johnson RB. Comparison of azithromycin and ceftriaxone for the treatment of chancroid. Clinical Infectious Diseases. 1995;21:409-14. [ Links ]
78. Malonza IM, Tyndall MW, Ndinya-Achola JO, Maclean I, Omar S, MacDonald KS, et al. A randomized, double-blind, placebo-controlled trial of single-dose ciprofloxacin versus erythromycin for the treatment of chancroid in Nairobi, Kenya. The Journal of Infectious Diseases. 1999;180:1886-93. [ Links ]
79. Greaves AB, Hilleman MR, Taggart SR, Bankhead AB, Feld M. Chemotherapy in bubonic lymphogranuloma venereum: a clinical and serological evaluation. Bull World Health Organ. 1957;16:277-89. [ Links ]
80. Martin DH, Mroczkowski TF, Dalu ZA, McCarty J, Jones RB, Hopkins SJ, et al. A controlled trial of a single dose of azithromycin for the treatment of chlamydial urethritis and cervicitis. The Azithromycin for Chlamydial Infections Study Group. The New England journal of medicine Clinical Trial. Comparative Study. Multicenter Study. Randomized Controlled Trial. 1992;327:921-5. [ Links ]
81. Thorpe EM, Jr., Stamm WE, Hook EW, 3rd, Gall SA, Jones RB, Henry K, et al. Chlamydial cervicitis and urethritis: single dose treatment compared with doxycycline for seven days in community based practises. Genitourin Med. 1996;72:93-7. [ Links ]
82. Banov L, Jr. Rectal strictures of lymphogranuloma venereum; some observations from a five-year study of treatment with the broad spectrum antibiotics. Am J Surg. 1954;88:761-7. [ Links ]
83. Greenblatt RB, Barfield WE, Dienst RB, West RM. Terramycin in treatment of granuloma inguinale. J Vener Dis Inf. 1951;32:113-5. [ Links ]
84. Robinson HM, Jr., Cohen MM. Treatment of granuloma inguinale with erythromycin. J Invest Dermatol. 1953;20:407-9. [ Links ]
85. Bowden M, Plunkett, & Bastian. Pilot study of azithromycin in the treatment of genital donovanosis. Genitourin Med. 1996;72:17-9. [ Links ]
86. Bryson YJ, Dillon M, Lovett M. Treatment of first episodes of genital herpes simplex virus infection with oral acyclovir. A randomized double-blind controlled trial in normal subjects. New England Journal of Medicine. 1983;308:916-21. [ Links ]
87. Mertz GJ, Critchlow CW, Benedetti J. Double-blind placebo-controlled trial or oral acyclovir in first-episode genital herpes simplex virus infection. Journal of the American Medical Association. 1984;252:1147-51. [ Links ]
88. Nilsen AE, Aasen T, Halsos AM, Kinge BR, Tjotta EA, Wikstrom K, et al. Efficacy of oral acyclovir in the treatment of initial and recurrent genital herpes. Lancet. 1982 ;2:571-3. [ Links ]
89. Fife KH, Barbarash RA, Rudolph T, Degregorio B, Roth R. Valaciclovir versus acyclovir in the treatment of first-episode genital herpes infection. Results of an international, multicenter, double-blind, randomized clinical trial. The Valaciclovir International Herpes Simplex Virus Study Group. Sex Transm Dis. 1997;24:481-6. [ Links ]
90. Lebrun-Vignes B, Bouzamondo A, Dupuy A, Guillaume JC, Lechat P, Chosidow O. A meta-analysis to assess the efficacy of oral antiviral treatment to prevent genital herpes outbreaks. Journal of the American Academy of Dermatology. 2007;57:238-46. [ Links ]
91. French P. Syphilis. Bmj. 2007;334:143-7. [ Links ]
92. Eccleston K, Collins L, Higgins SP. Primary syphilis. International journal of STD & AIDS. 2008;19:145-51. [ Links ]
93. Gupta R, Warren T, Wald A. Genital herpes. Lancet. 2007;370:2127-37. [ Links ]
94. Lewis DA. Chancroid: clinical manifestations, diagnosis, and management. Sex Transm Infect. 2003;79:68-71. [ Links ]
95. Mabey D, Peeling RW. Lymphogranuloma venereum. Sex Transm Infect. 2002;78:90-2. [ Links ]
96. Blencowe H, Cousens S, Kamb M, Berman S, Lawn JE. Lives Saved Tool supplement detection and treatment of syphilis in pregnancy to reduce syphilis related stillbirths and neonatal mortality. BMC Public Health. 2011;11(Suppl3):S9. [ Links ]
97. Walker GJ. Antibiotics for syphilis diagnosed during pregnancy. Cochrane Database Syst Rev. 2001:CD001143. [ Links ]
98. Wendel GD, Sheffield JS, Hollier LM, Hill JB, Ramsey PS, Sanchez PJ. Treatment of syphilis in pregnancy and prevention of congenital syphilis. Clin Infect Dis. 2002;35(Suppl 2):S200-9. [ Links ]
99. Walker GJ, Walker DG. Congenital syphilis: a continuing but neglected problem. Semin Fetal Neonatal Med. 2007;12:198-206. [ Links ]
100.Brown ZA, Selke S, Zeh J, Kopelman J, Maslow A, Ashley RL, et al. The acquisition of herpes simplex virus during pregnancy. N Engl J Med. 1997;337:509-15. [ Links ]
101.Lowe NK, Neal JL, Ryan-Wenger NA. Accuracy of the clinical diagnosis of vaginitis compared with a DNA probe laboratory standard. Obstet Gynecol. 2009;113:89-95. [ Links ]
102.Pépin J, Sobela F, Khonde N, Agyarko-Poku T, Diakité S, Deslandes S, et al. The syndromic management of vaginal discharge using single-dose treatments: a randomized controlled trial in West Africa. Bull World Health Organ. 2006;84:729-38. [ Links ]
103.Oduyebo OO Anorlu RI, Ogunsola FT. The effects of antimicrobial therapy on bacterial vaginosis in non-pregnant women. Cochrane Database Syst Rev. 2009:CD006055. [ Links ]
104.Bohbot JM, Vicaut E, Fagnen D, Brauman M. Treatment of bacterial vaginosis: a multicenter, double-blind, double-dummy, randomised phase III study comparing secnidazole and metronidazole. Infect Dis Obstet Gynecol. 2010. 2010. pii: 705692. doi: 10.1155/2010/705692 [ Links ]
105.Forna FGA. Interventions for treating trichomoniasis in women. Cochrane Database of Systematic Reviews; 2003. [ Links ]
106.Nurbhai MGJ, Watson M, Bond CM, Mollison JA, Ludbrook A. Oral versus intra-vaginal imidazole and triazole anti-fungal treatment of uncomplicated vulvovaginal candidiasis(thrush). Cochrane Database of Systematic Reviews; 2007. [ Links ]
107.Kanno M, Sobel JD. Late recurrence of resistant Trichomonas vaginalis vaginitis: relapse or re-infection? Sex Transm Infect. 2003;79:260-1. [ Links ]
108.Hager WD. Treatment of metronidazole-resistant Trichomonas vaginalis with tinidazole: case reports of three patients. Sex Transm Dis. 2004;31:343-5. [ Links ]
109.Saporiti AM, Gomez D, Levalle S, Galeano M, Davel G, Vivot W, et al. Vaginal candidiasis: etiology and sensitivity profile to antifungal agents in clinical use. Rev Argent Microbiol. 2001;33:217-22. [ Links ]
110.Sobel JD, Ferris D, Schwebke J, Nyirjesy P, Wiesenfeld HC, Peipert J, et al. Suppressive antibacterial therapy with 0.75% metronidazole vaginal gel to prevent recurrent bacterial vaginosis. Am J Obstet Gynecol. 2006;194:1283-9. [ Links ]
111.Sobel JD, Wiesenfeld HC, Martens M, Danna P, Hooton TM, Rompalo A, et al. Maintenance fluconazole therapy for recurrent vulvovaginal candidiasis. N Engl J Med. 2004;351:876-83. [ Links ]
112.Roth AC, Milsom I, Forssman L, Wahlén P. Intermittent prophylactic treatment of recurrent vaginal candidiasis by postmenstrual application of a 500 mg clotrimazole vaginal tablet. Genitourin Med. 1990;66:357-60. [ Links ]
113.Lyng J, Christensen J. A double-blind study of the value of treatment with a single dose tinidazole of partners to females with trichomoniasis. Acta Obstet Gynecol Scand. 1981;60:199-201. [ Links ]
114.Calderón-Márquez JJ. Itraconazole in the treatment of vaginal candidosis and the effect of treatment of the sexual partner. Rev Infect Dis. 1987;9(Suppl1):S143-5. [ Links ]
115.Mehta SD. Systematic review of randomized trials of treatment of male sexual partners for improved bacteria vaginosis outcomes in women. Sex Transm Dis. 2012;39:822-30. [ Links ]
116.McDonald HM, Brocklehurst P, Gordon A. Antibiotics for treating bacterial vaginosis in pregnancy. Cochrane Database Syst Rev. 2007:CD000262. [ Links ]
117.Lamont R, Nhan-Chang C, Sobel J, Workowski K, Conde-Agudelo A, Romero R. Treatment of abnormal vaginal flora in early pregnancy with clindamycin for the prevention of spontaneous preterm birth: a systematic review and metaanalysis. Am J Obstet Gynecol. 2011;205:177-90. [ Links ]
118.Gulmezoglu AM, Azhar M. Interventions for trichomoniasis in pregnancy. Cochrane Database Syst Rev. 2011:CD000220. [ Links ]
119.Caro-Paton T, Carvajal A, Martin de Diego I, Martin-Arias LH, Alvarez Requejo A, Rodriguez Pinilla E. Is metronidazole teratogenic? A meta-analysis. Br J Clin Pharmacol. 1997;44:179-82. [ Links ]
120.Young GL, Jewell D. Topical treatment for vaginal candidiasis (thrush) in pregnancy. Cochrane Database Syst Rev. 2001:CD000225. [ Links ]
121.Cotch MF, Pastorek JG, Nugent RP, Hillier SL, Gibbs RS, Martin DH, et al. Trichomonas vaginalis associated with low birth weight and preterm delivery. The Vaginal Infections and Prematurity Study Group. Sex Transm Dis. 1997;24:353-60. [ Links ]
122.Smith LM, Wang M, Zangwill K, Yeh S. Trichomonas vaginalis infection in a premature newborn. J Perinatol. 2002;22:502-3. [ Links ]
123.Cotch MF, Hiller SL, Gibbs RS, Eschenbach DA. Epidemiology and outcomes associated with moderate to heavy Candida colonization during pregnancy. Vaginal Infections and Prematurity Study Group. American Journal of Obstetrics and Gynecology. 1998;178:374-80. [ Links ]
124.Trojian TH, Lishnak TS, Heiman D. Epididymitis and orchitis: an overview. Am Fam Physician. 2009;79:583-7. [ Links ]
125.Stewart A, Ubee SS, Davies H. Epididymo-orchitis. BMJ. 2011;342:d1543. [ Links ]
126.Ostaszewska I, Zdrodowska-Stefanow B, Darewicz B, Darewicz J, Badyda J, Pucilo K, et al. Role of Chlamydia trachomatis in epididymitis. Part II: Clinical diagnosis. Med Sci Monit. 2000;6:1119-21. [ Links ]
127.Kemp M, Christensen JJ, Lautenschlager S, Vall-Mayans M, Moi H. European guideline for the management of chancroid, 2011. Int J STD AIDS. 2011;22:241-4. [ Links ]
128.Nieuwenhuis RF, Ossewaarde JM, Götz HM, Dees J, Thio HB, Thomeer MG, et al. Resurgence of lymphogranuloma venereum in Western Europe: an outbreak of Chlamydia trachomatis serovar l2 proctitis in The Netherlands among men who have sex with men. Clin Infect Dis. 2004;39:996-1003. [ Links ]
129.Mistrangelo M, Conte ID, Gregori G, Castellano I, Famiglietti F, De Vries HJ. Rectal Lymphogranuloma Venereum. Colorectal Dis; 2012. [ Links ]
130.Bekler C, Kultursay N, Ozacar T, Sayiner A, Yalaz M, Akisu M. Chlamydial infections in term and preterm neonates. Jpn J Infect Dis. 2012;65:1-6. [ Links ]
Conflicto de intereses: ninguno declarado.
Flujograma general de manejo de ITS/ITG en mujeres
Flujograma general de manejo de ITS/ITG en hombres
Flujograma síndrome cervicitis
Flujograma síndrome de descarga uretral











 texto em
texto em 

