Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Obstetricia y Ginecología
Print version ISSN 0034-7434On-line version ISSN 2463-0225
Rev Colomb Obstet Ginecol vol.70 no.1 Bogotá Jan/Mar. 2019
https://doi.org/10.18597/rcog.3183
Investigación original
PREVALENCIA DE AGENTES MICROBIOLÓGICOS POTENCIALMENTE PATÓGENOS EN EL EXUDADO VAGINAL DE GESTANTES ASINTOMÁTICAS, BARRANQUILLA, COLOMBIA, 2014-2015
1 Bacteriologist, Master in Microbiology. Caribbean Infectious Diseases and Microbial Resistance Research Group, Universidad Metropolitana, Barranquilla (Colombia). lucilagomez@unimetro.edu.co
2 Bacteriologist, Master in Clinical Microbiology. Caribbean Infectious Diseases and Microbial Resistance Research Group, Universidad Metropolitana, Barranquilla (Colombia).
3 Obstetrician and Gynecologist. Umedquir Group. Universidad Metropolitana, Barranquilla(Colombia).
4 Biologist, Master in Microbiology, doctor in Biomedical Sciences. Caribbean Infectious Diseases and Microbial Resistance Research Group, Universidad Metropolitana, Barranquilla (Colombia).
5 Industrial Engineer, Master in Applied Statistics. Caribbean Infectious Diseases and Microbial Resistance Research Group, Universidad Metropolitana, Barranquilla (Colombia).
Objetivo:
establecer la prevalencia de agentes microbiológicos potencialmente patógenos en el exudado vaginal de gestantes asintomáticas del departamento del Atlántico, Colombia.
Materiales y métodos:
estudio de corte transversal descriptivo. Se incluyeron gestantes asintomáticas que acudieron a una institución privada de atención primaria en salud en Barranquilla, Colombia, en 2014 y 2015. Se excluyeron gestantes con tratamiento antimicrobiano en los últimos 30 días, sangrado genital, discapacidad mental e inmunosupresión. Se hizo un muestreo consecutivo no estricto. Se calculó la prevalencia de periodo de colonización por algunos de los agentes microbiológicos y la específica: número de mujeres con infección por tipo de agente/número de mujeres evaluadas en riesgo.
Resultados:
la prevalencia global fue de 24,8 % (56/226). De estas, el 55,4 % (31/56) fue debido a vaginitis y el 44,6 % (25/56) por vaginosis. La prevalencia específica según tipo de patógenos fue: vaginitis por Candida spp. en 13,3 % (30/226) y por T. vaginalis 0,4 % (1/226). La VB se presentó en 8,0 % (18/226) y una flora intermedia de 3,1 % (7/226).
Conclusión:
existe una importante colonización del tracto genital inferior de gérmenes potencialmente patógenos en mujeres gestantes de 35 a 37 semanas. Se requieren estudios adicionales para determinar el beneficio de la tamización poblacional en términos de malos resultados maternos perinatales evitados y costos.
Palabras clave: vaginitis; vaginosis bacteriana; VB
Objective:
To determine the prevalence of potentially pathogenic microbiological agents in vaginal exudates in a sample of asymptomatic pregnant women in the Department of Atlantico, Colombia.
Materials and Methods:
Descriptive cross-sectional study of a sample of asymptomatic pregnant women who attended a private primary healthcare institution in Barranquilla, Colombia, between 2014 and 2015. Pregnant women having received antimicrobial treatment within the last 30 days, with vaginal bleeding, mental disability or immunosuppression, were excluded. Consecutive sampling was performed. The prevalence of colonization time by some of the microbiological agents as well as specific prevalence were estimated: number of women with infection by agent type/number of women at risk assessed.
Results:
Overall prevalence was 24.8% (56/226); 55.4% (31/56) was due to vaginitis causal agents, and 44.6% (25/56) to vaginosis. The specific prevalence by type of pathogen, 13.3% (30/226) was vaginitis due to colonization by Candida spp. and 0.4% (1/226) was vaginitis due to T. vaginalis. Bacterial vaginosis (BV) was found in 8.0% (18/226).
Conclusion:
Substantial colonization of the lower genital tract by potentially pathogenic germs is found in pregnant women between 35 and 37 weeks of gestation. Further studies are required in order to determine the benefit of population screening in terms of avoiding poor maternal and perinatal outcomes, and the impact on the resulting overcosts.
Key words: vaginitis; bacterial vaginosis; BV
INTRODUCCIÓN
El microbioma vaginal está dominado por especies de Lactobacillus y miembros de las familias Clostridiales, Bacteriodales y Actinomycetales1. Dentro del género Lactobacillus, las especies más frecuentemente aisladas son: Lactobacillus gasseri, Lactobacillus crispatus, Lactobacillus jensenii y Lactobacillus iners; estas bacterias, productoras de ácido láctico, protegen la mucosa del tracto urogenital de microrganismos patógenos mediante: a) la adherencia específica al epitelio, lo que bloquea su asentamiento; b) la producción de compuestos antimicrobianos que mantienen pH < 4,5 y tienen un efecto microbicida; c) la coagregación con los patógenos, que potencia su efecto microbiocida 2; el papel crítico en la inhibición de la infección bacteriana y micótica en el tracto urogenital 3. Cuando este microbioma se altera, se pueden desencadenar infecciones por hongos, o alteración de la flora vaginal conocida como vaginosis bacteriana (VB), que pueden cursar con inflamación (vaginitis) y ser sintomáticas (prurito, mal olor, etc.) o asintomáticas 4. En el primer caso, la vaginitis puede ser el resultado de la proliferación de agentes endógenos, como especies de Candida spp., o por agentes exógenos transmitidos sexualmente, como Trichomonas vaginalis. La VB es el resultado del desbalance del ecosistema vaginal, que conlleva un desplazamiento de las especies de Lactobacillus spp. por la proliferación de bacterias anaerobias y bacterias tipo Gardenella 5.
Durante el embarazo, la infección por Candida se da como consecuencia del incremento de hormonas sexuales como la progesterona, que genera en el epitelio vaginal una disminución de la respuesta celular local, mediada por su acción inmunomoduladora sobre linfocitos T y polimorfonucleares, y de los estrógenos que aumentan el glicógeno del tejido vaginal, y crean un ambiente rico en carbono para el desarrollo de la levadura 6. En particular, los estudios de Leli et al. indican que las mujeres embarazadas tienden a presentar mayor frecuencia de colonización asintomática por Candida spp, que sus contrapartes no embarazadas (46,5 % vs. 16,0 %) 7. Igualmente, este tipo de infección se ha asociado con un incremento del riesgo de corioamnioitis, síndrome de vestibulitis vulvar y parto prematuro durante el tercer trimestre de gestación 8,9. En el caso de infección neonatal, la principal fuente de adquisición de Candida albicans es el canal del parto, a diferencia de otras especies que se asocian en mayor medida a una transmisión horizontal 10. El diagnóstico de vaginitis por Candida spp. se basa en la observación de levaduras más hifas o pseudo hifas en el montaje con KOH al 10 %, y más de 5 leucocitos por campo en la tinción de Gram como indicador de respuesta inflamatoria vaginal (RIV). Además del aislamiento selectivo de la levadura en el agar Sabouraud, el realizado en agares cromogénicos permite la diferenciación de C. albicans5,11,12 presente en el 90 % de los casos, de otras especies como C. glabrata, C. parapsilosis y C. tropicalis, el cultivo es considerado el patrón de oro.
Por otro lado, las mujeres embarazadas que cursan infecciones asintomáticas por el protozoo Trichomonas vaginalis pueden transmitirlo verticalmente durante el parto al recién nacido, y producirle una infección genitourinaria o una neumonía neonatal 9-11. El diagnóstico incluye un examen microscópico directo del flujo, una tinción de Giemsa y el cultivo del protozoo; este último es el método de referencia para el diagnóstico, con una sensibilidad del 98 % 5.
Otra etiología que durante el embarazo está relacionada con resultados adversos como mayor riesgo de parto prematuro, ruptura prematura de membranas y, posiblemente, aborto espontáneo, es la VB 13. En este caso, el incremento del número de bacterias anaerobias o facultativas facilitaría el desencadenamiento de estos resultados 14. El diagnóstico puede ser efectuado aplicando los criterios clínicos y microbiológicos propuestos por Amsel 15, y analizando los morfotipos bacterianos presentes en la tinción de Gram, de acuerdo con los criterios de Nugent, método de laboratorio considerado el estándar de oro 5.
De esta manera, las infecciones asintomáticas pueden predisponer a una colonización ascendente del tracto vaginal, infiltración de las membranas fetales e invasión de la cavidad amniótica, con el consecuente daño fetal que desencadenan los procesos infecciosos, y que constituyen una de las razones más frecuentes de morbilidad materna, y morbilidad y mortalidad perinatal 16-19.
Es poco lo que se conoce en nuestro medio sobre la magnitud y las implicaciones de la infección asintomática de mujeres gestantes en el tercer trimestre de la gestación por estos agentes potencialmente patógenos. La información sobre la frecuencia de la colonización y los resultados perinatales y maternos de las mujeres con infección asintomática serviría para determinar si se requieren intervenciones en estas mujeres o programas poblacionales.
Este estudio busca hacer una aproximación al problema de la frecuencia, por tanto, su objetivo fue establecer la prevalencia de agentes microbiológicos potencialmente patógenos en el exudado vaginal de una muestra de gestantes asintomáticas del departamento del Atlántico, Colombia.
MATERIALES Y MÉTODOS
Diseño y población
Estudio de corte transversal descriptivo, que incluyó mujeres gestantes de 35 y 37 semanas sin signos o síntomas de infección del tracto genital inferior, y con curso normal de la gestación, atendidas durante la consulta del programa de control prenatal desde octubre de 2014 a mayo de 2015 en Barranquilla, en la costa Caribe de Colombia. El estudio fue realizado en una institución prestadora de salud (IPS) de primer nivel, de carácter privado, que atiende pacientes pertenecientes a los regímenes subsidiado y contributivo en el sistema de seguridad social en Colombia. Se excluyeron mujeres con tratamiento antimicrobiano en los últimos 30 días, sangrado genital al momento del examen, discapacidad mental, inmunosupresión o tratamiento con fármacos inmunosupresores. Muestreo consecutivo en mujeres que aceptaron participar en el estudio.
Procedimiento
La captación de las participantes fue realizada por la ginecóloga del grupo de investigación, quien las seleccionó durante la consulta de control prenatal. Si cumplían con los criterios de inclusión y aceptaban participar, se les explicaba el objetivo del estudio y se les solicitaba el diligenciamiento del consentimiento informado. Una vez firmado el consentimiento, se les aplicó un instrumento de recolección de datos previamente diseñado en Excel, que incluía variables sociodemográficas y antecedentes ginecoobstétricos; se garantizó en todo momento la confidencialidad de la información suministrada. Posteriormente, la ginecóloga procedió a tomar el exudado de fondo de saco vaginal para el estudio microbiológico, que incluyó: una primera muestra con escobillón en solución salina para montaje en fresco, extendido para Gram, medición de pH y prueba de aminas; una segunda muestra con escobillón en medio de transporte Stuart, sin carbón para cultivo y tinción Giemsa de MayGrunwald. El procesamiento fue realizado por un microbiólogo entrenado bajo los protocolos establecidos por el Laboratorio de Microbiología de la Universidad Metropolitana de Barranquilla.
El diagnóstico de vaginitis por Candida spp
Se realizó a partir de la detección de levaduras más hifas o pseudohifas en el montaje directo con KOH al 10 %, y en tinción de Gram y aislamiento en el medio de cultivo CHROMagar Candida (BectonDickinson). La identificación final se hizo mediante método semiautomatizado API 20C AUX (bioMérieux). El diagnóstico de vaginitis por T. vaginalis se realizó mediante la observación microscópica de los trofozoítos en fresco y en la coloración Giemsa de MayGrunwald 20.
Para el diagnóstico de VB se implementaron en conjunto los criterios de Nugent 21 y Amsel 15. Con los criterios de Nugent, tomados como método de referencia, se cuantificó la presencia de morfotipos bacterianos por campo de inmersión bajo la tinción de Gram (Lactobacillus spp., Gardnerella-Prevotella y Mobiluncus); se consideró VB cuando se obtenía un puntaje de 7 a 10; flora intermedia de 4 a 6 y flora microbiana normal de 0 a 3. Aplicando los criterios microbiológicos de Amsel, se diagnosticó VB cuando se cumplían en conjunto los siguientes parámetros: presencia en la coloración de Gram de células epiteliales descamadas cubiertas por bacilos cortos Gram variables (células guía), pH ≥ 4,5 y prueba de aminas positiva.
Una RIV significativa, como criterio de vaginitis, se consideró como el hallazgo de más de 5 leucocitos por campo (aumento de 400 X) en la tinción de Gram, o un conteo mayor a 10 en montaje en fresco.
Variables medidas
Se midieron las siguientes variables: edad materna, edad gestacional, edad de inicio de vida sexual y obstétrica, número de compañeros sexuales, estado civil, lugar de procedencia, escolaridad, antecedentes de infecciones del tracto urinario (ITU), tratamiento con antibióticos, bacteriuria asintomática, antecedentes de abortos, trabajo de parto pretérmino, infecciones de transmisión sexual.
Análisis estadístico
Para el análisis de las variables de estudio se utilizó el software estadístico Statgraphics versión 16. Las variables cuantitativas se expresaron como media y desviación estándar; las variables cualitativas se expresaron como proporciones. La prevalencia global: número de mujeres con Candida, T. vaginales o VB / número de mujeres examinadas. Prevalencia específica: número de mujeres con infección / número de mujeres evaluadas en riesgo.
Aspectos éticos
El estudio fue aprobado por el Comité de Ética de la Universidad Metropolitana de Barranquilla preservando los principios de confidencialidad y privacidad de todas las gestantes. En todos los casos, el microbiólogo reportó a la ginecóloga los resultados obtenidos según metodología establecida; a esta le correspondió informar a las participantes y tomar medidas para su tratamiento y seguimiento posterior dentro el programa de control prenatal.
RESULTADOS
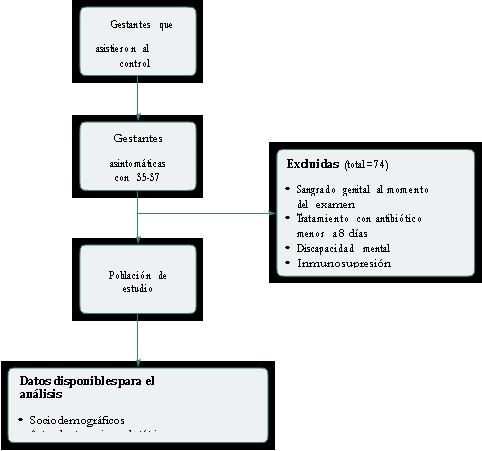
Durante el periodo de observación se seleccionaron 300 pacientes asintomáticas potencialmente candidatas a formar parte del estudio, de las cuales 260 cumplieron con los criterios de inclusiónexclusión; de estas, 226 (86 %) gestantes otorgaron su consentimiento para la participación en el estudio (Figura 1). De las 226 gestantes que participaron en el estudio, 53 residían en la ciudad de Barranquilla, 20 % en Soledad y 27 % en otros municipios del departamento; las gestantes tenían una edad promedio de 24,5 años (± 6,0 DS). En cuanto a la escolaridad, el 10,6 % había cursado solo la primaria, el 75,2 % había completado su secundaria, y el 14,2 % tenía un nivel superior de escolaridad.
El 77,4 % de las gestantes había iniciado su vida sexual en el rango entre 15 y 19 años, el 14,2 % después de los 19 años y el 8,4 % entre los 10 y 14 años. Al momento del estudio, el 48 % había tenido más de un compañero sexual, la edad promedio de la madre al tener su primer hijo fue de 20 años, con un mínimo de 13 años y un máximo de 38. El 25 % (n = 57) de las gestantes tenía abortos como antecedentes; el 12,3 % (n = 28) trabajo de parto pretérmino; el 40,2 % (n = 91) ITU, y 2 (1 %) tenían antecedente de alguna enfermedad de transmisión sexual.
La prevalencia general de las alteraciones en la microbiota vaginal fue de 24,8 % (56/226). De esta, el 55,4 % (31/56) fue debido a vaginitis y el 44,6 % (25/56) por vaginosis. Al discriminar por tipo de patógenos observamos que la prevalencia de infección asintomática por Candida se presentó en 13,3 % (30/226), y en infección por T. vaginalis en 0,4 % (1/226). Dentro de los casos de vaginitis asociados a levaduras, el 70,0 % (n= 21) fue por C. albicans y 30,0 % (n= 9) por C. no albicans. Respecto a la prevalencia de VB cuando se aplicaron los criterios de Nugent para detectar morfotipos bacterianos asociados con alteraciones, se observó VB en 8,0 % (18/226) y una flora intermedia de 3,1 % (7/226); una categoría que, aunque no es diagnóstico de vaginosis, es considerada una alteración de la flora vaginal normal. La prevalencia por el test de Amsel fue del 7,1 % (n = 16). La RIV significativa estuvo presente en 56,7 % (17/31) de los casos de colonización por C. albicans o T. vaginalis.
DISCUSIÓN
Nuestros resultados encuentran una prevalencia general del 24,8 % (56/226) de agentes microbiológicos potencialmente patógenos en embarazadas asintomáticas de 3537 semanas de gestación; la vaginitis por Candida es la más prevalente, con un 13,3 % (30/226), y la producida por T. vaginalis solo se presentó en el 0,4 % de los casos (1/226). La prevalencia de VB fue de 8 %.
Nuestros resultados son similares a los informados por Farr et al. en mujeres gestantes asintomáticas en Viena, Austria, quienes informan una frecuencia de C. albicans del 13,5 % 22, y son inferiores a los reportados por Touzon et al.23 en gestantes asintomáticas a las que se les realizó cultivo para Candida spp. y T vaginalis, y prueba de Nugent para BV que informan una prevalencia de VB de 19 %, T. vaginalis del 1 % y por Candida spp. de 19,5 %, y a la prevalencia de colonización por Candida spp. informada por Leli et al. en Italia, quienes reportan una prevalencia del 35 % en mujeres embarazadas asintomáticas 13, y Duque et al. en Medellín, Colombia, que informan una prevalencia de 25,6 % de Candida spp. en 162 mujeres gestantes asintomáticas 24. Además del estudio mencionado de Touzon et al., no encontramos reportes de detección de T. vaginalis en mujeres gestantes asintomáticas.
Respecto a la prevalencia de VB nuestros datos son similares a los presentados por Tolosa et al. en un estudio multicéntrico realizado en embarazadas asintomáticas que tenían entre 1835 semanas de gestación, el cual señala una prevalencia de vaginosis en Colombia del 9 %; nuestros resultados son superiores a los informados en Irlanda (5,9 %) y Estados Unidos (5,8 %), e inferiores a los reportados en este estudio en Myanmar (15,6 %) y Zimbabue (24,4 %), con prevalencias inferiores a las informa das por Campos en Brasil 25 (26,2 %) en mujeres gestantes de 14 a 24 semanas, o a los informados por Menguistie 26 en Etiopía, quien reporta una prevalencia del 15,9 % en mujeres gestantes asintomáticas; sin embargo, no se presenta la edad gestacional a la que se hizo el estudio.
Como fortalezas del estudio se tiene el uso del patrón de oro para el diagnóstico microbiológico de la infección por Candida spp., T. vaginalis y VB en gestantes asintomáticas. Respecto a las limitaciones del estudio, en este no se incluyó la detección del Streptococcus agalactiae y el tipo de muestreo, lo que pudo llevar a sesgos de selección.
CONCLUSIONES
Existe una importante colonización del tracto genital inferior por gérmenes potencialmente patógenos en mujeres gestantes de 35 a 37 semanas. Se requieren estudios adicionales para determinar el beneficio de la tamización poblacional en términos de evitar los malos resultados maternos y perinatales, así como los sobrecostos que esto implica.
REFERENCIAS
1. Aagaard K, Riehle K, Ma J, Segata N, Mistretta TA, Coarfa C. et al. A metagenomics approach to characterization of the vaginal microbiome signature in pregnancy. PLoS ONE. 2012;7:1-15. Doi: 10.1371/journal.pone.0036466. [ Links ]
2. Martín R, Soberón N, Vázquez F, Suárez J. La microbiota vaginal: composición, papel protector, patología asociada y perspectivas terapéuticas. Enferm Infecc Microbiol Clin. 2008;26:160-7. Doi: 10.1157/13116753 [ Links ]
3. McLean NW, Rosenstein IJ. Characterisation and selection of a Lactobacillus species to re-colonise the vagina of women with recurrent bacterial vaginosis. J Med Microbiol. 2000;49:543-52. Doi: 10.1099/0022-1317-49-6-543 [ Links ]
4. Coppolillo EF, Vay C, Menghi C, Cora EM, Gatta C, et al. Prevalencia de infecciones vaginales en embarazadas sintomáticas y asintomáticas. Enf Tract Gen Inf. 2007;1:17-22. [ Links ]
5. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines. MMWR. 2015;64:69-75. [ Links ]
6. Nuriel-Ohayon M, Neuman H, Koren O. Microbial Changes during Pregnancy, Birth, and Infancy. Front.Microbiol. 2016;7:1-13. Doi: 10.3389/fmicb.2016.01031 [ Links ]
7. Leli C, Menaccit A, Meucci M. Association of preg- nancy and candida vaginal colonization in women with or without symptoms of vulvovaginitis. Miner Ginecol. 2013;65:303-9. [ Links ]
8. Guzel AB, Iikit M, Burgut R, Ferhat I, Tuncay F. An evaluation of risk factors in pregnant women with candida vaginitis and the diagnostic value of simultaneous vaginal and rectal sampling. Mycopathologia. 2011;172:25-36. Doi: 10.1007/s11046-011-9392-z [ Links ]
9 - Lara-Ávila L, Morgan-Ortiz F, Muñoz-Estrada VF, Rubio-Rodríguez MZ, Gómez Llanos-Navidad M, Lizárraga-Gutiérrez CL. Infección por Candida y vaginosis bacteriana y su asociación con parto pre-término y ruptura prematura de membranas. Rev Med UAS. 2010;1:13-20. [ Links ]
10. Izquierdo G, Santolaya M. Candidiasis invasoras en recién nacidos: diagnóstico, tratamiento y prevención. Rev Chilena Infectol. 2014;31:73-83. doi: 10.4067/S0716-10182014000100011 [ Links ]
11. Ciudad-ReynaudI A. Infecciones vaginales por cándida: diagnóstico y tratamiento. Rev Per Ginecol Obstet. 2007;53:159-66. [ Links ]
12. Babic M, Hucik M. Candida albicans and non- albicans species as etiological agent of vaginitis in pregnant and non-pregnant women. Bosn J Basic Med Sci. 2010;10:89-97. doi: 10.17305/bjbms.2010.2744 [ Links ]
13. Hill GB. The microbiology of bacterial vaginosis. Am J Obstet Gynecol. 1993;169:450-4. doi: 10.1016/0002-9378(93)90339-K [ Links ]
14. Tolosa J, Chaithongwongwatthana S, Daly S, Maw WW, Gaitán H, Lumbiganon P, et al. The International Infections in Pregnancy (IIP) study: Variations in the prevalence of bacterial vaginosis and distribution of morphotypes in vaginal smears among pregnant women. Am J Obstet Gynecol. 2006;195:1198-204. Doi: 10.1016/j.ajog.2006.08.016 [ Links ]
15. Amsel R, Totten PA, Spiegel CA, Chen KC, Eschenbach DA, Holmes KK. Nonspecifi vaginitis. Diagnostic criteria and microbial and epidemiologic associations. Am J Med. 1983;74:14-22. Doi: 10.1016/0002-9343(83)91112-9 [ Links ]
16. Campo-Urbina ML, Ortega-Ariza N, Parody-Muñoz A, Gómez-Rodríguez LC. Caracterización y perfil de susceptibilidad de uropatógenos asociados a la presencia de bacteriuria asintomática en gestantes del departamento del Atlántico, Colombia, 2014-2015. Estudio de corte transversal. Rev Colomb Obstet Ginecol. 2017;68:62-70. doi: 10.18597/recorg.2981. [ Links ]
17. Beigi RH, Yudin MH, Cosentino L, Meyn LA, Hillier SL. Cytokines, pregnancy, and bacterial vaginosis: Comparison of levels of cervical cytokines in pregnant and nonpregnant women with bacterial vaginosis. J Infect Dis. 2007;196:1355-60. Doi: 10.1086/521628 [ Links ]
18. Gotsch F, Romero R, Kusanovic JP, Mazaki-Tovi S, Pineles BL, Erez O, et al. The fetal inflammatory response syndrome. Clin Obstet Gynecol. 2007;50:652- 83. doi: 10.1097/GRF.0b013e31811ebef6 [ Links ]
19. Huiza L, Pacora P, Santivaez A, Castro G, Ayala M. La enfermedad perinatal y la prematuridad pertenecen a un síndrome clínico multifactorial: participación de la herencia de enfermedad vascular, la flora microbiana vaginal y el estado nutricional. Anales de la Facultad de Medicina. 2003;64:167-9. Doi: 10.15381/anales.v64i3.1440 [ Links ]
20. Perazzi B, Menghi C, Coppolillo E, Gatta C, Cora- Elisehts M, Vay C, et al. Investigación de Trichomonas vaginalis durante el embarazo mediante diferentes metodologías. Rev Arg Microbiol. 2007;39:99-104 [ Links ]
21. Nugent P, Krohn A, Hillier L. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of Gram stain interpretation. J Clin Microbiol. 1991;29:297-301. [ Links ]
22. Farr A, Kiss H, Holzer I, Husslein P, Hagmann M, Petricevic L. Effect of asymptomatic vaginal colonization with Candida albicans on pregnancy outcome. Acta Obstet Gynecol Scand. 2015;94:989-96. doi: 10.1111/aogs.12697 [ Links ]
23. Touzon MS, Losada M, Eliseht MC, Menghi C, Gatta C, et al. Evaluación de la disfunción vaginal en mujeres embarazadas sintomáticas y asintomáticas mediante la utilización de los estados vaginales básicos (EVB) y su comparación con el estudio microbiológico convencional. Rev Arg Microbiol. 2014;46:182-7. Doi: 10.1016/S0325-7541(14)70070-7 [ Links ]
24. Duque CM, Uribe OL, Soto AF, Alarcón JR. Candidiasis vulvovaginal en un grupo mujeres gestantes de Medellín. Infectio. 2009;13:14-20. doi: 10.22354/in.v13il.73. [ Links ]
25. Campos AA, Leite AP, Lisboa CV, Andrade CC, Be- zerra AF, Mattar R, et al Comparative study between the pH test and of the KOH versus Nugent score for diagnosis of bacterial vaginosis in pregnant women. Rev Bras Ginecol Obstet. 2012;34:209-14. doi: 10.1590/S0100-72032012000500004 [ Links ]
26. Mengistie Z, Woldeamanuel Y, Asrat D, Adera A. Prevalence of bacterial vaginosis among pregnant women attending antenatal care in Tikur Anbessa University Hospital, Addis Ababa, Ethiopia. BMC Res Notes. 2014;7:822. doi: 10.1186/1756-0500-7-82 [ Links ]
Recibido: 13 de Abril de 2018; Aprobado: 19 de Marzo de 2019











 text in
text in